La coexistencia de insuficiencia cardiaca (IC) con fracción de eyección del ventrículo izquierdo (FEVI) reducida y diabetes es muy frecuente. En los últimos años, el sacubitrilo-valsartán (SV) y la familia de los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) han pasado a formar parte del arsenal terapéutico habitual del profesional dedicado a la IC. Comparado con el enalapril, se ha demostrado con el SV en pacientes con IC y FEVI reducida una clara mejoría a nivel pronóstico y de calidad de vida; la familia de fármacos glucosúricos ha mostrado beneficios significativos en protección renal y hospitalización por IC en una población más variada, donde la prevalencia de IC basal es baja. Se revisa la evidencia actual de los 2 fármacos y el uso combinado de ambos.
Información sobre el suplemento: este artículo forma parte del suplemento titulado «Controversias para una nueva era en el tratamiento de la insuficiencia cardiaca», que ha sido patrocinado por Novartis.
Palabras clave
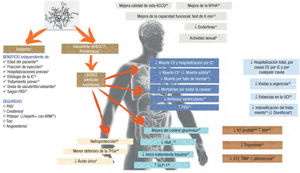
Es por todos conocido el efecto del sacubitrilo-valsartán (SV) frente a enalapril en pacientes IC con FEVI reducida1, que hace que sea el tratamiento de elección para asegurar el beneficio pronóstico de los pacientes con esta enfermedad. No obstante, y más allá del ensayo fundamental, se han publicado otros estudios que recogen otros efectos observados con la molécula (figura 1), que se resumen a continuación.
Reingresos por ICUno de los mayores retos en IC es evitar el reingreso de los pacientes, y especialmente en el primer mes tras el alta. En este sentido, el SV condiciona la reducción del ingreso precoz por cualquier causa y por IC a los 30 días del alta2. Respecto a los reingresos por IC, disminuyen de manera significativa, respecto a enalapril (reducción absoluta del 3,2% y reducción relativa del 26%).
Es bien conocido el mal pronóstico que condicionan los reingresos frecuentes por IC, con una supervivencia media tras el primer ingreso de 2,4 años, frente a 1,4 años en la segunda o 0,6 años en el cuarto reingreso3, punto muchas veces poco estudiado en los ensayos clínicos, donde se analiza únicamente el tiempo hasta el primer evento. En el PARADIGM-HF, el 34% de los pacientes con un primer evento sufrieron otro a lo largo del seguimiento. Comparado con enalapril, el SV reduce el primer y sucesivos eventos a lo largo de la evolución de la enfermedad4.
Si se analiza el momento de inicio del tratamiento respecto a una descompensación, se observa que el beneficio del SV es independiente del tiempo desde el ingreso, y hay beneficio tanto para los pacientes con ingresos recientes como con ingresos alejados en el tiempo5.
Estos datos se ven reforzados tras la publicación del ensayo clínico PIONEER-HF6 que demostró la superioridad de SV frente a enalapril en pacientes con FEVI reducida estabilizados durante un ingreso por IC, con una reducción de las cifras de NT-proBNP en un tiempo promedio de 4 y 8 semanas (29%) y una reducción del 44% de las rehospitalizaciones a las 8 semanas a favor del SV. Además, el uso precoz de SV desde el ingreso frente al cambio de enalapril a SV a las 8 semanas del ingreso reduce un 33% los eventos como muerte, hospitalización por IC, trasplante o necesidad de asistencia ventricular7.
Contra lo que cabría esperar, la reducción de ingresos precoces por IC se logró con una reducción significativa de la dosis de diuréticos del asa en el grupo de SV8. La reducción de los diuréticos ocurre en el 6% de los pacientes en 24 meses de tratamiento y, sobre todo, la necesidad de incrementar dicho tratamiento se reduce en un 3,6% de los pacientes en el mismo periodo de tiempo.
Calidad de vida, consumo de oxígeno y actividad físicaEl efecto del SV redunda en una mejora en la calidad de vida del paciente, que «rejuvenece» 9 años9, y se constata además una mejora en las actividades habituales y la capacidad de esfuerzo, con beneficio que es más marcado en lo relativo a las actividades habituales del hogar y la actividad sexual, incluso con una mejoría franca del estado nutricional del paciente10.
Esta mejora de la actividad muy posiblemente esté relacionada con su acción reguladora de las concentraciones de endorfinas y la mejoría del consumo máximo de oxígeno, que se consigue con el tratamiento con SV11,12.
Muerte súbitaComo es conocido, la muerte súbita se redujo en un 20% en el grupo de SV respecto al tratamiento con enalapril1. Cabe destacar que, gracias a este estudio, se sabe que no existe una correlación entre la clase funcional de la New York Heart Association (NYHA) y el riesgo de muerte súbita, dado que gran parte de los eventos de carácter súbito se presentaron en pacientes catalogados como NYHA II.
En la reducción de la muerte súbita, no presente con los inhibidores de la enzima de conversión de la angiotensina o los antagonistas del receptor de la angiotensina II13, el SV evidencia una reducción de la carga arrítmica, del porcentaje de extrasistolia ventricular y de la necesidad de terapias apropiadas en pacientes con dispositivos implantados14,15.
BiomarcadoresLos pacientes con una reducción significativa de las cifras de NT-proBNP tenían una menor tasa de eventos en el seguimiento, independientemente del tratamiento farmacológico que recibieron. En el grupo de SV, la probabilidad de que se reduzcan las cifras de NT-pro- BNP por debajo de 1.000 pg/ml era 2 veces mayor que con enalapril.
Por lo tanto, parece que el tratamiento farmacológico adecuado con SV, obtiene una reducción de cifras de NT-proBNP superior al tratamiento con enalapril16. Tras la publicación del estudio PROVE-HF17 sabemos que esta reducción de NT-proBNP es brusca, alcanzando el 30% en las primeras dos semanas y mantenida a lo largo de los 12 meses de seguimiento, correlacionándose el parámetro bioquímico con el remodelado ventricular inverso.
Otro de los biomarcadores relacionados con la IC que presentan modificaciones de interés es el ST-218, que tenía mayores reducciones con el tratamiento con SV. Además, se constató el poder de discriminación de este biomarcador, con una relación lineal entre su concentración basal y al mes del inicio del estudio, y que es uno de los mayores predictores de eventos, de modo similar a los péptidos natriuréticos.
El SV reduce el estado profibrótico presente en la IC19. Entre todos estos biomarcadores indicativos de fibrosis se incluyen, aparte del mencionado ST2, la aldosterona, los inhibidores de metaloproteasas tisulares de matriz, metaloproteasas de matriz tipo 2 y 9, galectina-3, propéptido N-terminal de colágeno I y el propéptido N-terminal de colágeno III. En conjunto, todos estos factores relacionados con la homeostasis de matriz extracelular mostraron un impacto pronóstico, con peores resultados en los pacientes con valores basales más altos, así como una mejoría pronóstica en el objetivo primario del estudio en caso de reducirse las cifras de ST2 soluble y la metaloproteasa tisular en tratamiento con SV a los 8 meses del inicio del tratamiento.
Metabolismo hidrocarbonadoUna interesante línea de investigación con SV se encuentra en su efecto en el metabolismo hidrocarbonado20, donde se observan reducciones ligeras de glucohemoglobina (HbA1c) (enalapril, el 0,16% a 1 año; SV, el 0,26% a 1 año), con menor necesidad de insulinización en la rama de SV, con reducciones de un 29% a lo largo del ensayo (inicio de insulina: enalapril, un 10%; SV, un 7%), en probable relación con el efecto GLP1 de la neprilisina.
Beneficio cardiovascular de los ísglt2AntecedentesEn los últimos años asistimos a una revolución en el tratamiento de la diabetes mellitus, puesto que por primera vez se ha empezado a objetivar beneficio clínico en objetivos duros como mortalidad, infarto de miocardio u hospitalización por IC. Sin embargo, no siempre fue así. Durante gran parte del siglo anterior, la diabetes mellitus se consideraba una mera alteración en el metabolismo de la glucosa. Por lo tanto, no es de extrañar que la inmensa mayoría de los fármacos antidiabéticos centraran su efecto en conseguir una disminución de la glucemia que la acercara lo máximo posible a la normalidad.
Si bien es cierto que un control más estricto de la glucemia se había asociado con una disminución de la afección microvascular (neuropatía, nefropatía, retinopatía), no había evidencia alguna que indicara un beneficio similar en la macrovascular (mortalidad cardiovascular, infarto, ictus).
De hecho, un metanálisis sobre los efectos macrovasculares de la rosiglitazona21, en el que se demostró un incremento en la incidencia de infarto de miocardio y una tendencia hacia una mayor mortalidad cardiovascular, cambió el enfoque y el diseño de los ensayos clínicos con fármacos antidiabéticos ulteriores. A partir de 2008, la Food and Drug Administration (FDA) comenzó a exigir la realización de ensayos clínicos específicamente diseñados para evaluar la repercusión cardiovascular de los nuevos fármacos.
Beneficio clínico de los iSGLT2Los iSGLT2 constituyen una nueva clase farmacológica disponible dentro del gran arsenal terapéutico para la diabetes mellitus tipo 2. Pero, a diferencia de otros grupos, se ha demostrado repetida y consistentemente que produce marcados beneficios macrovasculares hasta hace poco inimaginables, y más concretamente cardiovasculares.
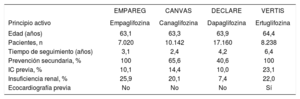
La sucesiva publicación de los estudios EMPAREG, CANVAS y DECLARE22-24, realizados respectivamente con empaglifozina, canagli- fozina y dapaglifozina, muestran una mejoría no solo en el objetivo principal combinado de muerte de causa cardiovascular, ictus o infarto de miocardio (en torno al 10-15%), sino también una reducción de riesgo incluso mayor en la tasa de hospitalización por IC (aproximadamente un 30%).
Además, dichos fármacos proporcionan una excelente nefropro- tección, con un descenso del 45% del objetivo compuesto de deterioro de la función renal, enfermedad renal terminal y muerte de causa renal, homogéneo en todos los estadios de insuficiencia renal a partir de tasas de filtrado glomerular gt; 30 ml/min.
Agrupando los estudios en metanálisis25, se aprecia incluso una ligera reducción en la mortalidad total del 10-15%. Llamativamente, todo ello se consigue a pesar de una muy discreta reducción de la HbA1c del 0,4-0,6%.
Todavía hay cierta incertidumbre acerca de un hipotético efecto de clase. Aunque la tendencia hacia la reducción de eventos clínicos en los diferentes objetivos es homogénea, la magnitud de dicho beneficio es variable según el fármaco. No obstante, con la creciente disponibilidad de información cada vez se acepta más la teoría de que la diversidad apreciada entre los iSGLT2 se debe principalmente a las diferencias en las características basales de la población incluida en los ensayos. De modo que, a mayor riesgo de la población estudiada, mayor beneficio observado (tabla 1, que incluye el ensayo VERTIS-CV realizado con ertuglifozina26).
Características basales de las poblaciones incluidas en los diferentes ensayos clínicos con iSGLT2
| EMPAREG | CANVAS | DECLARE | VERTIS | |
|---|---|---|---|---|
| Principio activo | Empaglifozina | Canaglifozina | Dapaglifozina | Ertuglifozina |
| Edad (años) | 63,1 | 63,3 | 63,9 | 64,4 |
| Pacientes, n | 7.020 | 10.142 | 17.160 | 8.238 |
| Tiempo de seguimiento (años) | 3,1 | 2,4 | 4,2 | 6,4 |
| Prevención secundaria, % | 100 | 65,6 | 40,6 | 100 |
| IC previa, % | 10,1 | 14,4 | 10,0 | 23,1 |
| Insuficiencia renal, % | 25,9 | 20,1 | 7,4 | 22,0 |
| Ecocardiografía previa | No | No | No | Sí |
IC: insuficiencia cardiaca.
Debido a los efectos cardioprotector y renoprotector de este grupo farmacológico, se han dedicado numerosos esfuerzos tanto experimentales como clínicos a intentar entender el modo de actuar de los iSGLT2.
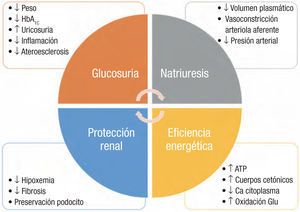
Aunque a priori el mecanismo de acción puede parecer tan simple como la mera glucosuria, en realidad los iSGLT2 modulan diferentes procesos metabólicos a diversos niveles27 (figura 2):
- •
Por un lado, por medio de la glucosuria posibilitan un balance calórico negativo, que a su vez conlleva una pérdida de peso y disminución de la grasa epicárdica, con la consiguiente reducción de inflamación y fibrosis. Además, el descenso de la HbA1c y la urico- suria que producen enlentencen la progresión de la ateroesclero- sis.
- •
Por otro lado, por medio de la natriuresis se reducen la presión arterial y la rigidez arterial, así como disminuyen, el volumen plasmático y, por tanto, la tensión parietal miocárdica. Asimismo, la regulación del feedback glomérulo-tubular conduce a una vasoconstricción de la arteriola aferente, lo que constituye un mecanismo protector contra la hiperfiltración glomerular.
- •
La utilización de iSGLT2 a dosis alta es capaz de reducir en aproximadamente 4 mmHg la presión arterial sistólica, de manera similar a dosis bajas de hidroclorotiazida28. El efecto diurético se produce fundamentalmente a expensas de la reducción del edema interstiticial, a diferencia de la depleción intravascular producida por los diuréticos del asa, lo que evitaría la activación neurohormonal deletérea típica de la IC29.
- •
En los riñones, además de la natriuresis y la restauración de un adecuado feedback glomérulo-tubular, se hipotetiza que los iSGLT2 preservarían la estructura y la composición del podocito mediante el mantenimiento de los filamentos de actina (dañados por la proteinuria), y reducirían la hipoxemia, la activación fibroblástica y la fibrosis secundarias a la sobrecarga de glucosa en las células epiteliales del tùbulo contorneado proximal30‘31.
- •
Por ùltimo, existe una mejora en la eficiencia energética miocár- dica, con una reducción en la cantidad intracitoplásmica de calcio y un incremento en la producción de ATP, fundamentalmente por un incremento de los cuerpos cetónicos y un mejor aprovechamiento de la oxidación de la glucosa32,33.
Como ya se ha mencionado, la reducción de las hospitalizaciones por IC son el beneficio fundamental derivado de la utilización de iSGLT2.
Se observó una disminución del 30% del riesgo relativo en los diferentes estudios, homogéneo tanto en prevención primaria como secundaria, e independientemente de que hubiera antecedentes de IC o no34. Además, el porcentaje de reducción en el reingreso por IC se relacionó de modo inversamente proporcional con la función renal (reducciones del 40, el 31 y el 12% para tasas de filtrado glomerular
60, 60-90 y gt; 90 ml/min respectivamente)25. Subanálisis posteriores han demostrado incluso una reducción de las rehospitalizaciones tras un ingreso previo por IC35.
Recientemente se ha comunicado cierto efecto diferencial de la dapaglifozina al estratificar a la población del ensayo DECLARE por fracción de eyección del ventrículo izquierdo basal, con una mayor reducción en mortalidad cardiovascular y hospitalizaciones por IC en el subgrupo de fracción de eyección del ventrículo izquierdo reducida (hazard ratio [HR] = 0,62 frente a HR = 0,88), si bien es cierto que dicho subgrupo suponía ùnicamente un 3,9% del total de la población36.
Sin embargo, ¿hasta qué punto son valorables las reducciones en la hospitalización por IC derivadas de la utilización de iSGLT2?
La hospitalización por IC fue un objetivo secundario en estos ensayos, perfectamente definido en el diseño y adecuadamente recogido en la evolución. No obstante, el problema surge al analizar las características basales de los pacientes incluidos. Únicamente entre un 10 y un 15% presentaban IC diagnosticada antes de su inclusión en los diferentes estudios, y no se recogió ningùn tipo de información relativa a clase funcional, fracción de eyección del ventrículo izquierdo o bio- marcadores basales ni durante la evolución.
Afortunadamente, la duda sobre el beneficio real de la utilización de iSGLT2 en pacientes con IC establecida empieza a disiparse tras la presentación del estudio DAPA-HF. En dicho ensayo, el empleo de dapaglifozina en pacientes sintomáticos con IC establecida y FEVI
o = 40% con niveles de péptidos natriuréticos elevados y tratamiento médico óptimo, tanto con como sin DM conocida (55% de pacientes incluidos no diabéticos), mostró una reducción del 25% del evento combinado de muerte cardiovascular e ingreso por IC, tanto de forma conjunta como en cada uno de los objetivos por separado, incluyendo una disminución de la mortalidad total al añadir dapagliflocina al tratamiento óptimo de IC37. Dicho beneficio fue independiente de la existencia o no de DM basal.
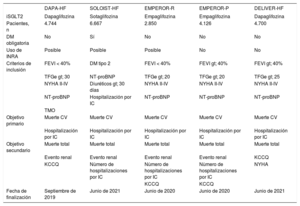
Perspectivas futurasLa caracterización de los diferentes subgrupos de IC en los que la utilización de iSGLT2 podría ser eficaz como tratamiento específico de dicho síndrome se encuentra actualmente en desarrollo (tabla 2)38. Cabe destacar que el diseño de los diferentes ensayos clínicos en marcha comprende no solo la distinción entre IC con fracción de eyección reducida o conservada, sino que también incluye un gran número de pacientes sin diabetes mellitus establecida, puesto que se cree que son la natriuresis y la consiguiente regulación del feedback glomérulo-tubular, y no tanto la glucosuria, el mecanismo fundamentalmente implicado en la reducción de los ingresos por IC.
Ensayos clínicos en marcha para valorar la eficacia de iSGLT2 en diferentes poblaciones con insuficiencia cardiaca
| DAPA-HF | SOLOIST-HF | EMPEROR-R | EMPEROR-P | DELIVER-HF | |
|---|---|---|---|---|---|
| iSGLT2 | Dapaglifozina | Sotaglifozina | Empaglifozina | Empaglifozina | Dapaglifozina |
| Pacientes, n | 4.744 | 6.667 | 2.850 | 4.126 | 4.700 |
| DM obligatoria | No | Sí | No | No | No |
| Uso de INRA | Posible | Posible | Posible | No | No |
| Criterios de inclusión | FEVI < 40% | DM tipo 2 | FEVI < 40% | FEVI gt; 40% | FEVI gt; 40% |
| TFGe gt; 30 | NT-proBNP | TFGe gt; 20 | TFGe gt; 20 | TFGe gt; 25 | |
| NYHA II-IV | Diuréticos gt; 30 días | NYHA II-IV | NYHA II-IV | NYHA II-IV | |
| NT-proBNP | Hospitalización por IC | NT-proBNP | NT-proBNP | NT-proBNP | |
| TMO | |||||
| Objetivo primario | Muerte CV | Muerte CV | Muerte CV | Muerte CV | Muerte CV |
| Hospitalización por IC | Hospitalización por IC | Hospitalización por IC | Hospitalización por IC | Hospitalización por IC | |
| Objetivo secundario | Muerte total | Muerte total | Muerte total | Muerte total | Muerte total |
| Evento renal | Evento renal | Evento renal | Evento renal | KCCQ | |
| KCCQ | Nùmero de hospitalizaciones por IC | Nùmero de hospitalizaciones por IC | Nùmero de hospitalizaciones por IC | NYHA | |
| KCCQ | KCCQ | ||||
| Fecha de finalización | Septiembre de 2019 | Junio de 2021 | Junio de 2020 | Junio de 2020 | Junio de 2021 |
DM: diabetes mellitus; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; INRA: inhibidores de la neprilisina y del receptor de la angiotensina; NYHA: clase funcional de la New York Heart Association; TFGe: tasa de filtrado glomerular estimada; TMO: tratamiento médico óptimo.
Por otra parte, han comenzado a conocerse los resultados de ensayos clínicos dirigidos a valorar eventos fundamentalmente renales: el estudio CREDENCE, que incluyó a pacientes con diabetes tipo 2 e insuficiencia renal crónica y macroalbuminuria (tasa de filtrado glomerular de 30-90 ml/min y cociente albúmina/creatinina gt; 300), se ha interrumpido prematuramente debido a una reducción del 30% en el objetivo primario renal (diálisis, trasplante renal o reducción mantenida del filtrado glomerular gt; 15 ml/min) en el grupo de canaglifozina comparada con placebo39. Los ensayos Dapa-CKD y EMPA-KIDNEY, actualmente en marcha, añadirán información sobre el posible efecto renal de clase de los iSGLT2, tanto en pacientes diabéticos como en no diabéticos.
Sacubitrilo-valsartán e isglt2 en la ic: ¿separación de poderes o bienes gananciales? cómo manejar la combinaciónConceptos generales de la combinaciónParece claro que, con la evidencia actual previamente revisada, muchos de nuestros pacientes con IC crónica, fracción de eyección reducida y diabetes (e incluso no diabéticos) se van a beneficiar del uso concomitante de SV y un fármaco glucosúrico.
No obstante, y sin una evidencia científica clara sobre el uso concomitante de estos 2 nuevos fármacos (en el ensayo DAPA-HF solo un 11% de los pacientes incluidos estaba en tratamiento con SV)37, siempre que se tenga en la consulta a un paciente con IC y diabetes, se debe tener en cuenta los siguientes factores basados en la evidencia actual disponible:
- •
En un paciente con IC crónica, FEVI reducida y clase funcional NYHA II-IV, y siguiendo las recomendaciones de la guía de práctica clínica de la Sociedad Europea de Cardiología, se debe optimizar el tratamiento de la IC con los siguientes objetivos terapeúticos: reducir la mortalidad cardiovascular, la mortalidad por IC, la muerte súbita y las hospitalizaciones40.
- •
En caso de que el paciente con IC sea además diabético, los fármacos glucosúricos son el segundo escalón en el tratamiento antidia bético. Estudios no diseñados para población con IC demuestran una reducción de las hospitalizaciones, principalmente en pacientes sin antecedentes de IC25.
- •
Respecto al uso combinado de estos 2 fármacos, es posible la siguiente situación: pacientes con IC tratados con SV para quienes está indicado el uso de un iSGLT2 con el objetivo terapéutico de mejorar el control de su diabetes, o un paciente diabético tratado con iSGLT2 que contrae IC para el que se decide optimizar el tratamiento con SV.
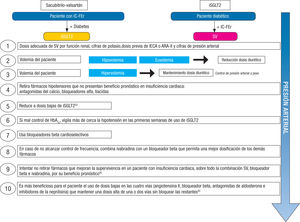
En cualquiera de los 2 casos anteriores se suma el efecto vasodilatador de los péptidos al aumento de la glucosuria y la natriuresis, 2 situaciones que reducen la presión arterial. Por lo tanto, se debe prestar especial atención al manejo práctico de las cifras tensionales (figura 3), teniendo en cuenta estos 10 puntos:
- 1.
1. Pautar la dosis ajustada de SV según dosis previa de IECA/ARA-II, cifras de presión arterial, filtrado renal y cifras de potasio, teniendo en cuenta que el beneficio clínico frente a enalapril es similar en las 3 dosis de SV41.
- 2.
Evaluar el estado volémico: en caso de euvolemia o hipovolemia, se reduce la dosis de diurético que el paciente esté tomando.
- 3.
Evaluar el estado volémico: en caso de hipervolemia, se mantiene el tratamiento médico previo, revaluando la presión arterial y el peso de manera frecuente.
- 4.
En caso de hipotensión: se retiran los fármacos hipotensores que no produzcan beneficio pronóstico en la IC: antagonistas del calcio, bloqueadores alfa, tiacidas.
- 5.
En caso de que persistan las cifras de presión arterial bajas y sintomáticas, se reduce la dosis de iSGLT2 si es posible, dado que los beneficios cardiovasculares son idénticos con dosis bajas y altas22.
- 6.
Se monitoriza de manera frecuente las cifras de presión arterial en caso de añadirse iSGLT2 y mal control glucémico previo.
- 7.
Usar bloqueadores beta cardioselectivos, evitando fármacos con efecto alfa.
- 8.
En caso de no alcanzarse la frecuencia cardiaca objetivo, se valora la introducción de ivabradina en combinación para permitir titular los demás fármacos.
- 9.
Inténtese no retirar fármacos que mejoran la supervivencia a un paciente con IC, sobre todo la combinación de SV, bloqueador beta y antagonista del receptor de mineralocorticoides, por el beneficio pronóstico de la combinación42.
- 10.
Es más beneficioso para el paciente el uso de dosis bajas en las 4 vías (angiotensina II, bloqueador beta, antagonista de la aldoste- rona e inhibidores de la neprilisina) que mantener una dosis alta de 1 o 2 vías sin bloquear las restantes43.
En el momento actual, y a la espera de nuevos estudios en el campo de los iSGLT2 en pacientes con antecedentes de IC, la combinación de fármacos que ha mostrado mayor beneficio pronóstico en la IC es la de bloqueador beta, antagonista del receptor de mineralocor- ticoides y SV42.
Con respecto al SV, la mejoría pronóstica evidenciada en el PARA- DIGM-HF1 se ha reforzado a lo largo de los últimos años con nuevos estudios que indican nuevos efectos sistémicos de dicha molécula: la mejora en la calidad de vida, la reducción de la carga arrítmica, el efecto protector renal y el efecto metabólico, todo ello causado posiblemente por los más de 50 péptidos vasoactivos que se ven afectados por la acción de la inhibición de la neprilisina (figura 1).
Por otra parte, los iSGLT2 se han convertido en una familia de fármacos utilizados de manera habitual en las consultas de cardiología. No obstante, y aunque su beneficio cardiovascular está sobradamente demostrado en el paciente diabético, todavía se debe esperar a la publicación de nuevos estudios en poblaciones específicas con IC para conocer su posicionamiento terapéutico en este tipo de pacientes, ya sean con fracción de eyección conservada o reducida.
Como conclusión, y gracias a la evidencia disponible de ambas moléculas, parece evidente que será una combinación de amplio uso en IC, cuyo tratamiento conjunto se debe conocer, prestando especial atención a las cifras de presión arterial y la función renal.
Conflicto de interesesA. Valle declara que ha recibido honorarios por consultoría de Novartis, MSD, Astra Zeneca, Boehringer Ingelheim y Janssen, y honorarios por ponencias de Novartis, MSD, Astra Zeneca, Boehringer Ingelheim, Janssen y Rovi y honorarios por desarrollo de presentaciones educativas de Novartis y MSD. H. Morillas Climent declara que ha recibido honorarios por ponencias de Novartis y honorarios por presentaciones educativas de Novartis y Rovi. Á. Vicedo López no declara ninguno.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Controversias para una nueva era en el tratamiento de la insuficiencia cardiaca», que ha sido patrocinado por Novartis.