La hipertensión pulmonar (HP) es una enfermedad progresiva e irreversible que, si no se detecta precozmente, puede progresar a fallo del ventrículo derecho e insuficiencia cardiaca (IC) terminal. Se han desarrollado importantes avances en cuanto al tratamiento farmacológico1, pero aun así la esperanza de vida sigue siendo corta, del 57% a los 5 años, y es más agresiva en niños que en adultos2.
La septostomía auricular (SA) es una estrategia indicada para niños con HP en clase funcional III o IV de la clasificación de Ross que sufran síncopes recurrentes y/o IC derecha refractaria a la terapia médica, como puente al trasplante pulmonar3,4. Las contraindicaciones principales son una presión media en la aurícula> 20mmHg y una saturación de oxígeno <90%5.
La SA se puede realizar de varias formas; una de las más empleadas y utilizada en nuestro centro es la colocación de un stent en el tabique interauricular. Esta técnica se realiza con una vaina de 7 Fr y una aguja de Brockenbrough pediátrica, que previamente ha pasado en cava inferior por dentro de un lazo de 15mm puesto desde la vena contralateral. Una vez se ha comprobado que la presión en la aurícula derecha no contraindica el procedimiento, se realiza la punción del tabique y se pasa la vaina a la aurícula izquierda y una guía coronaria a la vena pulmonar. Se selecciona un stent Palmaz Génesis large de 10×19mm y se coloca centrado en el tabique. Luego se coloca el lazo en mitad del stent, y se procede a la dilatación, que está limitada por el lazo en la zona central, con lo que el stent adquiere forma de diábolo y gran estabilidad. Entonces se dilata con balones coronarios/periféricos, en función de la saturación, hasta llegar a un máximo de 5-7mm según el tamaño del paciente; se puede volver a disminuir el calibre del defecto, si así se considera oportuno, ciñendo el lazo. Así se puede regular y adaptar el defecto a la situación del paciente.
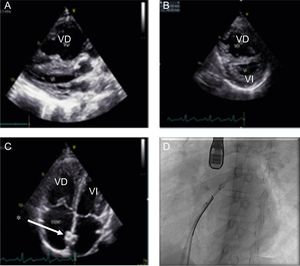
Se revisaron retrospectivamente las historias clínicas de todos los pacientes en edad pediátrica con diagnóstico de HP intervenidos con SA en nuestro centro, el 90,9% de los procedimientos de los últimos 10 años. Se realizó con anestesia general y guiada por ecocardiografía transesofágica (figura 1), y como parte del protocolo se estableció seguimiento y observación durante 24 h en la unidad de cuidados intensivos pediátricos con la medicación vasodilatadora pulmonar habitual.
A: ecocardiografía; se observa la dilatación del VD que comprime el VI. B: TIV de tipo IV y alteración del índice de esfericidad, signos ecocardiográficos de HP grave. C: imagen del stent (*) correctamente posicionado. D: cateterismo; colocación del stent guiado por ETE. ETE: ecocardiografía transesofágica; TIV: tabique interventricular; VD: ventrículo derecho; VI: ventrículo izquierdo.
Para los análisis estadísticos se utilizó SPSS STATISTICS Versión 24 (IBM Corp). Las variables continuas se evaluaron por mediana (intervalo) y las discontinuas, por porcentajes. La desaparición de los síntomas se evaluó mediante la prueba de la χ2 (prueba exacta de Fisher), y se consideró estadísticamente significativo un valor de p <0,05. Se trazó la supervivencia en curvas de Kaplan-Meier.
Se practicó la SA en 11 de un total de 45 niños en seguimiento por HP (24,4%), todos afectados de HP tipo I (en 8, idiopática o familiar); la distribución por sexo fue similar (el 45,5% eran niñas). La media de edad al diagnóstico y a la realización de la SA eran 3,10 (0,08-7,90) y 4,86 (0,39-11,87) años respectivamente. El tiempo entre el diagnóstico de HP y el procedimiento fue en promedio de 20,4 meses (tabla 1).
Datos de los pacientes y procedimientos de septostomía auricular en edad pediátrica
| Edad alDx (años) | Edad a la SA (años) | Sexo | Tipo de HP I | Indicación de SA | Tratamiento VDP | Tipo de SA | SA (mm) | PAD (mmHg) | PAPmedia (mmHg) | Satpre-SA (mmHg) | Sat O2post-SA (mmHg) | TAPSE pre-SA (mm) | TAPSE post-SA (mm) | Complicaciones | Evolución | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 3,4 | 8,75 | V | CC | ICDR | Bosentán, sildenafilo, iloprost | Stent | 5 | 11 | 46 | 96 | 100 | 12 | 12 | No | Clase funcional III inicial pasó a clase II |
| 2 | 2,8 | 2,85 | V | Idiopática | ICDR | Óxido nítrico, sildenafilo, prostaciclina | Stent | 10 | 8 | 81 | 100 | 95 | 13 | 12 | No | Sin mejoría de la clase funcionalMuerte a los 34 días de la SA |
| 3 | 7,2 | 7 | M | Idiopática | ICDR | Óxido nítrico | Angioplastia y dilatación con balón | 12 | 8 | 62 | 97 | 97 | 17 | 17 | No | Clase IV inicial pasó a clase II |
| 4 | 7,9 | 11,8 | M | Idiopática | SE | Bosentán, sildenafilo, iloprost | Stent | 4 | 8 | 77 | 100 | 91 | 13 | 16 | No | Sin síncopesSe trasplantó 6,5 meses tras la SA |
| 5 | 6,5 | 10,83 | M | Idiopática | SE | Bosentán, sildenafilo, iloprost, nifedipino | Stent | 5 | 9 | 44 | 99 | 100 | 23 | 25 | No | Desaparición de síncopes |
| 6 | 0,3 | 0,38 | M | Idiopática | ICDR | Óxido nítrico, sildenafilo, epoprostenol | Stent | 10 | 8 | 62 | 94 | 97 | 10 | 25 | No | Clase III inicial pasó a clase II |
| 7 | 0,7 | 0,78 | V | Idiopática | ICDR | Bosentán, sildenafilo, iloprost | Stent | 4,5 | 16 | 79 | 98 | 85 | 11 | 13 | No | Sin mejoría de la clase funcionalMuerte a los 35 días de la AS |
| 8 | 1,8 | 1,89 | M | Idiopática | ICDR | Bosentán, sildenafilo | Stent | 3,5 | 12 | 56 | 100 | 76 | 11 | 9 | Crisis de HP | Sin mejoría de la clase funcionalSe trasplantó 13 meses tras la SA |
| 9 | 2,7 | 4,68 | V | CC | SE | Bosentán, sildenafilo, iloprost | Stent | 5 | – | – | 100 | – | 2 | 24 | No | Sin síncopes de esfuerzo (reaparecieron a los 4 años) |
| 10 | 0,2 | 2,78 | V | Familiar | SE | Bosentán, sildenafilo, iloprost, nifedipino | Stent | 10 | 11 | 87 | 99 | 91 | 9 | 15 | No | Sin síncopes de esfuerzoSe trasplantó 2 años y 11 meses tras la SA |
| 11 | 0,08 | 1,68 | V | CC | SE | Bosentán, sildenafilo, iloprost | Quirúrgico (agenesia de VCI) | 6 | 10 | 43 | 98 | 98 | 9 | 10 | Crisis de HP | Sin síncopes de esfuerzoSe trasplantó 1 año y 3 meses tras la SA |
CC: cardiopatía congénita; Dx: diagnóstico; HP: hipertensión pulmonar; ICDR: insuficiencia cardiaca derecha refractaria; M: mujer; PAD: presión media en la aurícula derecha; PAP: presión media en la arteria pulmonar; SA: septostomía auricular; SE: síncope de esfuerzo; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; V: varón; VCI: vena cava inferior.
Un total de 5 niños (45,45%) tenían síncopes, que desaparecieron tras la SA, y 6 tenían signos de insuficiencia del ventrículo derecho a pesar del tratamiento vasodilatador pulmonar optimizado (el 63,3% con triple terapia). La SA se realizó por intervencionismo en 10 (9 con stent y 1 con angioplastia y dilatación con balón) y en 1 caso, tras intento hemodinámico fallido, fue quirúrgica. La mediana del tamaño de la SA fue de 5 (3,5-12) mm.
No hubo mortalidad periprocedimiento. Como complicaciones asociadas, 2 pacientes sufrieron crisis HP grave durante el procedimiento, 1 requirió adrenalina, óxido nítrico inhalado, iloprost y epoprostenol y luego se estabilizó, y 1 requirió aumento del tratamiento vasodilatador pulmonar. No se observaron cambios iniciales significativos en los valores ecocardiográficos de remodelación y función del ventrículo derecho, como el índice de esfericidad y el tipo de tabique interventricular, pero sí mejora del desplazamiento sistólico del plano del anillo tricuspídeo en 3 casos (27,2%).
La mediana de seguimiento fue de 25,85 meses. La supervivencia libre de eventos (muerte y/o trasplante) al mes fue del 100%; a los 6 meses, el 72,72% (2 pacientes fallecieron por progresión de su enfermedad y no llegaron al trasplante pulmonar); al año, el 72,72% y a los 2 años, el 54,54% (4 pacientes se sometieron a trasplante). La presencia del stent no representó ninguna dificultad añadida y se retiró durante el mismo acto operatorio.
La SA en niños con HP es un procedimiento que, a pesar del riesgo por su situación clínica, tiene baja mortalidad, permite mejorar la situación clínica con desaparición de los síncopes, aunque la progresión de la enfermedad continúa. Cabe destacar que, pese a tratarse de una revisión retrospectiva, una muestra heterogénea y un pequeño número de pacientes, es la serie más larga de niños tratados con esta técnica en España.
CONFLICTO DE INTERESESA. Moreno-Galdó ha recibido pagos por conferencias de Abbvie y asistencia a congresos de Novartis y Actelion. D.C. Albert Brotons ha recibido pagos por asistencia a congresos de Actelion.