Palabras clave
INTRODUCCIÓN
Las cámaras cardiacas derechas y la circulaciónpulmonar tienen un importante papel en la homeostasis cardiovascular tanto en condiciones normalescomo en estados patológicos. Sin embargo, loscambios de su anatomía y función asociados a laenfermedad se han considerado a menudo menos trascendentes que los que se producen en el lado izquierdo, en especial en el ámbito clínico. Una de lasrazones de esta disparidad es la disponibilidad másamplia y precoz de técnicas de imagen no invasivaspara una evaluación exacta y fiable de la funcióndel ventrículo izquierdo. Durante mucho tiempo, elcateterismo cardiaco derecho y la angiografía decontraste han sido los métodos de referencia para elestudio de la anatomía del corazón derecho y la circulación pulmonar, así como de sus repercusioneshemodinámicas en diferentes enfermedades. En lasúltimas tres décadas se ha producido un desplazamiento progresivo hacia métodos no invasivos, especialmente debido a las mejoras conseguidas enecocardiografía, tomografía computarizada (TC) yresonancia magnética (RM).
La modalidad ideal de diagnóstico por imagendebe permitir evaluar no sólo la circulación pulmonar y las cámaras cardiacas derechas, sino también el corazón izquierdo y, de ser posible, la ventilación pulmonar. Sería deseable que proporcionarauna alta resolución en los detalles anatómicos,junto con información funcional, por ejemplo sobrelos patrones de flujo sanguíneo o los cambios dinámicos durante el ciclo cardiaco. Debería ser unatécnica exacta, reproducible, ampliamente disponible, no invasiva y de bajo coste. Lamentablemente,ninguna de las modalidades existentes cumple todasestas exigencias, y todas ellas tienen puntos fuertesy limitaciones específicas. En esta revisión abordaremos las aplicaciones específicas de las diferentestécnicas de imagen para el estudio del corazón derecho y la circulación pulmonar, con especial referencia a la hipertensión pulmonar (HP).
RADIOGRAFÍA DE TÓRAX
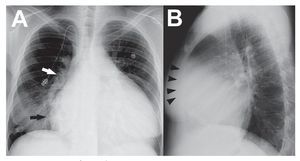
La radiografía de tórax es una técnica barata yampliamente disponible, pero proporciona tan sólouna información aproximada respecto al estadocardiopulmonar. Aunque su sensibilidad es alta, lasanomalías observadas en la radiografía simple detórax frecuentemente carecen de especificidad1. Enel caso de la HP, los signos radiográficos tienden amostrar una mala correlación con la gravedad de laenfermedad, y es frecuente que aparezcan en unafase avanzada de ésta. El crecimiento auricular derecho se aprecia sobre todo por una convexidadprominente en la parte inferior del borde cardiacoderecho en la proyección posteroanterior (fig. 1A).La dilatación ventricular derecha (VD) se detectamejor en la proyección lateral cuando la silueta cardiaca ocupa más del 40% del espacio retroesternalinferior (fig. 1B). Además, la dilatación de las cámaras cardiacas derechas produce una rotación ensentido posterior del eje cardiaco y un desplazamiento lateral del tracto de salida del VD, lo cualda lugar a un contorno de la «arteria pulmonar»más prominente en el borde cardiaco izquierdo. Laradiografía también puede identificar signos deetiologías subyacentes, como anomalías del parénquima pulmonar o una cardiopatía izquierda2.
Fig. 1. A: radiografía de tórax posteroanterior en un paciente con hipertensión pulmonar idiopática, en la que se aprecia cardiomegalia significativa, dilatación de la aurícula derecha (flecha negra), arterias pulmonares centrales dilatadas (arteria pulmonar derecha, flecha blanca) y reducción difusa de la vascularización periférica. Se observa también un catéter intravascular para infusión de medicación. B: radiografía de tórax lateral en el mismo paciente, que muestra crecimiento del ventrículo derecho (puntas de flecha negras).
Por lo que respecta a la circulación pulmonar, ladilatación de las arterias pulmonares centralespuede cuantificarse sumando las distancias horizontales de las primeras divisiones de las arterias pulmonares derecha e izquierda hasta la línea media ydividiendo el resultado por el diámetro transversalmáximo del tórax. Un valor > 0,38 a menudo indica presiones pulmonares elevadas3. Los diámetrosde las AP descendentes derecha e izquierda > 16 y> 18 mm, respectivamente, en la proyección posteroanterior también indican HP4. Mientras que enlas comunicaciones sistemicopulmonares se produce un aumento de la densidad vascular periférica(hiperemia por shunt), un signo característico de laHP es la imagen de «árbol podado» (por reduccióndel calibre y la densidad de los vasos periféricos)2,5.
Puede observarse dilatación postestenótica de la APprincipal y la AP izquierda en casos de estenosisvalvular pulmonar, mientras que la dilatación deAP y VD sin hiperemia ni imagen de «árbol podado» puede indicar insuficiencia de la válvula pulmonar. Además, los signos de HP con parénquimapulmonar normal junto con oligoemia regional sugieren HP tromboembólica crónica (HPTEC)2.
ECOCARDIOGRAFÍA
La ecocardiografía es la técnica de diagnósticopor imagen más frecuentemente utilizada para laevaluación sistemática del VD por su amplia disponibilidad, su seguridad extrema y su coste relativamente bajo5. La combinación de ecografía bidimensional (2D), modo M y Doppler permite evaluar demanera simultánea las funciones ventricular y valvular. Proporciona información hemodinámica deinestimable valor, con una caracterización de losflujos tanto en el lado izquierdo como en el lado derecho del corazón. Sin embargo, no es apropiadapara el examen de los vasos pulmonares (excepto laAP principal). Además, las técnicas estándar tienenlimitaciones debidas a la geometría compleja delVD y su posición retroesternal, así como a la marcada dependencia hemodinámica de los índices funcionales del VD, por lo que la cuantificación frecuentemente sólo es estimativa. Avances recientespueden aportar información complementaria a lasmedidas 2D estándar (tabla 1).
Modalidades ecocardiográficasconvencionales
Evaluación del ventrículo derecho
Una adecuada evaluación del tamaño, el volumeny la contractilidad del VD requiere un conjuntocompleto de imágenes 2D estandarizadas6. Las alteraciones características de la sobrecarga de volumeny/o presión del VD incluyen la dilatación de la aurícula derecha y del VD, con o sin hipertrofia del VD,y la disfunción sistólica del VD (fig. 2A). Un valor> 5 mm del grosor de la pared libre del VD en telediástóle (medido en la proyección subcostal decuatro cámaras) indica hipertrofia y se asocia conaumento crónico de la poscarga7.
Fig. 2. A: proyección de cuatro cámaras de una ecocardiografía bidimensional en un paciente con hipertensión pulmonar severa, en la que se aprecia aumento de tamaño del ventrículo derecho (flecha blanca), un ventrículo izquierdo pequeño (punta de flecha blanca) y aplanamiento del septo. Se indica con el asterisco la presencia de derrame pericárdico. Además, el Doppler color muestra insuficiencia tricuspídea. B: el registro Doppler continuo del jet de regurgitación tricuspídeo permite medir la velocidad máxima de regurgitación (flecha blanca) de 3,9 m/s que corresponde a un gradiente de presión máximo de 60,8 mmHg entre el ventrículo derecho y la aurícula derecha.
Los volúmenes del VD son difíciles de cuantificar, dadas la compleja geometría del VD y la dificultad de trazar la superficie endocárdica intensamente trabeculada. Así pues, los métodos 2D que sebasan en la fórmula de Simpson carecen de estandarización y tienen tendencia a infravalorar los volúmenes. En su lugar, a menudo se utiliza la estimación visual del tamaño del VD en comparación conel ventrículo izquierdo o las mediciones de los diámetros transversal y longitudinal. Un patrónanormal del movimiento del tabique interventricular (desplazamiento hacia la izquierda en la sístole o la diástole cuando hay sobrecarga de presióno de volumen, respectivamente) refleja una hemodinámica anormal del VD. La convexidad del septointerventricular hacia el lado izquierdo conduce aun llenado ventricular insuficiente y una reduccióndel volumen de eyección, incluso con función sistólica normal (fig. 2A). El índice de excentricidad ventricular izquierdo se calcula mediante el cocienteentre la distancia anteroposterior y la septolateralde la cavidad ventricular izquierda en la proyecciónde eje corto. Un valor de 1 se considera normal8, y un índice diastólico de excentricidad elevado se harelacionado con la incidencia de muerte o trasplantepulmonar en la HP idiopática9. Además, el gradode curvatura septal y su relación con la curvaturade la pared libre ventricular izquierda pueden utilizarse para estimar los gradientes de presión transeptal y las presiones sistólicas del VD10.
El desplazamiento longitudinal del plano anulartricuspídeo del VD hacia el ápex cardiaco (tricuspidannulus plane systolic excursion [TAPSE]) se calculaen modo M utilizando la proyección de cuatro cámaras apical. Un valor < 1,8 cm indica disfuncióndel VD y se ha demostrado que predice la supervivencia en la HP11. Este método muestra una fuertecorrelación con la fracción de eyección del VD en laangiografía radioisotópica12, aunque tiene pobrecorrelación con la RM13. Aunque es un método rápido y sencillo, es de carácter unidimensional y refleja principalmente la función sistólica regional(basal) del VD. La determinación del acortamientofraccional del tracto de salida del VD puede aportarun valor adicional al TAPSE. El acortamiento fraccional del área del VD se define como el porcentajede cambio en el área del VD en una proyección decuatro cámaras apical durante el ciclo cardiaco, yparece ser el parámetro que guarda mejor correlación con la RM13. El índice de Tei o índice de función miocárdica global del VD es una evaluaciónconjunta de las funciones sistólica y diastólica del VD. Se define como el cociente del tiempo isovolumétrico total del VD (tiempo de contracción isovolumétrica más tiempo de relajación isovolumétrica)dividido por el tiempo de eyección del VD14. Elvalor normal es 0,28 ± 0,04, y un índice elevado (≥ 0,83) se asocia a un aumento de la mortalidad cardiaca y de la necesidad de trasplante de pulmón enlos pacientes con HP15. El índice de Tei ha mostrado una correlación significativa con la fracciónde eyección del VD en la ventriculografía radioisotópica y, según se ha descrito, es más independientede las condiciones de carga y de la frecuenciacardiaca14,16.
Evaluación hemodinámica de la circulaciónpulmonar
La ecocardiografía Doppler permite realizar unaestimación no invasiva de las presiones de la AP yde las resistencias vasculares. La velocidad del jetde regurgitación tricuspídea es el método utilizadocon más frecuencia en la práctica clínica para calcular la presión sistólica de la AP mediante la ecuación de Bernoulli, como 4v2 + presión auricular derecha (fig. 2B), donde v es la velocidad deregurgitación máxima (m/s). La presión auricularderecha se estima a partir del diámetro de la venacava inferior y sus cambios con la respiración. Undiámetro en eje largo < 1,5 cm con una variaciónrespiratoria normal (~50%) corresponde a unas presiones auriculares derechas < 10 mmHg6.
La velocidad máxima de la señal de Doppler pulsado y el tiempo hasta alcanzar la aceleraciónmáxima del flujo (tiempo de aceleración) en la APprincipal se reducen en la HP. Un tiempo de aceleración corto (< 100 ms) indica HP, y un tiempo <62 ms se ha correlacionado con un reducción de lasupervivencia en la HP idiopática17. Sin embargo, eltiempo de aceleración depende de la frecuencia ydel gasto cardiaco por lo que debe interpretarse concautela. La presión diastólica de la AP puede determinarse también con la ecuación 4v2 + presión auricular derecha; en este caso v es la velocidad del jetde regurgitación pulmonar telediastólico. Otra contribución de la ecocardiografía Doppler es la estimación de la resistencia vascular pulmonar, que secalcula como el cociente de la velocidad de regurgitación tricuspídea (m/s) respecto al intervalo velocidad-tiempo (cm) del tracto de salida del VD. Esteíndice se ha validado en niños con HP grave18 y muestra una excelente correlación con las mediciones realizadas por métodos invasivos19. Además,la ecocardiografía de esfuerzo puede revelar incrementos inducidos por el ejercicio en la presión sistólica de la AP, observación que podría corresponder a fases iniciales de la enfermedad vascularpulmonar20.
Técnicas ecocardiográficas emergentes
Ecocardiografía tridimensional
En los últimos años, la introducción de transductores con nuevas matrices y avances en las técnicasde adquisición y análisis de imágenes han permitidoutilizar la ecocardiografía 3D en tiempo real en elcontexto clínico21. Siguen existiendo limitaciones encuanto a la resolución temporal subóptima de lasimágenes en tiempo real o la necesidad de unamedia de 4-7 ciclos cardiacos con obtención de imágenes de volumen completo, lo cual puede causarartefactos en casos de arritmia.
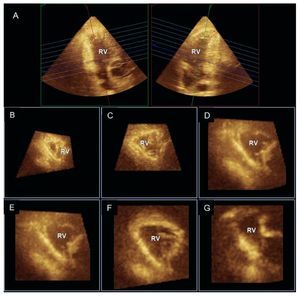
La visualización directa de la globalidad del VDmediante la ecocardiografía 3D es factible con elmodo de adquisición de imágenes de volumen completo. Esta capacidad es especialmente atractivapara el VD ya que aporta la posible ventaja decuantificar los volúmenes ventriculares sin asunciones geométricas previas. Tanto técnicas iniciales22 como métodos más recientes de 3D entiempo real23,24 han sido validados para la cuantificación del volumen del VD, y esta informaciónpuede proporcionar datos de gran importancia pronóstica en diversos escenarios clínicos, como las cardiopatías congénitas25. Estas técnicas han permitido demostrar la geometría no planar de la válvulatricúspide, así la contribución del VD a la generación de insuficiencia tricuspídea funcional26,27. El análisis de reconstrucciones multiplanares permiteuna evaluación precisa de la geometría y funciónsegmentarias del VD (fig. 3). En la HP crónica secundaria a cardiopatías izquierdas se ha descritoque la dilatación del VD es más acentuada en lossegmentos más próximos al infundíbulo (nivelesbasal y medio)28.
Fig. 3. Ecocardiografía tridimensional en tiempo real (adquisición en modo de volumen completo) del ventrículo derecho (VD) reformateado en proyecciones coronal (A, derecha), sagital (A, izquierda) y múltiples proyecciones de eje corto que muestran la geometría segmentaria del VD (B y C: vértice; D y E: segmentos medios; F y G: segmentos basales).
Imagen de Doppler tisular (DTI)
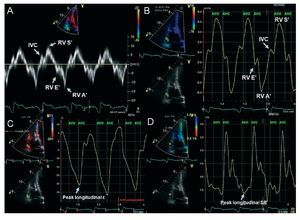
El Doppler pulsado a nivel del anillo tricuspídeopuede utilizarse para medir las velocidades de bajafrecuencia en sístole y diástole, que reflejan el movimiento miocárdico longitudinal del VD. El DTI espectral cuantifica las velocidades máximas (fig. 4A).Hay buena correlación entre el DTI del anillo tricuspídeo y la fracción de eyección del VD cuantificada mediante angiografía radioisotópica29. Unvalor de S' < 9,7 cm/s indica una contractilidadanormal del VD30 y puede ser útil para la detecciónde fases iniciales de disfunción del VD31. El valor deS' está también reducido en los pacientes con HP idiopática respecto a sujetos sanos y se correlacionainversamente con las presiones de la AP y la resistencia vascular32. La aceleración miocárdica durante la contracción isovolumétrica es un nuevo parámetro de función sistólica global del VD, que secalcula dividiendo la velocidad miocárdica isovolumétrica máxima por el tiempo a la velocidad pico.Este parámetro parece ser más independiente de lacarga hemodinámica que otros métodos33. Por loque respecta a la función diastólica del VD, el DTIpuede ser una modalidad diagnóstica útil en combinación con el análisis de Doppler pulsado del flujode llenado tricuspídeo, y permite la cuantificaciónde los cocientes E/A, E/E' y E'/A'. El tiempo de relajación isovolumétrico puede considerarse una técnica sencilla para estimar la presión sistólica en la AP cuanto se corrige por la frecuencia cardiaca, y se ha demostrado que aumenta de manera progresiva en presencia de HP34. Sin embargo, los resultados deben interpretarse con cautela cuando lafunción del VD está deteriorada35.
Fig. 4. Ejemplo de imagen de Doppler tisular (DTI) y de imagen de strain en un individuo con función ventricular derecha (VD) normal. A: DTI espectral de la función sistólica y diastólica del VD en el anillo tricuspídeo lateral. B: fases de DTI color con el volumen de muestra situado en el segmento basal del VD. C: imagen de deformación miocárdica (strain; ε) mostrando un strain sistólico longitudinal máximo de -26%, y D: strain rate (SR) de -1,4 s-1, ambos a nivel basal del VD. AVO: apertura de la válvula aórtica; IVC: velocidad positiva máxima de contracción isovolumétrica; AVC: cierre de la válvula aórtica; RVA': velocidad máxima auricular (contracción de la aurícula derecha); RVE': velocidad máxima protodiastólica (durante la relajación VD máxima); RVS': velocidad máxima sistólica (eyección) (durante la sístole mecánica).
El DTI color codifica las velocidades miocárdicasmedias en una región de interés específica del VDen una escala de color (fig. 4B).
Permite la evaluación simultánea de los segmentos anular, basal, medio y apical en un mismo ciclo cardiaco, de una manera reproducible36. Además de cuantificar la velocidad miocárdica, elDTI color permite también medir el strain (porcentaje de deformación miocárdica) y el strain rate(tasa de deformación miocárdica en el tiempo) (fig.4C y D)27. Ambos métodos mejoran la evaluaciónfuncional en segmentos acinéticos adyacentes almiocardio normal que pueden tener velocidadesmiocárdicas normales. En el VD, el estudio deimagen de strain ha estado limitado a la proyecciónapical de cuatro cámaras (strain longitudinal). Elacortamiento circular se evalúa en la proyección deeje corto y continúa siendo un método de investigación. Las velocidades y la deformación miocárdicasdel VD sufren un deterioro en los pacientes con HP,sobre todo en el ápex37. En comparación con el DTIespectral, el DTI en color mejora la resolución espacial del movimiento de la pared del VD. Sin embargo, continúa siendo en gran medida un instrumento de investigación, dada su dependencia delángulo y de la frecuencia de adquisición de imágenes, así como del complejo posprocesado, la bajaresolución espacial y la relativa inexperiencia con suempleo. De forma análoga, la evaluación de la disincronía del VD con DTI está todavía en fases iniciales de desarrollo.
Speckle tracking
La técnica de speckle tracking analiza el movimiento de puntos ecorefringentes situados en elmiocardio, utilizando un algoritmo que identifica lalocalización de estos en fotogramas secuenciales(imagen de vector de velocidad), y obtiene con ello los valores de strain. Este método depende enmenor medida de la calidad de la imagen 2D, de lafrecuencia de adquisición de imágenes y del ángulo,y permite medir el strain en el VD tanto en el planolongitudinal como en el axial. Varios estudios hanpuesto de manifiesto que es un método factible yexacto para valorar la función global y regional delVD en voluntarios normales y en pacientes conHP38,39.
Ecocardiografía intracardiaca
Mediante un catéter de ecografía intravascular sepueden obtener imágenes 2D, Doppler color y pulsado de las estructuras intracardiacas. Los datospreliminares obtenidos en modelos animales ponende relieve la factibilidad y la exactitud de esta técnica para cuantificar los volúmenes y la función sistólica del VD40.
TÉCNICAS NUCLEARES
Las ventajas de las técnicas nucleares incluyen laausencia de asunciones geométricas para cuantificarla fracción de eyección del VD al basarse en la detección de cuentas, la elevada relación contrasteruido y la posibilidad de evaluar simultáneamentela ventilación/ perfusión pulmonar (gammagrafíaV/Q). Sus principales inconvenientes son la escasaresolución espacial, los tiempos de obtención deimagen relativamente largos y la necesidad de utilizar isótopos radiactivos. Para la evaluación delVD, estas técnicas han sido reemplazadas en muchos centros por otras modalidades, como la ecocardiografía o la RM, que no precisan del uso deradiación ionizante y proporcionan una resoluciónsuperior. La ventriculografía radioisotópica deprimer paso se basa en la detección y cuantificacióncon una gammacámara del tránsito de un bolo deltrazador a través del VD. El agente preferido es el 99mTc-DTPA, que tiene una eliminación renal rápida, con lo que la irradiación del paciente es menory puede repetirse la exploración más tempranamente en caso necesario41. La calidad de la inyección del bolo inyección es crucial para proporcionarcuentas suficientes en el VD, lo cual afecta a la determinación exacta de la fracción de eyección delVD. Los valores normales son del 52% ± 6%, conun límite inferior de la normalidad del 40%42. Aunque limitada a imágenes en un solo plano, permite diferenciar adecuadamente el VD y la aurículaderecha, se correlaciona bien con el cateterismo derecho y la RM (aunque con unos límites de confianza amplios) y se considera el método nuclear deelección para la evaluación del VD43,44.
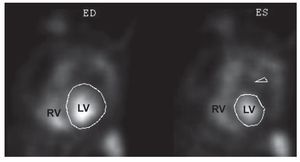
También pueden obtenerse índices funcionalesdurante un periodo mayor y en múltiples proyecciones utilizando la gammagrafía isotópica enequilibrio (fig. 5), que es menos exigente desde elpunto de vista técnico. Las imágenes planarestienen la limitación del solapamiento de la cavidaddel VD con las estructuras adyacentes y, por lotanto, no se recomienda su empleo44,45. Las imágenes topográficas constituyen una alternativaprometedora y ofrecen ventajas teóricas, puestoque proporcionan un conjunto de datos realmente3D y permiten una mejor diferenciación de las cámaras cardiacas. Sin embargo, esta técnica no hasido validada ampliamente43,46. Por lo que respectaal estudio del miocardio, datos preliminares con elempleo de la tomografía de emisión de positronesen pacientes con HP muestran un aumento de lacaptación de 18F-fluorodesoxiglucosa en la paredlibre del VD, que está correlacionada con la gravedad de la enfermedad y con el nivel de sobrecarga del VD47.
Fig. 5. Proyecciones oblicuas anteriores izquierdas de una gammagrafía isotópica en equilibrio sincronizada con el ECG, tras la inyección de hematíes marcados in vivocon pertecnetato de 99mTc. ED: telediástole; ES: telesístole; LV: ventrículo izquierdo; RV: ventrículo derecho. Cortesía de la Dra. Milena Henzlova.
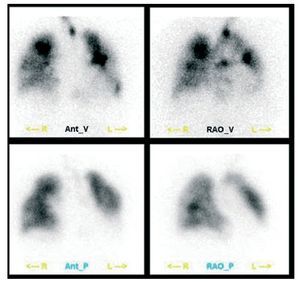
La gammagrafía de V/Q pulmonar es un métodoampliamente validado para la evaluación de la embolia pulmonar aguda, ya que el material embólicoproduce una hipoperfusión regional con preservación de la ventilación. Estas áreas de discordanciade la perfusión/ventilación constituyen la base deldiagnóstico y también de la probabilidad de embolia en función de criterios establecidos (tabla 2,fig. 6)48. Aun siendo una exploración fiable, la tasarelativamente elevada de estudios con probabilidadintermedia no concluyentes constituye una de las limitaciones más importantes de la gammagrafía pulmonar49. Las imágenes tomográficas pueden mejorar la calidad de la imagen y el rendimiento diagnóstico50. La gammagrafía de V/Q se realiza sistemáticamente dentro del estudio diagnóstico de lospacientes con HP. Dado que la HPTEC puede serclínicamente indiferenciable de la HP idiopática,debe considerarse la posibilidad de tromboemboliacrónica en ausencia de una etiología conocida deHP. En general, la gammagrafía V/Q pulmonar seconsidera la exploración de elección, dado que susensibilidad es superior a la de la TC2,51. Una exploración con un resultado normal o de «baja probabilidad» predice una probabilidad muy baja deHPTEC52,53, y por el contrario, un defecto de perfusión relativamente pequeño en la gammagrafía V/Qpuede corresponderse con una enfermedad angiográfica grave54.
Fig. 6. Gammagrafía de ventilación (V; fila superior) y perfusión (P; fila inferior) en un paciente con enfermedad tromboembólica, que muestra áreas de discordancia de ventilación/perfusión en lóbulos inferiores. La perfusión se estudió con macroagregados de albúmina marcados con 99mTc y la ventilación con 99mTc-DTPA. Ant: anterior; I: izquierdo; D: derecho; RAO: oblicua anterior derecha. Cortesía del Dr. Josef Machac.
ANGIOGRAFÍA INVASIVA
La angiografía invasiva continúa siendo el patrónde referencia en la evaluación del árbol pulmonar,pero ha sido sustituida en gran parte por exploraciones no invasivas. Tanto la angiografía del VDcomo la angiografía pulmonar son técnicas costosasy no exentas de riesgo, que se asocian con unas tasas de morbilidad y mortalidad de un 3,5-6% y un0,2-0,5%, respectivamente55. Las complicacionespueden deberse a arritmia, aumento agudo de laspresiones pulmonares en relación con la sobrecargaaguda de volumen u otros mecanismos. Parecen sermás frecuentes en pacientes con una HP más avanzada y, especialmente, en los que presentan una disfunción del VD más severa56.
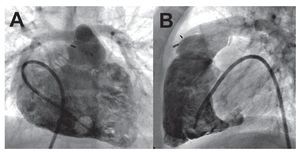
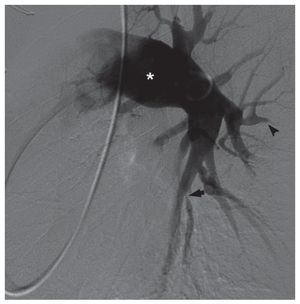
Las cineangiografías del VD obtenidas tras la administración de contraste a través de un catéter pigtail o similar (fig. 7) pueden proporcionar estimaciones exactas de los volúmenes y la función del VDcon la aplicación del método de Simpson7 o conmodelos analíticos simplificados58. No obstante,estos métodos tienen la limitación de la necesidadde partir de supuestos geométricos previos. La angiografía de sustracción digital (ASD) pulmonar invasiva puede utilizarse en el diagnóstico de la embolia pulmonar aguda cuando otras exploracionesno son concluyentes, aunque esa indicación es infrecuente49. Sin embargo, la ASD se utiliza con frecuencia en el contexto de la HP crónica tras un resultado positivo de la gammagrafía V/Q pulmonar.Los signos angiográficos característicos de laHPTEC incluyen lo siguiente: reducción brusca del calibre de ramas, oclusión vascular completa, irregularidades luminales causadas por trombos murales, áreas de tipo receso debidas a trombos oclusivos o suboclusivos, y membranas o bandas que pueden causar estenosis de ramas y dilataciones postestenóticas (fig. 8)59. Debe considerarse esta técnica en pacientes con disnea no explicada y defectos segmentarios o de mayor tamaño en la gammagrafía de V/Q pulmonar, sobre todo si hay signos ecocardiográficos de crecimiento auricular derecho o disfunción del VD. La finalidad de la ASD es confirmar el diagnóstico de HPTEC y definir la localización de los trombos oclusivos, puesto que la trombendarterectomía eficaz es más probable si éstos afectan a las arterias principales, lobulares o segmentarias proximales60. La ASD se continúa considerando la exploración de elección en la planificación prequirúrgica, preferible a otras modalidades no invasivas alternativas como la RM y la TC2,61. Los resultados no concluyentes de la ASD pueden conducir a la realización preoperatoria de otras exploraciones de imagen invasivas, como angioscopia con fibra óptica60.
Fig. 7. Ventriculografía con contraste del corazón derecho biplanar en un niño con una tetralogía de Fallot reparada. A: proyección anterior; B: proyección de perfil. Cortesía del Dr. Barry Love.
Fig. 8. Angiografía de sustracción digital de la circulación pulmonar izquierda en un paciente con hipertensión pulmonar tromboembólica crónica. Se aprecia dilatación de las arterias centrales (asterisco), así como áreas de estenosis luminal (flecha) y oclusión vascular (punta de flecha). Cortesía del Dr. Robert Lookstein.
TOMOGRAFÍA COMPUTARIZADA
La angiografía mediante TC (angio-TC) concontraste es la técnica más comúnmente utilizadapara evaluar los vasos pulmonares. Proporcionaseries de datos 3D con una excelente resolución espacial isotrópica (submilimétrica con los escáneres multidetectores actuales) en un tiempo de exploración muy breve. Además, puede evaluar simultáneamente el parénquima pulmonar, y mediantesincronización electrocardiográfica permite estudiar parámetros cardiacos funcionales. Por otrolado, la TC sólo proporciona información funcional limitada (no permite cuantificar flujos) y requiere el empleo de contraste yodado y de radiación ionizante.
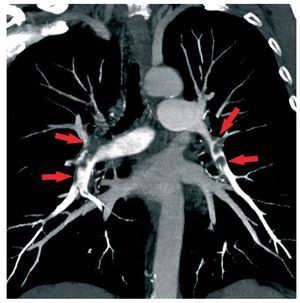
Una de las indicaciones más frecuentes es la sospecha de embolia pulmonar aguda (fig. 9). Aunquela ASD se ha considerado tradicionalmente el método de referencia, en la práctica clínica la TC es laprimera exploración que se realiza en la mayoría delos centros49. La baja sensibilidad en la detección delos émbolos subsegmentarios ha sido considerada lalimitación principal de la TC, a pesar de que la probabilidad de recurrencia clínica en los pacientes conuna exploración normal es muy baja62. Los escáneres de múltiples detectores permiten la evaluaciónde los vasos pulmonares hasta las ramas de sextoorden y parecen aumentar significativamente la tasade detección de émbolos pulmonares distales. En elestudio multicéntrico Prospective Investigation ofPulmonary Embolism Diagnosis II (PIOPED II), lasensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo de la angio-TCcon multidetector fueron del 83, el 96, el 86 y el95%, respectivamente63. En comparación con lagammagrafía V/Q pulmonar, parece que la TCidentifica un mayor número de émbolos64. En la HPTEC, la TC es también muy útil y muestra hallazgos similares a las que se obtienen en la ASD65. Sin embargo, con el empleo de la ASD invasivacomo patrón de referencia, la angio-TC no se considera todavía lo suficientemente exacta para sustituir a la gammagrafía de V/Q2.
Fig. 9. Reconstrucción coronal de proyección de máxima intensidad de una angiografía pulmonar con contraste de TC en un paciente con embolias pulmonares múltiples bilaterales (flechas).
La TC puede revelar la presencia de otros signosque indiquen HP, con independencia de la etiologíasubyacente. El grado de dilatación de las arteriaspulmonares centrales presenta una correlación moderada con la gravedad de la enfermedad, y un cociente del diámetro de la AP principal respecto al dela aorta ascendente > 1 o un diámetro de la APprincipal ≥ 29 mm son indicadores moderadamenteespecíficos de HP, aunque con una sensibilidadlimitada66,67. Una dilatación asimétrica de las arterias principales sugiere HPTEC65. En los pacientescon embolia pulmonar aguda, un cociente de losdiámetros ventriculares máximos derecho-izquierdo> 0,9 en una proyección de cuatro cámaras tienevalor predictivo respecto a la mortalidad a 30 días68.
La adquisición de imágenes con sincronización electrocardiográfica retrospectiva ha sido validadacomo una modalidad precisa para la cuantificaciónde los volúmenes y la función del VD en comparación con la RM (fig. 10), aunque a costa de unadosis de radiación significativa69. Se ha descrito laposibilidad de detectar disfunción del VD en pacientes con embolia pulmonar70; sin embargo, no seha estudiado de manera sistemática su importanciapronóstica ni su aplicación en la HP crónica.
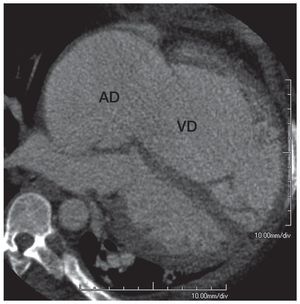
Fig. 10. Imagen multiplanar en proyección de cuatro cámaras de la tomografía computarizada cardiaca de un paciente con dilatación severa de la aurícula derecha (AD) y del ventrículo derecho (VD) como consecuencia de insuficiencia tricuspídea.
La evaluación simultánea del parénquima pulmonar puede orientar a etiologías específicas de laHP, puesto que pueden identificarse con facilidadmuchas manifestaciones propias de la enfermedadpulmonar obstructiva o intersticial. Un patrón demosaico en combinación con signos de HP puedeobedecer a una perfusión pulmonar heterogénea ysugiere HPTEC71. Los infartos pulmonares previos(consolidaciones cuneiformes en las regionessubpleurales) respaldan también el diagnóstico deHPTEC65. Otros signos indirectos de aumento de lapresión venosa sistémica son el agrandamiento dela vena cava superior e inferior, la ascitis y los derrames pericárdicos y/o pleurales.
RESONANCIA MAGNÉTICA
La RM ha evolucionado en la última décadahasta convertirse en una de las modalidades dediagnóstico por imagen más atractivas para el estudio tanto del corazón derecho como de la circulación pulmonar72,73. Tiene un buen balance de altaresolución espacial, temporal y de contraste; puedeobtener imágenes en cualquier orientación espacialy no sufre limitaciones de ventana «acústica».Además, es una técnica segura, muy exacta y reproducible, y proporciona información tanto anatómica como funcional. Sus principales limitacionesson el elevado coste, la limitada disponibilidad conla consecuente menor experiencia y las restriccionesrelacionadas con el campo magnético. Además, seha expresado cierta preocupación por la posibleasociación de los medios de contraste de gadoliniocon la fibrosis sistémica nefrogénica. En el contextoespecífico de la HP, la RM tiene poca capacidadpara cuantificar las presiones de la AP74.
Evaluación del VD
La RM se considera actualmente el método dereferencia para la cuantificación de los volúmenes yfracción de eyección del VD31. El enfoque utilizadocon más frecuencia consiste en aplicar el método deSimpson a una serie de ejes cortos consecutivos obtenidos desde la base hasta el ápex. Este método esmuy exacto y no se basa en ninguna asuncióngeométrica73,75. La elevada reproducibilidad inter-estudios resalta también el papel de la RM en el seguimiento de los pacientes, por ejemplo en la evaluación de efectos terapéuticos76. El grado dedilatación, hipertrofia y disfunción sistólica del VDes directamente proporcional a la severidad de laHP. Así, por ejemplo, un cociente de masa del VDrespecto al ventrículo izquierdo > 0,6 detecta HPcon una sensibilidad del 84% y una especificidad del71%, y se ha descrito como más específico que laecocardiografía Doppler77. Es importante destacar que la cuantificación de los parámetros funcionalesdel VD parece aportar información pronóstica adicional, según lo indicado por un estudio de pacientes con HP idiopática en que un índice de volumen telediastólico del VD ≥ 84 ml/m2 y un índicede volumen telediastólico ventricular izquierdo ≤ 40ml/m2 fueron factores predictivos independientes demortalidad a 1 año78. Pueden obtenerse análisis mássofisticados de la función del VD con la cuantificación simultánea de las presiones con catéteres compatibles con RM, con el fin de obtener curvas depresión-volumen del VD79. Se ha utilizado el marcaje (tagging) miocárdico para detectar patronesanormales de strain regional del VD en la HP,aunque esta técnica tiene poca resolución y requiereun posprocesado prolongado. Estas limitacionespodrían resolverse con la recientemente desarrollada técnica de RM con codificación de strain80. Alternativamente, las velocidades miocárdicaspueden cuantificarse con imágenes de contraste defase, de manera similar al DTI81.
La RM puede emplearse también para cuantificar la curvatura del tabique interventricular (fig. 11), que se define como la inversa del radio. La curvatura telediastólica del tabique muestra una fuertecorrelación con la gravedad de la HP y el abombamiento del tabique hacia la izquierda se ha asociadoa una presión sistólica de la AP > 67 mmHg82. Lacomparación de las curvaturas del tabique interventricular y de la pared libre del ventrículo izquierdopuede usarse también para cuantificar con exactitud la presión sistólica de la AP83. Asimismo,puede observarse realce tardío post-contraste, indicativo de fibrosis, en pacientes con HP a nivel delos puntos de inserción del VD en el septo y a menudo extendiéndose al mismo, hallazgo asociado almovimiento paradójico del tabique. El grado de fibrosis se correlaciona directamente con el grado deHP y se observa con independencia de la etiologíade la misma; probablemente se debe a un aumentode la tensión mecánica existente en esos puntos84,85.
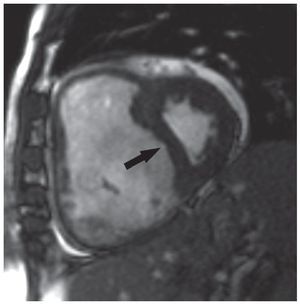
Fig. 11. Proyección en eje corto obtenida con resonancia magnética en un paciente con hipertensión pulmonar severa. Se aprecia una dilatación grave del ventrículo derecho que causa desplazamiento del septo (flecha) y compresión del ventrículo izquierdo.
Actualmente se desconoce si esta observación tieneimplicaciones clínicas.
Evaluación de la circulación pulmonar
La angiografía de resonancia magnética de altaresolución puede utilizarse para detectar emboliapulmonar, delimitar características propias de laHP crónica o identificar HPTEC86,87. Con el empleode este método, estudios preliminares indican buenaprecisión diagnóstica en la diferenciación de la HPidiopática y la HPTEC87. En comparación con laASD y la TC, la RM ofrece una delimitación excelente de anomalías proximales, pero su exactitud esmenor para los vasos subsegmentarios49,86,87. Además, la angiografía de RM de alta resolución temporal puede utilizarse para visualizar el paso dinámico del contraste a través de los vasos pulmonares (fig. 12). Esta técnica también permite analizar la perfusión pulmonar, mostrando buenacorrelación con la gammagrafía nuclear87,88. Estudios preliminares ponen de manifiesto tambiénla factibilidad de evaluar la ventilación pulmonarcon RM89.
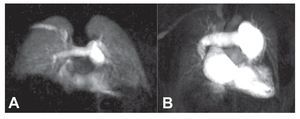
Fig. 12. Imagen coronal de una angiografía de resonancia magnética con alta resolución temporal en un sujeto sano (A) y en un paciente con hipertensión pulmonar idiopática (B). Obsérvese la dilatación del tronco de la arteria pulmonar y la hipoperfusión periférica difusa en un paciente conhipertensión pulmonar.
La cuantificación de las velocidades del flujo sanguíneo con imágenes de contraste de fase se utilizageneralmente para la medición precisa de la relación de flujo sistemicopulmonar en pacientes concortocircuitos congénitos90. Además, pueden caracterizarse con exactitud los perfiles de flujo de la APprincipal o sus ramas91. Se ha descrito la correlaciónde múltiples parámetros de flujo con el grado deelevación de las presiones de la AP y/o resistenciavascular pulmonar, aunque con resultados variables74. Una velocidad media del flujo sanguíneo <11,7 cm/s proporciona sensibilidad y especificidaddel 93 y el 82%, respectivamente, para la detecciónde HP92. Más recientemente, la RM de contraste defase 3D ha mostrado patrones anormales en la APprincipal (vórtices de flujo telesistólico y flujos diastólicos anterógrados prolongados) que permitierondiferenciar a los pacientes con HP en reposo, HPinducida por el ejercicio o sin HP93. Además,pueden utilizarse imágenes de contraste de fase o decine para evaluar los cambios dinámicos de la sección transversal arterial y, por tanto, de la rigidezde la AP94. Recientemente se ha identificado que un cambio del área transversal de la AP < 16% duranteel ciclo cardiaco se asocia a una mayor mortalidaden la HP95. Además, pueden detectarse modificaciones de la elasticidad de la AP antes de que existaHP manifiesta, lo cual podría ser útil en la detección precoz de anormalidades en la fisiología circulatoria96.
CONCLUSIONES
En la actualidad pueden combinarse varias modalidades de imagen para la evaluación del corazónderecho y la circulación pulmonar. Los avances entécnicas nucleares, ecocardiografía, TC y RM hanampliado nuestro conocimiento del crucial papel dela circulación menor en muchos estados patológicos. Los avances tecnológicos, en especial en elcampo de la RM, prometen mejorar nuestra capacidad de detectar estadios tempranos de la enfermedad o evaluar los mecanismos de acción y la eficacia de nuevas intervenciones terapéuticas.Avances en las técnicas de imagen moleculares concualquiera de estas modalidades serán de especialinterés en la evaluación de múltiples procesos biológicos in vivo.
ABREVIATURAS
2D: bidimensional.
3D: tridimensional.
AP: arteria pulmonar.
ASD: angiografía de sustracción digital.
DTI: imagen de Doppler tisular.
HP: hipertensión pulmonar.
HPTEC: hipertensión pulmonar tromboembólicacrónica.
RM: resonancia magnética.
TAPSE: desplazamiento sistólico del plano anulartricuspídeo.
TC: tomografía computarizada.
V/Q: cociente ventilación/perfusión.
VD: ventrículo derecho.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. Javier Sanz.
Cardiovascular Institute. Mount Sinai Hospital.
One Gustave L Levy Place, Box 1030. New York, NY 10029.Estados Unidos.
Correo electrónico: Javier.Sanz@mssm.edu