La rotura de septo interventricular tras un infarto es una complicación rara, pero muy grave, con una alta tasa de mortalidad. Nuestro propósito es analizar qué factores han podido influir en la mortalidad por esta afección durante la última década, incluyendo los relacionados con la asistencia circulatoria mecánica.
MétodosEl registro CIVIAM es un estudio retrospectivo, observacional y multicéntrico desarrollado en España. Se diseñó un análisis comparativo, cuyos objetivos primarios son describir el tratamiento de esta afección, así como los cambios en la mortalidad hospitalaria y al año, dividiendo el periodo de observación en 2 periodos iguales (enero de 2008 a junio de 2013 y julio de 2013 a diciembre de 2018).
ResultadosEn total se reclutó a 120 pacientes consecutivos. La mortalidad total al año fue del 61,7%. Los pacientes en el segundo periodo del estudio eran significativamente más jóvenes. Se encontró una reducción significativa de la mortalidad al año en el segundo periodo del estudio (el 75,6 frente al 52,7%; p=0,01), confirmada después de ajustar por factores de confusión (OR=0,40; IC95%, 0,17-0,98). Se sometió a reparación quirúrgica al 58,7 frente al 70,3% (p=0,194) y a cierre percutáneo, al 8,7 y el 6,8% respectivamente (p=0,476). Se realizó trasplante cardiaco a 1 frente a 5 pacientes (el 2,2 frente al 6,8%; p=0,405). La principal diferencia entre uno y otro periodo del estudio fue el mayor uso de oxigenador extracorpóreo de membrana venoarterial en el segundo (el 4,4 frente al 27%; p=0,001).
ConclusionesLa comunicación interventricular posinfarto aún presenta altas tasas de mortalidad. Se observa una tendencia a una mayor utilización del oxigenador extracorpóreo de membrana venoarterial y mayor acceso a tratamiento correctivos, con mejores tasas de supervivencia.
Palabras clave
En 1875, Latham et al.1 describieron por primera vez la rotura del tabique ventricular (RTV) causada por isquemia, y desde entonces se ha considerado que esta es una de las complicaciones más graves del infarto agudo de miocardio (IAM). Hoy la epidemiología de la RTV ha cambiado, y su prevalencia actual varía del 0,2 al 0,3%, en comparación con las estimadas del 3% que se daban antes de la aplicación generalizada de los tratamientos de reperfusión2-4. Sin embargo, la supervivencia de los pacientes que la sufren no parece haber mejorado. Los registros contemporáneos muestran unas tasas de mortalidad a 30 días extraordinariamente altas, de un 38 a un 88%, como consecuencia de la aparición de shock cardiogénico y fallo multiorgánico3,4. La aplicación generalizada de estrategias de reperfusión basadas en stents probablemente haya ayudado a reducir las tasas de complicaciones mecánicas de los IAM, pero a pesar de las continuas mejoras técnicas introducidas en la cardiología intervencionista, no parece que la mortalidad hospitalaria esté disminuyendo5-7.
La utilización temprana de asistencia circulatoria mecánica podría marcar un punto de inflexión en la evolución del tratamiento de las complicaciones mecánicas, como la RTV o la rotura de músculos papilares. La mejoría hemodinámica puede ayudar a una estabilización adecuada, que evite las consecuencias sistémicas de la baja perfusión de los tejidos y el fallo multiorgánico antes de la cirugía de reparación8-14. Con esta estrategia se han observado resultados favorables incluso en pacientes con un perfil de riesgo muy elevado evaluado según la clasificación del Interagency Registry for Mechanically Assisted Circulatory Support (INTERMACS) y con fallo multiorgánico establecido14. No obstante, aunque parece que la identificación y el tratamiento precoz del shock cardiogénico modifican el mal pronóstico de la RTV aparecida tras un IAM, la evidencia al respecto continúa siendo escasa. Y además escasean los datos actuales sobre la RTV en la era de la reperfusión óptima con intervención coronaria percutánea (ICP) primaria.
El objetivo de este estudio es analizar los avances realizados en el tratamiento y el pronóstico de los pacientes con RTV tras un IAM en un registro multicéntrico en el que participaron centros terciarios con redes de tratamiento de reperfusión bien desarrolladas, y que disponían de instalaciones locales para cirugía cardiaca o tenían acceso rápido a ellas.
MÉTODOSDiseño del estudio, población y obtención de los datosEn este estudio observacional, retrospectivo y multicéntrico, se compararon las diferencias en el tratamiento y el pronóstico de los pacientes con una RTV tras un IAM durante la última década.
Después de que el estudio fuera autorizado por los comités de ética de investigación de los centros, se seleccionó a todos los pacientes consecutivos con RTV tras un IAM del periodo comprendido entre el 1 de enero de 2008 y el 31 de diciembre de 2018 en cada una de las bases de datos locales. Se cursó una invitación a 11 hospitales terciarios de España, situados en diferentes regiones geográficas, que disponían de redes de reperfusión organizadas. Cada centro contaba con servicios de cirugía cardiaca o acceso a un traslado rápido de los pacientes con complicaciones mecánicas. A su vez, se disponía de historia clínica electrónica, de la que se obtuvieron los datos sobre el evento y el seguimiento. No hubo criterios de exclusión específicos. El diagnóstico definitivo de RTV se obtuvo mediante ecocardiografía Doppler o cateterismo cardiaco. Puede consultarse la disponibilidad general de redes de tratamiento del IAM para la reperfusión temprana en las diferentes regiones de los centros incluidos en la tabla 1 del material adicional. La base de datos se construyó con la información disponible en los registros electrónicos y las bases de datos individuales específicas de las unidades de cuidados intensivos cardiovasculares.
Objetivos clínicosEl objetivo principal fue la mortalidad por cualquier causa tras un 1 año de seguimiento. La mortalidad hospitalaria se analizó como otro objetivo principal. Se compararon simétricamente los resultados de la primera mitad del periodo de reclutamiento con los de la segunda mitad. Los objetivos secundarios fueron los cambios de tendencias a lo largo del tiempo por lo que respecta al tratamiento, incluida la revascularización, el uso de una asistencia circulatoria mecánica como el oxigenador extracorpóreo de membrana venoarterial (ECMO-VA) o el balón de contrapulsación intraaórtico, utilizados solos o en combinación, y el cierre quirúrgico o percutáneo de la RTV.
Análisis estadísticoPara el análisis de tendencias temporales, se dividió a los pacientes en 2 periodos simétricos: del 1 de enero de 2008 al 30 de junio de 2013 y del 1 de julio de 2013 al 31 de diciembre de 2018.
Las características de los pacientes se resumieron y describieron expresando las variables continuas en forma de media±desviación estándar o mediana [intervalo intercuartílico] si la distribución no era normal, y las variables cualitativas en forma de frecuencia y porcentaje.
En la primera etapa, se realizó un análisis univariante. Se compararon las características de los 2 grupos mediante la prueba de la t de Student para las variables continuas con una distribución normal y con la prueba de Wilcoxon para las de distribución asimétrica. Las variables cualitativas dicotómicas se compararon con la prueba de la χ2 o con la prueba exacta de Fisher cuando procediera. Las variables cualitativas no dicotómicas se compararon con una prueba de ANOVA.
En la segunda etapa, se realizó un análisis multivariante con regresión de Cox. En el modelo de análisis multivariante se incluyeron todas las variables estadísticamente significativas identificadas en el análisis univariante. Se incluyeron también otras variables preseleccionadas que influyen en el pronóstico: edad, diabetes, revascularización del IAM, reparación con éxito de la RTV y asistencia con ECMO-VA. Los factores de confusión se evaluaron con el método de cambio en la estimación, utilizando un umbral de variación del 10% en los valores de hazard ratio ajustada (HRa)15,16.
El método del cambio en la estimación para analizar los factores de confusión compara los valores de HRa de los modelos con todas las variables preseleccionadas y todos los modelos posibles, con lo que se crea una combinación diferente de estas variables seleccionadas. Si la HRa se desviaba más de un 10% de la HRa del modelo máximo, había un factor de confusión causante de sesgo, y la variable se incluía en el modelo final. Después del modelo de regresión, se utilizó el factor de inflación de la varianza para descartar la multicolinealidad.
Se construyeron los modelos para la mortalidad hospitalaria y la mortalidad a 1 año. El modelo final se expresó mediante HRa (intervalo de confianza del 95% [IC95%]). Dado el origen heterogéneo de los datos de los pacientes, posteriormente se llevó a cabo un análisis de la desviación para confirmar la equidispersión en la muestra.
La estimación de la incidencia de la RTV en el periodo de estudio se determinó mediante el número total de RTV dividido por el valor medio extrapolado de casos notificados en cada hospital con los datos disponibles. Se dispuso de información sobre la supervivencia y de un seguimiento de 1 año de todos los pacientes.
Todos los análisis estadísticos se llevaron a cabo con el programa Stata/IC 15.1 for Windows (StataCorp LLC, Estados Unidos).
RESULTADOSCaracterísticas basales e incidencia de la rotura del tabique ventricularEn total, 120 pacientes cumplían los criterios de inclusión, 46 en el primer periodo y 74 en el segundo. La incidencia estimada de la RTV durante el periodo de estudio fue diversa en los distintos centros, con valores de entre el 0,27 y el 0,46% para todo el espectro del IAM.
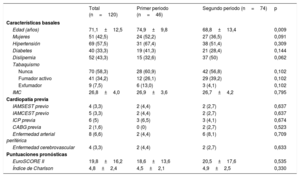
En la tabla 1 se indican las características basales. No hubo diferencias significativas en cuanto a los factores de riesgo cardiovascular clásicos. La edad de los pacientes fue inferior en el segundo periodo. No hubo diferencias significativas en los antecedentes cardiovasculares previos (IAM, enfermedad cerebrovascular y enfermedad arterial periférica) entre los 2 periodos de tiempo. La población del estudio presentaba valores altos tanto del índice de comorbilidad de Charlson como de la puntuación EuroSCORE II y otros factores predictivos de mal pronóstico, sin que se apreciaran diferencias significativas entre los 2 periodos.
Características basales
| Total (n=120) | Primer periodo (n=46) | Segundo periodo (n=74) | p | |
|---|---|---|---|---|
| Características basales | ||||
| Edad (años) | 71,1±12,5 | 74,9±9,8 | 68,8±13,4 | 0,009 |
| Mujeres | 51 (42,5) | 24 (52,2) | 27 (36,5) | 0,091 |
| Hipertensión | 69 (57,5) | 31 (67,4) | 38 (51,4) | 0,309 |
| Diabetes | 40 (33,3) | 19 (41,3) | 21 (28,4) | 0,144 |
| Dislipemia | 52 (43,3) | 15 (32,6) | 37 (50) | 0,062 |
| Tabaquismo | ||||
| Nunca | 70 (58,3) | 28 (60,9) | 42 (56,8) | 0,102 |
| Fumador activo | 41 (34,2) | 12 (26,1) | 29 (39,2) | 0,102 |
| Exfumador | 9 (7,5) | 6 (13,0) | 3 (4,1) | 0,102 |
| IMC | 26,8±4,0 | 26,9±3,6 | 26,7±4,2 | 0,795 |
| Cardiopatía previa | ||||
| IAMSEST previo | 4 (3,3) | 2 (4,4) | 2 (2,7) | 0,637 |
| IAMCEST previo | 5 (3,3) | 2 (4,4) | 2 (2,7) | 0,637 |
| ICP previa | 6 (5) | 3 (6,5) | 3 (4,1) | 0,674 |
| CABG previa | 2 (1,6) | 0 (0) | 2 (2,7) | 0,523 |
| Enfermedad arterial periférica | 8 (6,6) | 2 (4,4) | 6 (8,1) | 0,709 |
| Enfermedad cerebrovascular | 4 (3,3) | 2 (4,4) | 2 (2,7) | 0,633 |
| Puntuaciones pronósticas | ||||
| EuroSCORE II | 19,8±16,2 | 18,6±13,6 | 20,5±17,6 | 0,535 |
| Índice de Charlson | 4,8±2,4 | 4,5±2,1 | 4,9±2,5 | 0,330 |
CABG: cirugía de revascularización coronaria; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; IMC: índice de masa corporal.
Los valores expresan n (%) o media ± desviación estándar.
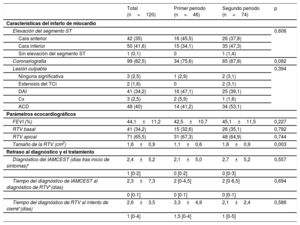
En la tabla 2 se resumen las principales características del evento isquémico. La prevalencia del infarto de miocardio con elevación del segmento ST de cara anterior y de cara inferior fue similar en los 2 periodos, al igual que ocurrió con la distribución de las lesiones culpables entre la arteria descendente anterior izquierda y la derecha. La localización apical de la RTV fue más frecuente que la basal, sin que hubiera diferencias significativas entre los grupos. El tamaño estimado de la comunicación fue mayor en el segundo periodo de estudio, pero este dato solo pudo obtenerse en 71 pacientes.
Características del evento isquémico
| Total (n=120) | Primer periodo (n=46) | Segundo periodo (n=74) | p | |
|---|---|---|---|---|
| Características del infarto de miocardio | ||||
| Elevación del segmento ST | 0,606 | |||
| Cara anterior | 42 (35) | 16 (45,5) | 26 (37,8) | |
| Cara inferior | 50 (41,6) | 15 (34,1) | 35 (47,3) | |
| Sin elevación del segmento ST | 1 (0,1) | 0 | 1 (1,4) | |
| Coronariografía | 99 (82,5) | 34 (75,6) | 65 (87,8) | 0,082 |
| Lesión culpable | 0,394 | |||
| Ninguna significativa | 3 (2,5) | 1 (2,9) | 2 (3,1) | |
| Estenosis del TCI | 2 (1,6) | 0 | 2 (3,1) | |
| DAI | 41 (34,2) | 16 (47,1) | 25 (39,1) | |
| Cx | 3 (2,5) | 2 (5,9) | 1 (1,6) | |
| ACD | 48 (40) | 14 (41,2) | 34 (53,1) | |
| Parámetros ecocardiográficos | ||||
| FEVI (%) | 44,1±11,2 | 42,5±10,7 | 45,1±11,5 | 0,227 |
| RTV basal | 41 (34,2) | 15 (32,6) | 26 (35,1) | 0,792 |
| RTV apical | 71 (65,5) | 31 (67,3) | 48 (64,9) | 0,744 |
| Tamaño de la RTV (cm2) | 1,6±0,9 | 1,1±0,6 | 1,8±0,9 | 0,003 |
| Retraso al diagnóstico y el tratamiento | ||||
| Diagnóstico del IAMCEST (días tras inicio de síntomas)* | 2,4±5,2 | 2,1±5,0 | 2,7±5,2 | 0,557 |
| 1 [0-2] | 0 [0-2] | 0 [0-3] | ||
| Tiempo del diagnóstico de IAMCEST al diagnóstico de RTV*(días) | 2,3±7,3 | 2 [0-4,5] | 2 [0-6,5] | 0,694 |
| 0 [0-1] | 0 [0-1] | 0 [0-1] | ||
| Tiempo del diagnóstico de RTV al intento de cierre*(días) | 2,6±3,5 | 3,3±4,9 | 2,1±2,4 | 0,586 |
| 1 [0-4] | 1,5 [0-4] | 1 [0-5] | ||
ACD: arteria coronaria derecha; Cx: arteria circunfleja; DAI: arteria descendente anterior izquierda; FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; RTV: rotura del tabique ventricular; TCI: tronco coronario izquierdo.
Los valores expresan media ± desviación estándar o mediana [intervalo intercuartílico].
Los pacientes de esta serie consultaron habitualmente después de la ventana temporal aceptable para la reperfusión primaria, y la media de tiempo transcurrido entre los síntomas iniciales y el diagnóstico definitivo de la RTV fue 2,3 ± 7,3 días en ambos grupos (tabla 2). De los 65 pacientes (55,6%) que acudieron en las primeras 24 h siguientes al inicio de los síntomas, se practicó una ICP solo a 31 (47%). Ninguno de estos pacientes recibió tratamiento trombolítico antes del cateterismo.
La RTV tras el IAM se diagnosticó una media de 2,3±7,3 días después del diagnóstico definitivo del IAM. La complicación se detectó después de las primeras 24 h siguientes al ingreso en 19 pacientes durante el primer periodo y 21 en el segundo (el 41,3 frente al 28,4%; p=0,144).
No hubo diferencias en las tasas de coronariografías e ICP, que en el conjunto de la cohorte se realizaron respectivamente en 99 (82,5%) y 52 pacientes (43,3%).
En 3 pacientes de nuestro registro no se evidenció ninguna afección significativa de las arterias epicárdicas en la coronariografía invasiva (infarto de miocardio con ateroesclerosis coronaria no obstructiva [MINOCA]). Todos estos casos se dieron en mujeres, con una mediana de edad de 64 años. Ninguna de estas pacientes recibió tratamiento trombolítico antes del cateterismo. De las 3 pacientes, 2 fallecieron durante la hospitalización.
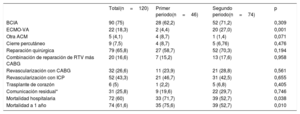
Características del tratamientoLas características del tratamiento se resumen en la tabla 3. Hubo una diferencia significativa en el uso del ECMO-VA entre los 2 periodos (el 4,4 frente al 27%; p=0,001), pero no se observaron diferencias claras en el empleo de balón de contrapulsación intraaórtico (el 62,2 frente al 71,2%; p=0,309) u otros dispositivos de asistencia circulatoria mecánica (el 8,7 frente al 1,4%; p=0,071). El número de días transcurridos desde el diagnóstico de la RTV hasta la reparación quirúrgica fue mayor en los pacientes asistidos con ECMO-VA, aunque esta diferencia no fue significativa (2 [1-6] frente a 5 [1-6] días; Wilcoxon, p=0,2199).
Tratamiento y resultados
| Total(n=120) | Primer periodo(n=46) | Segundo periodo(n=74) | p | |
|---|---|---|---|---|
| BCIA | 90 (75) | 28 (62,2) | 52 (71,2) | 0,309 |
| ECMO-VA | 22 (18,3) | 2 (4,4) | 20 (27,0) | 0,001 |
| Otra ACM | 5 (4,1) | 4 (8,7) | 1 (1,4) | 0,071 |
| Cierre percutáneo | 9 (7,5) | 4 (8,7) | 5 (6,76) | 0,476 |
| Reparación quirúrgica | 79 (65,8) | 27 (58,7) | 52 (70,3) | 0,194 |
| Combinación de reparación de RTV más CABG | 20 (16,6) | 7 (15,2) | 13 (17,6) | 0,958 |
| Revascularización con CABG | 32 (26,6) | 11 (23,9) | 21 (28,8) | 0,561 |
| Revascularización con ICP | 52 (43,3) | 21 (46,7) | 31 (42,5) | 0,655 |
| Trasplante de corazón | 6 (5) | 1 (2,2) | 5 (6,8) | 0,405 |
| Comunicación residual* | 31 (25,8) | 9 (19,6) | 22 (29,7) | 0,746 |
| Mortalidad hospitalaria | 72 (60) | 33 (71,7) | 39 (52,7) | 0,038 |
| Mortalidad a 1 año | 74 (61,6) | 35 (75,6) | 39 (52,7) | 0,010 |
ACM: asistencia circulatoria mecánica; BCIA: balón de contrapulsación intraaórtico; CABG: cirugía de revascularización coronaria; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; ICP: intervención coronaria percutánea; RTV: rotura del tabique ventricular.
Los valores expresan n (%).
Se llevó a cabo la reparación percutánea de la RTV en unos pocos pacientes durante el periodo de estudio (4 en el primero y 5 en el segundo; p=0,476), y los resultados generales de este tratamiento fueron malos en nuestro estudio, con un 100% de mortalidad hospitalaria, independientemente del éxito inicial del implante del dispositivo.
Se llevó a cabo una reparación quirúrgica en 27 pacientes en el primer periodo y 52 en el segundo, sin que se produjeran diferencias significativas (el 58,7 frente al 70,3%; p=0,194). Se practicó una cirugía de revascularización coronaria además del cierre de la comunicación en el 16,6% de los pacientes, con unas tasas similares en ambos periodos de tiempo (el 15,2 frente al 17,6%; p=0,958). A pesar del intento de cierre, hubo cierto grado de comunicación residual o reaparecida en 31 pacientes (25,8%), con una distribución similar en los 2 grupos (tabla 3).
Por lo que respecta al momento óptimo para la intervención quirúrgica de los pacientes con ECMO-VA, los sometidos a reparación quirúrgica a partir del día 4 tuvieron una tasa de mortalidad significativamente inferior a las de los intervenidos en un máximo de 24 h o los operados al cabo de 1-3 días (OR = 0,34; IC95%, 0,12-0,94) (tabla 4).
Se llevó a cabo trasplante cardiaco en 1 frente a 5 casos respectivamente (p=0,405). Solo 1 de los pacientes sometidos a trasplante falleció durante la hospitalización.
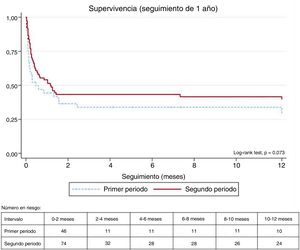
ObjetivosLa mortalidad hospitalaria y a 1 año fueron del 60 y el 61,7%. Los resultados del análisis univariante indicaron una reducción estadísticamente significativa de la mortalidad en el segundo periodo de estudio, tanto de la mortalidad hospitalaria como de la mortalidad a 1 año (tabla 3). Se elaboraron las curvas de Kaplan-Meier de las tasas de supervivencia de ambos grupos durante los primeros 12 meses (figura 1).
Por lo que respecta al momento óptimo para la intervención quirúrgica de los pacientes con ECMO-VA, los sometidos a reparación quirúrgica a partir del día 4 tuvieron una tasa de mortalidad significativamente inferior a las de los pacientes operados en un máximo de 24 h o los operados al cabo de 1-3 días (HR = 0,34; IC95%, 0,12-0,94) (tabla 4).
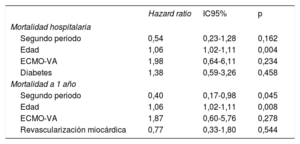
En el análisis multivariante se incluyeron las variables edad, asistencia con ECMO-VA, diabetes, reparación con éxito de la RTV y cualquier tratamiento de revascularización a lo largo de los periodos de estudio completos. Los modelos finales tras la regresión de Cox se muestran en la tabla 5. La mayor edad fue un factor independiente predictivo de la mortalidad tanto hospitalaria como a 1 año. El tratamiento de la RTV durante la segunda mitad del estudio mostró una correlación independiente con una mayor supervivencia a 1 año (HR = 0,40; IC95%, 0,17-0,98; p=0,045). En la tabla 2 del material adicional se resume un análisis completo de la mortalidad hospitalaria.
Resultados del análisis multivariante
| Hazard ratio | IC95% | p | |
|---|---|---|---|
| Mortalidad hospitalaria | |||
| Segundo periodo | 0,54 | 0,23-1,28 | 0,162 |
| Edad | 1,06 | 1,02-1,11 | 0,004 |
| ECMO-VA | 1,98 | 0,64-6,11 | 0,234 |
| Diabetes | 1,38 | 0,59-3,26 | 0,458 |
| Mortalidad a 1 año | |||
| Segundo periodo | 0,40 | 0,17-0,98 | 0,045 |
| Edad | 1,06 | 1,02-1,11 | 0,008 |
| ECMO-VA | 1,87 | 0,60-5,76 | 0,278 |
| Revascularización miocárdica | 0,77 | 0,33-1,80 | 0,544 |
ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; IC95%: intervalo de confianza del 95%.
Los principales resultados de nuestro estudio fueron: a) la RTV continúa siendo una complicación relativamente rara del IAM, con una tasa de mortalidad aún muy elevada; b) se trató a los pacientes con una RTV con una asistencia tipo ECMO-VA con mayor frecuencia en los últimos años, y se observó una tendencia al alza en la práctica de cirugía de reparación exitosa o trasplante cardiaco; c) se observa una tendencia al aumento de la supervivencia a 1 año, si bien las tasas de mortalidad hospitalaria continúan siendo > 50%.
A pesar de los avances actuales en el tratamiento del IAM, las tasas de mortalidad de la RTV tras un infarto continúan siendo extremadamente altas, de alrededor de un 60% en nuestra serie y otros registros2. Nuestros datos son similares a otros publicados, con una prevalencia de la RTV < 1% del total de los IAM3. No se ha observado ninguna tendencia nueva a lo largo del tiempo en cuanto a las características de los pacientes, excepto por una menor edad en el último quinquenio. No hay una explicación clara para el aumento del número de pacientes en la segunda mitad del estudio y la disminución de la edad de los pacientes en esta cohorte. Podría tener relación con un estudio diagnóstico menos completo con la ecocardiografía a la cabecera del paciente durante los primeros años de este análisis retrospectivo o a que algunos casos de diagnóstico de esta complicación mecánica relacionada con el IAM no se hubieran incluido en nuestra base de datos, que se elaboró con datos obtenidos prospectivamente en varios hospitales. Esta observación resulta intrigante y podría estar relacionada con la puesta en marcha de redes de ICP primaria en algunos de los centros participantes a partir de 2013-2014 (tabla 1 del material adicional), con un aumento del número total de pacientes con infarto agudo de miocardio con elevación del segmento ST en los centros más grandes. Sin embargo, creemos que este aspecto deberá explorarse en un estudio más grande, preferiblemente de ámbito nacional.
El análisis de los aspectos clínicos del evento isquémico puso de manifiesto que la localización apical de la RTV fue la más frecuente, tal como se ha descrito anteriormente, con una distribución similar entre infartos de la coronaria derecha y la coronaria izquierda. El tiempo transcurrido hasta el diagnóstico es también importante, y constituye un problema reiterado y clásico por lo que respecta a las complicaciones mecánicas del IAM. Al igual que la literatura previa, nuestro estudio pone de manifiesto que la RTV tras un IAM es más frecuente en pacientes cuya asistencia médica tras el inicio de los síntomas se retrasa, de tal manera que en un número sustancial de pacientes la RTV se produce una vez que el paciente se encuentra ya en el hospital.
Creemos que, a pesar de los síntomas iniciales en el momento del diagnóstico, el rápido deterioro del estado hemodinámico de estos pacientes debe preverse y motivar una respuesta precoz basada en la aplicación de tratamientos de asistencia circulatoria mecánica. La asistencia circulatoria con un ECMO-VA, con o sin balón de contrapulsación intraaórtico, es la opción preferida en la mayor parte de los centros17,18. La estabilización con un ECMO-VA podría favorecer unas mejores condiciones generales para practicar una reparación quirúrgica definitiva en el momento oportuno. En nuestro estudio, la tendencia al aumento del uso del ECMO-VA se asoció con una supervivencia ligeramente mejor en el análisis univariante.
Sigue siendo necesario desarrollar mejores técnicas de reparación de la comunicación creada por el defecto del tabique. Se ha descrito el cierre percutáneo con diferentes dispositivos, pero la comunicación izquierda-derecha residual o recurrente se asocia en ambos casos con unos resultados generales muy desfavorables, tal como indica nuestro estudio19-23. La reparación quirúrgica suele ser la opción preferida, pero tiene la limitación de que requiere parches grandes para superar la fragilidad de los bordes de la RTV, lo cual da lugar a una cavidad del ventrículo izquierdo pequeña o restrictiva y shock cardiogénico en algunos casos. Teniendo en cuenta los malos resultados generales de las opciones percutánea y quirúrgica, es de destacar que se utilizara el trasplante de corazón como estrategia de primera línea en algunos de nuestros centros, y con buenos resultados (supervivencia, 5 de 6 pacientes). No todos los centros incluidos pueden practicar trasplantes de corazón, pero el traslado de los pacientes a unidades de insuficiencia cardiaca avanzada específicas es relativamente frecuente y factible dentro del sistema de salud de España, incluso de pacientes en estado grave como los considerados posibles candidatos a un trasplante. A pesar de las limitaciones bien conocidas derivadas de la escasez de donantes, la idoneidad de los pacientes para el trasplante y la complejidad logística, es posible que el trasplante cardiaco sea la mejor opción para ciertos subgrupos específicos, como los pacientes con insuficiencia del ventrículo derecho o izquierdo grave e irreversible o con una comunicación grande.
Otra cuestión importante es el tiempo que transcurre entre la asistencia con ECMO-VA y la reparación quirúrgica definitiva. Por un lado, teóricamente, dejar que transcurra tiempo para permitir que se produzca una cicatrización definitiva de los bordes de la RTV podría facilitar las suturas de la reparación quirúrgica14. Sin embargo, la asistencia mecánica prolongada se asocia con más complicaciones vasculares y hemorrágicas17,18,24. En algunos estudios se ha observado que el beneficio real de una reparación quirúrgica retardada aparece 7 días después del diagnóstico25. Ariza-Solé et al.14 proponen que la cirugía debe retrasarse hasta la recuperación del fallo multiorgánico, 3-4 días después de la colocación del ECMO, y que el dispositivo debe retirarse 2-3 días después de la reparación quirúrgica cuando el paciente se haya estabilizado por completo. Malhotra et al.26 han propuesto un sistema de puntuación pronóstica para establecer el momento óptimo para la reparación quirúrgica. A falta de ensayos clínicos aleatorizados, las grandes series de datos observacionales, como la del presente estudio, indican que se obtiene beneficio con una estrategia basada en el ECMO-VA como tratamiento puente a la cirugía reparadora final o el trasplante cardiaco. Nuestro estudio observa una tendencia no significativa a la reparación retardada de los pacientes asistidos con ECMO-VA, con un aumento de la media de tiempo hasta la reparación, que pasó de 2 a 5 días. En los pacientes tratados con un ECMO-VA, el momento óptimo para la cirugía parecer ser a partir del cuarto día, con una mortalidad hospitalaria del 36%. Esto coincide con los estudios previos ya mencionados14.
Una observación de interés es que se identificó a 3 pacientes con unas arterias coronarias sin obstrucción en el cateterismo cardiaco. Anteriormente se ha identificado que el MINOCA ha sido causa de RTV en varios casos clínicos27-30. La aparición de esta complicación en el MINOCA parece ser extremadamente rara, y no se conocen bien sus características fisiopatológicas.
Este estudio presenta varias limitaciones. El carácter observacional y retrospectivo de nuestro registro, que se basa en datos históricos de los centros participantes, es una posible causa de sesgo de selección, que es la principal limitación. El diseño del estudio original no permite establecer asociaciones causales. Este diseño puede favorecer la pérdida de datos de pacientes con RTV y shock cardiogénico temprano, que fallecieron en las primeras horas de asistencia médica y posiblemente han sido excluidos de las bases de datos de cada una de las unidades. Por lo que respecta al tiempo hasta la ICP, no se dispone de información sobre el intervalo exacto en horas hasta la intervención, que podría explorar mejor la incidencia de la RTV en relación con el retraso en la aplicación del tratamiento. No se utilizó un recurso externo de control de calidad para el análisis de estos datos. Sin embargo, todos los centros seleccionados disponen de una base de datos que registra de manera prospectiva, lo cual debiera haber facilitado que la pérdida de información relevante sea mínima. La incidencia de la RTV es un valor estimado que se basa en los informes de los centros que participaron voluntariamente, y por consiguiente debe interpretarse con cautela. Por último, el hecho de que en esta base de datos participaran solo centros hospitalarios grandes podría limitar la posibilidad de extrapolar la prevalencia o las manifestaciones clínicas de la RTV a otros contextos, aunque creemos que esto tuvo poca repercusión en el análisis del objetivo principal, y los datos presentados deben interpretarse en el contexto de centros terciarios similares.
CONCLUSIONESLa RTV tras un IAM sigue produciendo una alta mortalidad hospitalaria y a 1 año. Se observa una tendencia temporal a una disminución de la mortalidad de la RTV tras el IAM que parece ser multifactorial. Las diferencias en los tratamientos aplicados en los 2 periodos de tiempo analizados fueron los aumentos en la aplicación de asistencia con ECMO-VA y el trasplante cardiaco, este como posible alternativa para casos seleccionados. La contribución del ECMO-VA a la supervivencia total deberá abordarse en ensayos clínicos apropiados.
- –
La RTV después de un infarto de miocardio es una complicación mecánica rara pero grave, con una tasa de mortalidad elevada.
- –
La cirugía de reparación suele ser el tratamiento de elección, pero implica una gran tasa de mortalidad y la elección del momento óptimo para practicarla es un verdadero reto.
- –
Se trata a algunos pacientes con dispositivos de asistencia circulatoria mecánica como puente a una reparación definitiva. No se ha establecido claramente la contribución a la supervivencia específica de estos tratamientos de asistencia invasiva.
- –
Este estudio es un gran registro contemporáneo de RTV que actualiza la información sobre características clínicas y estrategias de tratamiento importantes.
- –
Se observa un aumento de la supervivencia de los pacientes con RTV tras un infarto en la última década.
- –
Ha aumentado la asistencia con ECMO-VA en el tratamiento de la RTV tras un infarto.
- –
Hay una urgente necesidad de evaluar el papel de las estrategias de asistencia mecánica, como el ECMO-VA, como puente para la reparación definitiva o el trasplante cardiaco.
Los autores no recibieron apoyo económico alguno para la investigación, la autoría o la publicación del artículo.
CONTRIBUCIÓN DE LOS AUTORESM. Sanmartín Fernández elaboró el proyecto original y la hipótesis, así como el diseño y los objetivos, y revisó el manuscrito final. J.D. Sánchez Vega, G.L. Alonso Salinas, J.M. Viéitez Flórez y J.L. Zamorano Gómez participaron en los análisis de los datos y la redacción del manuscrito. Los demás autores junto con los ya enumerados participaron en el proceso de inclusión de pacientes. Todos los autores revisaron críticamente el artículo en relación con contenido intelectual importante, han participado en el trabajo y han aprobado la versión final.
CONFLICTO DE INTERESESLos autores declaran no tener conflictos de intereses.
.
.
Colaboración en la recogida de datos: Nagore Horrillo Alonso y Jorge Díaz Calvo del Hospital Universitario de Cruces (Baracaldo), Sandra Rosillo del Hospital Universitario la Paz, IDIPAZ, Madrid. Los autores quisieran dar las gracias a la Dra. Sara Rosenstone Calvo por su ayuda en la corrección de este manuscrito.
Juan Diego Sánchez Vega, Marcelo Sanmartín Fernández, Gonzalo Luis Alonso Salinas, José María Viéitez Flórez, José Luis Zamorano Gómez, Albert Ariza-Solé, Esteban López de Sá, Ricardo Sanz Ruiz, Virginia Burgos Palacios, Sergio Raposeiras-Roubín, Susana Gómez Varela, Juan Sanchis, Lorenzo Silva Melchor, Xurxo Martínez-Seara, Nagore Horrillo Alonso, Jorge Díaz Calvo, Lorena Malagón López, María Luisa Blasco, Andrea Izquierdo Marquisa y Sandra Rosillo.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2020.07.028