Palabras clave
INTRODUCCIÓN
La estenosis aórtica (EA) y la insuficiencia mitral (IM) son actualmente las enfermedades valvulares más comunes en los países desarrollados1. El tratamiento de referencia para la EA y la IM severas es la cirugía: el recambio valvular para la válvula aórtica (RVA) y la reparación o el reemplazo valvular para la válvula mitral (RVM). Durante los últimos 30 años hemos presenciado la rápida evolución de las técnicas de tratamiento percutáneo, de tal forma que en el año 2002 se realizó el primer implante percutáneo de prótesis aórtica (IPPA) en el ser humano2, y en 2005 se comunicaron los primeros resultados en humanos de la reparación percutánea de la VM3.
Estas nuevas modalidades de tratamiento están evolucionando muy rápidamente. En el presente trabajo se debate sobre estas tecnologías emergentes y se destacan varios mensajes importantes para el lector.
ESTENOSIS AÓRTICA
Tratamiento actual
La EA es la valvulopatía más común en la población occidental. Su prevalencia aumenta con la edad y se diagnostica en el 4,6% de los adultos mayores de 75 años4. En el período de 10 años comprendido entre 1995 y 2004, prácticamente se ha doblado el número de RVA quirúrgicos5, lo que se explica fundamentalmente por el aumento de la esperanza de vida en los países desarrollados. Por lo tanto, cabe esperar que la necesidad del RVA continúe aumentando a medida que la población envejezca6.
El RVA quirúrgico se realiza desde comienzos de la década de los sesenta y actualmente constituye la opción terapéutica de referencia para los pacientes con EA severa, en los que se asocia a alivio de la sintomatología y mejora de la supervivencia7,8.
Aunque la mortalidad operatoria media del RVA es de un 3-8%, las tasas de morbimortalidad operatoria varían en función del cirujano y el volumen de cirugías del centro, así como con la comorbilidad del paciente7-10. Así, en Estados Unidos se ha descrito una mortalidad operatoria del 5,1% en los hospitales con mayor volumen quirúrgico, frente a un 11,8% en los hospitales con menor volumen. Las tasas de mortalidad aumentan igualmente con la edad y con la disfunción del ventrículo izquierdo11.
A pesar de que el RVA tiene un riesgo aceptable en la mayoría de los pacientes, en algunos grupos (como en los muy ancianos o los que tienen comorbilidad importante) éste se eleva de forma evidente, lo que conlleva que en muchos de estos casos no llegue a plantearse la intervención7,8,14-16. Según el último EuroHeart Survey17, el 33% de los pacientes mayores de 75 años con EA sintomática severa no fueron intervenidos, y la edad avanzada y la disfunción del ventrículo izquierdo (VI) se relacionaron con la decisión de no intervenir.
Además, el 24% de los pacientes mayores de 75 años con EA severa se encuentran asintomáticos, motivo por el que no se les ofrece el RVA. Sin embargo, hay datos que sugieren que la historia natural de la EA asintomática severa no es benigna, y en este grupo de pacientes se ha descrito una mejor supervivencia a los 5 años con el RVA quirúrgico18 que con el tratamiento conservador (supervivencia del 38% en los pacientes no operados, frente al 90% en los operados). Factores asociados a una mayor mortalidad en el grupo de pacientes no intervenidos fueron la edad, la fracción de eyección y la insuficiencia renal, y se asociaron a una mayor supervivencia el uso de bloqueadores beta y estatinas. Integrando los datos expuestos previamente, se concluye que en más del 50% de los pacientes mayores de 75 años con EA severa no se realiza RVA quirúrgico.
Se han desarrollado diversos sistemas de puntuación para predecir la mortalidad operatoria. Los más utilizados son el EuroSCORE logístico y la puntuación de la Society of Thoracic Surgeons (STS)12,13. Las diferencias entre ambos sistemas o su valor respectivo se hallan fuera de los objetivos de este artículo y, por tanto, no se debatirán aquí.
Implante vía percutánea de prótesis aórtica (IPPA)
Los avances tecnológicos han permitido el desarrollo de prótesis cardiacas de implantación percutánea (PCP) en localización aórtica. Este concepto fue evaluado ya en 1992 por Anderson et al19, quienes colocaron una bioprótesis porcina montada sobre un stent y un catéter en distintas localizaciones de la aorta, con resultados hemodinámicos satisfactorios. Diez años más tarde, Cribier et al2 informaron sobre el primer implante percutáneo de prótesis aórtica realizado con éxito en humanos. Varios grupos han comunicado ya su experiencia inicial con PCP aórticas, bien autoexpansibles, bien montadas sobre balón20-27. En la actualidad existen hasta 17 programas de implante aórtico percutáneo en fase de investigación activa.
Dispositivos para IPPA en fase de ensayo clínico
Válvula sobre balón expansible (Edwards LifeScience Inc)
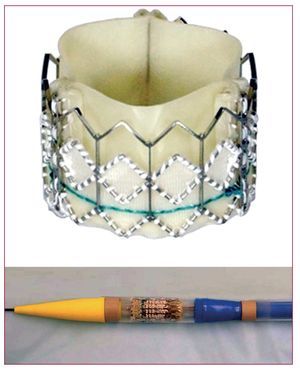
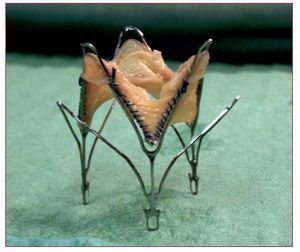
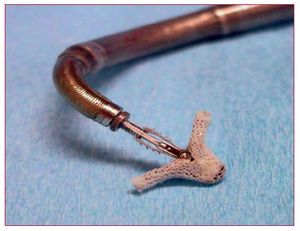
Está formada por tres velos de pericardio, inicialmente equino (Cribier-Edwards) y actualmente bovino (Edwards-Sapien), cosidos dentro de un stent tubular de acero inoxidable que se pliega sobre un balón expansible (fig. 1). La primera prótesis tenía una altura de 14 mm y un diámetro expandido de 23 mm; dispositivos posteriores permiten un segundo tamaño de prótesis, con una altura de 16 mm y un diámetro expandido de hasta 26 mm. Estos dispositivos requieren una vaina de calibre interno 22 F (para la prótesis de 23 mm) o 24 F (para la de 26 mm)2,20,24,26,27. Se está trabajando ya en el desarrollo de prótesis más pequeñas (19 mm), que podrán ser implantadas a través de un introductor de 19 F.
Fig. 1. Prótesis de Edward-Sapiens y catéter para su colocación.
Las primeras PCP aórticas montadas sobre balón expansible se implantaron vía anterógrada mediante abordaje transeptal, tras la canalización de una vena femoral con un introductor de calibre interno 24 F. Esta técnica evita, por lo tanto, el riesgo de lesión arterial periférica2,20. Sin embargo, se ha asociado a un elevado riesgo de lesión de la valva anterior mitral con aparición de IM severa, lo que puede conducir al colapso hemodinámico y muerte20,23,27. Más recientemente se ha demostrado que la vía retrógrada, a través de la arteria femoral y la aorta empleando un catéter dirigible específico, es más segura. De todas formas, debido al gran tamaño del sistema, es necesario en la mayoría de los casos recurrir a un acceso vascular quirúrgico, con disección y exposición de la arteria y cierre quirúrgico tras el procedimiento percutáneo24,26.
Además, debido a que una vez posicionado en el anillo aórtico el balón inflable sobre el que se monta la prótesis tiende a proyectarse hacia delante con cada contracción ventricular, es necesario disminuir el volumen de eyección durante la liberación de la prótesis para impedir su migración a la aorta. Esto se logra realizando estimulación ventricular rápida transitoria desde el ventrículo derecho durante la liberación, con una frecuencia ventricular de 200 lat/min o, en su defecto, la mayor frecuencia con la que se logre conducción auriculoventricular 1:1 estable. El proceso exige una excelente sincronización entre los miembros del equipo para lograr un correcto posicionamiento de la prótesis en el anillo. Investigadores franceses y canadienses han tenido éxito con esta técnica, cuyos resultados ya han publicado26,27. El grupo francés utilizó tanto la vía anterógrada (23 pacientes) como la retrógrada (4 pacientes). El EuroSCORE medio fue de 12 ± 2 puntos (mortalidad teórica > 20% a los 30 días); el éxito del procedimiento, del 75% y la mortalidad a los 30 días, del 16%. En un seguimiento a 26 meses no se ha detectado deterioro funcional de la PCP, y se mantiene el beneficio clínico27.
El grupo canadiense obtuvo mejores resultados utilizando sólo la vía retrógrada (50 pacientes), con un catéter dirigible especialmente diseñado. El éxito del procedimiento fue del 86% y la mortalidad a los 30 días, del 12% (para un EuroSCORE logístico estimado del 28%). Se hace evidente la existencia de una curva de aprendizaje pronunciada, con un éxito creciente del procedimiento y una reducción de las complicaciones vasculares en los segundos 25 pacientes en comparación con los 25 primeros26. Resultados similares (no publicados) han documentado los investigadores de Estados Unidos en el registro REVIVAL II. En la actualidad hay ensayos clínicos en curso que comparan el RVA quirúrgico con el IPPA y con el tratamiento médico (PARTNER-US y PARTNER-EU), utilizando esta PCP sobre balón expansible.
Más recientemente se ha descrito la implantación transapical de esta prótesis, con resultados aceptables28-30. Este método puede ser idóneo para los pacientes con alto riesgo quirúrgico y arteriopatía periférica significativa que impida el uso de la vía retrógrada. En un registro multicéntrico con 59 pacientes, el éxito del procedimiento fue del 90% y la mortalidad a los 30 días del 13,6%, frente a una mortalidad media de 27 ± 14% prevista por el EuroSCORE logístico30. Este método elimina el riesgo de lesión arterial y sus consecuencias, y hace menos importante el calibre del introductor. Además, ofrece un acceso más fácil y directo a la válvula aórtica y quizá una mejor manipulación de la PCP. Sin embargo, cabe esperar que el número de pacientes que requieran este método alternativo disminuya pronto, según se produzcan nuevos avances tecnológicos y mejore el perfil de los dispositivos de implantación retrógrada.
Válvula autoexpansible (Revalving System, Core Valve)
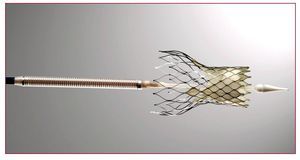
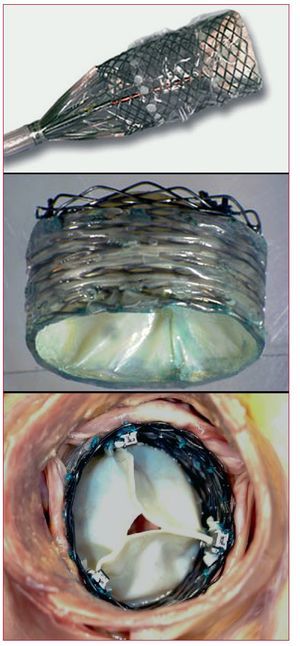
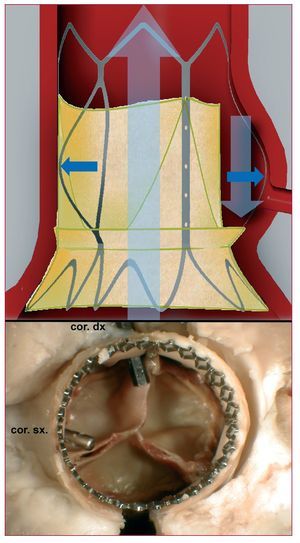
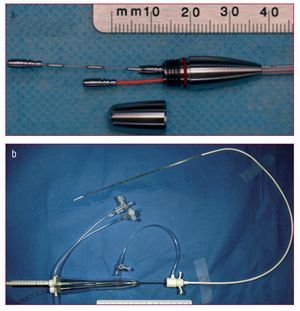
Está formada por tres velos de tejido pericárdico, inicialmente bovino y actualmente porcino, montados y suturados sobre un stent autoexpansible de nitinol (fig. 2). Los diámetros valvulares disponibles son de 22 y 26 mm, y la longitud del stent es de 50 mm. La porción inferior (entrada) tiene una elevada fuerza radial, lo que permite expandir y excluir las valvas aórticas calcificadas; en la porción media está montada la válvula en sí y es donde se sitúa el punto de coaptación de las valvas; esta zona tiene menor diámetro para evitar la obstrucción de las arterias coronarias; la porción superior (salida) es acampanada y fija y orienta el stent en la aorta ascendente.
Fig. 2. Prótesis de CoreValve y catéter para su colocación.
Los dispositivos de primera generación requerían introductores de 25 F. Los de segunda generación incorporaron tejido pericárdico porcino, que permitió rebajar el diámetro de la vaina a 21 F. Para el dispositivo actual se ha rediseñado el método de fijación del tejido valvular al stent, con lo que se ha logrado reducir el diámetro a 18 F21,22,25. Este dispositivo de última generación ha mostrado una superioridad inmediata sobre los previos, puesto que permite realizar el implante percutáneo de la válvula aórtica sin ningún tipo de apoyo hemodinámico ni estimulación ventricular rápida. Además, el empleo de dispositivos de cierre arterial percutáneo preparados antes del procedimiento permite obviar la necesidad del acceso quirúrgico y la reparación vascular local, lo que convierte a este procedimiento en una técnica verdaderamente propia de un laboratorio de intervencionismo percutáneo.
Mientras que los resultados obtenidos con el dispositivo de primera generación mostraron una abrupta curva de aprendizaje y pusieron de manifiesto el largo camino que le quedaba por recorrer a esta tecnología emergente21, los dispositivos de segunda y tercera generación presentaron unos resultados aceptables25. El éxito del procedimiento en una serie de 86 pacientes alcanzó el 88%, y la mortalidad a los 30 días fue del 12% (frente a una mortalidad teórica de 23% ± 13% estimada por el EuroSCORE logístico)25. No se produjeron casos de insuficiencia aórtica (IA) severa después del implante de la PCP, y todas las IA posprocedimiento eran de origen paravalvular. En el momento actual se han implantado más de 800 prótesis y se dispone de seguimiento de hasta 3 años, en el que no se han evidenciado disfunciones protésicas31.
Esta PCP (Core Valve) se ha empleado también en pacientes con una bioprótesis previa degenerada32, siguiendo el concepto de una «válvula dentro de otra válvula». Con la implantación de una PCP en estos casos, teóricamente cabría esperar una incidencia de fenómenos adversos (fugas paravalvulares o embolias cerebrales) menor que con el tratamiento de una válvula aórtica nativa calcificada. El anillo protésico previo sirve como marcador para el posicionamiento, lo que simplifica el proceso. Por tanto, este método aspira a ser una alternativa más segura que la reintervención quirúrgica en muchos pacientes con bioprótesis degeneradas.
Tecnología venidera
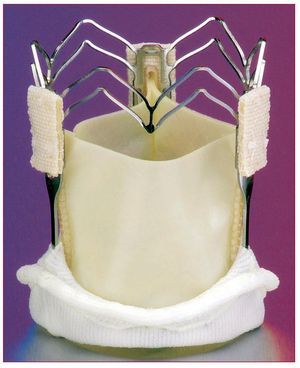
Existen al menos otras 7 PCP en fase de pruebas clínicas iniciales o con los primeros resultados en humanos (FIM), a saber: Paniagua Valve (Endoluminal Technologies) (fig. 3), de la que se ha publicado 1 implante humano33; la válvula autoexpandible Enable (ATS [3F]), de tejido pericárdico montado sobre una estructura de nitinol y diseñada partiendo del concepto definido como «form follows function» («la función determina la forma») (fig. 4); la AorTx valve (fig. 5), una válvula autoexpansible de nitinol que permite recapturar y reposicionar la válvula expandida, y que se ha implantado en quirófano en 8 pacientes de forma transitoria antes de una cirugía de RVA (datos no publicados); la Direct Flow Valve (fig. 6), un concepto muy innovador de PCP (no puede clasificarse ni como autoexpansible ni como expansible con balón), ya que se fija en la posición deseada mediante un polímero no reabsorbible para hinchar los anillos. Tiene la ventaja de que también puede ser recapturada y reposicionada, y se ha probado temporal y permanentemente en el ser humano (datos no publicados). La Sadra-Lotus valve (fig. 7), es una PCP autoexpansible y reposicionable, que se acorta inicialmente de forma pasiva con moderada fuerza radial permitiendo el centrado de la prótesis, y que presenta un factor posterior de acortamiento activo que aumenta la fuerza radial y la fija en la posición final. Se acaba de publicar el primer implante con éxito en humanos, vía retrógrada a través de un introductor de 21 F, en el que no quedó regurgitación aórtica residual y cuyos resultados hemodinámicos se mantienen en el seguimiento a 3 meses34. La PCP autoexpansible Perceval (fig. 8), consta de dos estructuras funcionalmente independientes: un stent de nitinol autoexpansible patentado que se aproxima a la morfología anatómica de la raíz aórtica y los senos de Valsalva, y unos pilares no expansibles que soportan una válvula de doble lámina de tejido pericárdico y refuerzan el sellado contra la válvula natural para reducir las fugas paravalvulares. Finalmente, la Jena Valve (fig. 9) es una PCP autoexpansible de nitinol, de menor perfil y reposicionable, y que también tiene resultados FIM no publicados.
Fig. 3. Prótesis de Paniagua.
Fig. 4. Prótesis Enable PHV.
Fig. 5. Prótesis AorTx.
Fig. 6. Prótesis Direct Flow.
Fig. 7. Prótesis Sadra-Lotus.
Fig. 8. Prótesis Perceval.
Fig. 9. Prótesis Jena.
Existen además varias PCP en fase de investigación que introducen conceptos innovadores, como: la Heart Leaflet Technologies's Valve, elaborada a partir de una malla de nitinol invertida y con un collar anti-reflujo reposicionable y recapturable (fig. 10); la PCP desarrollada por Zegdi et al (fig. 11), que es reposicionable y recapturable, y en la que el sistema de liberación facilita la orientación de acuerdo con las angulaciones de la anatomía nativa35; la prótesis Valvexchange (fig.12), con una estación de anclaje que se sutura quirúrgicamente y sobre la que se anclan las valvas, lo que permite reemplazarlas percutáneamente en caso necesario; o la PCP Lutter, con valvas desarrolladas mediante tecnología tisular montadas sobre un stent auto-expansible de nitinol (fig. 13). Finalmente, una tecnología muy prometedora es la aplicación de la nanotecnología para el desarrollo de nuevos materiales con diferentes propiedades fisicoquímicas, como la Perc-Valve (fig. 14), en la que tanto la estructura como las valvas están elaboradas con un nuevo nitinol elástico nanosintetizado, desarrollado por Advanced Bio-prosthetic Surfaces. Los estudios iniciales en animales mostraron una endotelización muy rápida de las valvas de nitinol, 2 semanas después del implante (datos no publicados); si esto se confirmase en humanos, podría evitarse la necesidad de la anticoagulación de forma indefinida, a pesar de la presencia de valvas metálicas.
Fig. 10. Heart Leaflet Technologies.
Fig. 11. Prótesis desarrollada por Zegdi et al.
Fig. 12. Valvexchange.
Fig. 13. Lutter.
Fig. 14. Perc-Valve.
REGURGITACIÓN MITRAL
Tratamiento quirúrgico de la IM
La sustitución o la reparación quirúrgicas de la válvula mitral (VM) presentan una mortalidad operatoria media del 6 y el 2% respectivamente, y son hoy en día el tratamiento de referencia para los pacientes con IM severa. Sin embargo, al igual que ocurre en la cirugía de la EA, las tasas de mortalidad quirúrgica varían en función del cirujano que realice la intervención, del volumen de cirugías del hospital10,36 y de la comorbilidad del paciente5, así como con la edad y la disfunción ventricular izquierda11.
Los pacientes con IM sintomática severa tienen un pronóstico desfavorable, y las perspectivas para aquellos con IM asintomática severa, especialmente si presentan disfunción o dilatación del ventrículo izquierdo, tampoco son benignas37,38, por lo que estas situaciones son indicación de clase I del American College of Cardiology-American Heart Association (ACC-AHA) de cirugía valvular mitral37.
La sustitución quirúrgica de la VM se lleva a cabo desde comienzos de la década de los sesenta, y se asocia a una mejoría de los síntomas y a un incremento de la supervivencia7,8. Durante la última década, la reparación de la VM se lleva a cabo cada vez con más frecuencia5. Se ha visto que la reparación de la VM presenta menos mortalidad perioperatoria y mejor supervivencia que el reemplazo valvular mitral, con mejor preservación de la función sistólica del VI. Además evita las complicaciones asociadas al reemplazo valvular, como la endocarditis o los fenómenos tromboembólicos37,39,40. Por lo tanto, en los pacientes apropiados y en centros donde la habilidad y la experiencia quirúrgicas sean suficientes, debe darse prioridad a la reparación sobre el reemplazo de la VM, aunque técnicamente sea un procedimiento más complejo37. Además, en los últimos años se están introduciendo técnicas de reparación valvular mitral mínimamente invasivas, mediante miniesternotomía o por toracoscopia, en ocasiones ayudados por tecnología robótica41-43.
Al igual que ocurre en la EA, es frecuente no someter a cirugía a los pacientes con riesgo quirúrgico muy elevado, generalmente muy ancianos o con comorbilidad importante44. Sin embargo, hay estudios que muestran que los pacientes ancianos obtienen beneficios similares a los que obtienen los más jóvenes, en cuanto a recuperación de la esperanza de vida tras la cirugía mitral, lo que cuestiona esta actitud45. Un análisis reciente del EuroHeart Survey mostró que se había tomado la decisión de no intervenir al 49% de los pacientes con IM severa sintomática, y que esta decisión se relacionaba con la edad del paciente, la disfunción ventricular izquierda y el índice de comorbilidad de Charlson. Además, en este registro, el 26% de los pacientes con IM severa se definían asintomáticos, por lo que las probabilidades de ser intervenidos eran aún menores. Sin embargo, hay estudios que demuestran que la historia natural de la IM asintomática severa no es benigna, y se ha visto que la evolución a largo plazo en determinados grupos de pacientes (disfunción ventricular, dilatación ventricular izquierda, orificio regurgitante > 40 mm2)38 mejora con la cirugía37,46.
Si dispusiéramos de técnicas de abordaje percutáneo (y, por tanto, menos invasivas) para la reparación de la IM, éstas constituirían una opción atractiva para estos pacientes, ya que el tratamiento percutáneo permitiría evitar la cirugía, o al menos retrasarla sin perjudicar la función ventricular.
Nuevos enfoques de tratamiento percutáneo para la insuficiencia mitral
La VM es una estructura anatómicamente más compleja que la válvula aórtica, ya que es parte de la estructura ventricular. La alteración de cualquiera de sus componentes puede producir una IM o contribuir a ella, como las alteraciones del anillo mitral o de los velos mitrales, de los músculos papilares, las cuerdas tendinosas, la pared del VI o la aurícula izquierda.
La reparación quirúrgica de la IM se fundamenta en unas técnicas básicas: resección parcial de las valvas (resección cuadrangular), plicatura de las valvas, anuloplastia, modificación papilar o reemplazo cordal y remodelado del ventrículo izquierdo (VI). La mayoría de las técnicas de reparación percutánea de la VM se basan en estos principios quirúrgicos, por lo que las principales técnicas de reparación percutánea en la actualidad son: plicatura de las valvas, anuloplastia indirecta (remodelado del seno coronario [SC]), anuloplastia asimétrica, anuloplastia directa y remodelado del VI.
Reparación percutánea de las valvas borde con borde (plicatura de las valvas)
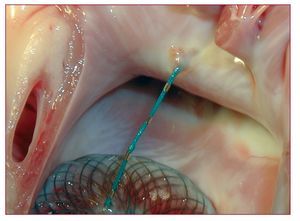
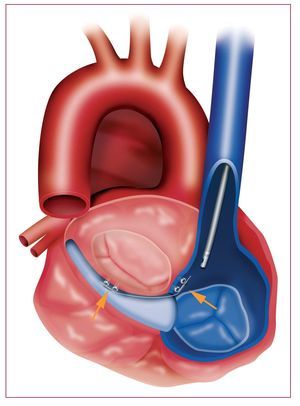
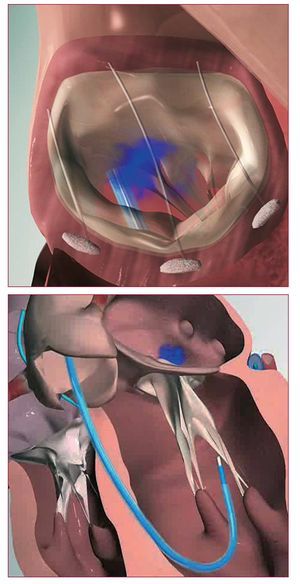
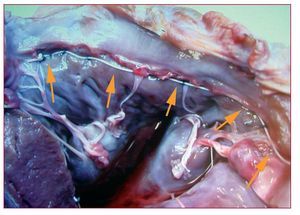
Esta técnica se basa en el método descrito por Alfieri et al47, según el cual se suturan los velos anterior y posterior en sus porciones centrales, lo que genera una válvula mitral de «doble orificio» y restablece la coaptación valvular. El dispositivo MitraClip (Evalve, Inc., Redwood City, California, Estados Unidos) (fig. 15) emula esta técnica. Precisa un acceso transeptal a la aurícula izquierda y, posteriormente, con un catéter dirigible se coloca una grapa uniendo los bordes de los velos anterior y posterior de la VM. Se ha completado el ensayo en fase I (EVEREST I) y está en curso un ensayo clínico en fase II frente a cirugía (EVEREST II).
Fig. 15. MitraClip.
Los resultados iniciales del EVEREST I mostraron éxito del procedimiento en el 81% de los pacientes3, pero al mes de seguimiento sólo el 63% de los pacientes con un resultado inicial satisfactorio presentaba una IM £ grado 2, que era el objetivo de eficacia. El 82% de los pacientes dados de alta con una grapa se encontraban libres de cirugía valvular a los 6 meses3. A 3 pacientes no se les implantó MitraClip, y finalmente fueron intervenidos quirúrgicamente, y 6 de los pacientes con reparación percutánea exitosa precisaron cirugía mitral posterior, sin que este procedimiento percutáneo inicial limitase las opciones o las técnicas quirúrgicas posteriores48. No se produjeron muertes, complicaciones cardiacas ni embolizaciones del dispositivo asociados al procedimiento, ni se precisó cirugía urgente. Los fenómenos adversos incluyeron un ictus por hipotensión persistente después del procedimiento y 3 pacientes con desprendimiento parcial del MitraClip en una valva3. El seguimiento a 2 años del ensayo EVEREST I mostró que el 80% de los pacientes dados de alta con una grapa seguían vivos y libres de IM recurrente (mayor de grado II) y de cirugía de la VM49. Para tener datos a más largo plazo sobre la evolución de la reparación percutánea, así como para la comparación con la cirugía, será necesario esperar a los resultados del ensayo EVEREST II, actualmente en curso.
Un segundo dispositivo que utiliza una sutura para la plicatura de las valvas es el dispositivo Mobius (Edwards Life Sciences). Estudios en animales demostraron la viabilidad del sistema50; sin embargo, su desarrollo se interrumpió después de los primeros 14 implantes en humanos.
Anuloplastia indirecta-remodelado del seno coronario
Este grupo de dispositivos trata de emular el efecto del anillo de anuloplastia quirúrgico, en este caso modificando la forma del anillo mitral (AM) desde el seno coronario, dada su proximidad a éste. Aunque la colocación quirúrgica de un anillo reduce eficazmente la IM, esta técnica se realiza generalmente en combinación con la revascularización coronaria quirúrgica y se acompaña de una elevada mortalidad51,52. Por este motivo, los dispositivos de anuloplastia mitral transvenosa percutánea poseen un atractivo obvio. Varios de éstos se han utilizado experimentalmente en humanos.
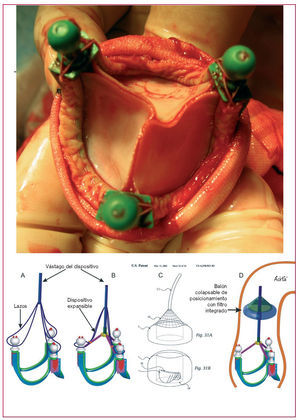
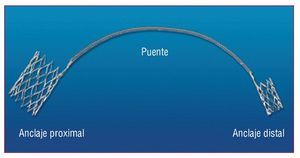
El primero de ellos es el dispositivo Carillon (Cardiac Dimension Inc., Kirkland, Washington, Estados Unidos), que consta de un anclaje distal y otro proximal de nitinol conectados mediante un puente del mismo material. Éstos se posicionan y liberan en la vena cardiaca magna y el SC proximal, respectivamente, mediante un catéter especialmente diseñado (fig. 16). Al aplicar tensión al sistema se comprime el anillo mitral. En un estudio de viabilidad a pequeña escala se observó que este dispositivo reducía moderadamente el diámetro del AM en su dimensión septal-lateral, y también se producía una reducción moderada de la IM cuando se colocaba con carácter transitorio53. Datos no publicados del ensayo AMADEUS, un estudio multicéntrico europeo, mostraron que en 34 pacientes con insuficiencia cardiaca e IM funcional el éxito del implante fue del 70%, con reducción de la IM hasta en un 80% de los pacientes, y con mejoría de la clase funcional de la NYHA en al menos un grado en el 75%. La implantación se realizó incluso en casos en que una arteria coronaria cruzaba el SC54. Sólo en 2 casos fue necesario recapturar el dispositivo por compresión de la arteria coronaria, lo que puso de manifiesto que no todas las arterias coronarias cruzadas se veían finalmente comprometidas.
Fig. 16. Dispositivo Carillon.
El dispositivo Viacor emplea un concepto diferente (figs. 17a, 17b). Con barritas de nitinol de longitudes y rigidez variables colocadas en el SC mediante un catéter, se logra ejercer una fuerza hacia el exterior que da lugar a un desplazamiento anterior de la porción media del anillo mitral posterior, lográndose una disminución de la dimensión septal-lateral del AM y una reducción de la IM. Este dispositivo se ha sometido a prueba en unos pocos pacientes, aunque la implantación fue sólo transitoria55.
Fig. 17. Dispositivo Viacor y vaina.
El dispositivo Viking de AMTP (Edwards Lifesciences, Inc.) consta de un catéter guía externo, un catéter interno de menor calibre que permite el posicionamiento, y un implante de nitinol. El implante tiene 3 secciones: un anclaje autoexpansible distal, un anclaje autoexpansible proximal y un puente entre ambos de tipo muelle, constituido de forma parcial por material reabsorbible, y que se acorta según este material desaparece. De este modo, el SC proximal y la vena cardiaca magna distal se aproximan, lo que desplaza indirectamente el anillo posterior hacia delante, con reducción del diámetro septal-lateral. El estudio inicial de viabilidad mostró un efecto inicial favorable sobre la IM, pero la aparición de fallos del dispositivo y la recurrencia de la regurgitación mitral obligaron a interrumpir el estudio para mejorar el diseño del dispositivo56.
El dispositivo Monarc es la segunda generación del Viking, con un diseño similar pero con un refuerzo en el segmento del puente (fig. 18). En el estudio de fase I EVOLUTION (en 55 pacientes), se obtuvo un éxito del 89% en el implante, con 6 fallos por anatomía tortuosa o por dimensiones inapropiadas del SC57. De los casos con implante satisfactorio, sólo en el 70% se colocó el dispositivo en la localización pretendida y sin complicaciones cardiacas. A los 6 meses, la IM había disminuido más de un grado en el 92% de los pacientes. Entre los 9 pacientes con complicaciones cardiacas durante el implante, uno presentó un infarto de miocardio por compresión del dispositivo sobre la primera arteria diagonal, y en 2 casos se produjo taponamiento cardiaco por la guía metálica. Próximamente comenzará el estudio EVOLUTION II.
Fig. 18. Dispositivo Monarc.
A pesar de estos resultados positivos de viabilidad y seguridad, existen algunas limitaciones para el uso de la vía del SC. Estos dispositivos probablemente encogen el AM sólo de forma indirecta, por tracción sobre la pared de la AI, aprovechando la proximidad del anillo mitral al SC. Sin embargo, estudios anatómicos quirúrgicos indican que el SC está localizado por detrás de la pared de la AI, a una distancia significativa del AM58. De modo similar, la tomografía computarizada con múltiples detectores ha identificado una variabilidad significativa en la relación del SC con el AM, distancia que parece aún mayor en los pacientes con IM severa y dilatación anular59.
Existe el riesgo, además, de que estos dispositivos compriman un vaso coronario epicárdico, ya que se ha descrito que la arteria circunfleja cruza entre el SC y el AM en un 64-84% de los sujetos estudiados, y la arteria interventricualr anterior cruza la DA o el ramo bisectriz en el 16% de los pacientes58,59. Esto se hizo patente en el estudio EVOLUTION I, como ya se ha comentado. Otras limitaciones de este método incluyen la calcificación significativa del AM, la presencia de electrodos marcapasos en el SC y anomalías estructurales de las valvas mitrales.
Anuloplastia asimétrica
Este grupo de dispositivos busca remodelar el AM de forma más directa que los previos. Así, el sistema PS3 (Ample Medical, Foster City, CA) (fig. 19) utiliza un anclaje en el SC (barra en T) unido mediante un puente a un segundo anclaje situado en el septo interauricular (Amplatzer PFO occluder). El anclaje del SC y el puente se unen mediante imanes especialmente diseñados, y la tensión ejercida sobre el puente modula el acortamiento septal-lateral60. Disponemos ya de resultados FIM con este dispositivo, con el que se logró una reducción del 30% en la dimensión septal-lateral, y reducción mayor de un grado de la IM, sin compromiso de la arteria circunfleja60. Se desconoce la durabilidad de este sistema, así como si se produce remodelado auricular o del AM con la IM recurrente.
Fig. 19. Dispositivo PS3.
Un segundo dispositivo en fase de desarrollo preclínico (St. Jude Medical, fig. 20) utiliza 2 anclajes helicoidales: uno se coloca en el miocardio del VI entre P2 y P3, accediendo a través del SC, y el segundo se implanta en el trígono postero-medial accediendo a través de la aurícula derecha. Ambos se conectan por un cable, que cincha el AM.
Fig. 20. Dispositivo de cinchaje St. Jude.
Anuloplastia directa
Pretende evitar las limitaciones inherentes a las anuloplastias asimétrica e indirecta. El dispositivo Mitralign (Mitralign, Tewksbury, Massachusetts, Estados Unidos) (fig. 21) consta de dos anclajes que se colocan directamente en el AM posterior, al que se accede desde el SC y el VI mediante un dispositivo magnético. Se conectan mediante una sutura, creando una «bolsa de tabaco», lo que disminuye la longitud el AM. Se ha logrado un acceso retrógrado fiable desde el VI al espacio perianular. Los modelos preclínicos han tenido éxito y se están programando estudios clínicos.
Fig. 21. Dispositivo Mitralign.
El Guided Deliverty Systems (GDS) Accucinch Annuloplasty System (fig. 22), que tiene ya resultados FIM (datos no publicados), utiliza este mismo enfoque. El anillo se cincha circularmente por debajo de la valva mitral posterior, de trígono a trígono, y se remodela la base del VI, produciéndose mejoría aguda de la IM y de la función del VI cuando se realiza en asociación con la cirugía de revascularización coronaria.
Fig. 22. GDS Accucinch Annuloplasty System.
El dispositivo QuantumCore (Q-Care) (fig. 23) induce la cicatrización y el consiguiente acortamiento del anillo mitral aplicándole radiofrecuencia, logrando así un efecto de anuloplastia directa. El dispositivo posee una punta «en asa» que contiene varios electrodos y pares térmicos que regulan la cuantía de la energía aportada, y se halla en fase de desarrollo preclínico. Es necesario el abordaje transeptal.
Fig. 23. Dispositivo QuantumCore.
Se están investigando también técnicas híbridas y no puramente percutáneas. Así, el anillo de anuloplastia ajustable MitralSolutions (fig. 24) se implanta quirúrgicamente, y puede ser ajustado posteriormente por vía transeptal mediante un cable mecánico rotatorio. Un enfoque similar es el Dynamic Annuloplasty Ring System, de Micardia Inc. (fig. 25), un anillo de anuloplastia que también se implanta quirúrgicamente, pero que se ajusta mediante energía de radiofrecuencia a través de un catéter transeptal. Ambos se hallan actualmente en desarrollo preclínico.
Fig. 24. Anillo de anuloplastia ajustable MitralSolutions.
Fig. 25. Micardia Dynamic Annuloplasty Ring System.
Remodelado del VI
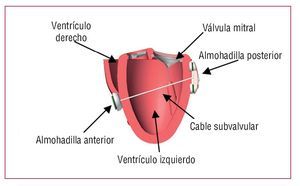
La tecnología percutánea iCoapsys se basa en el sistema quirúrgico Coapsys (Myocor, Maple Grove, MN, USA) (fig. 26), que coloca almohadillas en ambos lados del ventrículo izquierdo, unidas mediante un cable que atraviesa la cavidad del mismo y que aplica tensión al anillo mitral y a la pared basal del VI. Los datos quirúrgicos iniciales indican que el dispositivo se puede implantar con seguridad, con reducción aguda de la IM y del remodelado positivo del VI61. El dispositivo percutáneo se implanta transpericárdicamente por vía sub-xifoidea, y se halla actualmente en fase preclínica.
Fig. 26. Sistema iCoapsys.
Tecnologías venideras
Dado que los mecanismos de la IM son múltiples, es improbable que el uso de una única técnica percutánea proporcione una reducción tan eficaz de la IM como la que se logra con la reparación quirúrgica, pues el cirujano emplea habitualmente una combinación de técnicas bajo control visual directo. Por tanto, para conseguir unos resultados comparables a los de la cirugía, probablemente sea necesaria también una combinación de técnicas percutáneas.
Cabe esperar que el desarrollo de las técnicas de reemplazamiento valvular mitral percutáneo permita lograr mejores resultados que la reparación mitral percutánea en determinados pacientes. Una prótesis mitral de implantación percutánea en fases iniciales de desarrollo es la Endovalve-Hermann (fig. 27), que se implanta desde la aurícula izquierda mediante acceso transeptal y que requiere una vaina de 24 F para su colocación. Aún se están realizando mejoras técnicas previas a las pruebas clínicas.
Fig. 27. Prótesis Endovalve-Hermann.
Orientaciones futuras
El alto ideal de cooperación que mantiene viva la Estación Espacial Internacional permite la colaboración de más de diez países, 116 tripulaciones y científicos de diversas nacionalidades, y 10.000 individuos involucrados en diferentes agencias espaciales. Este mismo espíritu de colaboración es el que debe impulsar el desarrollo de las tecnologías de tratamiento valvular percutáneo. En este contexto, es vital la colaboración entre cirujanos cardiacos, cardiólogos intervencionistas, ecocardiografistas, expertos en ciencias básicas, así como con la industria y las entidades reguladoras. Las competencias de territorios no sólo dificultan la evolución y avance de estas tecnologías, sino que, lo que es más importante, perjudican a los pacientes.
La terapéutica valvular percutánea está evolucionando muy rápidamente. Existen en la actualidad dos prótesis cardiacas aórticas de implantación percutánea en fase de ensayo clínico, y varias con resultados FIM o en fase preclínica. Los resultados iniciales parecen prometedores, lo que indica que el IPPA será una opción real para pacientes seleccionados en un plazo relativamente breve. El futuro del tratamiento percutáneo de la EA requiere el desarrollo de dispositivos de menor perfil, reposicionables y recapturables, así como probablemente precise integrar otros materiales manipulados mediante nanotecnología e ingeniería hística. En última instancia, según se profundice en el conocimiento de la etiopatogenia de la EA, el tratamiento farmacológico óptimo en el futuro debería evitar la aparición de la enfermedad o frenar su progresión.
En el campo del tratamiento percutáneo de la regurgitación mitral se están ensayando distintas técnicas, la mayoría basadas en técnicas quirúrgicas previas. En comparación con el IPPA, la reparación mitral es un proceso más complejo, dado que la insuficiencia valvular puede deberse a mecanismos muy diversos. Las técnicas actuales sólo son adecuadas para determinados pacientes cuidadosamente seleccionados y con una etiología específica de IM. Lo más probable es que para una reparación satisfactoria de la VM sea necesaria una combinación de estas técnicas, a pesar de lo cual muchos pacientes precisarán probablemente un recambio valvular. Por lo tanto, el reemplazo percutáneo de la VM —o el implante percutáneo de prótesis mitrales— puede ser una apasionante alternativa en un futuro próximo. A medida que aumente nuestro conocimiento sobre la regurgitación mitral, se ampliarán también las opciones de tratamiento; esperemos que llegue un día en el que el tratamiento farmacológico permita evitar la aparición de esta afección o, al menos, retrasar su progresión de forma significativa.
ABREVIATURAS:
AM: anillo mitral.
EA: estenosis aórtica.
FIM: «first in man».
IM: insuficiencia mitral.
IPPA: implante percutáneo de prótesis aórtica.
PCP: prótesis cardiaca de implantación percutánea.
RVA: recambio valvular aórtico.
SC: seno coronario.
VI: ventrículo izquierdo.
VM: válvula mitral.
Conflicto de intereses:
El Dr. Carlos E. Ruiz es consultor de CoreValve.
Correspondencia: Carlos E. Ruiz, MD, PhD. 130 East 77th Street. 9th Floor Blackhall. New York, NY 10021. Estados Unidos. Correo electrónico: cruiz@lenoxhill.net