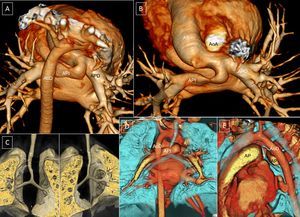
El desarrollo de la tomografía computarizada con multidetectores ha supuesto una revolución en el estudio de la aorta y los grandes vasos y ha sustituido a la angiografía para diagnosticar las anomalías congénitas del arco aórtico, en particular los anillos vasculares. La tomografía computarizada con multidetectores ofrece la gran ventaja de que se puede evaluar nítidamente y en tres dimensiones no solo las estructuras vasculares, sino también la compresión en la vía aérea y el esófago. Queremos hacer un abordaje del desarrollo embriológico del arco aórtico y de las anomalías en su desarrollo que determinan la formación de anillos vasculares y ofrecer un enfoque actual del papel de la tomografía computarizada con multidetectores para su abordaje diagnóstico y terapéutico.
Palabras clave
Los anillos vasculares (AV) son anomalías congénitas del desarrollo de los arcos aórticos por las que las estructuras vasculares circundan y pueden comprimir la vía aérea y el esófago1. El término AV fue introducido por Robert Gross en 19482. Pueden ser completos, si las estructuras vasculares rodean totalmente la vía aérea y la digestiva, o incompletos, conocidos en la literatura anglosajona como slings, en los que la compresión no es completa1 (tabla). Las malformaciones congénitas más frecuentes del arco aórtico —en concreto, el arco izquierdo con subclavia derecha anómala (ARSA, por sus siglas en inglés) y el arco derecho con vasos en espejo— no forman anillos salvo en situaciones excepcionales.
Tipos de anillos vasculares
| Anillos vasculares completos | Anillos vasculares incompletos |
|---|---|
| Doble arco aórtico | AAI + ARSA |
| AAD con vasos en espejo y ligamento posterior | AAD con vasos en espejo |
| AAD con ALSA y DAP izquierdo | AAD con ASI aislada |
| AAD con ASI aislada y DAP derecho | Sling pulmonar |
| Aorta descendente contralateral al arco aórtico y DAP contralateral |
AAD: arco aórtico derecho; AAI: arco aórtico izquierdo; ALSA: arteria subclavia izquierda anómala; ARSA: arteria subclavia derecha anómala; ASI: arteria subclavia izquierda; DAP: ductus arterioso permeable.
La prevalencia de AV es difícil de precisar porque la mayoría de los datos proceden de series antiguas que recogen datos de pacientes sintomáticos, mientras que actualmente se diagnostican con frecuencia en periodo prenatal y en muchos casos son asintomáticos tanto en el periodo neonatal como posteriormente3–6. Los AV más frecuentes son el doble arco aórtico (DAA) y el arco derecho con subclavia izquierda anómala (ALSA, por sus siglas en inglés). En el DAA, producen la compresión de la vía aérea y digestiva los arcos izquierdo y derecho en sí mismos. En el arco aórtico derecho (AAD) con subclavia anómala (AAD con ALSA), la compresión se debe al curso retroesofágico de la subclavia izquierda y al ligamento resultante del cierre del ductus arterioso izquierdo que fija la aorta descendente (posterior) a la arteria pulmonar (anterior).
La detección de cardiopatías congénitas ha mejorado en las últimas décadas gracias a una mayor precisión diagnóstica en los periodos prenatal y neonatal. La prevalencia de las distintas cardiopatías está sufriendo cambios motivados por diversos factores, como la interrupción voluntaria del embarazo y el aumento de gestaciones procedentes de fertilización in vitro y de madres mayores. Aun así, un estudio recientemente publicado7 muestra una prevalencia de cardiopatías congénitas de 67,7:10.000 recién nacidos vivos, similar a las de estudios epidemiológicos clásicos8, y cita una prevalencia de AV de 1:10.000 recién nacidos vivos7. Las series fetales actuales, sin embargo, ofrecen una incidencia en torno a 1–1,5:1.0003–6. La discrepancia de cifras entre unas y otras hace pensar en un espectro más amplio de la enfermedad, que abarcaría desde casos leves detectados prenatalmente con curso clínico prácticamente asintomático4–6 hasta situaciones graves desde el nacimiento con dificultad respiratoria grave por afección de la vía aérea3–6.
Los síntomas respiratorios son secundarios a la compresión de la vía aérea y pueden manifestarse precozmente por síndrome de dificultad respiratoria grave o estridor inspiratorio franco. También pueden producir síntomas menos llamativos como broncospasmo o infecciones respiratorias recurrentes. Los síntomas de compresión digestiva consisten en alteraciones de la deglución a sólidos o líquidos y son más frecuentes en pacientes mayores, mientras que los respiratorios son los predominantes en lactantes9–11.
Las técnicas diagnósticas tradicionalmente utilizadas para el diagnóstico han sido el esofagograma, la ecocardiografía y la angiografía. La compresión traqueoesofágica es tanto a izquierda-derecha, como anterior y posterior en el caso del DAA, mientras que es fundamentalmente posterior en el caso de que haya una subclavia izquierda o derecha anómala. Las zonas de compresión son evidentes en los esofagogramas baritados. La compresión esofágica anterior es característica del sling de la arteria pulmonar porque la arteria pulmonar izquierda pasa entre la tráquea y el esófago9–11. La ecocardiografía, aunque se realiza sistemáticamente, no es la técnica más útil porque con frecuencia arroja falsos negativos, sobre todo en el caso de subclavia anómala izquierda o derecha. La disposición habitual de los grandes vasos en el AAD es especular respecto a la que tienen en el arco izquierdo, de modo que el primer vaso es el tronco braquiocefálico izquierdo. La pista para el diagnóstico ecográfico de subclavia anómala izquierda o derecha es la falta de bifurcación del primer tronco supraórtico, pero esta no es una imagen fácil de obtener en todos los estudios, incluso en casos seleccionados con diagnóstico prenatal de AV11,12. La angiografía se realizaba habitualmente para confirmar el diagnóstico, pero el desarrollo de la resonancia magnética (RM) y la tomografía computarizada ha permitido el diagnóstico no invasivo y ha relegado la angiografía al pasado13–15. La fibrobroncoscopia permite comprobar de manera dinámica la compresión de la vía aérea, así como descartar enfermedad intrínseca de la vía aérea. Actualmente la tomografía computarizada con multidetectores (TCMD) ofrece no solo el diagnóstico de las anomalías vasculares, sino imágenes claras de la vía aérea, que incluyen la reconstrucción virtual del árbol traqueobronquial, lo que permite seleccionar a los pacientes para broncoscopia preoperatoria13–15.
La última técnica en sumarse al diagnóstico de los AV es la ecocardiografía fetal. La incorporación del plano de tres vasos y tráquea16 y su gran difusión en la rutina del estudio del corazón fetal han facilitado el diagnóstico de anomalías de arco aórtico en la etapa fetal3–6,9–12. La presencia de AAD debe alertar sobre la posibilidad de un AV, especialmente si se asocia a ALSA. Los grupos de diagnóstico prenatal han llegado a un alto grado de precisión diagnóstica3–6,9–12,17–19.
TOMOGRAFÍA COMPUTARIZADA CON MULTIDETECTORESEl proceso de adquisición de las imágenes consiste en un movimiento constante de la mesa, mientras el gantry rota continuamente y emite rayos X. Hay una atenuación de los rayos X por los diferentes tejidos según su densidad, y esto es lo que reciben los detectores. La imagen final consiste en un mapa de atenuación en el que cada píxel tiene un valor que depende del componente de cada tejido20. El daño causado por los rayos X está directamente relacionado con la edad, la radiosensibilidad de los órganos en crecimiento y el efecto de la radiación acumulada hasta la vida adulta, por lo que se hace mucho más estrecha la relación causa-efecto en niños20–22. Se debe buscar siempre el máximo beneficio diagnóstico con la menor dosis de radiación posible15,20–22. En los estudios de cardiopatías congénitas en edad pediátrica, se usa contraste monomérico no iónico de baja osmolaridad, de 300 mg/ml, a una dosis de 1,5–2 ml/kg de peso15,23. La inyección debe hacerse con inyector automático de doble cabezal, con velocidad de inyección según la vía canalizada.
Habitualmente se obtiene una única hélice desde el opérculo torácico hasta la cúpula diafragmática, y la adquisición se inicia con rastreo automático del bolo en la aorta. El volumen reconstruido se envía a la consola auxiliar, en la que se emplean diferentes algoritmos y técnicas de reconstrucción preestablecidos: aórtica o cardiaca, multiplanar, de máxima intensidad de proyección y volumétrica tridimensional (3D) para las estructuras vasculares y multiplanar, de superficie o navegación virtual para la valoración de la vía aérea15.
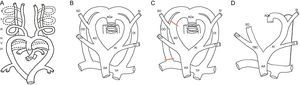
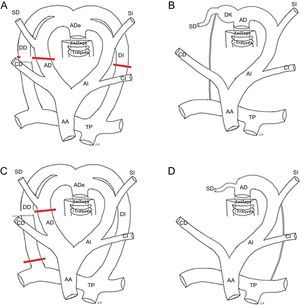
DESARROLLO DE LAS ANOMALÍAS DEL ARCO AÓRTICO. EMBRIOLOGÍALos AV son secundarios a alteraciones del desarrollo embriológico que ocurren entre la tercera y la octava semana de gestación, momento en el que se produce el desarrollo de la aorta torácica y los principales troncos arteriales. Inicialmente, forman el árbol embrionario dos vasos centrales, que corresponden a la aorta dorsal y ventral primitiva, conectados entre sí mediante seis pares de arcos y arterias intersegmentarias. La mayor parte del primero, el segundo y el quinto arco involuciona. Los terceros arcos originan las arterias carótidas. La porción ventral de los sextos arcos da lugar a las arterias pulmonares proximales. En el lado izquierdo, la contribución dorsal del sexto arco dará lugar al ductus arterioso. Las arterias intersegmentarias surgen de la aorta dorsal y forman las arterias subclavias9,24 (figura 1A).
A: esquema embrionario con arcos branquiales. B: modelo hipotético de Edwards. C: regresión normal (arco aórtico izquierdo). D: esquema de arco aórtico izquierdo. AA: aorta ascendente; AD: arco derecho; ADe: aorta descendente; CD: carótida derecha; CI: carótida izquierda; DD: ductus derecho; DI: ductus izquierdo; SD: subclavia derecha; SI: subclavia izquierda; TBC: tronco braquiocefálico; TP: tronco pulmonar.
Edwards propuso en 1948 el modelo hipotético del DAA25 (figura 1B). En él se muestra un arco aórtico y un conducto arterioso a cada lado con la aorta dorsal en una posición media. Los troncos supraaórticos izquierdos se originan desde el arco izquierdo y los derechos, desde el derecho. Las carótidas están en situación anterior y las subclavias, en situación posterior. Este modelo ayuda a entender el desarrollo normal y las anomalías que pueden producirse, dependiendo de la zona de interrupción del sistema. No se conoce en realidad por qué durante la embriogénesis se desarrolla un arco izquierdo y no un arco derecho26, pero lo normal es que el arco de los humanos sea izquierdo y se produce por la regresión del segmento dorsal del arco derecho, entre la arteria subclavia derecha y la aorta descendente y la del ductus arterioso derecho (figura 1C). La tráquea queda detrás y a la derecha del arco y el ligamento ductal izquierdo queda delante y a la izquierda del arco (figura 1D). Cuando la interrupción se produce en otro nivel, da lugar a otra conformación vascular diferente que puede producir un AV o un sling vascular.
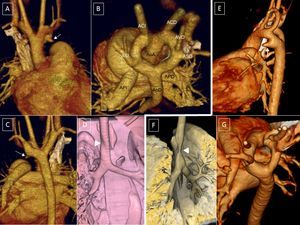
TIPOS DE ANILLOS VASCULARESDoble arco aórticoEl DAA es el anillo más sencillo de entender. Se explica simplemente por la persistencia del sistema embrionario de Edwards (figura 1B). La aorta ascendente se divide en dos arcos, derecho e izquierdo, que rodean la tráquea y el esófago y se unen entre sí por detrás del esófago para formar la aorta descendente. De cada uno de ellos, nacen de forma independiente las arterias carótidas por delante y las arterias subclavias por detrás. Habitualmente persiste el ductus izquierdo, que al cerrarse se convierte en un ligamento. Raramente pueden persistir el ductus derecho o ambos ductus9 (figura 2).
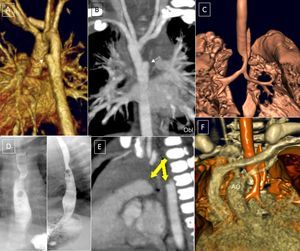
A–D (caso 1): angiografía por tomografía computarizada con reconstrucción volumétrica tridimensional; paciente de 4 años con síndrome de Rubinstein-Taybi, con sospecha de doble arco aórtico, comunicación interventricular y ductus arterioso. A: visión anterior, aorta ascendente derecha, doble arco; pequeña ampolla ductal del arco aórtico izquierdo (flecha). B: visión postero-superior, arco aórtico doble amplio. C: visión posterior, aorta descendente derecha, con ligera elevación del arco derecho respecto del izquierdo y calibre ligeramente menor. D: reconstrucción de vía aérea principal; escasa repercusión en la vía aérea (cabeza de flecha). E y F (caso 2): paciente de 9 días de vida. E: visión lateral izquierda; ampolla ductal izquierda (flecha). F: tráquea, visión lateral derecha; el doble arco aórtico produce una estenosis traqueal crítica (cabeza de flecha). G: visión postero-superior; el arco izquierdo es de calibre ligeramente mayor que el derecho. ACD: carótida derecha; ACI: carótida izquierda; APD: arteria pulmonar derecha; API: arteria pulmonar izquierda; AoA: aorta ascendente; AoD: aorta descendente; ASD: subclavia derecha; ASI: subclavia izquierda; AVD: vertebral derecha.
Los dos arcos pueden ser de calibre similar o que uno de ellos predomine, más frecuentemente el derecho. También puede haber regresión de algún segmento vascular que se convierte en una estructura ligamentosa, especialmente de los arcos posteriores, comprendidos entre la subclavia y la aorta descendente (figura 3). Cuando hay una regresión total del arco posterior izquierdo (figura 3A y B), es difícil de diferenciar de un AAD con vasos relacionados normalmente. En ese caso habría un origen común de las arterias carótida y subclavia izquierda en un tronco común (tronco braquiocefálico izquierdo) (figura 4B y figura 5).
Angiografía por tomografía computarizada, reconstrucción volumétrica tridimensional. A y C: visión postero-superior; deformidades por posible presencia de ligamento en arco izquierdo que cierra el anillo (flechas). B y D: visión posterior del arco aórtico con diferentes grados de regresión del componente del arco posterior izquierdo (*). E y F: esofagograma con compresión secundaria (flechas pequeñas).
Arco aórtico derecho con vasos en espejo. A y B: pequeña dilatación en margen izquierdo de aorta descendente (flecha). C y F: reconstrucción tridimensional de la vía aérea con compresión traqueobronquial distal producida por la impronta del arco aórtico derecho. D: compresión esofágica posterior y lateral. E: se intuyen pequeñas excrecencias en el margen superior de la arteria pulmonar y la aorta, que indican ligamento ductal (flechas amarillas). AO: aorta; T: tráquea.
La TCMD ofrece una visión diagnóstica muy precisa. La visión craneal brinda la visión más real de las estructuras vasculares del anillo y de la compresión que producen27. Cuanto menor sea el espacio interior del anillo, más precoces y más graves serán los síntomas (figura 2). Las imágenes de reconstrucción tridimensional son muy útiles para planear la cirugía, en la que lo ideal es seccionar el arco más pequeño entre la subclavia y la aorta descendente. Aunque la mayoría de los pacientes precisan cirugía, ocasionalmente el interior del anillo es amplio y puede retrasarse la aparición de síntomas, con lo que se podría retrasar o evitar el procedimiento quirúrgico. Es necesario un control clínico estrecho, ya que se han descrito casos de muerte súbita por enfermedad respiratoria grave28.
Arco aórtico derechoEl AAD es la anomalía más frecuente del arco aórtico. Se debe a la regresión de la zona de unión del arco embrionario izquierdo con la aorta descendente (figura 4). Su incidencia se estima entre el 0,086 y el 0,1% de las gestaciones en poblaciones de bajo riesgo de cardiopatía congénita3–6,12,17–19,29. Suele acompañarse de malformaciones intracardiacas, sobre todo tetralogía de Fallot o atresia pulmonar. Es relativamente frecuente que se asocie a anomalías cromosómicas o alteraciones extracardiacas, pero también puede presentarse de manera aislada o con anomalías leves17–19.
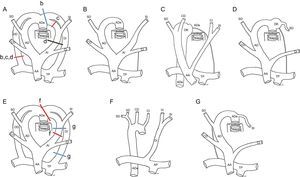
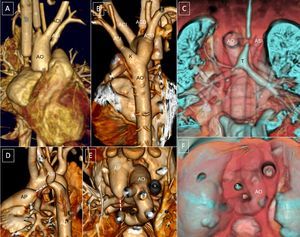
Desarrollo embrionario de los distintos tipos de arco aórtico derecho. A y E: modelo hipotético; la regresión de segmentos de los arcos aórticos y ductus izquierdos o derechos a partir de diversos puntos (líneas b–d, f y g en A y E) condicionan la formación de los distintos tipos de arco aórtico derecho (B–D, F y G); b: arco aórtico derecho con vasos en espejo y ligamento ductal (sin anillo vascular); c: arco aórtico derecho con divertículo de Kömmerell y anillo vascular; d: arco aórtico derecho con divertículo de Kömmerell y subclavia izquierda anómala; f: arco aórtico derecho con desconexión de subclavia izquierda y conexión de esta a la arteria pulmonar; g: arco aórtico derecho con subclavia izquierda anómala y ductus derecho. AA: aorta ascendente; AD: arco derecho; Ade: aorta descendente; CD: carótida derecha; CI: carótida izquierda; DD: ductus derecho; DI: ductus izquierdo; DK: divertículo de Kommerell; SD: subclavia derecha; SI: subclavia izquierda; TP: tronco pulmonar; VD: vertebral derecha; VI: vertebral izquierda.
Es el tipo más frecuente de AAD. El arco izquierdo anterior forma el tronco braquiocefálico derecho, que es anterior. El arco embrionario derecho persiste y forma el AAD, y el ductus izquierdo se transforma en un ligamento que queda anterior y no suele formar anillo (figura 4B).
Las series fetales han puesto de manifiesto su asociación casi constante con malformaciones intracardiacas complejas y anomalías cromosómicas, en particular deleción 22q113–6. Aunque el AAD con vasos en espejo no suele formar anillo (figura 4B), puede formarse excepcionalmente un AV en el caso de que persista un ductus que conecte la aorta descendente derecha con la arteria pulmonar9,26,29 (figura 4D y figura 5). El ductus cursaría por detrás del esófago y se dirigiría hacia delante para contactar con la arteria pulmonar, que es anterior. Después del nacimiento, al cerrarse el ductus, el ligamento ductal cerraría el anillo vascular y desviaría la tráquea hacia la izquierda comprimiéndola (figura 5).
En estos casos, la compresión posterior no se produce por una estructura vascular, sino únicamente el ligamento, por lo que no se ve ninguna estructura vascular mediante la TCMD (figura 5). La hipótesis embrionaria implicaría una regresión del arco posterior izquierdo proximal a la inserción del ductus (figura 4A y C).
Existiría así un divertículo de la aorta posterior que contribuiría a la formación del anillo (figura 5). Se lo conoce como divertículo de Kömmerell (DK), que realizó su descripción inicial fuera de casos necrópsicos en 193630. Se trataba de un paciente que presentaba un arco izquierdo con ARSA. Del DK parte el ligamento ductal, que no es visible por TCMC por no tener luz vascular, pero sí que puede producir una deformidad tanto en el DK como en la arteria pulmonar que indique los puntos de inserción del ligamento (figura 4C y figura 5B y E). Puede incluso persistir un ligamento que una la aorta descendente a la arteria pulmonar sin que sea evidente un DK en algunos casos de AAD con vasos en espejo26,29.
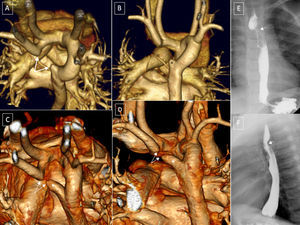
Arco aórtico derecho con arteria subclavia izquierda anómala, tipo II de EdwardsLa arteria subclavia izquierda nace como última rama del arco aórtico, es de localización posterior y se dirige por detrás del esófago al brazo izquierdo29. El anillo se completa por el ligamento ductal que une la zona de la aorta descendente, donde se origina la subclavia izquierda (posterior), con la arteria pulmonar (anterior) (figura 4D y figura 6). La zona de unión de la subclavia izquierda con la aorta queda habitualmente dilatada y forma un DK, cuya presencia indica la existencia de un ligamento ductal desde su ápex dirigido a la arteria pulmonar izquierda.
Arco aórtico derecho (AAD) con subclavia izquierda anómala (ALSA); paciente de 20 días con tetralogía de Fallot, con cánulas de oxigenación por membrana extracorpórea. *: cánulas arterial y venosa. A y B: AAD con ALSA. C: divertículo de Kömmerell e hipoplasia traqueal grave. D y E: visión lateral izquierda y postero-superior; excrecencia del margen superior del tronco pulmonar y anterior de la subclavia izquierda que indica la presencia de ligamento (línea punteada). C y F: reconstrucción coronal y postero-superior de la vía aérea y los vasos. ACD: carótida derecha; ACI: carótida izquierda; AP: arteria pulmonar; AO: aorta; ASD: subclavia derecha; ASI: subclavia izquierda; E: esófago; K: divertículo de Kömmerell; T: tráquea.
En algunos casos de AAD con ALSA asociados a tetralogía de Fallot, puede no haber DK y se postula que se debe a regresión del ductus izquierdo durante la gestación. De este modo no hay ligamento ductal ni divertículo, y no se produce AV9.
El anillo resultante de un AAD con ALSA no es tan apretado como el producido por un DAA y es mucho menos sintomático. La gravedad de la compresión de esófago y tráquea que se produce depende en gran parte de la dilatación del DK. No suele producir síntomas en el recién nacido y el lactante.
Recientemente se presentó una serie multicéntrica española31 que estudió 73 casos de AV detectados durante el embarazo y puso de manifiesto, al igual que otros estudios fetales, que la mayoría de los casos de AAD con ALSA no se acompañan de malformaciones intracardiacas, a diferencia del AAD con vasos en espejo6,12,17,18. Ocasionalmente se pueden asociar a anomalías cromosómicas. Los síntomas que producen en la infancia son predominantemente respiratorios9–11, mientras que en adultos se manifiesta sobre todo por disfagia32. También se han descrito casos de disección33 y rotura aórtica en adultos34.
La TCMD (figura 6) muestra la posición del arco aórtico a la derecha de la tráquea y la columna, define la presencia de una ALSA y puede definir los puntos de partida del ligamento ductal, en este caso del DK. También muestra la amplitud del anillo y el grado de compresión de la vía aérea y el esófago.
La cirugía se indica para casos sintomáticos y obliga, como mínimo, a resecar el ligamento ductal por toracotomía izquierda35,36. Algunos grupos han utilizado la toracoscopia37 para la sección de AV, aunque también se ha señalado un tiempo quirúrgico más largo con escasos beneficios38. Además de la sección del ligamento, se puede resecar el divertículo y hacer pexias de arco aórtico para evitar reintervenciones36–39. Algunos autores40,41 han comenzado a recomendar que sistemáticamente se reseque el divertículo, se seccione la subclavia izquierda y se reanastomose a la carótida izquierda porque han tenido que reintervenir a algunos pacientes de sus series por dilataciones del DK42. El estudio histológico de los divertículos resecados como procedimiento primario, incluso en niños muy pequeños, puede mostrar, hasta en la mitad de los casos, lesiones quísticas de la media41, hallazgo que podría relacionarse con la dilatación posterior del divertículo, como se ha descrito en adultos32–34.
El abordaje de los casos asintomáticos es controvertido, ya que se suelen diagnosticar durante la gestación y pueden permanecer asintomáticos a largo plazo. La mayoría de los centros hace algún tipo de prueba de confirmación posnatal del AV, especialmente ecocardiografía pero, dado que esta tiene limitaciones, se ha propuesto la realización de RM. No hay acuerdo sobre la indicación de RM a los recién nacidos diagnosticados de AAD con ALSA durante la etapa fetal. Se ha propuesto para los pacientes sintomáticos y aquellos a quienes no se pueda confirmar la presencia de un AV por ecocardiografía realizada por un experto6,43. También se puede indicar TCMD con técnicas de disminución de radiación15,21,22. La TCMD ofrece grandes ventajas por su mejor imagen y porque es una prueba más rápida, que puede evitar la anestesia del paciente y está disponible en la mayoría de nuestros centros. Muestra, además, el grado de afección de la vía aérea, lo que ofrece una información general sobre el grado de compresión y la posibilidad de complicaciones inesperadas en pacientes asintomáticos.
Arco aórtico derecho con desconexión de arteria subclavia izquierda, tipo III de EdwardsEs el más infrecuente de los AAD. La arteria subclavia izquierda se encuentra aislada del arco y conectada al conducto arterioso. Su origen embriológico se debe a interrupción del arco izquierdo del modelo de Edwards en dos niveles: entre la carótida y la subclavia izquierda y en la inserción del arco posterior izquierdo9,44 (figura 4E y F). De esa manera se interrumpe la conexión entre la aorta y la subclavia izquierda, que queda unida a la arteria pulmonar a través del ductus (figura 7).
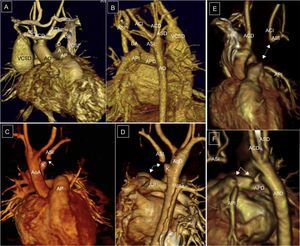
Arco aórtico derecho con desconexión de la arteria subclavia izquierda. A y B: continuidad de la arteria subclavia izquierda distal (ASI) con el ductus arterioso. C y D: visión anterior y posterior, pequeño divertículo de Kömmerell e interrupción del paso de contraste (flechas). E y F: desconexión de tronco braquiocefálico izquierdo. E: visión anterior, ductus arterioso hipotético (flecha, puntos). F: visión lateral izquierda, arco aórtico derecho, ampolla ductal y ligamento ductal; pequeños divertículos que indican la presencia de ligamentos (flechas). ACD: carótida derecha; ACI: carótida izquierda; AP: arteria pulmonar; AO: aorta; ASD: subclavia derecha; ASI: subclavia izquierda; DA: ductus arterioso; E: esófago; K: divertículo de Kömmerell; T: tráquea; VAz: vena ácigos; VCSD: vena cava superior derecha; VCSI: vena cava superior izquierda.
Suele asociarse a otras malformaciones cardiacas, más frecuentemente ductus persistente y coartación aórtica. También se asocia a anomalías cromosómicas, en especial deleción 22q11. En estas situaciones se puede establecer un fenómeno de robo de la circulación cerebral a través del polígono de Willis. Después del nacimiento, el ductus puede involucionar y la subclavia puede desconectarse de la arteria pulmonar (figura 7C y D), por lo que también se conoce como arteria subclavia izquierda aislada o suspendida. Si el ductus permanece abierto (figura 7A y B) y no está estenótico, se puede establecer un flujo descendente a través de este desde la arteria vertebral izquierda hacia la arteria pulmonar. En caso de que el ductus se cierre (figura 7C y D) tiene que establecerse flujo a la subclavia también a través del polígono de Willis y de la vertebral izquierda.
Es todavía más infrecuente que haya desconexión del tronco braquiocefálico, lo que correspondería a una involución del segmento anterior del arco aórtico izquierdo, proximal al origen de la carótida izquierda en el esquema de Edwards (figura 7E y F). La ecografía Doppler color de los vasos del cuello en este caso mostraría un flujo invertido en la carótida izquierda, ya que el flujo de todo el tronco braquiocefálico depende del cortocircuito desde el polígono de Willis45.
La TCMD muestra claramente la situación del arco aórtico, la presencia o ausencia del ductus y, por lo tanto, la conexión de la subclavia izquierda con la arteria pulmonar. También muestra la distancia del vaso aislado, ya sea la subclavia o el tronco braquiocefálico, al arco aórtico. La cirugía estará indicada en caso de robo de la subclavia y síntomas compresivos y deberá realizarse reconectando el vaso aislado a la carótida izquierda en caso de que sea la subclavia izquierda o al arco aórtico si fuera el tronco braquiocefálico46.
Arco aórtico derecho con descendente izquierda (arco aórtico cervical)Es una malformación excepcional en la que los arcos aórticos proximal y distal están en lados diferentes de la columna y la aorta cruza por detrás de la tráquea y el esófago9 (figura 8).
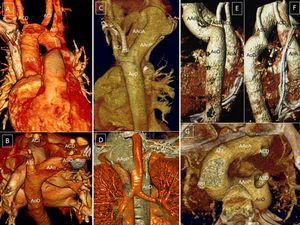
Caso 1: arco aórtico derecho con descendente izquierda. A: visión anterior, reconstrucción volumétrica tridimensional; arco derecho y acodadura de la subclavia izquierda (línea de puntos imaginaria de ligamento ductal). B: visón postero-superior; el arco aórtico cruza por detrás de la tráquea y el esófago. Caso 2: arco aórtico derecho cervical. C: visión posterior; ápex aórtico superior al opérculo torácico; deformidad del arco y situación del origen de troncos supraórticos a nivel torácico. D: compresión de vía aérea por el arco aórtico posterior. Caso 3: aorta ascendente izquierda con descendente derecha, arteria subclavia derecha anómala y ligamento ductal derecho; reconstrucción volumétrica tridimensional. E: visión posterior; arco aórtico izquierdo cruzando hacia la derecha por delante de la columna vertebral y por detrás del esófago; aorta descendente derecha. F: visión lateral derecha; deformidad del arco aórtico por el anclaje que produce el ligamento ductal derecho en la arteria pulmonar derecha. G: visión postero-superior; origen independiente de los cuatro troncos supraaórticos. ACD: carótida derecha; ACI: carótida izquierda; AAoA: arco aórtico anterior; AAoP: arco aórtico posterior; AoA: aorta ascendente; AoD: aorta descendente; ASD: subclavia derecha; ASI: subclavia izquierda.
Es más frecuente el AAD con descendente izquierda (figura 8A-D) que el arco izquierdo con descendente derecha (figura 8E-G). En caso de AAD, el primer vaso es la carótida izquierda, que nace en la porción basal de la aorta ascendente; la subclavia y la carótida derechas nacen de la porción apical del arco. Si el arco asciende por encima de las clavículas, se conoce como arco aórtico cervical9,47 (figura 8C-D). El cayado aórtico une la aorta ascendente derecha con la descendente izquierda haciendo una curva cerrada hacia abajo para dirigirse hacia la izquierda de la columna vertebral, pasando por detrás de la tráquea y el esófago. La subclavia izquierda nace de la aorta descendente a la izquierda de la columna9,47–49. Puede haber un DK situado a la izquierda, del que puede partir un ligamento ductal dirigido a la pulmonar izquierda que cierre el anillo.
Los pacientes con arco aórtico cervical presentan una masa pulsátil en el cuello y característicamente los pulsos femorales disminuyen al comprimirla50. No es frecuente que presenten síntomas compresivos y no suelen precisar cirugía. Se ha descrito su asociación a otras malformaciones cardiacas y a alteraciones cromosómicas, especialmente deleción 22q1147–49,51.
Arco aórtico izquierdo con arteria subclavia derecha anómala y ligamento ductal derechoEn estos casos la arteria subclavia derecha se origina como último tronco en la unión del arco aórtico con el inicio de la aorta descendente en un DK (figura 9A y B). El AV estaría formado por la aorta ascendente por delante, el arco aórtico a la izquierda, la arteria subclavia anómala por detrás y la persistencia del conducto arterioso derecho. Son casos muy poco frecuentes9.
Modelos hipotéticos y esquemas definitivos. A y B: arco aórtico izquierdo con divertículo de Kömmerell, subclavia anómala y ligamento ductal derecho. C y D: arco aórtico izquierdo con subclavia derecha anómala y ductus izquierdo (sin anillo vascular). AA: aorta ascendente; AD: arco derecho; ADe: aorta descendente; CD: carótida derecha; CI: carótida izquierda; DD: ductus derecho; DI: ductus izquierdo; DK: divertículo de Kömmerell; SD: subclavia derecha; SI: subclavia izquierda; TP: tronco pulmonar.
La ARSA nace de manera anómala como último vaso del arco y discurre por detrás del esófago hacia el brazo derecho. Forman el sling la aorta ascendente, el arco aórtico a la izquierda y la arteria subclavia anómala por detrás, pero sin producir un anillo completo. La anatomía es especular con respecto al AAD con ALSA, pero no se suele acompañar de divertículo ni de AV (figura 9D).
La prevalencia de ARSA en series necrópsicas52 es de un 1–2%. Sin embargo, en las series fetales actuales se describe una incidencia mucho más alta y además se considera marcador de síndrome de Down53. Tras diversos metanálisis, se ha estimado que la prevalencia real de ARSA en fetos con síndrome de Down es del 23,6%, que prácticamente se limita a los que tienen malformaciones intracardiacas asociadas a las alteraciones del arco, y del 1,02% en fetos euploides54,55.
La mayoría de los pacientes con ARSA están asintomáticos, salvo que presenten anomalías intracardiacas asociadas9–11,56. Los casos aislados se suelen detectar por casualidad y no tienen indicación quirúrgica. En ocasiones pueden ser sintomáticos, especialmente en la adolescencia o la edad adulta56–58. Pueden presentar disfagia por compresión esofágica y, en caso de que se acompañen de DK, puede haber dilatación aneurismática que produzca síntomas compresivos evidentes solo en adultos56–58. También se han descrito disección y rotura aórtica secundaria59.
La cirugía en los casos sintomáticos implica liberar el curso retroesofágico, resecar el aneurisma e, idealmente, restablecer el flujo a la subclavia derecha anastomosándola a la carótida derecha. La vía de abordaje, especialmente en la infancia, debe ser por toracotomía derecha60,61. También se están utilizando técnicas híbridas de reparación con implante percutáneo de stents en aorta y cierre percutáneo de divertículos y bypass de carótida a subclavia derechas59,62.
La TCMD10,11,14,15,63 permite el diagnóstico, identificar el origen y el curso de la arteria, el grado de compresión producida y la presencia de aneurisma aórtico, datos importantes para la cirugía que evitan la realización de angiografía.
Arco aórtico derecho con arteria subclavia izquierda anómalaEl AAD con ALSA naciendo de un DK produce un AV completo relativamente frecuente (figura 4D y figura 6). Menos frecuentemente puede dar lugar a sling vascular, en vez de un anillo completo, que quedaría formado por la aorta ascendente por delante, el arco aórtico a la derecha y la arteria subclavia anómala por detrás, de modo que el AV no se cierra. En estos casos no se acompaña de DK9.
Arteria pulmonar izquierda anómala o sling pulmonarEs una anomalía infrecuente, en la cual la arteria pulmonar izquierda se origina de la porción proximal y posterior de la rama pulmonar derecha, se dirige hacia la izquierda pasando entre la tráquea y el esófago, comprime ambas estructuras y forma un sling (figura 10). Para el diagnóstico correcto, es imprescindible demostrar no solo el origen anómalo de la arteria pulmonar izquierda en la derecha, sino también su curso anómalo que abraza la tráquea9,19,63. La compresión esofágica anterior es un hallazgo del esofagograma prácticamente patognomónico.
Sling de arteria pulmonar. Origen de arteria pulmonar izquierda en la derecha. A: reconstrucción volumétrica tridimensional de angiografía por tomografía computarizada, visión posterior. B: visión postero-superior. C: reconstrucción de la vía aérea en tres dimensiones; estenosis traqueobronquial difusa. D y E: visión posterior y lateral izquierda de reconstrucción tridimensional de los vasos y la vía aérea que muestra todas las relaciones anatómicas; obsérvese la arteria pulmonar izquierda que abraza la tráquea (D). AoA: aorta ascendente; AoD: aorta descendente; AP: arteria pulmonar; APD: arteria pulmonar derecha; API: arteria pulmonar izquierda; T: tráquea.
Moreno et al64 describieron por primera vez un origen anómalo de la arteria pulmonar izquierda en la derecha, pero con un curso anterior a la tráquea y el esófago sin producir compresión de la vía aérea ni sling. Posteriormente se ha denominado a esa entidad pseudosling65. El desarrollo de la TCMD ha permitido describir casos de sling parcial en los que hay una bifurcación normal de la arteria pulmonar que irriga uno de los lóbulos y un origen anómalo de la arteria del otro lóbulo en la arteria pulmonar derecha con un curso anómalo formando un sling66.
Es muy frecuente la asociación de sling pulmonar y anomalías de la vía aérea con patrones de bifurcación bronquial anormal, compresión traqueobronquial secundaria y anillos cartilaginosos completos ()9,67. El sling se ha asociado con otras alteraciones cardiacas (defectos septales, persistencia del conducto arterioso, tetralogía de Fallot, coartación aórtica y persistencia de vena cava superior izquierda) y malformaciones extracardiacas1,9,10.
Es imprescindible realizar un estudio endoscópico del árbol traqueobronquial antes de la cirugía en todos los casos63,68. Tanto la tomografía computarizada como la RM son diagnósticas, pero las imágenes aportadas por la TCMD y las reconstrucciones tridimensionales, tanto del sling como de la vía aérea, pueden ofrecer un diagnóstico de estas anomalías más preciso63,67. Además la TCMD permite visualizar la vía aérea y las estructuras vasculares. El tiempo de estudio es mucho más corto que el de la RM y permite evitar la anestesia general y la intubación en estos casos, que suelen ser lactantes y recién nacidos en situación crítica.
El abordaje quirúrgico en los casos de sling35 suele ser por toracotomía media con extracorpórea y es recomendable realizar endoscopia respiratoria preoperatoria63,67,68 e intraoperatoria para descartar zonas de malacia persistente tras la cirugía vascular y decidir si se debe acompañar de cirugía traqueal o de pexias de los vasos11,15,35,36,39,68.
CONSIDERACIONES FINALESEn nuestra experiencia15,27,31,36,39,64,69, la imagen obtenida por TCMD de baja dosis con reconstrucciones multiplanares y volumétricas tridimensionales es la técnica más completa de estudio de los AV. En los casos sintomáticos ayuda a planificar la cirugía e incluso prever la necesidad de cirugía traqueal acompañante, lo que exigiría un abordaje quirúrgico multidisciplinario. El esofagograma y la angiografía hoy raramente tienen indicación, aunque su realización por otros motivos puede poner de manifiesto estas anomalías no sospechadas de antemano.
La endoscopia traqueal se incluye con frecuencia en el curso del proceso diagnóstico de las anomalías del arco aórtico. La TCMD ofrece imágenes claras del arco aórtico, posibles AV y la compresión de la vía aérea que producen, y en muchas ocasiones pueden evitar fibrobroncoscopias. Se puede reservar para el estudio preoperatorio de sling de la pulmonar, los casos sintomáticos o más complejos y su utilización intraoperatoria. En las anomalías que incluyan un ARSA o un ALSA, se debe buscar dilataciones de las estructuras vasculares compatibles con DK porque indicarían un AV completo que podría requerir cirugía. Su ausencia, especialmente en casos asociados a otras malformaciones cardiacas congénitas, debe poner en duda la existencia de un AV.
Actualmente, el desarrollo de las técnicas de ecocardiografía fetal está poniendo de manifiesto una alta incidencia de malformaciones de arco aórtico que pueden originar AV. Aunque muchos de ellos sean asintomáticos, sería conveniente confirmar el diagnóstico en periodo posnatal. Dado que la ecocardiografía tiene poco valor diagnóstico en las anomalías del arco aórtico, la RM o la TCMD de baja dosis se convierten en las técnicas ideales para esta indicación. Muchos autores recomiendan únicamente seguimiento clínico y RM en casos sintomáticos6,17,19,43. En nuestro centro se realiza TCMD de baja dosis para confirmar o descartar la sospecha prenatal de AV15, ya que se entiende que la información obtenida es la más completa y la más accesible en nuestro sistema sanitario. Permite confirmar el diagnóstico y valorar correctamente el grado de afección de la vía aérea, así como programar cirugía preventiva para los casos asintomáticos pero con afección grave de la vía aérea.
CONFLICTO DE INTERESESNinguno.