Los pacientes con insuficiencia cardiaca avanzada tienen mal pronóstico y el trasplante cardiaco es actualmente la mejor opción de tratamiento disponible. Sin embargo, la escasez de donantes, los largos tiempos de espera y un número creciente de pacientes inestables han favorecido el desarrollo del soporte circulatorio mecánico. Esta revisión resume las indicaciones del trasplante cardiaco, cómo evaluar a los posibles candidatos, las estrategias actuales de inmunosupresión, cómo evaluar y tratar el rechazo, la profilaxis infecciosa y los resultados a corto y largo plazo. Respecto al soporte circulatorio mecánico, se diferencia entre las asistencias ventriculares de corto y largo plazo, así como las diferentes estrategias disponibles: puente hasta la decisión, recuperación, candidatura, trasplante y terapia de destino. Posteriormente se resumen las indicaciones, la valoración del riesgo previo al implante, el manejo de las complicaciones, especialmente de las asistencias de largo plazo y los resultados. Finalmente se plantean los retos futuros y cómo el uso generalizado de las asistencias ventriculares de largo plazo para pacientes con insuficiencia cardiaca avanzada solo será viable si se reducen sus complicaciones y costes.
Palabras clave
La insuficiencia cardiaca (IC) es un síndrome clínico causado por una reducción del gasto cardiaco o una elevación de las presiones intracardiacas1. Su prevalencia es del 1 al 2% de los adultos en los países desarrollados y constituye un importante problema de salud pública con una elevada carga económica2. A pesar de la disponibilidad de fármacos modificadores de la enfermedad y tratamientos mediante dispositivos implantables, el pronóstico continúa siendo malo.
Aproximadamente un 5% de los pacientes se encuentran en una IC avanzada, según lo definido en la tabla 13. En un porcentaje muy pequeño de estos pacientes, el trasplante cardiaco (TxC) es el único tratamiento aplicable. Lamentablemente, el número de donantes es escaso, lo que hace que anualmente se realicen de 250-300 TxC en España y 2.000 en Estados Unidos4,5. Los largos tiempos de espera1 y el número de pacientes inestables en aumento han favorecido el desarrollo de la asistencia circulatoria mecánica (ACM) como puente hasta la recuperación, puente al trasplante (PT) y puente hasta la candidatura o la decisión; inicialmente con dispositivos de asistencia ventricular de corta duración (DAVCD) y, en las últimas décadas, con dispositivos de asistencia ventricular de larga duración (DAVLD). El desarrollo de los DAVLD han creado la posibilidad de su uso como terapia de destino (TD) en pacientes que no son candidatos a TxC (tabla 2)1.
Definición de la insuficiencia cardiaca crónica avanzada
| 1. Síntomas graves de insuficiencia cardiaca con disnea o fatiga en reposo o con un esfuerzo mínimo (clase funcional de la NYHA III o IV) |
| 2. Episodios de retención de líquidos (congestión pulmonar o sistémica, edema periférico) o gasto cardiaco en reposo reducido (hipoperfusión periférica) |
| 3. Signos objetivos de disfunción cardiaca grave, evidenciados por al menos 1 de las siguientes manifestaciones: a) Fracción de eyección del ventrículo izquierdo baja (< 30%) b) Una anomalía grave de la función cardiaca en la ecocardiografía Doppler con un patrón de flujo de entrada mitral seudonormal o restrictivo c) Presiones de llenado del ventrículo izquierdo altas (media de PCPE > 16 mmHg o media de PAD > 12 mmHg en el cateterismo arterial pulmonar) d) Altas concentraciones de péptido natriurético en ausencia de causas no cardiacas |
| 4. Deterioro grave de la capacidad funcional evidenciado por 1 de las siguientes características: a) Incapacidad de realizar ejercicio b) Prueba de la marcha de 6 min ≤ 300 m o menos en las mujeres o los pacientes de edad ≥ 75 años c) Consumo pico de oxígeno < 12-14 ml/kg/min |
| 5. Antecedentes de al menos 1 hospitalización por insuficiencia cardiaca en los últimos 6 meses |
| 6. Presencia de todas las características previas a pesar de los «intentos de optimización», incluido el tratamiento con diuréticos, inhibidores del sistema renina-angiotensina-aldosterona y bloqueadores beta, salvo intolerancia o contraindicación, y terapia de resincronización cardiaca cuando esté indicada |
NYHA: New York Heart Association; PAD: presión auricular derecha; PCPE: presión capilar pulmonar enclavada.
Adaptada con permiso de Metra et al.3.
Indicaciones para la asistencia circulatoria mecánica
| Puente hasta la decisión/puente hasta el puente | Uso de ACM de corta duración en pacientes con shock cardiogénico hasta que los parámetros hemodinámicos y la perfusión orgánica se estabilicen, se haya descartado las contraindicaciones para una ACM de largo plazo (daño cerebral tras la reanimación) y se pueda evaluar opciones terapéuticas alternativas, como el tratamiento con un DAV de larga duración o el trasplante cardiaco |
| Puente hasta la candidatura | Uso de ACM (generalmente DAVI) para mejorar la función orgánica, revertir la hipertensión pulmonar o el sobrepeso o proporcionar el tiempo suficiente sin cáncer, para conseguir que el paciente sea considerado elegible para trasplante cardiaco |
| Puente hasta el trasplante | Uso de ACM (DAVI o DAVBi) para mantener al paciente con vida debido al alto riesgo de muerte antes del trasplante |
| Puente hasta la recuperación | Uso de ACM (DAVI o DAVBi) para mantener al paciente con vida hasta que la función cardiaca se recupere lo suficiente para retirar la ACM |
| Terapia de destino | Uso de ACM (DAVI) a largo plazo en pacientes con insuficiencia cardiaca terminal no elegibles para trasplante cardiaco |
ACM: asistencia circulatoria mecánica; DAV: dispositivo de asistencia ventricular; DAVBi: dispositivo de asistencia biventricular; DAVI: dispositivo de asistencia ventricular izquierda.
Adaptada con permiso de Ponikowski et al.1.
El TxC es el tratamiento de referencia para el tratamiento de la IC terminal, ya que mejora la supervivencia, el estado funcional y la calidad de vida6.
IndicacionesAunque el TxC es la mejor opción, tiene una mortalidad de aproximadamente un 15% en el primer año4,5. En consecuencia, es imprescindible evaluar el pronóstico de los pacientes con IC avanzada. Las escalas de riesgo más comúnmente utilizadas son la Heart Failure Survival Score7 y el Seattle Heart Failure Model8. Un nivel de riesgo medio o alto en la primera o una supervivencia estimada a 1 año < 80% en la segunda son los valores de corte utilizados para la inclusión en las listas de espera de TxC. La calculadora BCNbioHF aporta información pronóstica derivada de parámetros clínicos, pero incorpora también biomarcadores9.
Con frecuencia se utiliza el estado funcional evaluado con la prueba de esfuerzo con consumo de oxígeno para determinar la elegibilidad para el TxC. Un consumo pico de oxígeno en esfuerzo máximo < 14 ml/kg/min o < 12 ml/kg/min en pacientes tratados con bloqueadores beta se considera el valor de corte para el TxC10. Si el ejercicio es submáximo, una pendiente de la curva de ventilación respecto al dióxido de carbono > 35 tiene también valor pronóstico. Una distancia recorrida en la prueba de 6 min de marcha < 300 m indica también un riesgo elevado.
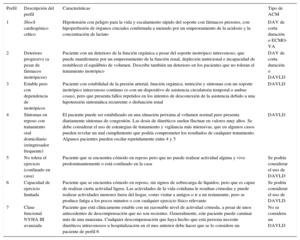
En los pacientes con inestabilidad hemodinámica, el TxC puede realizarse con carácter de emergencia médica, precedido o no de una ACM. Para estratificar a los pacientes que se encuentran en IC avanzada, el Interagency Registry for Mechanical Assisted Circulatory Support (INTERMACS) estableció una clasificación que tiene utilidad pronóstica y clínica respecto a la necesidad y el tipo de ACM11 (tabla 3). Esta clasificación se ha aplicado también a los pacientes trasplantados en situación de emergencia médica y ha demostrado un peor pronóstico para los pacientes trasplantados en INTERMACS 1-2 que para los trasplantados en INTERMACS 3-412. En consecuencia, se recomienda claramente la estabilización hemodinámica, con medicación o con ACM antes del TxC.
Perfiles del Interagency Registry for Mechanically Assisted Circulatory Support
| Perfil | Descripción del perfil | Características | Tipo de ACM |
|---|---|---|---|
| 1 | Shock cardiogénico crítico | Hipotensión con peligro para la vida y escalamiento rápido del soporte con fármacos presores, con hipoperfusión de órganos cruciales confirmada a menudo por un empeoramiento de la acidosis y la concentración de lactato | DAV de corta duración o ECMO-VA |
| 2 | Deterioro progresivo (a pesar de fármacos inotrópicos) | Paciente con un deterioro de la función orgánica a pesar del soporte inotrópico intravenoso, que puede manifestarse por un empeoramiento de la función renal, depleción nutricional e incapacidad de restablecer el equilibrio de volumen. Describe también un deterioro en los pacientes que no toleran el tratamiento inotrópico | DAV de corta duración o DAVLD |
| 3 | Estable pero con dependencia de inotrópicos | Paciente con estabilidad de la presión arterial, función orgánica, nutrición y síntomas con un soporte inotrópico intravenoso continuo (o con un dispositivo de asistencia circulatoria temporal o ambas cosas), pero que presenta fallos repetidos en los intentos de desconexión de la asistencia debido a una hipotensión sintomática recurrente o disfunción renal | DAVLD |
| 4 | Síntomas en reposo con tratamiento oral domiciliario (reingresador frequente) | El paciente puede ser estabilizado en una situación próxima al volumen normal pero presenta diariamente síntomas de congestión. Las dosis de diuréticos suelen fluctuar en valores muy altos. Se debe considerar el uso de estrategias de tratamiento y vigilancia más intensivas, que en algunos casos pueden revelar un mal cumplimiento que podría comprometer los resultados de cualquier tratamiento. Algunos pacientes pueden oscilar repetidamente entre 4 y 5 | DAVLD |
| 5 | No tolera el ejercicio (confinado en casa) | Paciente que se encuentra cómodo en reposo pero que no puede realizar actividad alguna y vive predominantemente o está confinado en la casa | Se podría considerar el uso de DAVLD |
| 6 | Capacidad de ejercicio limitada | Paciente que se encuentra cómodo en reposo, sin signos de sobrecarga de líquidos, pero que es capaz de realizar cierta actividad ligera. Las actividades de la vida cotidiana le resultan cómodas y puede realizar actividades menores fuera del hogar, como visitar a amigos o ir a un restaurante, pero se produce fatiga a los pocos minutos o con cualquier ejercicio físico relevante | Se podría considerar el uso de DAVLD |
| 7 | Clase funcional NYHA III avanzada | Paciente que está clínicamente estable con un razonable nivel de actividad cómoda, a pesar de unos antecedentes de descompensación que no son recientes. Generalmente, este paciente puede caminar más de una manzana. Cualquier descompensación que haya hecho que esta persona necesite diuréticos intravenosos u hospitalización en el mes anterior debe hacer que se lo considere un paciente de perfil 6 | No se considera un DAVLD |
ACM: asistencia circulatoria mecánica; DAV: dispositivo de asistencia ventricular; DAVLD: dispositivo de asistencia ventricular de larga duración; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; NYHA: New York Heart Association.
Adaptada con permiso de Ponikowski et al.1 y Stevenson et al.11.
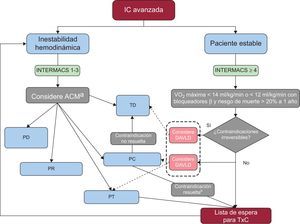
Se presenta un algoritmo para la toma de decisiones respecto al TxC en la figura 1.
Algoritmo de toma de decisión para los pacientes con IC avanzada según lo definido en la tabla 1 después de una adecuada optimización del tratamiento médico, quirúrgico y de dispositivos de asistencia. ACM: asistencia circulatoria mecánica; DAVLD: dispositivo de asistencia ventricular de larga duración; IC: insuficiencia cardiaca; INTERMACS: Interagency Registry for Mechanically Assisted Circulatory Support; PC: puente hasta la candidatura; PD: puente hasta la decisión; PR: puente hasta la recuperación; PT: puente hasta el trasplante; TD: terapia de destino; TxC: trasplante cardiaco; VO2: consumo de oxígeno. aEn los pacientes clasificados como INTERMACS 1, deberá implantarse un dispositivo de asistencia ventricular de corta duración, preferiblemente un oxigenador extracorpóreo de membrana venoarterial en situaciones como un estado neurológico no aclarado, inestabilidad hemodinámica grave o coagulopatía grave. En situaciones menos catastróficas y en un INTERMACS 2, puede implantarse un dispositivo de asistencia ventricular de corto plazo univentricular o biventricular, como el Centrimag, ya que puede dar asistencia hasta 1 mes. Tras la reanimación del paciente, debe intentarse el destete y, si no es posible, es esencial evaluar la posibilidad de un TxC. El paso siguiente debe ser el cambio a un DAVLD como PT o en algunos casos como TD. Para los pacientes clasificados como INTERMACS 3, se recomienda un DAVLD, preferiblemente como soporte solo del ventrículo izquierdo. bDespués de un puente hasta la candidatura, si se resuelve la contraindicación (hipertensión arterial pulmonar, tiempo sin cáncer o exceso de peso), se deberá incluir al paciente en la lista de espera.
Es imprescindible utilizar un abordaje holístico para elegir los mejores receptores de un recurso escaso. La mortalidad esperada después de un TxC puede calcularse con el modelo IMPACT13. Las comorbilidades que aumentan la morbilidad y la mortalidad del TxC pueden llegar a ser contraindicaciones absolutas o relativas y se describen en la tabla 4.
Contraindicaciones para el trasplante cardiaco
| Absolutas |
| Enfermedad sistémica con esperanza de vida < 2 años: Neoplasia activa (si es preexistente, es necesaria una evaluación por un especialista en oncología para estratificar el riesgo de recurrencia y establecer un tiempo de espera tras la remisión) Enfermedad sistémica con afección multiorgánica (lupus eritematoso sistémico, amiloidosis, sarcoidosis) Enfermedad pulmonar obstructiva crónica grave (VEMS < 1 l) Disfunción renal o hepática grave, si no se practica un trasplante combinado renal o hepático Hipertensión arterial pulmonar irreversible Presión arterial pulmonar sistólica > 50 mmHg Gradiente transpulmonar > 12 mmHg Resistencia vascular pulmonar > 3 unidades Wood a pesar del tratamiento |
| Relativas |
| Edad > 70 años (se puede considerar para pacientes cuidadosamente seleccionados) Diabetes con daño de órganos diana (excepto la retinopatía no proliferativa) o persistente mal control de la glucemia (HbA1c > 7,5%) a pesar del tratamiento Infección activa, excepto la infección del DAV. Se puede considerar para pacientes con VIH, hepatitis, enfermedad de Chagas y tuberculosis, con un manejo estricto Enfermedad arterial periférica o vascular cerebral grave no susceptibles de tratamiento Otra comorbilidad grave de mal pronóstico, como las enfermedades neuromusculares Obesidad: IMC > 35 Caquexia: IMC < 18 Fragilidad: cuando se dan 3 de los 5 síntomas posibles (pérdida no intencionada > 5 kg de peso en el último año, pérdida muscular, fatiga, lentitud de la marcha y bajo nivel de actividad física) Abuso actual de alcohol o drogas Apoyo social insuficiente Elevación de la reactividad del panel de anticuerpos, definida como > 10% |
IMC: índice de masa corporal; VEMS: volumen espiratorio máximo en 1 segundo; HbA1c: glucohemoglobina; VIH: virus de la inmunodeficiencia humana; DAV: dispositivo de asistencia ventricular.
La hipertensión pulmonar se produce en respuesta a una transmisión retrógrada pasiva de las presiones de llenado del ventrículo izquierdo elevadas, que con el tiempo causan un remodelado vascular. Se recomienda un cateterismo cardiaco derecho antes del TxC, puesto que la hipertensión pulmonar irreversible se asocia a IC derecha y mayor mortalidad14.
La hipertensión pulmonar reactiva se define como la presencia de un gradiente transpulmonar > 12 mmHg y una resistencia vascular pulmonar > 3 UW. Las pruebas de vasorreactividad pulmonar con el empleo de inotropos, vasodilatadores y diuréticos son necesarias para demostrar la reversibilidad, que se define como una reducción del gradiente transpulmonar hasta < 12 mmHg y de la resistencia vascular pulmonar a < 3 UW. Si no se alcanzan estos valores, el TxC está contraindicado10. En los pacientes en lista de espera de TxC, se debe revaluar la reversibilidad de la hipertensión pulmonar a intervalos de 3-6 meses.
A veces, el empleo de bosentán y sildenafilo puede revertir la hipertensión pulmonar en 3-4 meses y lograr que el paciente sea apto para el TxC15. Sin embargo, las guías de práctica clínica no respaldan su empleo en pacientes con IC izquierda14. Los dispositivos de asistencia ventricular izquierda (DAVI) pueden reducir la hipertensión pulmonar y se emplean como puente hasta la candidatura para los pacientes con hipertensión pulmonar irreversible refractaria al tratamiento médico16.
Situación actualEn los últimos años, se ha observado una tendencia al uso del trasplante en receptores de más edad y con perfiles clínicos complejos, el empleo de donantes subóptimos (54%) y tiempos de isquemia relativamente largos4,5. Hay una tendencia preocupante al aumento de los trasplantes en situaciones de emergencia médica (los criterios aplicados en España se presentan en la tabla 5), que suponen hasta un 40% (el 20% con ACM) de los trasplantes en España4; en 2013, el 50% de los candidatos pasaron por un tratamiento puente con ACM, según lo indicado por el registro internacional5. Estas cifras son el reflejo de una época de escasez de donantes y un aumento de la aceptación de candidatos más complejos para el TxC. A pesar de esta situación, la mortalidad temprana tras el TxC continúa siendo similar a la de periodos anteriores4,5.
Criterios para el trasplante de emergencia en España
| Emergencia de grado 0 (prioridad nacional) | IC avanzada con ACM de corta duración (incluido el ECMO) Disfunción de DAV de larga duración – Disfunción mecánica – Infección – Tromboembolia |
| Emergencia de grado 1 (prioridad regional) | IC avanzada con 1 de las siguientes características: – Fármacos vasoactivos y ventilación mecánica invasiva – Balón de contrapulsación intraórtico – DAV externa de larga duración La tormenta arritmogénica, definida como 3 o más episodios en 24 h de taquicardia ventricular sostenida, taquicardia ventricular polimórfica o fibrilación ventricular cuya finalización requiera intervención a pesar de un tratamiento antiarrítmico máximo |
ACM: asistencia circulatoria mecánica; DAV: dispositivo de asistencia ventricular; ECMO: oxigenador extracorpóreo de membrana; IC: insuficiencia cardiaca.
La información relativa a la cirugía, la preservación del órgano y la selección de los donantes puede consultarse en otra publicación17.
InmunosupresiónLos resultados a largo plazo dependen del mantenimiento de los niveles mínimos de inmunosupresión necesarios para evitar el rechazo y minimizar los efectos adversos.
Tratamiento de inducciónEl tratamiento de inducción asegura una inmunosupresión rápida y profunda inmediatamente después del TC. Tradicionalmente se ha usado la timoglobulina, que es muy eficaz para producir una depleción de linfocitos. La falta de ensayos aleatorizados y el aumento de la tasa de infecciones actualmente limitan su uso a los pacientes sensibilizados y a los que tienen un riesgo elevado de rechazo agudo. La dosificación de la timoglobulina en función del recuento de linfocitos reduce la dosis acumulada sin comprometer la eficacia18.
Actualmente, para pacientes con menos riesgo de rechazo, el tratamiento de inducción se realiza con antagonistas de los receptores de la interleucina 2, como basiliximab, que tiene un mejor perfil de seguridad19. Existen diferencias entre distintos centros en cuanto al uso del tratamiento de inducción por protocolo y, mientras que en España la inducción consiste en el empleo de basiliximab en el 85% de los pacientes, en la cohorte internacional solo se utiliza en un 30% de los casos4,5.
Las guías recomiendan el tratamiento de inducción para los pacientes con alto riesgo de rechazo agudo o de disfunción renal, con objeto de retrasar el empleo de los inhibidores de calcineurina17–19. Aunque se utiliza ampliamente, no se conoce su repercusión en la supervivencia y los efectos adversos a largo plazo.
Estrategias de mantenimiento de la inmunosupresiónLa inmunosupresión debe ser mayor en los primeros 3-6 meses. Con el paso de los años, puede reducirse en función del riesgo individual y de los resultados de la biopsia endomiocárdica. Inicialmente el tratamiento estándar incluye la combinación sinérgica de 3 grupos de fármacos17.
- •
Inhibidores de calcineurina: ciclosporina o tacrolimus. Ambos son metabolizados por el CYP-450 y, por consiguiente, tienen múltiples interacciones farmacológicas. Los efectos adversos (hipertensión arterial, diabetes melitus, dislipemia, neurotoxicidad) dependen de las concentraciones hemáticas, por lo que es imprescindible monitorizarlas estrechamente. Por lo que respecta a la eficacia, tacrolimus puede asociarse a unas tasas de rechazo inferiores sin diferencias en cuanto a infección o supervivencia20. La hipertensión arterial y la dislipemia son menos frecuentes con tacrolimus, mientras que el riesgo de diabetes aumenta. Actualmente, el 85% de los pacientes reciben tacrolimus durante el primer año4,5.
- •
Los fármacos antiproliferativos inhiben la síntesis de novo de las purinas y bloquean la proliferación de linfocitos citotóxicos y linfocitos B. Al añadirlos a los inhibidores de calcineurina, permiten una reducción de sus concentraciones. El micofenolato mofetilo es el fármaco elegido para el 96% de los pacientes3, ya que se ha observado mejor supervivencia, menos rechazo y menos vasculopatía del aloinjerto cardiaco que con azatioprina21. Los efectos adversos más frecuentes son la leucocitopenia y la intolerancia gastrointestinal (la formulación de liberación retardada se tolera mejor a este respecto).
- •
Corticoides. La amplia variedad de efectos adversos (hipertensión arterial, diabetes, hiperlipemia, osteopenia, miopatía, inestabilidad emocional, infección) requiere reducirlos y, de ser posible, interrumpirlos al cabo de 6 meses. La retirada de los corticoides debe ser objeto de estrecha vigilancia mediante biopsia, ya que se ha observado una alta tasa de rechazos agudos. Actualmente, el 80% de los pacientes continúan en tratamiento con corticoides después de 1 año4 y el 62%, a los 7 años5.
Las alternativas a los primeros 2 fármacos son los inhibidores de la diana de rapamicina en mamíferos (m-TOR) (everolimus, sirolimus), que inhiben la proliferación de los linfocitos y las células de músculo liso. Se ha observado que everolimus combinado con inhibidores de calcineurina reduce el rechazo y la vasculopatía cardiaca en comparación con micofenolato mofetilo, sin que haya diferencias en la supervivencia22. El ensayo SCHEDULE demostró una reducción de la progresión de la vasculopatía cardiaca en el grupo de pacientes con introducción temprana de everolimus y retirada del inhibidor de calcineurina, en comparación con el tratamiento estándar de inhibidor de calcineurina, pero se observó también una tasa de rechazo superior23. Aunque se recomienda combinar un inhibidor de m-TOR y un inhibidor de calcineurina para la vasculopatía cardiaca, se prefiere una estrategia de retirada o reducción al mínimo del inhibidor de calcineurina en los casos de disfunción renal y cáncer24,25. A pesar de que se ha demostrado que los inhibidores de la m-TOR son útiles, se ha observado una disminución significativa de su empleo en los últimos años4,5, principalmente por sus numerosos efectos adversos: infecciones, neumonitis, proteinuria, derrames, hiperlipemia, diarrea y mielotoxicidad26.
Se ha propuesto también el uso de tacrolimus en monoterapia a largo plazo, sin que haya diferencias en el rechazo en el primer año27. Sin embargo, este no es un enfoque frecuente (10%)5 y serán necesarios más estudios al respecto.
RechazoEl rechazo es una de las principales causas de muerte en los primeros años siguientes al TxC. El rechazo hiperagudo debido a anticuerpos preformados contra antígenos AB0 o los antígenos leucocitarios humanos hoy es excepcional.
Rechazo agudo celularEl rechazo agudo celular se produce mediado por los linfocitos T y se caracteriza por una infiltración inflamatoria con daño miocítico17. Su gravedad se clasifica según los hallazgos anatomopatológicos10. Solo a los pacientes sintomáticos o los asintomáticos con gravedad ≥ 2R (daño miocítico multifocal) se los trata con corticoides ± timoglobulina si hay inestabilidad hemodinámica. La incidencia del rechazo tratado en el primer año es de alrededor de un 15%5.
Se realizan sistemáticamente biopsias de vigilancia para detectar el rechazo en la mayoría de los centros, con mayor frecuencia en los primeros 3 meses; luego se reducen progresivamente hasta transcurrido 1 año desde el trasplante, y después solo se realizan si hay una sospecha clínica de rechazo17,19.
El Allomap es una prueba de determinación del perfil de expresión génica no invasiva que se emplea para la vigilancia del rechazo en los pacientes con TxC. Esta prueba tiene gran valor predictivo negativo, identifica a los pacientes con bajo riesgo de rechazo celular y puede evitar el empleo de biopsias sistemáticas unos pocos meses después del TxC28.
Rechazo a través de anticuerposEsta entidad se ha descrito recientemente y se da en un 10-20% de los pacientes con TxC. Los linfocitos B producen anticuerpos contra los antígenos leucocitarios humanos que activan una respuesta inflamatoria, la cual causa una disfunción endotelial. Es de capital importancia la prevención minimizando la exposición a aloantígenos (evitando transfusiones de sangre no esenciales) y manteniendo una inmunosupresión apropiada. El diagnóstico resulta difícil y la clave está en sospecharlo. El cuadro clínico habitual es el de un paciente con IC, disfunción ventricular izquierda sin infiltración celular en la biopsia, de sexo femenino, con alosensibilización, transfusiones previas, retrasplantado y con antecedentes de uso de DAVI o de infección por citomegalovirus. La confirmación se establece mediante las observaciones anatomopatológicas (vasculitis, edema), el depósito de C4d o C3d y la determinación de anticuerpos antiantígeno leucocitario humano en el suero. El tratamiento y su duración no están bien establecidos, pero hay consenso en tratar a los pacientes con hallazgos en la biopsia y disfunción o anticuerpos. Puede consultarse una revisión más detallada del diagnóstico y el tratamiento en otra publicación29.
Vasculopatía de aloinjerto cardiacoEsta entidad se caracteriza por un engrosamiento difuso y concéntrico de la íntima de las arterias coronarias epicárdicas e intramurales. Su etiología no está clara, pero se considera que es la manifestación de un rechazo crónico influido por factores no inmunológicos, como la diabetes mellitus, la hipertensión, el tabaquismo y la infección por citomegalovirus. Su expresión clínica consiste en angina, infarto de miocardio o muerte súbita, pero generalmente se manifiesta en forma de IC con o sin disfunción ventricular. Se ha demostrado que el tratamiento con estatinas reduce la vasculopatía del órgano trasplantado y la mortalidad, y por consiguiente su empleo está indicado para todo paciente con TxC, cualesquiera sean las concentraciones de lípidos17. Se recomienda una coronariografía basal 1 mes después del TxC y otra al cabo de 1 año. Después, la necesidad de repetir las coronariografías o el empleo de pruebas no invasivas es variable17,19.
Complicaciones infecciosas: profilaxisEl diagnóstico de la infección puede resultar difícil en los pacientes que reciben un TxC, y el tratamiento debe ser agresivo. La prevalencia es mayor en los primeros 6 meses. En la fase más temprana, infecciones previas del receptor pueden sufrir una exacerbación y pueden aparecer infecciones transmitidas por el donante o relacionadas con la cirugía. Entre los 0,5 y los 6 meses, aparecen infecciones oportunistas: virales (citomegalovirus), fúngicas (Aspergillus y Pneumocystis jirovecii) y bacterianas (Nocardia y Lysteria). Después de los 6 meses el riesgo disminuye, y lo más frecuente es las infecciones adquiridas fuera del hospital.
La profilaxis debe iniciarse de 10 a 15 días después del TxC: ganciclovir o valganciclovir para citomegalovirus durante 3 meses o tratamiento de anticipación guiado por determinaciones de reacción en cadena de polimerasa. En el caso de donante positivo y receptor negativo para citomegalovirus, se recomienda profilaxis durante 6-12 meses. Se recomienda para todos los pacientes el empleo de trimetoprim/sulfametoxazol para P. jirovecii y Toxoplasma gondii durante 6 meses o hasta 1 año si se usa everolimus, profilaxis antifúngica con nistatina para la prevención de la candidiasis mientras el paciente esté con dosis altas de corticoides y anfotericina B inhalada para Aspergillus durante la hospitalización inicial. Puede consultarse información adicional sobre la posología y las pautas de administración en diversas guías17–19.
Causas de muerte después del trasplante cardiacoLa supervivencia total a 1, 5 y 10 años es del 81, el 68 y el 51%4. En la cohorte española, la mediana de supervivencia es de 10,9 años. Es peor la supervivencia de los receptores más ancianos, con donantes mayores, trasplantes de urgencia y receptores con oxigenador extracorpóreo de membrana venoarterial (ECMO-VA)4,5.
El fallo primario del injerto es la principal causa de muerte en el primer mes, mientras que la infección lo es durante el primer año. El fallo primario del injerto se define como una disfunción ventricular sin etiología clara. La escala RADIAL es útil para la estratificación del riesgo30. Después del primer año, las principales causas de muerte son la vasculopatía cardiaca y el cáncer4. En general, la principal causa de muerte en España es la vasculopatía cardiaca (20%), seguida de la infección (16%), el fallo primario del injerto (14%) y los tumores (13%)4.
ASISTENCIA CIRCULATORIA MECÁNICAEl uso de la ACM ha crecido exponencialmente en los últimos 15 años, principalmente como PT. Sin embargo, tal como se ha señalado antes, hay otras estrategias tras la implantación de una ACM.
Tipo de asistencia circulatoria mecánicaEl tipo de ACM dependerá de la situación clínica, definida según la clasificación INTERMACS.
Se diferencian 2 grupos:
- •
Los DAVCD tienen como finalidad asistir a pacientes con IC hemodinámicamente inestables durante días o semanas. Inicialmente se utilizaron para el shock tras cardiotomía y su uso se amplió luego para estabilizar a un paciente en shock y ganar tiempo para llegar a la recuperación, a la decisión o como PT.
- •
Los DAVDL se han diseñado para la asistencia de pacientes con IC avanzada durante un periodo de meses o años, como puente a la candidatura, el trasplante y, en muy pocos casos, la recuperación. Sin embargo, con la aparición de los DAVLD de flujo continuo y su mayor durabilidad, la TD ha pasado a ser una opción. Para muchos pacientes que reciben tratamiento con un DAVLD, este equivale hoy a una TD, ya que solamente un 30% de los pacientes con ACM implantado como PT llegan a recibir un órgano durante el primer año de inclusión en la lista de espera31.
Además, el DAV puede clasificarse según diversos criterios: a) ventrículo al que se aplica la asistencia: izquierdo, derecho o ambos (DAV biventricular o corazón artificial total); b) localización: extracorpóreo o intracorpóreo; c) flujo proporcionado: flujo pulsátil o flujo continuo, y d) bomba: neumática, axial o centrífuga.
Dispositivos de asistencia ventricular de corta duraciónLos DAVCD percutáneos no se comentarán aquí puesto que han sido objeto de una revisión en otro artículo publicado en Revista Española de Cardiología.
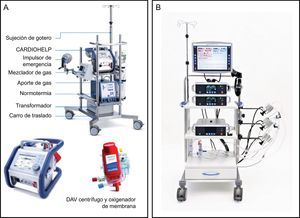
En nuestro medio, el ECMO-VA y el dispositivo Centrimag (St. Jude Medical; Pleasanton, California, Estados Unidos) son las opciones preferidas para los pacientes en INTERMACS 1-2. El ECMO-VA es un bypass cardiopulmonar modificado que proporciona asistencia a ambos ventrículos (3,5-4,5 l/min), con la posibilidad de canulación periférica, incluso fuera del quirófano. La Centrimag es una bomba central de flujo continuo (4-7 l/min) que puede utilizarse para asistencia ventricular izquierda, derecha o biventricular mediante esternotomía. El uso de uno u otro se comenta en la figura 1.
A pesar del uso de la ACM en el shock cardiogénico, la mortalidad continúa siendo de alrededor del 50%, principalmente debido a shock antes del implante y, con menor frecuencia, secundaria a las complicaciones del DAVCD32. Lo importante es diseñar una estrategia tras implantar un DAVCD, destinada a la recuperación cuando sea posible, pero también es importante tener la posibilidad de hacer un puente de ECMO-VA a Centrimag, de DAVCD a TxC si el tiempo de espera es aceptable, o de DAVCD a DAVLD. El implante de un DAVCD en un hospital de menor complejidad seguido de un puente a un DAVLD en un hospital terciario puede realizarse con unos resultados similares a los alcanzados cuando todo el proceso se lleva a cabo en el hospital terciario33, lo que enfatiza la importancia de la estabilización temprana con DAVCD en el shock cardiogénico.
En España, el 47% de los TxC se realizan en situaciones de emergencia: menos del 50% de ellos con balón de contrapulsación intraaórtico, un 23% con ECMO, un 16% con un DAV de flujo continuo y el 6,5% con un DAV de flujo pulsátil4. El ECMO-VA se asocia claramente a peor supervivencia tras el TxC4,5 que con las demás opciones. Sin embargo, el registro no diferencia entre DAVCD y DAVLD, de modo que no se conoce los resultados después del TxC de los pacientes con un DAVCD como el Centrimag34. Esta cuestión se esclarecerá mediante un análisis de los DAVCD como PT actualmente en curso (estudio ASIST-TC). Los DAVCD de uso más frecuente se indican en la figura 2.
Dispositivos de asistencia ventricular de corta duración. A: sistema de oxigenador extracorpóreo de membrana CARDIOHELP (Maquet; Bridgewater, New Jersey, Estados Unidos). B: Centrimag (St. Jude Medical; Pleasanton, California, Estados Unidos) es una bomba centrífuga de flujo continuo que sirve de apoyo a uno o ambos ventrículos. DAV: dispositivo de asistencia ventricular. Reproducida con permiso de Maquet y St. Jude Medical.
En el séptimo informe anual de la base de datos INTERMACS, se han descrito más de 15.000 DAVLD, con una tasa media de 2.500 pacientes por año en los últimos 2 años31. Aunque inicialmente se concibió como PT, su utilidad como TD se evaluó por primera vez en el ensayo REMATCH35. En ese ensayo se utilizaron DAVLD de flujo pulsátil y, aunque daban una asistencia adecuada, su empleo se vio limitado por la corta durabilidad, el coste y el gran tamaño. La introducción de los DAVLD de flujo continuo aportó una mejor supervivencia libre de ictus y fallos del dispositivo36. Hoy más del 90% de los DAVLD son de flujo continuo31. Esta mejora en la tecnología ha llevado también a un aumento del uso como TD en el 46% del total de implantes en Estados Unidos31.
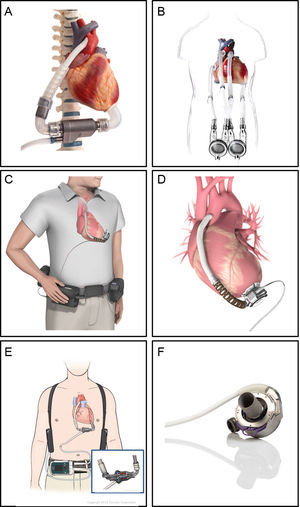
En España, el DAVLD utilizado con más frecuencia en los últimos años es el Excor (Berlin Heart; Berlín, Alemania). Sin embargo, dada la necesidad de altos niveles de anticoagulación y de tratamiento antiagregante plaquetario para evitar las complicaciones tromboembólicas37, la mayoría de los centros lo utilizan actualmente solo para asistencia a medio plazo o como asistencia biventricular. Actualmente los DAVLD de flujo continuo son la opción preferida para la asistencia a largo plazo.
Los DAV actualmente utilizados se indican en la figura 3. El INCOR fue el primer DAVLD utilizado en España. El HeartMate II es el DAVLD de flujo continuo empleado con más frecuencia, y el único aprobado para el uso como TD. Los demás son bombas centrífugas más pequeñas, que evitan la necesidad de un receptáculo abdominal. En los ensayos ADVANCE y ENDURANCE se ha demostrado que el HVAD no es inferior al HeartMate II. La experiencia inicial con el HeartMate III ha demostrado mejores resultados a los 6 meses en comparación con el HeartMate II, principalmente por la menor frecuencia de trombosis de la bomba38.
Dispositivos de asistencia ventricular de larga duración. A: el INCOR (Berlin Heart; Berlín, Alemania) es una bomba axial de flujo continuo intracorpórea que dispone de un propulsor levitado magnéticamente. B: el EXCOR (Berlin Heart, Berlín, Alemania) es una bomba de flujo pulsátil paracorpórea con 1 o 2 ventrículos. C y D: el HVAD (HeartWare; Framingham, Massachusetts, Estados Unidos) es una bomba centrífuga de flujo continuo intracorpórea. E: el HeartMate II (St. Jude Medical, Pleasanton, California, Estados Unidos) es una bomba de flujo continuo intracorpórea. F: el HeartMate 3 (St. Jude Medical; Pleasanton, California, Estados Unidos) es una bomba centrífuga de flujo continuo intracorpórea con levitación magnética. Reproducida con permiso de Berlin Heart, St. Jude Medical y HeartWare.
Los pacientes con IC aptos para implante de DAVI deben cumplir los criterios que se describen en la tabla 61.
Pacientes que podrían ser elegibles para implante de dispositivo de asistencia ventricular izquierda
| Pacientes con más de 2 meses de síntomas graves a pesar de tratamiento médico y con dispositivos óptimo, y más de 1 de las siguientes características: |
| Fracción de eyección del ventrículo izquierdo < 25% y, si se mide, VO2 máximo < 12 ml/kg/min Al menos 3 hospitalizaciones por IC en los 12 meses previos sin una causa desencadenante evidente Dependencia del tratamiento inotrópico por vía intravenosa Disfunción progresiva orgánica (empeoramiento de la función renal y/o hepática) a causa de una reducción de la perfusión y no de una presión de llenado ventricular insuficiente (PCPE ≥ 20 mmHg y PAS ≤ 80-90 mmHg o índice cardiaco ≤ 2 l/min/m) Ausencia de disfunción ventricular derecha grave junto con insuficiencia tricuspídea grave |
IC: insuficiencia cardiaca; PAS: presión arterial sistólica; PCPE: presión capilar pulmonar enclavada; VO2: consumo de oxígeno.
Adaptada con permiso de Ponikowski et al.1.
Es imprescindible una evaluación completa39 y, en general, los resultados obtenidos en los pacientes con DAVI de flujo continuo son satisfactorios. Las tasas de supervivencia actuales son de aproximadamente un 80 y un 70% a 1 y 2 años como PT y del 75 y el 65% como TD31, pero son peores con el apoyo biventricular (el 50% a 1 año). Los resultados del trasplante en los pacientes en los que se utiliza como puente un DAVLD de flujo continuo son similares a los de los pacientes sin tratamiento puente40.
En los pacientes clasificados como INTERMACS 131, debe evitarse implantar un DAVLD, puesto que su supervivencia es inferior. Para esos pacientes se debe considerar en su lugar el empleo de un DAVCD.
Por lo que respecta a la IC ambulatoria, el ensayo ROADMAP41 estudió a pacientes clasificados como INTERMACS ≥ 4. A 1 año, la ausencia de muerte, TxC urgente o implante de DAVLD tardío fue mejor en el grupo de DAVLD que en el grupo de tratamiento médico (el 80 frente al 63%; p = 0,024). Sin embargo, los eventos adversos fueron el doble de frecuentes con los DAVLD, lo cual pone de manifiesto la necesidad de tener precaución respecto a un implante demasiado precoz del DAVLD.
La escala de riesgo HeartMate II identificó la hipoalbuminemia, la disfunción renal, la coagulopatía, la experiencia del centro y la edad como factores de riesgo de mortalidad a 90 días42. Aunque los estudios realizados no han mostrado diferencias en la incidencia de complicaciones en los pacientes de edad > 70 años43, estos tienen peor supervivencia31. En la mayoría de los centros, los DAVLD se emplean en pacientes de hasta 75 años y tras este límite se realiza una evaluación «caso por caso». Además, la desnutrición, la fragilidad y la sarcopenia predicen también un peor resultado, y es esencial la optimización preoperatoria y una evaluación psicosocial.
En general, se ha demostrado que los DAVLD mejoran la calidad de vida y el estado funcional44.
Evaluación del ventrículo derecho y optimización previa al implanteEl fracaso del ventrículo derecho es una de las principales causas de morbilidad, mortalidad y prolongación de la hospitalización tras el implante de DAVI.
Los modelos predictivos pueden ser útiles para evaluar el riesgo. Los parámetros clínicos y analíticos que predicen un mal resultado son los siguientes: sexo femenino, intervención quirúrgica previa, miocardiopatía no isquémica, necesidad de vasopresores, bilirrubina ≥ 2,1 mg/dl, aspartato aminotransferasa ≥ 80 UI, albúmina < 3,4 mg/dl y creatinina ≥ 1,9 mg/dl. La presión venosa central elevada y un cociente de presión venosa central/presión enclavada de 0,63 son los mejores predictores hemodinámicos de insuficiencia del ventrículo derecho. El índice cardiaco < 2,2 l/min/m2, la presión arterial sistólica < 96 mmHg y el índice de trabajo de eyección del ventrículo derecho < 330 g/m2/latido predicen también insuficiencia del ventrículo derecho. Los mejores predictores ecocardiográficos de insuficiencia del ventrículo derecho son los siguientes: cociente ventrículo derecho/ventrículo izquierdo > 0,72, cociente de los diámetros del ventrículo derecho de eje corto/largo > 0,6, velocidad sistólica pico del anillo tricuspídeo lateral < 8 cm/s, strain rate (tasa de deformación) longitudinal máxima sistólica del ventrículo derecho < 0,6 cm/s, e insuficiencia tricuspídea grave con presión pulmonar sistólica < 50 mmHg45.
La optimización preoperatoria hasta una presión venosa central < 15 mmHg permite prevenir la insuficiencia del ventrículo derecho. Puede usarse óxido nítrico inhalado o sildenafilo para reducir la presión pulmonar, pero no está claro si con este tratamiento se reduce la insuficiencia del ventrículo derecho46. El empleo de milrinona o levosimendán puede ser útil también y a veces puede ser necesario un balón de contrapulsación intraórtico antes de implantar el DAVLD.
La presencia de un anillo tricuspídeo > 40 mm e insuficiencia tricuspídea moderada-grave se ha propuesto como indicador de la necesidad de reparación de la válvula tricúspide. Sin embargo, con esta intervención no se ha logrado reducir la mortalidad temprana ni la necesidad de asistencia ventricular derecha en los pacientes portadores de un DAVI y su uso se asocia a una estancia en el hospital más larga47. Se recomienda inicialmente una velocidad de bombeo baja, y pueden ser necesarios ajustes posteriores en función de los parámetros ecocardiográficos y hemodinámicos.
Pese a aplicarse una estratificación y un tratamiento médico adecuados, puede producirse insuficiencia del ventrículo derecho (0,49 episodios/100 pacientes-meses)31. Los pacientes que necesitan un DAV derecho tienen peores resultados. Sin embargo, si el implanta durante la intervención quirúrgica del DAVI, la supervivencia es mejor48. Puede aparecer una insuficiencia ventricular derecha tardía en hasta un 11% de los pacientes, y ello se asocia a una peor supervivencia en el PT49.
Complicaciones y tratamiento de los pacientes portadores de un dispositivo de asistencia ventricular izquierdaInicialmente, el tratamiento estándar para la prevención de las complicaciones tromboembólicas es el empleo de ácido acetilsalicílico a dosis de 81-325 mg/día con objeto de alcanzar una inhibición del ácido araquidónico > 70%, así como el uso de antagonistas de la vitamina K para alcanzar una razón internacional normalizada de 2-3. La práctica clínica ha establecido un objetivo máximo de una razón internacional normalizada de 2,5 si no hay otros factores de riesgo tromboembólico, puesto que las hemorragias se dan con mayor frecuencia que la trombosis, aunque el tratamiento antitrombótico debe individualizarse según el dispositivo específico utilizado y según las características del paciente. Habitualmente se recomienda terapia puente con heparina en el posoperatorio inicial.
Una de las complicaciones más temidas es el ictus, que puede darse en un 7-15% de los pacientes con DAVI. Los factores que predicen el ictus isquémico con el HVAD son el empleo de ácido acetilsalicílico ≤ 81 mg y la fibrilación auricular, mientras que los factores que predicen un ictus hemorrágico son una presión arterial media > 90 mmHg, el ácido acetilsalicílico a dosis ≤ 81 mg y la razón internacional normalizada > 3. Para reducir la incidencia de ictus hemorrágico, es crucial controlar estrictamente la presión arterial, de manera que la presión arterial media sea < 90 mmHg50.
La aparición de episodios hemorrágicos se ve favorecida por la tensión de cizalladura sobre los componentes de la sangre y por la presión del pulso reducida en la tecnología de flujo continuo. La incidencia actual (7,79 episodios/100 meses-paciente) es inferior a la de periodos previos31. La más prevalente es la hemorragia digestiva, que es la principal causa de rehospitalización, pero no afecta a la supervivencia. Los factores predisponentes descritos son la edad, valores de albúmina bajos y un índice de masa corporal bajo51. La fisiopatología se explica por un déficit adquirido de factor de von Willebrand, una agregación plaquetaria alterada y la formación de angiodisplasias gastrointestinales a causa de la reducción de la presión de pulso, de manera similar a lo que ocurre en el síndrome de Heyde52,53.
En el estudio TRACE de Estados Unidos54 se analizó a 100 pacientes con una reducción del tratamiento antitrombótico después de un episodio de sangrado. A pesar de ello, se produjeron hemorragias posteriores en un 52% de los casos, aunque las tasas de ictus isquémico fueron similares.
La incidencia de trombosis de la bomba aumentó del 2,2% a los 3 meses del implante en 2011 al 8,4% en 201355, probablemente por cambios en el manejo clínico, con unos objetivos más bajos de anticoagulación y antiagregación y un flujo inferior del DAVI para alcanzar una apertura de la válvula aórtica. La trombosis de la bomba es una complicación temible que depende de las características del dispositivo, la técnica operatoria, el tratamiento antitrombótico y los factores propios del paciente. Debe sospecharse esta complicación en presencia de hemolisis (elevación de la lactato deshidrogenasa y/o la hemoglobina libre plasmática alta), un aumento transitorio del consumo de energía de la bomba o una IC izquierda. El mejor instrumento diagnóstico del que se dispone para el Heartmate II es el estudio de la pendiente de Columbia56, en el que la amortiguación de las reducciones del diámetro telediastólico ventricular izquierdo en respuesta a los aumentos de velocidad de la bomba indican una obstrucción del flujo a través del dispositivo. Estos parámetros de pendiente no pueden aplicarse directamente a los pacientes con un HVAD, ya que la pendiente del diámetro telediastólico del ventrículo izquierdo es drásticamente inferior57. El tratamiento se basa en un aumento de la medicación antitrombótica y, si hay inestabilidad hemodinámica, fibrinolisis o cambio de la bomba.
Otra complicación frecuente es la insuficiencia aórtica, que se observa en un 25-52% de los pacientes al cabo de 1 año con un DAVI de flujo continuo, y que tiene un carácter acumulativo con el paso del tiempo. Se cree que las razones de la aparición de insuficiencia aórtica son las siguientes: a) falta de apertura de la válvula aórtica que puede conducir a una fusión de las valvas, y b) alteración de la dinámica de flujo en la aorta ascendente, que puede contribuir a una dilatación del seno aórtico. En consecuencia, cuando se detecta insuficiencia aórtica mayor que leve antes del implante de DAVI, se recomienda la reparación o sustitución de la válvula aórtica. Para prevenir la insuficiencia aórtica después del implante de DAVI, se recomienda optimizar la velocidad con objeto de eliminar la insuficiencia mitral mayor que leve y posicionar el tabique en la línea media. Si se consiguen ambas cosas, la velocidad puede reducirse para permitir la apertura intermitente de la válvula aórtica. Si la insuficiencia aórtica secundaria a un DAVI es asintomática, se recomienda reducir la velocidad para maximizar la apertura de la válvula aórtica. Si el paciente tiene síntomas, se recomienda aumentar la velocidad. Si los síntomas persisten después de una evaluación hemodinámica, se puede considerar la reparación, sustitución o cierre de la válvula aórtica con un parche o mediante sutura de las valvas58.
La infección del cable de alimentación es una complicación temida que con el tiempo se da en hasta un 40% de los pacientes. Se puede reducir la incidencia de infecciones dando instrucción sanitaria al paciente y usando un kit estandarizado con un apósito de plata y un dispositivo de anclaje59.
Por último, se ha descrito la aparición de anticuerpos contra antígenos leucocitarios humanos durante la ACM. La menor edad, la reactividad del panel de anticuerpos previo al DAV y el sexo femenino predijeron de manera independiente la elevación de los anticuerpos tras el DAV. Aunque la aparición de estos anticuerpos se asocia a mayor tiempo de espera para el TxC debido a la necesidad de pruebas cruzadas virtuales, no hay asociación con un aumento del rechazo, el fallo del injerto o la muerte tras el TxC60.
PERSPECTIVAS FUTURASEs posible que el uso incipiente de corazones de donantes tras la muerte circulatoria pueda aumentar la disponibilidad de donantes61. Sin embargo, este aumento podría no ser suficiente para satisfacer las necesidades de todos los pacientes con IC avanzada. Para aumentar el uso de los DAVLD en el futuro, sería necesario reducir su coste, reducir las complicaciones trombóticas y hemorrágicas y evitar el cable de alimentación para reducir al mínimo las infecciones.
En España, el uso de los DAVLD como PT o como puente a la candidatura aumenta lentamente, pero su uso como TD es todavía testimonial y se limita a pacientes jóvenes con una contraindicación absoluta para el TxC y a los pacientes de 65 a 75 años con comorbilidades que pueden limitar la supervivencia del injerto. El principal motivo de las bajas tasas de uso de DAVI es el elevado coste del dispositivo, de alrededor de 94.600 €. Con el umbral actual de 30.000 €/año de vida ajustado por calidad62 para las intervenciones de cuidados al final de la vida, con una reducción del coste de un 15%, el cociente de coste-efectividad incremental puede ser aceptable.
CONCLUSIONESEl TxC continúa siendo el mejor tratamiento disponible para los pacientes con IC avanzada, pero, dada la escasez de donantes y las largas listas de espera, se están utilizando cada vez más los DAVI para salvar vidas y mejorar la calidad de vida. En España, se está produciendo un cambio de los DAVCD a los DAVLD como PT o como puente hasta la candidatura, aunque a un ritmo lento. El implante de DAVLD como TD puede ser una alternativa para pacientes muy seleccionados, pero el acceso a estos dispositivos se ve limitado por su coste. El uso generalizado de los DAVLD solo será viable si sus complicaciones se reducen y llegan a tener una buena relación coste-efectividad.
CONFLICTO DE INTERESESU.P. Jorde es consultor de St. Jude Medical (sin honorarios).