La fibrilación auricular es la arritmia cardiaca sostenida que se observa con mayor frecuencia en la práctica clínica, y puesto que su prevalencia depende en gran medida de la edad, las repercusiones de salud pública que puede tener en nuestras sociedades cada vez más envejecidas pueden ser enormes1,2. No es solo que nuestra población sea cada vez de mayor edad, sino que, además, la incidencia y la prevalencia de la fibrilación auricular ajustadas por la edad están aumentando, y no hay indicio alguno de que estas tendencias se estén atenuando3,4,5,6. La prevalencia de la fibrilación auricular en Estados Unidos es de aproximadamente 2,3 millones de personas, pero es probable que esta cifra sea una notable subestimación, ya que no se diagnostica a muchos pacientes a causa de que su enfermedad es paroxística o asintomática o porque los síntomas son atípicos. Los factores subyacentes que alimentan este fenómeno no están bien definidos, pero las tendencias que están surgiendo en cuanto a aumento de los factores de riesgo tradicionales y de los de identificación más reciente parecen desempeñar un papel prominente; esto se da en especial por lo que respecta a la obesidad y sus comorbilidades, como la diabetes mellitus tipo 2, la hipertensión y la apnea obstructiva del sueño.
Ictus y tromboembolia sistémica en pacientes con fibrilación auricularLa fibrilación auricular es un importante factor de riesgo de ictus, ya que aumenta el riesgo de ictus isquémico en aproximadamente 5 veces7,8,9,10 y explica alrededor del 45% del total de ictus embólicos que se producen en Estados Unidos (es decir, aproximadamente 100.000 ictus al año). No es sólo que la edad sea un factor predictivo independiente y potente del ictus, sino que además otros factores de riesgo de ictus en pacientes con fibrilación auricular aumentan también con la edad; entre estos factores se encuentran la diabetes mellitus, la insuficiencia cardiaca congestiva, la hipertensión, la disfunción ventricular izquierda y la enfermedad vascular6. Es de destacar que, en los pacientes de menos de 60 años de edad y sin factores de riesgo conocidos, el riesgo de ictus es extremadamente bajo, lo cual indica que la causa de la tromboembolia sistémica no es solamente la arritmia, sino «lo que la acompaña»11,12.
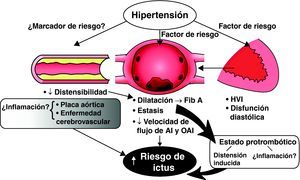
Los mecanismos fisiopatológicos que subyacen al ictus en los pacientes con fibrilación auricular son multifactoriales (Figura 1). Está ampliamente aceptado que la estasis en la aurícula izquierda y la orejuela de la aurícula izquierda, que conduce a la formación del trombo, probablemente sea una causa primaria de tromboembolia sistémica. Las comorbilidades que se dan en los ancianos, como disfunción diastólica, diabetes mellitus, hipertensión y aterosclerosis aórtica, se asocian a un aumento del volumen auricular izquierdo y tal vez a una mayor predisposición a la estasis y la formación de trombos en la aurícula izquierda2,13,14,15,16. La sobrecarga de volumen y la dilatación de la aurícula izquierda pueden conducir, de por sí, a un estado protrombótico, a través de mecanismos inducidos por la distensión, y a disfunción endotelial. Además, la aparición de fibrilación auricular puede llevar a la activación de factores hemostáticos17. Varios estudios han señalado que la fibrilación auricular induce un estado de hipercoagulabilidad, y esto se ha observado en la fibrilación auricular tanto paroxística como persistente17,18,19 (Figura 1). Por otra parte, se ha observado un aumento de las concentraciones plasmáticas de marcadores de la activación plaquetaria (tromboglobulina beta, factor plaquetario IV y P selectina soluble), aumento de los marcadores plasmáticos de la trombogénesis (complejos trombina-antitrombina) y evidencia de disfunción y lesión endoteliales (factor von Willebrand), que están correlacionados de manera independiente con tromboembolia20,21.
Figura 1. Papel de la hipertensión y riesgo de ictus en la hipertensión no valvular. La enfermedad vascular y el aumento de la rigidez arterial pueden conducir a hipertrofia ventricular izquierda, disfunción diastólica y sobrecarga de volumen auricular izquierdo con estasis y formación de trombos. Otros mecanismos pueden ser las repercusiones de la fibrilación auricular y la distensión auricular como factores que contribuyan a producir un estado hipercoagulable. La hipertensión y la valvulopatía pueden ser también un «marcador de riesgo» que indique la presencia de aterosclerosis cerebrovascular y cerebral, y un «medio» inflamatorio, pero de por sí no son factores que intervengan directamente en el ictus. AI: auricular izquierdo; Fib A: fibrilación auricular; HVI: hipertrofia ventricular izquierda; OAI: orejuela auricular izquierda.
En un porcentaje no especificado de pacientes, la fibrilación auricular puede ser un indicador sustitutivo o una manifestación del aumento de rigidez aórtica, aterosclerosis difusa y enfermedad vascular. En estos subgrupos clínicos, la presunta causa de ictus y embolia sistémica puede ser la aterosclerosis aórtica, la enfermedad cerebrovascular coexistente y tal vez un «medio» inflamatorio (Figura 1). La marea demográfica, que conduce a sociedades envejecidas tanto en los países de rentas altas como en los de rentas bajas-medias, es inexorable y pone de relieve la importancia creciente de la prevención del ictus en la fibrilación auricular.
Estratificación del riesgo de tromboemboliaEn las recomendaciones para el uso del tratamiento antiagregante plaquetario y anticoagulante subyace como fuerza impulsora la estratificación de los pacientes en función de su riesgo de hemorragia y el riesgo de ictus. Ello ha conducido, a su vez, a la publicación de varios esquemas diferentes de estratificación del riesgo22,23.
En un amplio estudio de adultos con fibrilación auricular, se comparó la capacidad predictiva de cinco escalas de riesgo diferentes, incluida la ampliamente utilizada puntuación CHADS223. Las distintas puntuaciones del riesgo fueron comparables en cuanto a su capacidad predictiva, pero la capacidad de discriminación fue uniformemente baja, con un valor del parámetro estadístico C que oscilaba entre 0,56 y 0,62, y unas proporciones de pacientes considerados en riesgo alto, bajo o intermedio que mostraban amplias variaciones en los distintos esquemas.
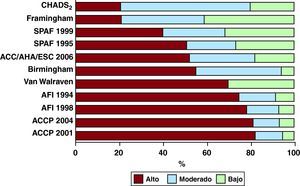
El grupo de trabajo Stroke Risk in Atrial Fibrillation analizó 12 esquemas publicados de estratificación del riesgo en pacientes con fibrilación auricular no valvular22. Cinco de ellos se basaban en consensos de expertos, cuatro tenían en cuenta solamente factores clínicos, mientras que siete incluían también variables ecocardiográficas. Además, el número de variables incluidas oscilaba entre cuatro y ocho. En la Figura 2 se pone de relieve la notable variabilidad de estas puntuaciones en cuanto a la predicción de la categoría de riesgo. La conclusión a la que llegó este grupo de trabajo fue que había diferencias sustanciales clínicamente relevantes entre los esquemas publicados y que todos ellos distaban mucho de ser óptimos. Los resultados eran especialmente subóptimos en los pacientes con bajo riesgo, y se puso de manifiesto una falta de datos respecto a las tasas reales de ictus en los pacientes con alto riesgo. Además, hay una falta de consenso respecto al papel de la insuficiencia cardiaca congestiva como factor de riesgo y respecto al impacto que tienen el tiempo de evolución, la gravedad y el tratamiento de trastornos clave como la hipertensión en el riesgo total. No se ha establecido el papel que tienen los biomarcadores que reflejan el estado protrombótico como factores contribuyentes en la estratificación del riesgo.
Figura 2. Distribución relativa del riesgo esperado de ictus al aplicar 12 escalas diferentes de estratificación del riesgo a una cohorte representativa de pacientes con fibrilación auricular. ACC: American College of Cardiology; ACCP, American College of Chest Physicians; AFI: Atrial Fibrillation Investigators; AHA: American Heart Association; ESC: European Society of Cardiology; SPAF: Stroke Prevention in Atrial Fibrillation. Reproducida con permiso de Stroke Risk in Atrial Fibrillation Working Group 22 .
De todos modos, y a pesar de las limitaciones conocidas de la escala de riesgo CHADS2 en la predicción del riesgo de ictus y de trombos de la aurícula izquierda24, parece claro que en los pacientes tratados con ácido acetilsalicílico y clopidogrel, la relación entre las puntuaciones crecientes y el riesgo de ictus es bastante sólida y clínicamente relevante25,26. Por otro lado, es preciso reconocer que el riesgo se sitúa en un espectro continuo y que una puntuación CHADS2 de 1 continúa implicando un aumento del riesgo y un posible efecto beneficioso de los anticoagulantes orales. Las recientes guías de la European Society of Cardiology (ESC) para el manejo de la fibrilación auricular han incorporado la escala de riesgo CHA2DS2-VASc, que amplía el esquema CHADS2 introduciendo una consideración del riesgo de ictus adicional27. La puntuación puede resultar especialmente útil en los pacientes que tienen una puntuación CHADS2 de 1, en los que el riesgo puede ser lo bastante alto como para justificar la anticoagulación oral (ACO) con uno de los tres factores «VASc» adicionales: edad de 65-74 (en comparación con la edad < 65), sexo femenino o enfermedad vascular. Ha habido un gran interés por la validación de esta escala en otras poblaciones y una serie amplia reciente ha señalado que, en una población anciana, los modelos de CHADS2 y CHA2DS2-VASc fueron los que mostraron mejor valor predictivo28,29. De todos modos, la utilidad clínica de la escala de riesgo CHA2DS2-VASc deberá ser validada mejor30. Conjuntamente con los factores de riesgo determinados para la predicción del riesgo de ictus, se han validado varias escalas del riesgo de hemorragia en los pacientes anticoagulados, nuevamente con una considerable variabilidad. Se ha elaborado una nueva escala sencilla del riesgo de hemorragia (HAS-BLED) basada en los factores de hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad del INR, edad superior a 65 años y toma concomitante de fármacos o alcohol y, según las guías de la ESC, una puntuación ≥ 3 indica un riesgo alto de hemorragia con el empleo de un tratamiento anticoagulante31.
Parece claro que una de las prioridades para nuevos estudios debe ser el desarrollo de esquemas óptimos y estandarizados para la prevención primaria, tal vez con el empleo de biomarcadores de la trombogénesis, además de otros parámetros.
Estrategias basadas en la evidencia para el tratamiento antiagregante plaquetario y antitrombótico en la fibrilación auricularLas indicaciones para el tratamiento de prevención de ictus y tromboembolia sistémica fuera del sistema nervioso central en los pacientes con fibrilación auricular se basan en una evaluación del riesgo absoluto de estos episodios y en el potencial de hemorragia. Estas indicaciones se abordan detalladamente en las guías actuales de la ESC y del American College of Cardiology/American Heart Association (ACC/AHA), pero tal como ocurre en otros muchos contextos clínicos, el tratamiento debe individualizarse y es preciso aplicar un juicio clínico bien fundamentado27,32. Ello requiere apreciar de forma completa al paciente como un todo, incluidas sus comorbilidades y su cumplimiento. Con una puntuación CHADS2 de 2 o superior, se recomienda una ACO; para una puntuación CHADS2 de 1, es razonable el empleo de ácido acetilsalicílico o ACO, y para una puntuación CHADS2 de 0, la de ácido acetilsalicílico o ninguna medicación. El esquema de CHA2DS2-VASc puede resultar especialmente útil en los pacientes con una puntuación CHADS2 de 1, en los que un factor VASc adicional puede comportar el paso a una categoría que justifique la ACO.
Ácido acetilsalicílicoUn metaanálisis de siete ensayos en los que se comparó ácido acetilsalicílico con placebo puso de manifiesto que este fármaco se asociaba a una reducción de la incidencia de ictus pequeña, del 19% (intervalos de confianza [IC] del 95%, –1 a 35%)33. El principal efecto parecía consistir en una reducción de los ictus discapacitantes. Sin embargo, los resultados del ensayo aleatorizado más reciente de ácido acetilsalicílico (150-200mg/dl) en comparación con placebo han sido completamente neutros34. Los datos relativos a dipiridamol son insuficientes para justificar una conclusión sólida. En resumen, parece que el ácido acetilsalicílico puede aportar un efecto beneficioso, pero su magnitud es pequeña y los datos no son concluyentes.
Ácido acetilsalicílico más clopidogrel en comparación con ácido acetilsalicílico soloEn el amplio estudio ACTIVE, un ensayo aleatorizado realizado en 7.554 pacientes con fibrilación auricular y uno o dos factores de riesgo de ictus, se comparó el empleo de clopidogrel en dosis de 75mg al día y ácido acetilsalicílico en dosis de 75 a 100mg al día con el de ácido acetilsalicílico solo (75 a 100mg al día) en pacientes que no eran candidatos a un tratamiento con warfarina según la preferencia del médico y del paciente35. Tras un periodo de 3,6 años, el empleo de clopidogrel más ácido acetilsalicílico redujo significativamente la tasa de la variable de valoración combinada formada por un primer episodio de ictus, embolia sistémica fuera del sistema nervioso central, infarto de miocardio y muerte de causa vascular, con un riesgo relativo de 0,89 (0,81-0,98), y ello se debió principalmente a una reducción del 28% en el riesgo relativo de ictus. Este efecto beneficioso se obtenía a costa de un aumento del 50% en las hemorragias mayores. De todos modos, este ensayo indica que un tratamiento antiagregante plaquetario combinado doble es una alternativa en los pacientes que no pueden tomar warfarina, aunque los riesgos de hemorragias son similares a los de los anticoagulantes orales.
Dosis ajustadas de warfarina en comparación con el tratamiento antiagregante plaquetarioEn un metaanálisis de 29 ensayos clínicos aleatorizados en los que participaron 28.000 pacientes con fibrilación auricular no valvular, el tratamiento con warfarina produjo una reducción del 64% (IC del 95%, 49-74%) en el riesgo relativo de ictus en comparación con placebo o con los antiagregantes plaquetarios. Es importante señalar también que la warfarina se asoció a una reducción relativa del 26% (IC del 95%, 3-34%) en la mortalidad por todas las causas33.
Hay diversos factores relativos a los ensayos controlados y aleatorizados que pueden tener influencia en la posibilidad de generalización al ámbito más general de la práctica clínica. Los efectos de la warfarina pueden haber sido exagerados por un «sesgo de inclusión» que limita la incorporación de pacientes con mayor riesgo de hemorragia, la participación de centros expertos, los ensayos de diseño abierto y el tratamiento de base limitado, lo cual podría elevar las tasas de episodios. En cambio, otros factores pueden haber reducido el efecto de la warfarina en relación con la práctica clínica por cuanto muchos pacientes no habían recibido ningún tratamiento previo con warfarina, algunos de los estudios fueron previos a la época en que se ha utilizado el INR y emplearon cocientes diversos de tiempo de protrombina, y la modificación enérgica de los factores de riesgo podría haber reducido los episodios vasculares.
Dosis ajustadas de warfarina en comparación con ácido acetilsalicílico y clopidogrelEn el ensayo ACTIVE W participaron 6.706 pacientes a los que se asignó aleatoriamente un antagonista de la vitamina K (objetivo de INR, 2-3) o ácido acetilsalicílico (75-100mg al día), y clopidogrel 75mg al día36. El ensayo fue interrumpido prematuramente, ya que la anticoagulación con warfarina fue claramente superior en cuanto a la variable de valoración primaria, efecto que se debió al ictus. Las tasas globales de hemorragia con el tratamiento antiagregante plaquetario combinado doble fueron también más elevadas. Es interesante que un análisis post-hoc posterior de este ensayo pusiera de manifiesto que el efecto beneficioso de los anticoagulantes orales estuviera limitado a los pacientes con un tiempo de permanencia dentro del rango terapéutico (TRT) del 65% o superior, y que en ellos el riesgo de un episodio primario con el empleo de ácido acetilsalicílico y clopidogrel fuera de más del doble del observado con warfarina37.
Warfarina a dosis bajasEl ensayo «SPAF III», llevado a cabo en 1.044 pacientes, demostró de manera inequívoca que las dosis bajas de warfarina (1,25mg al día o un objetivo de INR de 1,2-1,5) en combinación con 300 mg al día de ácido acetilsalicílico es claramente inferior al empleo de dosis ajustadas de warfarina en lo relativo a morbilidad y mortalidad38.
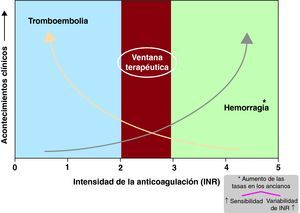
Limitaciones de los antagonistas de la vitamina KLas limitaciones de los antagonistas de la vitamina K son bien conocidas e incluyen el rango terapéutico estrecho, el «inicio y desaparición» de la acción lentos (Figura 3), numerosas interacciones alimentarias y farmacológicas, el impacto de las comorbilidades en la farmacocinética y la farmacodinámica y la influencia de la variabilidad genética en su eliminación39. La necesidad de una monitorización constante y frecuente del efecto anticoagulante y de ajustes de dosis frecuentes introduce un elemento de incomodidad.
Figura 3. Ilustración de la ventana terapéutica estrecha de los antagonistas de la vitamina K, con un aumento del riesgo de ictus cuando el INR es < 2 y un aumento del riesgo de hemorragia cuando los valores de INR son > 3-3,5. INR: cociente internacional normalizado.
También son motivo de preocupación la notable variabilidad existente en el tiempo durante el que el INR se encuentra dentro del TRT y el impacto que tiene la calidad del control del INR en relación con el efecto beneficioso aportado por la warfarina en comparación con el tratamiento antiagregante plaquetario37. En el estudio SPORTIF II, un ensayo aleatorizado de ximelagatrán en comparación con warfarina, al cabo de 12 semanas solamente un 57% de los pacientes estuvieron dentro del rango terapéutico de INR de 2-340. En un reciente ensayo aleatorizado multinacional, las distribuciones del tiempo medio de permanencia en el rango terapéutico del INR oscilaron entre el 44 y el 77%. La monitorización domiciliaria del INR ha tenido un efecto positivo pero sorprendentemente pequeño en el tiempo de permanencia en el TRT41. Varios estudios recientes han mostrado una intensa relación entre el control del INR y el ictus en pacientes con fibrilación auricular42,43. Sin embargo, a pesar de estas advertencias, en un amplio sistema de asistencia sanitaria integrada de California, se puso de manifiesto que la warfarina era muy eficaz en la prevención del ictus isquémico en pacientes con fibrilación auricular, y que el riesgo de hemorragia intracraneal era bajo44. No obstante, a pesar del hecho innegable de que la warfarina es un fármaco barato y eficaz, no es un producto fácil de administrar y parece que su empleo desagrada tanto a los médicos como a los pacientes y los medios de comunicación.
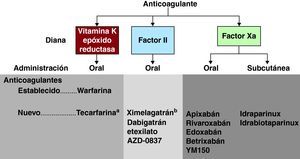
Alternativas a la warfarina: ¿una nueva era?La aparición de alternativas a la warfarina ha engendrado una respuesta entusiasta y, en ciertos ámbitos, unas expectativas tal vez poco razonables. La adopción de nuevos fármacos anticoagulantes para el uso clínico resulta complicada, y comporta dificultades metodológicas sustanciales, pero en los últimos años hemos asistido a progresos considerables en este campo45,46. El camino de investigación seguido con la mayor parte de los nuevos fármacos se ha iniciado generalmente con ensayos en pacientes con tromboembolia venosa en quienes los objetivos son los pasos específicos de la coagulación, como el inicio, la propagación y la actividad de la trombina. Esto puede fomentar la activación de otros factores de la coagulación a través del efecto del trombo. Otros ensayos posteriores y a veces paralelos se han centrado en los pacientes con fibrilación auricular y, para ciertos fármacos, en los pacientes con síndrome coronario agudo (Figura 4).
Figura 4. Anticoagulantes establecidos y de reciente aparición para la prevención del ictus en la fibrilación auricular. aEvita la vía del CYP450. bAbandono debido a hepatotoxicidad.
TecarfarinaA diferencia de otros fármacos que van dirigidos directamente a la cascada de la coagulación, la tecarfarina (ATI-5923) es un antagonista de la vitamina K epóxido reductasa que tiene un mecanismo de acción idéntico al de la warfarina. La ventaja que tiene es que se metaboliza por carboxilesterasas y no por la vía del citocromo P450 (CYP450). Desde un punto de vista teórico, esto podría reducir muchas de las interacciones alimentarias, farmacológicas y genéticas que pueden subyacer a la variabilidad de los INR, especialmente durante los primeros 3 meses siguientes a la instauración del tratamiento con warfarina.
La primera evaluación de este fármaco se ha realizado recientemente en 66 pacientes, en un estudio abierto de 6-12 semanas, e indica una mejoría moderada (aproximadamente un 10%) en el TRT en comparación con lo indicado por los estudios previos de warfarina47. Será necesario un estudio mucho más amplio, que incluya un grupo de control simultáneo con warfarina, para evaluar la eficacia, la seguridad y la tolerabilidad39.
Inhibidores del factor ii (inhibidores directos de la trombinA)La trombina desempeña un papel crucial en la hemostasia (Figura 4) y produce sus acciones a través de varias vías clave, como la conversión de fibrinógeno en fibrina, la amplificación del proceso de coagulación por la activación de factores críticos, la activación directa de las plaquetas y la estabilización del coágulo mediante diversos mecanismos independientes48,49. Es comprensible que la inhibición de la trombina sea un objetivo atractivo, y los inhibidores directos de la trombina son capaces de inactivar tanto la trombina soluble como la unida a un coágulo, lo cual es una característica que puede ser importante, ya que la liberación de trombina soluble tras la lisis puede desencadenar un ulterior crecimiento del trombo50.
El primer inhibidor directo de la trombina aprobado en fase clínica es el ximelagatrán para pacientes con tromboembolia venosa. A pesar de que produjo algunos resultados prometedores en pacientes con fibrilación auricular, el fármaco fue retirado del mercado a causa de la toxicidad hepática en febrero de 200651.
Dabigatrán etexilatoDabigatrán etexilato (Pradaxa®) es un inhibidor directo de trombina, de molécula pequeña y de administración oral, que fue aprobado en Europa en 2008, para la profilaxis de la tromboembolia venosa tras la cirugía ortopédica y traumatológica, y en Estados Unidos y Canadá en 2010, para la profilaxis del ictus en pacientes con fibrilación auricular. Se trata de un profármaco que se convierte en metabolito activo tras la toma, de manera independiente del CYP450; la biodisponibilidad es baja, y la toma se realiza dos veces al día. Se elimina predominantemente por vía renal (80%), con un inicio de acción rápido y un efecto anticoagulante que aparece en aproximadamente 1 h, pero con una semivida de 12-17 h. No requiere determinaciones del INR. En el ensayo clave RE-LY —de diseño abierto— realizado en 18.113 pacientes con fibrilación auricular, se observó que una dosis de 150 mg dos veces al día de dabigatrán se asociaba a unas tasas de ictus y de embolias sistémicas inferiores, pero con unas tasas de hemorragia mayor similares a las de warfarina52. A una dosis de 110mg dos veces al día, las tasas de ictus y embolias sistémicas fueron similares a las que se daban con warfarina, pero las tasas de hemorragias mayores fueron más bajas. Estos resultados positivos eran independientes de la calidad del control del INR en los centros participantes53. En los pacientes con antecedentes de ictus o accidente isquémico transitorio previos, los efectos de dabigatrán en ictus o embolia sistémica fueron similares a los asociados a warfarina, pero las tasas de hemorragia fueron menores54. Para ambas dosis de dabigatrán, el riesgo relativo de hemorragia intracraneal se redujo en un 60% en comparación con warfarina.
En Estados Unidos, se ha aprobado la dosis de dabigatrán 150mg dos veces al día, pero en pacientes con mala función renal (aclaramiento de creatinina de 15-30 ml/min) se recomienda una dosis menor, de 75 mg dos veces al día, en función de lo que indican los modelos farmacodinámicos. El dabigatrán constituye sin duda alguna un avance, pero su aprobación ha generado nuevas cuestiones, como las siguientes:
1) La pauta de administración de dos veces al día puede tener inconvenientes, incluido el cumplimiento de los pacientes.
2) La menor duración de acción puede aumentar la vulnerabilidad a un efecto de «rebote» si se deja de tomar alguna dosis.
3) Se produjo dispepsia en aproximadamente el 11%, frente al 5,8% de los pacientes tratados con warfarina en el ensayo RE-LY.
4) La posología para los pacientes con disfunción renal no ha sido sustanciada por ensayos clínicos.
5) Se ha observado una tasa de infartos de miocardio ligeramente superior, inexplicada, con dabigatrán en comparación con warfarina en el ensayo RE-LY, y no está claro si esto está relacionado con el hecho de no utilizar ácido acetilsalicílico en muchos pacientes, con un efecto directo de la warfarina, o si este aumento de las tasas de infarto de miocardio es clínicamente relevante o no.
6) Aunque las tasas de hemorragia han disminuido, la falta de reversibilidad si no es mediante hemodiálisis podría ser motivo de preocupación, sobre todo en los pacientes a los que se practica una intervención quirúrgica que comporta un riesgo elevado de hemorragia. En general, debe suspenderse el dabigatrán durante un periodo de 4-5 semividas (60-75 h) antes de una intervención invasiva. Si el paciente sufre una hemorragia, está indicado el uso de un apoyo presor, transfusiones de sangre y, en circunstancias excepcionales, diálisis. El uso de agentes hemostáticos adicionales, como el denominado actividad de bypass de corrección de factor VIII (FEIBA, factor VIII inhibitor bypass activity) y el factor VII activado, no se ha estudiado de manera sistemática en este contexto, está infrautilizado y podría conducir a una trombosis de rebote.
7) Otra cuestión no resuelta es el coste del fármaco, que para los pacientes puede diferir del coste para la sociedad, puesto que en muchos países los costes de las pruebas de INR no son asumidos por el paciente. Los candidatos ideales para el empleo de dabigatrán son los pacientes con fibrilación auricular no valvular, que son difíciles de controlar con warfarina debido a la amplia fluctuación de los valores de INR, los pacientes que viven en zonas alejadas o los casos en que no es posible un buen control de la anticoagulación (p. ej., monitorización domiciliaria del INR).
Por último, debe resaltarse que son necesarios un seguimiento a más largo plazo y una farmacovigilancia poscomercialización. El fármaco es prometedor y su introducción constituye un avance de gran interés, pero la experiencia en la práctica clínica es, en general, limitada.
Inhibidores del factor XaEl factor Xa es también una diana atractiva para los nuevos enfoques antitrombóticos, puesto que el factor Xa actúa, además, selectivamente sobre la proteasa central que es común a las vías intrínseca y extrínseca. De este modo, se inhibiría el origen principal y el paso limitante en la amplificación de la cascada de la coagulación48,49. En la Figura 4 se muestran diversos productos anti-Xa orales y subcutáneos actualmente en desarrollo. Por lo que respecta a la fibrilación auricular, el centro de interés está en los fármacos de administración oral.
RivaroxabánEl rivaroxabán es un inhibidor del factor Xa de molécula pequeña que ha sido evaluado ampliamente. Se absorbe con rapidez y con una alta biodisponibilidad; se administra una vez al día; tiene una semivida bastante corta, de 5-9 h en voluntarios sanos, pero significativamente mayor en los ancianos (9-13 h), y la eliminación se produce por vía renal en una tercera parte y por vía hepática en dos terceras partes. No requiere monitorización del INR.
El ensayo más amplio llevado a cabo en la fibrilación auricular (Randomized, Double-Blind Study Comparing Once Daily Oral Rivaroxaban With Adjusted-Dose Oral Warfarin for the Prevention of Stroke in Subjects With Non-Valvular Atrial Fibrillation [ROCKET-FA]) en 14.172 pacientes se ha presentado en las Sesiones Científicas de la AHA de 201055. Los pacientes de este ensayo a doble ciego tenían un riesgo elevado, de tal manera que un 90% tenía una puntuación de riesgo CHADS2 ≥ 3 y alrededor de la mitad, antecedentes de ictus o ataque isquémico transitorio previos. Aunque el fármaco fue no inferior respecto a la warfarina, no llegó a la superioridad. De todos modos, se deberá examinar los resultados desde una perspectiva favorable, pues estos datos sí ponen de manifiesto que se trata de una alternativa segura y efectiva a la warfarina. Al igual que el dabigatrán, el rivaroxabán produjo un riesgo de hemorragia intracraneal significativamente inferior al de la warfarina.
Las cuestiones que se plantean tras esta presentación son varias: a) ¿hay diferencias entre los efectos de los inhibidores del factor Xa y los inhibidores directos de la trombina (dabigatrán) y es factible y/o probable un ensayo de comparación directa?; b) dado que se trataba de una población con alto riesgo, ¿son más relevantes los resultados del ROCKET-AF para la población con riesgo elevado y los del RE-LY para la población con menor riesgo?, ¿fue óptima la dosis única diaria del ROCKET-AF, en especial teniendo en cuenta la semivida relativamente corta del fármaco?; c) ¿son más fiables los resultados del ROCKET-AF, dado el diseño a doble ciego del ensayo?, y d) ¿qué repercusiones tiene el menor porcentaje de tiempo de permanencia en el TRT (57,8%) de los pacientes tratados con warfarina, específicamente en relación con la magnitud de la diferencia de los resultados obtenidos con warfarina y con rivaroxabán? Se esperan con gran interés las publicaciones correspondientes a este ensayo.
ApixabánSe trata de un inhibidor potente y selectivo del factor Xa con semivida de 12 h, biodisponibilidad del 50%, eliminación predominantemente no renal y administración dos veces al día. No se conocen interacciones entre los alimentos y el fármaco, y es probable que haya pocas interacciones con otros fármacos. Se ha evaluado detalladamente su uso en ensayos realizados en la trombosis venosa profunda, en su profilaxis, con resultados alentadores. El ensayo Apixaban versus Acetylsalicylic Acid to Prevent Strokes (AVERROES), presentado en las Sesiones Científicas Anuales de 2010 de la ESC, comparó apixabán con ácido acetilsalicílico en 5.600 pacientes «no adecuados» para el uso de warfarina, por razones que incluían la tolerancia previa a este fármaco o la preferencia del médico o el paciente54. El ensayo fue interrumpido prematuramente porque el apixabán redujo significativamente el riesgo de ictus y de embolias sistémicas, sin ningún aumento del riesgo de hemorragia56.
El ensayo más amplio de apixabán en pacientes con fibrilación auricular es el Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation (ARISTOTLE), que ha completado la inclusión de 18.206 pacientes. Se espera la presentación de los resultados en 2011, y en ellos se incluirá la evaluación clínica de un número sustancial de pacientes no tratados anteriormente con warfarina.
Otros inhibidores de factor Xa de administración oral son betrixabán, darexabán y edoxabán, que están actualmente en estudio en ensayos de fase II (betrixabán y darexabán) y fase III (edoxabán). Por lo que respecta a edoxabán, el ensayo Effective Anticoagulation With Factor Xa Generation in Atrial Fibrillation Trial (ENGAGE AF-TIMI 48 [NCT00781391]) se limita a los pacientes con fibrilación auricular y una puntuación CHADS2 ≥ 247. Darexabán se está estudiando actualmente en otro ensayo de fase II49.
El papel de estos fármacos en los pacientes con síndrome coronario agudo queda fuera del ámbito de esta revisión. No obstante, es necesario tener precaución al respecto. Sabemos que la terapia triple con warfarina, ácido acetilsalicílico y Plavix aumenta los riesgos de hemorragia: ¿por qué debería ocurrir algo diferente con otros anticoagulantes? A este respecto, el ensayo APPRAISE II (Apixaban for Prevention of Acute Ischemic Safety Events II) realizado con apixabán en pacientes con síndrome coronario agudo, la mayoría en tratamiento antiagregante plaquetario combinado doble, hace poco fue interrumpido prematuramente a causa de un exceso de hemorragias55.
Enfoques no farmacológicosLos enfoques mecánicos y, en particular, los aplicados a través de un catéter para abordar la oclusión de la orejuela auricular izquierda constituyen un camino innovador y muy atractivo para la prevención del ictus. El éxito atribuido a estas técnicas se basa en el supuesto de que el origen totalmente mayoritario de los ictus embólicos en los pacientes con fibrilación auricular está en los trombos que se forman en la orejuela auricular izquierda57,58. Un contraargumento resalta el concepto de la fibrilación auricular como enfermedad vascular, en especial en los ancianos59. La fibrilación auricular se asocia a un aumento de la rigidez aórtica, aterosclerosis aórtica y cerebrovascular y alteraciones de la función plaquetaria y la coagulación. En este contexto hay múltiples orígenes posibles de ictus embólicos, y ello justifica una anticoagulación sistémica1,59.
En los pacientes que no toleran de forma segura el empleo de anticoagulantes debido al riesgo de hemorragia, la oclusión de la orejuela auricular izquierda es una opción atractiva, y se están evaluando diversos dispositivos; los resultados del único ensayo controlado y aleatorizado (Randomized Prospective Trial of Percutaneous LAA Closure vs Warfarin for Stroke Prevention in Atrial Fibrillation [PROTECT-AF]) con el dispositivo Watchman son alentadores60. En un futuro próximo asistiremos probablemente a la introducción iterativa de nuevas versiones de los dispositivos y se alcanzará mayor seguridad a medida que se obtenga más experiencia en la curva de aprendizaje. El papel que desempeñará finalmente la estrategia basada en el uso de dispositivos deberá valorarse en un nuevo ensayo, pero por el momento la anticoagulación continúa siendo la asistencia estándar.
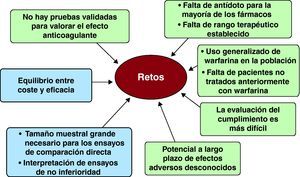
ConclusionesEl camino hacia el desarrollo y la aprobación de alternativas a la warfarina es tortuoso, y hay muchos obstáculos que superar (Figura 5)37,46. Continúa habiendo un considerable debate acerca del diseño óptimo de los ensayos clínicos, incluidas las cuestiones relativas al diseño abierto frente al doble ciego, la elección de las variables de valoración adecuadas, el diseño de ensayo de no inferioridad, la consideración de diseños de ensayo de superioridad y las posologías apropiadas. El desarrollo de medidas de utilidad para valorar el impacto de las diferentes variables de valoración en la calidad de vida puede ser una consideración importante en la decisión del paciente de iniciar el tratamiento con un nuevo fármaco. La relación coste-efectividad desde las perspectivas de la sociedad y del paciente es una cuestión enteramente distinta, pero importante.
Figura 5. Obstáculos que superar y dificultades existentes para la adopción de los nuevos anticoagulantes.
El contexto de regulación farmacológica desempeñará un papel importante en el diseño de los ensayos clínicos y, por lo que respecta al tamaño muestral, es probable que sea grande y costoso, dado que las tasas de episodios son relativamente bajas en los pacientes tratados con warfarina46. La farmacovigilancia tras los ensayos y los registros son cruciales para una evaluación equilibrada a largo plazo de un nuevo fármaco en un ámbito más amplio de práctica clínica fuera del medio restringido de un ensayo controlado y aleatorizado.
Como trasfondo que no debe olvidarse, está la amplia infrautilización de la warfarina en los pacientes elegibles, a pesar de los abundantes datos que respaldan su utilidad y de las guías que recomiendan su uso en los pacientes con un riesgo de ictus de moderado a grave7,49,61. Además, aun cuando se utilice, su empleo es con frecuencia subóptimo, con valores de INR situados fuera del rango pretendido.
En resumen, el desarrollo y la introducción en el ámbito clínico de nuevas estrategias antitrombóticas son una empresa importante y un objetivo que vale la pena perseguir teniendo en cuenta el problema de salud pública creciente que plantea la combinación de la edad y la fibrilación auricular. Cualquier tratamiento que permitiera obviar las limitaciones de la warfarina sería una adición al arsenal terapéutico bien recibida. La aprobación de dabigatrán en 2010, 56 años después de que la Federal Drug Administration aprobara el uso de la warfarina, marca el comienzo de una nueva era. En un futuro próximo, es probable que dispongamos de toda una gama de nuevos fármacos antitrombóticos, además de la piedra angular del tratamiento anticoagulante oral, claramente establecido pero de uso incómodo, que son los antagonistas de la vitamina K.
Full English text available from: www.revespcardiol.org
Conflicto de interesesNinguno.
Autor para correspondencia: Division of Cardiovascular Diseases, Department of Internal Medicine, Mayo Clinic, 200 First Street, SW, Gonda 5-368, Rochester, MN 55905-0001, Estados Unidos. gersh.bernard@mayo.edu