Actualmente está bien establecido que la alta reactividad plaquetaria a la adenosina difosfato durante el tratamiento con clopidogrel es un factor independiente predictivo del riesgo de eventos isquémicos en pacientes a los que se ha practicado una intervención coronaria percutánea. Sin embargo, el papel exacto de las pruebas de la función plaquetaria sigue siendo objeto de controversia. Las pruebas de la función plaquetaria para asegurar una inhibición plaquetaria óptima han sido recomendadas por algunos autores para mejorar los resultados en los pacientes tratados con clopidogrel. En ensayos prospectivos y aleatorizados recientes sobre tratamiento antiagregante plaquetario personalizado, no se ha podido demostrar un efecto favorable de las pruebas de la función plaquetaria en cuanto a mejora de los resultados clínicos. En este artículo se analizan los mecanismos de la falta de respuesta a clopidogrel, los ensayos recientes de las pruebas de la función plaquetaria y otros nuevos avances en el campo del tratamiento antiagregante plaquetario personalizado.
Palabras clave
La interacción entre adenosina difosfato (ADP) y receptor P2Y12 desempeña un papel central en la generación del trombo rico en plaquetas en los lugares de rotura de la placa y la posterior aparición de eventos isquémicos en pacientes con enfermedad coronaria. La eficacia clínica del tratamiento antiagregante plaquetario combinado doble consistente en ácido acetilsalicílico y un bloqueador del receptor P2Y12 se ha demostrado ampliamente en una gran variedad de pacientes con enfermedad coronaria de alto riesgo1. Sin embargo, el tratamiento con clopidogrel, que es el bloqueador del receptor P2Y12 más utilizado, se asocia a una respuesta farmacodinámica muy variable; aproximadamente uno de cada tres pacientes tratados con clopidogrel presenta alta reactividad plaquetaria durante el tratamiento (ARP). Esta complicación tiene clara relación con la aparición de un episodio isquémico tras la intervención coronaria percutánea (ICP) en estudios observacionales de miles de pacientes. A pesar de la importancia fundamental de los receptores P2Y12 no bloqueados en la génesis de la trombosis, la demostración clara de la falta de respuesta al clopidogrel, e incluso la identificación de genes asociados a la resistencia —CYP2C19*2 y *3— y de su intensa relación con el aumento del riesgo isquémico tras la ICP, los cardiólogos no suelen determinar la función plaquetaria o los polimorfismos genéticos en sus pacientes de alto riesgo tratados con clopidogrel. En comparación con las evaluaciones objetivas y los ajustes que se hacen con frecuencia durante el tratamiento con la mayoría de los demás fármacos cardiovasculares, este enfoque «no selectivo» o «de talla única» del uso de clopidogrel, el inhibidor de P2Y12 más ampliamente utilizado para prevenir la aparición de un evento trombótico catastrófico, resulta paradójico2,3.
Durante mucho tiempo ha habido cierta reticencia a evaluar la función plaquetaria debido a la posible introducción de artefactos como consecuencia de los métodos de laboratorio, el reflejo incompleto del proceso trombótico in vivo real y la imposibilidad de establecer inequívocamente una relación causal entre los resultados de la prueba y la aparición del evento trombótico. En la última década se ha producido una notable mejora del conocimiento sobre la fisiología del receptor plaquetario, se han desarrollado bloqueadores del receptor P2Y12 más potentes, que pueden superar algunas de las limitaciones del clopidogrel, y se ha comercializado el clopidogrel genérico, de menor coste. La introducción de análisis de la función plaquetaria de uso más sencillo que pueden evaluar de manera fiable el efecto antiagregante plaquetario de los bloqueadores del recetor P2Y12 y de pruebas genéticas para realizar en el lugar de asistencia que permiten determinar con fiabilidad los polimorfismos genéticos asociados al metabolismo de los bloqueadores del receptor P2Y12 (en especial clopidogrel y prasugrel) han estimulado un enorme interés por la monitorización del tratamiento antiagregante plaquetario y el tratamiento antiagregante plaquetario personalizado3,4.
MECANISMOS DE LA FALTA DE RESPUESTA AL CLOPIDOGRELVarias líneas de investigación indican claramente que la generación variable e insuficiente del metabolitos activos es la principal explicación de la variabilidad y la falta de respuesta al clopidogrel cuando se observa un efecto de clopidogrel antiagregante plaquetario insignificante o nulo5. El grado variable de generación del metabolito activo tras la administración de clopidogrel podría explicarse: a) absorción intestinal variable o escasa que puede verse influida por el polimorfismo del gen ABCB1, y b) variabilidad funcional de la actividad de la isoenzima del CYP (citocromo P450) que se ve influida por interacciones farmacológicas y polimorfismos de un solo nucleótido en genes que codifican las isoenzimas del CYP5.
Numerosos estudios han evaluado la influencia de los polimorfismos de un solo nucleótido tanto del gen que codifica el CY2C19 como del gen del transportador de glucoproteína P (ABCB1) en la variabilidad de la respuesta a clopidogrel y los resultados clínicos5. Los polimorfismos de un solo nucleótido más ampliamente analizados y más frecuentes son el CYP2C19*2 (alelo de pérdida de función o LoF), que se asocia a ausencia completa de actividad enzimática, y el *17 (alelo de ganancia de función), que se asocia a aumento de la expresión y la actividad enzimáticas6. Se demostró menor exposición al metabolito activo de clopidogrel en plasma (reducción relativa del 32%; p < 0,001) y menor inhibición plaquetaria (reducción absoluta del 9% respecto al valor basal; p < 0,001) en portadores sanos de al menos un alelo de CY2C19 LoF en comparación con los no portadores7. En el primer estudio de asociación de genoma completo, llevado a cabo en individuos amish sanos, el CYP2C19*2 fue el único polimorfismos de un solo nucleótido asociado a la variabilidad de la respuesta a clopidogrel y explicó tan solo un 12% de la variación de la agregación plaquetaria frente al ADP después del tratamiento con clopidogrel. En un estudio para replicar los resultados en pacientes tratados con ICP, los portadores del alelo CYP2C19*2 presentaron una tasa de eventos cardiovasculares ∼ 2,4 veces superior a la de los no portadores8. En un metanálisis colaborativo de diversos ensayos clínicos en los que participaron sobre todo pacientes sometidos a ICP (el 91%; el 55% tenía síndrome coronario agudo [SCA]), hubo un aumento del riesgo de la variable de valoración combinada formada por muerte cardiovascular, infarto de miocardio o ictus en los portadores de un alelo LoF (razón de riesgos [HR] = 1,55; intervalo de confianza del 95% [IC95%], 1,10-2,17; p = 0,01), así como en los portadores de dos alelos LoF (HR = 1,76; IC95%, 1,24-2,50; p = 0,002) en comparación con los no portadores. Se observó un aumento significativo del riesgo de trombosis del stent tanto en los portadores de un alelo LoF (HR = 2,67; IC95%, 1,69-4,22; p < 0,0001) como en los portadores de dos alelos LoF (HR = 3,97; IC95%, 1,75-9,02; p = 0,001) en comparación con los no portadores9.
Los posteriores análisis retrospectivos de ensayos realizados en pacientes sin ICP no mostraron asociación significativa entre ser portador del alelo CYP2C19 LoF y una evolución clínica adversa. La relación del estado de portador del alelo de ganancia de función (CYP2C19*17) y de los genotipos ABCB1 y paraoxonasa-1 con la respuesta antiplaquetaria y los resultados clínicos en los pacientes tratados con clopidogrel no son concluyentes por el momento9–12. Además, el estado de portador del alelo LoF es un importante predictor independiente de la respuesta farmacodinámica a clopidogrel y de los resultados clínicos en los pacientes de alto riesgo tratados con clopidogrel sometidos a ICP. En 2009, la Food and Drug Administration indicó que los profesionales de la asistencia sanitaria deben ser conscientes de que se dispone de pruebas para determinar el genotipo y de que la respuesta antiagregante plaquetaria en los metabolizadores lentos aumenta con el uso de dosis altas de clopidogrel. La Food and Drug Administration recomendó también el uso de otros medicamentos antiagregantes plaquetarios u otras estrategias de administración de clopidogrel alternativas para los metabolizadores lentos13.
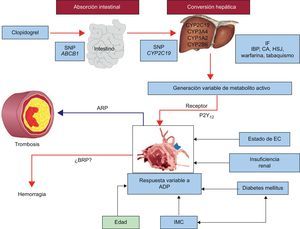
Por último, se debe señalar que la isoenzima CYP2C19 no es el único factor que determina la respuesta antiagregante plaquetaria a clopidogrel, ya que incluso en los metabolizadores lentos se ha observado cierto grado de inhibición plaquetaria cuando no se espera actividad enzimática alguna. En un estudio de individuos sanos con el genotipo metabolizador rápido de CYP2C19 homocigoto, se administró clopidogrel 75 mg/día durante 9 días. En ese estudio, todos los factores identificados juntos explicaban solo un 18% de la variación interindividual de los parámetros farmacocinéticos y un 32-64% de la variación interindividual de la función plaquetaria medida con el ensayo VASP-P (fosforilación de la fosfoproteína estimulada por vasodilatadores), el análisis VerifyNow P2Y12 y la agregación plaquetaria inducida por ADP según el análisis convencional14. Se ha demostrado que la estimulación de la actividad de CYP3A4 producida por la rifampicina y por la hierba de San Juan y la de la actividad de CYP1A2 producida por el consumo de tabaco potencian la inhibición plaquetaria inducida por clopidogrel15–17. El efecto del consumo de tabaco en la acción antiagregante plaquetaria del clopidogrel se ha asociado con los resultados clínicos y puede explicar en parte la «paradoja del fumador»18. Por el contrario, los productos que compiten con el clopidogrel por el CYP o lo inhiben atenúan el efecto antiagregante plaquetario del clopidogrel. Se ha observado una disminución de la respuesta farmacodinámica al clopidogrel con la administración conjunta de inhibidores de la bomba de protones como omeprazol, estatinas lipófilas y antagonistas del calcio metabolizados por las isoenzimas CYP2C19 y CYP3A419–21. Aunque en algunos estudios ex vivo se ha demostrado una disminución del grado de inhibición plaquetaria inducido por el clopidogrel tras la administración conjunta de estos fármacos, el efecto de estas interacciones en el riesgo de evento isquémico es aún objeto de controversia. Además de los mecanismos antes citados que explican la variabilidad farmacodinámica del clopidogrel, la edad avanzada, el aumento del índice de masa corporal, la insuficiencia renal, la diabetes mellitus y los SCA se han asociado también a una disminución de la respuesta antiagregante plaquetaria al clopidogrel (figura)22. Por último, la falta de cumplimiento es un factor obvio que es preciso descartar en el diagnóstico de falta de respuesta al clopidogrel. Al intentar definir la causalidad de una alta reactividad plaquetaria relacionada con la aparición de eventos clínicos en pacientes tratados con clopidogrel, es preciso considerar todos los mecanismos antes mencionados. Las ventajas y los inconvenientes de las pruebas de la función plaquetaria (PFP) y la determinación del genotipo se indican en la tabla 1.
Diversos factores que influyen en la reactividad plaquetaria y los eventos clínicos durante el tratamiento con clopidogrel. ADP: adenosina difosfato; ARP: alta reactividad plaquetaria durante el tratamiento; BRP: baja reactividad plaquetaria durante el tratamiento; CA: antagonista del calcio; CYP: citocromo P450; EC: enfermedad coronaria; HSJ: hierba de San Juan; IBP: inhibidor de la bomba de protones; IF: interacción entre fármacos; IMC: índice de masa corporal; PON 1: paraoxonasa 1; SNP: polimorfismo de un solo nucleótido. Adaptado con permiso de Gurbel et al22.
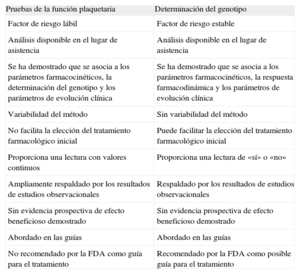
Ventajas e inconvenientes de la realización de pruebas de la función plaquetaria y la determinación del genotipo en pacientes tratados con bloqueadores del receptor P2Y12
| Pruebas de la función plaquetaria | Determinación del genotipo |
| Factor de riesgo lábil | Factor de riesgo estable |
| Análisis disponible en el lugar de asistencia | Análisis disponible en el lugar de asistencia |
| Se ha demostrado que se asocia a los parámetros farmacocinéticos, la determinación del genotipo y los parámetros de evolución clínica | Se ha demostrado que se asocia a los parámetros farmacocinéticos, la respuesta farmacodinámica y los parámetros de evolución clínica |
| Variabilidad del método | Sin variabilidad del método |
| No facilita la elección del tratamiento farmacológico inicial | Puede facilitar la elección del tratamiento farmacológico inicial |
| Proporciona una lectura con valores continuos | Proporciona una lectura de «sí» o «no» |
| Ampliamente respaldado por los resultados de estudios observacionales | Respaldado por los resultados de estudios observacionales |
| Sin evidencia prospectiva de efecto beneficioso demostrado | Sin evidencia prospectiva de efecto beneficioso demostrado |
| Abordado en las guías | Abordado en las guías |
| No recomendado por la FDA como guía para el tratamiento | Recomendado por la FDA como posible guía para el tratamiento |
FDA: Food and Drug Administration.
Basándose en la enorme cantidad de datos observacionales acumulados, las recientes guías estadounidenses y europeas de 2011 han otorgado una recomendación de clase IIb para pacientes de alto riesgo a las PFP o la determinación del genotipo si existe la posibilidad de que los resultados de las pruebas lleven a una modificación del tratamiento del paciente (tabla 2)23–25. Sin embargo, en ensayos prospectivos y aleatorizados, el uso de las PFP no demostró beneficio clínico, lo cual pone en duda la utilidad de los actuales análisis de PFP en la modificación del tratamiento antiagregante plaquetario para influir en los resultados clínicos26–28.
Guías estadounidenses y europea para las pruebas de la función plaquetaria
| Guía para la intervención coronaria percutánea de 2011 de ACCF/AHA/SCAI23 |
| Clase IIb |
| 1. Puede considerarse el uso de PFT para pacientes con riesgo alto de mal resultado clínico (nivel de evidencia: C) |
| 2. Para pacientes tratados con clopidogrel que presentan alta reactividad plaquetaria, podría considerarse el uso de fármacos alternativos, como prasugrel o ticagrelor (nivel de evidencia: C) |
| Clase III: ausencia de beneficio |
| 1. No se recomienda el uso en la práctica clínica ordinaria de las PFP como examen de detección sistemática en los pacientes tratados con clopidogrel sometidos a ICP (nivel de evidencia: C) |
| Actualización de temas específicos en el tratamiento de pacientes con AI/IAMSEST de 2012 de ACCF/AHA24 |
| Clase IIb |
| 1. Puede considerarse el uso de PFP para determinar la respuesta inhibitoria plaquetaria de los pacientes con AI/IAMSEST (o después de SCA e ICP) tratados con un inhibidor del receptor P2Y12 si existe la posibilidad de que los resultados de las pruebas puedan llevar a una modificación del tratamiento (nivel de evidencia: B) |
| Guía de la ESC para el tratamiento del SCA en pacientes sin elevación persistente del segmento ST25 |
| Clase IIb |
| 1. Puede considerarse la determinación del genotipo y/o las PFP para pacientes seleccionados cuando se emplea clopidogrel (nivel de evidencia: B) |
| 2. No se aconseja el empleo sistemático de aumento de la dosis de mantenimiento de clopidogrel en función de los resultados de las PFP, pero puede considerarse su uso para pacientes seleccionados (nivel de evidencia: B) |
| 3. Cuando se considere apropiado disponer de un grado moderado de inhibición de P2Y12 en el momento de la operación, como ocurre con frecuencia poco después de un SCA en pacientes sometidos a CABG, puede interrumpirse la administración de los fármacos más cerca de la operación. En estas circunstancias, es razonable suspender la administración de clopidogrel 5 días antes de la cirugía, o menos, si un método validado de prueba de la función plaquetaria muestra mala respuesta al clopidogrel |
| 4. No puede recomendarse el uso clínico habitual de las PFP para pacientes con SCA tratados con clopidogrel |
ACCF: American College of Cardiology Foundation; AHA: American Heart Association; AI: angina inestable; CABG: cirugía de revascularización aortocoronaria; IAMSEST: infarto de miocardio sin elevación del ST; ICP: intervención coronaria percutánea; PFP: pruebas de la función plaquetaria; SCA: síndrome coronario agudo; SCAI: Society for Cardiovascular Angiography and Interventions.
En el ensayo GRAVITAS26, primer estudio a gran escala sobre el tratamiento antiagregante plaquetario personalizado en pacientes sometidos a ICP electiva, participaron pacientes con ARP a los que se asignó aleatoriamente a una dosis de carga adicional de 600 mg de clopidogrel administrada el día siguiente al implante del stent, seguida de un tratamiento con clopidogrel 150 mg/día (dosis alta) o 75 mg/día durante 6 meses. El tratamiento con clopidogrel a dosis alta no fue eficaz para reducir el objetivo combinado de los diversos eventos isquémicos y hubo una tasa de episodios inesperadamente baja (2,3%) en ambos grupos26. Las posibles explicaciones de que se observara ese efecto neutro son: a) efectividad subóptima del tratamiento con dosis altas de clopidogrel para superar la ARP29, pues las dosis altas de clopidogrel redujeron la prevalencia de ARP a los 30 días solo en un 60% de los pacientes, hipótesis respaldada por el ensayo ELEVATE-TIMI 5630, en el que fue necesaria una dosis de clopidogrel de hasta 225mg/día para superar la ARP; b) el valor de corte utilizado para definir la ARP puede haber sido demasiado alto; en un análisis de regresión de Cox con una covariable dependiente del tiempo para la reactividad plaquetaria durante el tratamiento en el ensayo GRAVITAS, las unidades de reacción de P2Y12 (PRU) > 208 fueron un factor independiente predictivo de la supervivencia libre de eventos a los 60 días (HR = 0,23; IC95%, 0,05-0,98; p = 0,047) y hubo una tendencia inversa a que fueran un factor predictivo independiente a los 6 meses (HR = 0,54; IC95%, 0,28-1,04; p = 0,06)31, y c) la mayoría de los pacientes incluidos en el ensayo GRAVITAS eran pacientes de bajo riesgo con enfermedad coronaria estable. Solo el tratamiento con un método muy eficaz para superar la ARP tendría la posibilidad de producir unos resultados positivos, dada la muy baja tasa de eventos. También es posible que la única prueba utilizada no haya reflejado de manera fiable el efecto del clopidogrel en la formación del coágulo inducida por ADP en todos los sujetos.
En el estudio TRIGGER-PCI llevado a cabo en pacientes estables sometidos a ICP electiva (excluido el infarto agudo de miocardio sin elevación del segmento ST o el infarto agudo de miocardio con elevación del segmento ST [IAMCEST]), se utilizó como valor de corte de ARP > 208 PRU. Se utilizó una dosis de prasugrel 10 mg/día en el grupo de tratamiento activo, que resultó muy eficaz para reducir la prevalencia de ARP; solo ∼ 6% de los pacientes presentaban ARP después de 90 días de tratamiento con prasugrel. Sin embargo, el estudio se interrumpió prematuramente por futilidad. Solo hubo un episodio del objetivo principal en los 236 pacientes que completaron 6 meses de seguimiento. Además, ∼ 30% de los pacientes incluidos rechazaron la inclusión en la asignación aleatoria después de que se hubiera identificado la presencia de ARP27.
Por último, en el estudio ARCTIC28 participaron 2.440 pacientes programados para implante de stent coronario, a los que se asignó aleatoriamente a una estrategia de monitorización de la función plaquetaria y ajuste de la medicación o una estrategia convencional sin monitorización. En el grupo de monitorización, un tercio de los pacientes tenían ARP (> 235 PRU) antes del implante de stent; el 80% de estos pacientes recibieron inmediatamente un tratamiento adicional de clopidogrel y el 2,3%, una dosis de carga de prasugrel. Al final del estudio, el 86% de los pacientes del grupo de estrategia convencional y el 80% del grupo de monitorización recibían tratamiento con clopidogrel, y solo el 6% del grupo de estrategia convencional y el 12% del grupo de monitorización recibían tratamiento con prasugrel. El objetivo combinado de muerte, infarto de miocardio, trombosis de stent, ictus o revascularización urgente en el plazo de 1 año no presentó diferencias entre el grupo de monitorización y el grupo de estrategia convencional (el 34,6 frente al 31,1%; HR = 1,13; IC95%, 0,98-1,29; p = 0,10). Los objetivos secundarios clave, es decir, trombosis de stent o cualquier revascularización de urgencia, y la tasa de eventos de hemorragia mayor no mostraron diferencias estadísticamente significativas entre los grupos28. En este ensayo, la prevalencia de pacientes con SCA fue baja (el 27% con SCA sin elevación del segmento ST y el 73% con enfermedad arterial coronaria estable); se excluyó del estudio a los pacientes con un riesgo muy alto de sufrir eventos aterotrombóticos tempranos, como por ejemplo los pacientes con IAMCEST. El prasugrel, que es una alternativa más eficaz para superar la ARP que el uso de dosis dobles de clopidogrel, se utilizó solo en ∼ 10% de los pacientes. Hubo el doble de pacientes perdidos para el seguimiento en el grupo de estrategia convencional que en el de monitorización (el 3,8 frente al 1,9%). Por último, la tasa de eventos en el ARCTIC se debió fundamentalmente a los infartos de miocardio periintervención, evaluados con un procedimiento posterior aplicando una metodología poco uniforme. El objetivo combinado de este estudio incluyó también otros eventos que pueden no estar relacionados con la función plaquetaria.
Aunque los resultados de estos tres ensayos aleatorizados fueron negativos, estudios de menor tamaño han señalado que el abordaje centrado en las PFP puede ser efectivo con una aplicación adecuada. En dos ensayos multicéntricos de pequeño tamaño, se utilizó el análisis VASP-P para individualizar la dosis de carga incremental de clopidogrel para reducir la reactividad plaquetaria durante el tratamiento por debajo de los valores de corte establecidos para la ARP. Esta estrategia se asoció a una significativa reducción posterior de la frecuencia de acontecimientos adversos, incluida la trombosis temprana del stent, sin que se incrementaran las hemorragias mayores o menores según los criterios TIMI (Thrombolysis In Myocardial Infarction)32,33. De igual modo, otros dos estudios han indicado que la administración selectiva de un inhibidor del receptor de la glucoproteína IIb/IIIa a pacientes sometidos a ICP electiva identificados como con mala respuesta al ácido acetilsalicílico o al clopidogrel fue eficaz para reducir los eventos isquémicos tras la ICP, tanto a los 30 días como a 1 año, sin que se produjera ningún aumento de las tasas de hemorragia34,35. Tiene interés señalar que todos estos estudios tuvieron como objetivo reducir la reactividad plaquetaria por debajo del umbral de ARP, que se asocia a eventos isquémicos tras la ICP.
En el reciente registro prospectivo multinacional ADAPT-DES36,37, se evaluó la reactividad plaquetaria en 8.583 pacientes (el 52% con SCA) después de una ICP realizada con éxito empleando los análisis en el punto de asistencia VerifyNow, y el objetivo principal fue la trombosis del stent definitiva o probable a 1 año. Este estudio reforzó la conclusión de que hay asociación independiente entre la ARP y la trombosis de stent definitiva o probable. En ese estudio, la ARP (> 208 PRU) mostró asociación independiente con la trombosis de stent definitiva o probable a los 30 días (HR = 3,0; p = 0,005), la trombosis de stent definitiva o probable (HR = 2,49; p = 0,001) y el infarto de miocardio a 1 año (HR = 1,42; p = 0,01), y la trombosis de stent definitiva o probable (HR ajustada = 1,84; p = 0,009) y el infarto de miocardio a 2 años (HR = 1,33; p = 0,01). Además, el valor > 208 PRU se asoció de manera independiente a una menor incidencia de hemorragia a 1 año (HR = 0,73; p = 0,002) y 2 años (HR = 0,82; p = 0,02). En estudios recientes se ha puesto de manifiesto que hay asociación entre la baja reactividad plaquetaria al ADP durante el tratamiento y un mayor riesgo de hemorragia36,37.
Aun siendo un importante factor determinante de la aparición de eventos trombóticos tras la ICP, la ARP no es el único factor causal de dichos eventos. En cambio, la ausencia de ARP es el mejor dato de que disponemos de momento para tranquilizar respecto a la baja probabilidad de eventos isquémicos futuros. Los valores de corte utilizados para la ARP que se describen en muchos estudios se asocian a un valor predictivo negativo elevado y un valor predictivo positivo bajo. Sin embargo, dada la baja prevalencia general de los eventos trombóticos en esos estudios, el valor predictivo positivo bajo y el valor predictivo negativo elevado son observaciones comprensibles. Se debe tener en cuenta otros factores, como los de carácter demográfico, clínico y angiográfico, para identificar de manera óptima a los pacientes que presentan el riesgo más elevado. En este sentido, algunos estudios recientes han señalado que la adición de variables clínicas y el genotipo a las determinaciones de la reactividad plaquetaria (un factor de riesgo combinado) puede mejorar la predicción del riesgo38,39.
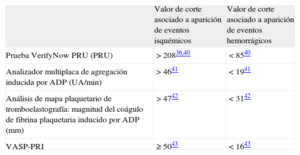
CONCEPTO DE VENTANA TERAPÉUTICAAdemás del umbral superior para la definición del riesgo de isquemia (es decir, la ARP), algunos pequeños estudios de investigación traslacional han puesto de manifiesto la relación entre baja reactividad plaquetaria y hemorragia. Se ha propuesto el concepto de «ventana terapéutica» de la reactividad del receptor P2Y12 asociada tanto a la frecuencia de eventos isquémicos (umbral superior) como al riesgo hemorrágico (umbral inferior). Se ha publicado un documento de consenso que resalta las observaciones mencionadas, con un concepto de ventana terapéutica que incluye un valor de corte actualizado para la ARP y la baja reactividad plaquetaria para el tratamiento inhibidor de P2Y12 (tabla 3)36,40–43. Este enfoque tiene más sentido cuando se realiza un ajuste individualizado de la dosis de los bloqueadores más potentes del receptor P2Y12, que se sabe asociados a aumento de la incidencia de hemorragias2.
Valor de corte de la reactividad plaquetaria asociado a los eventos isquémicos y hemorrágicos (ventana terapéutica)
| Valor de corte asociado a aparición de eventos isquémicos | Valor de corte asociado a aparición de eventos hemorrágicos | |
| Prueba VerifyNow PRU (PRU) | > 20836,40 | < 8540 |
| Analizador multiplaca de agregación inducida por ADP (UA/min) | > 4641 | < 1941 |
| Análisis de mapa plaquetario de tromboelastografía: magnitud del coágulo de fibrina plaquetaria inducido por ADP (mm) | > 4742 | < 3142 |
| VASP-PRI | ≥ 5043 | < 1643 |
ADP: adenosina difosfato; PRU: unidades de reacción de P2Y12; UA: unidades de agregación; VASP-PRI: fosfoproteína estimulada por vasodilatadores-índice de reactividad plaquetaria.
Se ha producido un aumento significativo del uso de clopidogrel genérico, de bajo coste. Sin embargo, se han planteado algunas preocupaciones importantes respecto a su adopción generalizada sin disponer de estudios rigurosos que demuestren la eficacia clínica y farmacodinámica y la seguridad del preparado. Además del estado de portador del alelo de CYP2C19 LoF, hay muchos factores epigenéticos, como las medicaciones concomitantes, que influyen en el metabolismo del clopidogrel y causan una respuesta antiagregante plaquetaria que puede influir en la eficacia clínica4. Según lo establecido en el proceso abreviado para solicitud de aprobación de un nuevo fármaco (Abbreviated New Drug Application) por la Food and Drug Administration, no son necesarios ensayos clínicos para demostrar la eficacia y la seguridad de las formulaciones genéricas, sino que las aprueban basándose en estudios pequeños (p. ej., solo se realizaron determinaciones farmacocinéticas periódicas tras una dosis única de 150 mg de clopidogrel en 32 h a 24 voluntarios sanos para la aprobación de una formulación de bisulfato de clopidogrel)44. Se han planteado algunas preocupaciones respecto al proceso de autorización adoptado por la Food and Drug Administration para la recomendación de las formulaciones genéricas de clopidogrel en Estados Unidos44. En un estudio reciente, en el que participaron más de 1.500 pacientes con SCA de Italia, la formulación genérica (clopidogrel base) comparada con Plavix® se asoció a mayor agregación plaquetaria inducida por ADP (diferencia media del 2-11%) y mayor prevalencia de ARP (el 42,4 frente al 25,4%; p < 0,0001)45. Sin embargo, otros estudios no han observado diferencias significativas entre diversas formulaciones genéricas y Plavix®. No obstante, estos estudios tienen limitaciones importantes: solo presentaron la diferencia de la agregación plaquetaria media, no hubo determinaciones de la generación de metabolito activo y, en la mayoría de los casos, solo se utilizó un método de laboratorio para evaluar la respuesta farmacodinámica46–49. Muy recientemente, en Estados Unidos se ha descrito un aumento de 3,2 veces en la tasa de trombosis de stent a los 30 días con el tratamiento de clopidogrel genérico en comparación con los datos históricos de 3 años respecto a Plavix® (el 0,38 [4 de 1.054] frente al 0,12% [17 de 14.432]; p = 0,050)50. Se ha descrito que algunas formulaciones de clopidogrel genérico contienen cloruro de metilo, que tiene propiedades genotóxicas conocidas51. Estas observaciones resaltaron la preocupación que una transición generalizada a clopidogrel genérico conlleva y exigen más precaución con la monitorización estricta de la respuesta al clopidogrel durante la adopción del clopidogrel genérico.
TRATAMIENTO BLOQUEADOR DEL RECEPTOR P2Y12 PARA PACIENTES CON INFARTO DE MIOCARDIO CON ELEVACIÓN DEL STSe acumulan datos que indican que la absorción del fármaco en los pacientes con SCA está deteriorada, en especial en los casos de pacientes con IAMCEST. Se ha demostrado un deterioro de la biodisponibilidad del clopidogrel en los pacientes con IAMCEST que da lugar a una inhibición plaquetaria subóptima en comparación con lo observado en los controles sanos52. En un reciente estudio prospectivo, a ciego simple, a 55 pacientes con IAMCEST sometidos a ICP se los asignó aleatoriamente a ticagrelor o prasugrel y se realizaron PFP seriadas53. Aunque la reactividad plaquetaria medida con el análisis VerifyNow fue alta en comparación con los estudios previos llevados a cabo en pacientes estables sin ICP al cabo de 1 h, no hubo diferencias significativas entre ticagrelor y prasugrel. Sin embargo, la ARP a las 2 h persistió en un porcentaje significativo de pacientes de ambos grupos y volvió a diferir de los resultados obtenidos en pacientes estables sin ICP que mostraron una frecuencia de ARP insignificante durante el tratamiento53. En otro estudio de 50 pacientes con IAMCEST sometidos a ICP primaria y en tratamiento con bivalirudina en monoterapia, se los asignó aleatoriamente a un tratamiento con dosis de carga de 60 mg de prasugrel o con dosis de carga de 180 mg de ticagrelor. Tanto el tratamiento con prasugrel como el de ticagrelor resultaron eficaces para inhibir la reactividad plaquetaria en solo ∼ 50% de los pacientes a las 2 h. Fueron necesarias como mínimo 4 h para alcanzar una inhibición plaquetaria efectiva en ∼ 80% de los pacientes. Tiene interés señalar que el uso de morfina se asoció a un retraso de la actividad de ambos fármacos54. Estos resultados en pacientes con IAMCEST dan que pensar, y serán necesarios futuros estudios más amplios para confirmarlos y determinar su trascendencia clínica. En un estudio posterior, a 24 voluntarios sanos se los asignó aleatoriamente a placebo o 5 mg de morfina intravenosa además de 600 mg de clopidogrel. En ese estudio, el uso de morfina se asoció a retraso en la absorción de clopidogrel y reducción de la cantidad de metabolito activo del clopidogrel, que se acompañó de un retraso en la inhibición plaquetaria máxima (de hasta 4 h)55.
TRATAMIENTO ANTIAGREGANTE PLAQUETARIO PERSONALIZADO EN EL PACIENTE QUIRÚRGICOLa principal justificación para la interrupción durante 5–7 días del tratamiento con el inhibidor del receptor P2Y12 que recomiendan las guías para los pacientes sometidos a cirugía de revascularización aortocoronaria fue permitir la recuperación de la función plaquetaria y evitar con ello un exceso de hemorragia perioperatoria56–59. Un estudio reciente ha puesto de manifiesto que los pacientes tratados con clopidogrel sometidos a una primera cirugía de revascularización aortocoronaria con bomba extracorpórea presentaron el mismo grado de hemorragia perioperatoria que los que no habían tomado clopidogrel cuando la cirugía de revascularización aortocoronaria se programó en función de la determinación preoperatoria de la reactividad plaquetaria. La reactividad plaquetaria preoperatoria se determinó mediante tromboelastografía con cartografía plaquetaria. La intervención quirúrgica de los pacientes tratados con clopidogrel se programó para 24 h tras la última dosis de clopidogrel en los pacientes con una amplitud máxima (MAADP) > 50 mm, para 3–5 días tras la última dosis en los que tenían una MAADP de 35–50 mm, y para 5 días tras la última dosis en los que presentaban una MAADP < 35 mm57. En la guía de 2012 de la Society of Thoracic Surgeons, se incluye una recomendación de clase IIa de realizar PFP a los pacientes tratados con clopidogrel para reducir el tiempo de espera (tabla 4)60.
Guía de la Society of Thoracic Surgeons de 2012 para las pruebas de la función plaquetaria en pacientes de cirugía cardiaca y no cardiaca60
| Opciones de tratamiento para pacientes tratados con antiagregantes plaquetarios que requieren cirugía de urgencia |
| Clase IIa |
| Para los pacientes con un tratamiento antiagregante plaquetario combinado doble, es razonable tomar la decisión de aplazar la operación basándose en las pruebas de inhibición plaquetaria más que en el uso arbitrario de un periodo de aplazamiento operatorio especificado (nivel de evidencia: B) |
| Monitorización de la función plaquetaria |
| Clase IIb |
| Dado su alto valor predictivo negativo, las pruebas preoperatorias en el lugar de asistencia para evaluar el riesgo hemorrágico pueden ser útiles para identificar a los pacientes con alta reactividad plaquetaria residual tras la dosis habitual de antiagregantes plaquetarios a los que se puede operar sin aumento del riesgo hemorrágico (nivel de evidencia: B) |
| Las pruebas en el lugar de asistencia para evaluar la función plaquetaria perioperatoria pueden ser útiles para reducir las transfusiones de sangre (nivel de evidencia: B) |
| Antiagregantes plaquetarios después de operaciones cardiacas |
| Clase IIb |
| Una vez se ha reducido el riesgo hemorrágico postoperatorio, cabría considerar el uso de pruebas de respuesta a los fármacos antiagregantes plaquetarios mediante análisis genético o pruebas de la función plaquetaria en el lugar de asistencia precozmente tras las operaciones cardiacas, para optimizar el efecto de la medicación antiagregante plaquetaria y reducir al mínimo el riesgo trombótico en los injertos venosos (nivel de evidencia: B) |
| Para pacientes con una reactividad plaquetaria alta después de la dosis habitual de clopidogrel, el paso a otro inhibidor de P2Y12 (p. ej., prasugrel o ticagrelor) puede ser útil |
Actualmente, la evidencia indica que la ARP y el estado de portador de CYP2C19 LoF se asocian claramente a peor resultado clínico en los pacientes de alto riesgo tratados con clopidogrel sometidos a ICP. Es preciso reconocer que los ensayos aleatorizados sobre el tratamiento antiagregante plaquetario personalizado tienen limitaciones importantes, como la inclusión de pacientes de bajo riesgo, que hizo que las tasas de eventos fueran bajas (con lo que los estudios tuvieron una potencia estadística insuficiente), y el uso de dosis altas de clopidogrel, que no es una estrategia óptima para superar la ARP y mejorar los resultados clínicos. En consecuencia, los resultados de estos ensayos aleatorizados no deben usarse para rechazar la utilidad de las PFP o las estrategias de tratamiento antiagregante plaquetario personalizado.
Los datos de los ensayos TRITON-TIMI 38 y PLATO indican claramente que el prasugrel y el ticagrelor son alternativas eficaces al clopidogrel que superan la influencia del estado de portador del alelo LoF. Los estudios farmacodinámicos ponen de manifiesto que el prasugrel y el ticagrelor son eficaces para superar la ARP durante el tratamiento con clopidogrel41,42. En consecuencia, una estrategia razonable es evaluar la función plaquetaria de los pacientes de alto riesgo tratados con clopidogrel (p. ej., pacientes con un SCA actual o previo, antecedentes de trombosis de stent y revascularización del vaso diana, mala función ventricular izquierda, implante de stents en múltiples vasos, anatomía compleja —stents en bifurcación, vasos largos o finos—, índice de masa corporal alto y diabetes mellitus y pacientes tratados simultáneamente con inhibidores de la bomba de protones) y utilizar un tratamiento más potente contra el receptor P2Y12 de manera selectiva para pacientes con ARP. Además, el tratamiento sin selección utilizando los nuevos bloqueadores del receptor P2Y12 se asocia a un aumento de la hemorragia. Mediante la personalización del tratamiento, los clínicos pueden identificar el fármaco antiagregante plaquetario que alcance el nivel de reactividad plaquetaria óptimo para el paciente, con independencia del coste. Si el clopidogrel genérico es realmente efectivo farmacodinámicamente para pacientes concretos, ofrecerles esta opción de menor coste parece favorable tanto desde el punto de vista de coste como por lo que respecta a la eficacia.
Por último, es probable que estudios futuros pongan de manifiesto la ausencia de inferioridad del uso selectivo del clopidogrel genérico y los nuevos inhibidores de P2Y12. Sin embargo, las bajas tasas de eventos en la práctica clínica actual requerirían la inclusión de un número de pacientes muy elevado, y las perspectivas de encontrar financiación para este tipo de proyectos no parecen prometedoras. Por consiguiente, debemos basarnos en lo indicado en las guías y en los datos observacionales existentes y, al mismo tiempo, tener muy en cuenta el papel que desempeña la fisiología plaquetaria en la aparición de eventos clínicos catastróficos en los pacientes tratados con ICP.
CONFLICTO DE INTERESESEl Dr. Gurbel ha sido consultor de Daiichi Sankyo, Eli-Lilly, Bayer, AstraZeneca, Accumetrics, Nanosphere, Sanofi-Aventis, Merck, Medtronic, CSL y Haemonetics; ha recibido o tiene pendiente recibir subvenciones de los National Institutes of Health, Daiichi Sankyo, Eli-Lilly, CSL, AstraZeneca, Haemonetics, Medtronic, Harvard Clinical Research Institute y Duke Clinical Research Institute y ha dado conferencias o ha formado parte de paneles de conferenciantes de Eli-Lilly, Daiichi Sankyo, Nanosphere, Sanofi-Aventis, Merck e Iverson Genetics. El Dr. Gurbel posee acciones u opciones de compra de acciones de Merck, Medtronic y Pfizer y es titular de patentes en el campo del tratamiento antiagregante plaquetario personalizado y la cardiología intervencionista.
Sección patrocinada por AstraZeneca