En pacientes con insuficiencia cardiaca, fracción de eyección del ventrículo izquierdo ≤35% y ritmo sinusal, en ausencia de fibrilación auricular, trombos intracavitarios o tromboembolia previa, la indicación de anticoagulación es controvertida. Nuestro objetivo es evaluar la actitud actual respecto de la anticoagulación en estos pacientes, variables asociadas a su utilización y su efecto en diversos eventos cardiovasculares.
MétodosDe los pacientes con fracción de eyección del ventrículo izquierdo ≤ 35% y ritmo sinusal sin otra indicación de anticoagulación incluidos en el registro REDINSCOR (pertenecientes a 18 centros españoles), se comparó a los que recibían este tratamiento frente al resto.
ResultadosEntre 2007 y 2010 se incluyeron 2.263 pacientes; 902 tenían fracción de eyección del ventrículo izquierdo ≤35% y ritmo sinusal. De ellos, 237 (26%) recibían anticoagulación. Las variables asociadas a su utilización fueron menor fracción de eyección del ventrículo izquierdo, etiología no isquémica, clase funcional avanzada, mayor anchura del QRS, mayor diámetro auricular izquierdo y hospital prescriptor del tratamiento anticoagulante. Tras una mediana de seguimiento de 21 (11-32) meses, no se observaron diferencias significativas en mortalidad (14 frente a 12,5%) ni ictus (0,8 frente a 0,9%). El análisis multivariado ajustado por propensity score mostró una reducción en la combinación de mortalidad cardiaca, trasplante cardiaco, revascularización coronaria e ingresos cardiovasculares (hazard ratio = 0,74; intervalo de confianza del 95%, 0,56-0,97; p=0,03) en el grupo anticoagulado. No se recogió información sobre episodios hemorrágicos en el seguimiento.
ConclusionesEn una serie amplia y contemporánea de pacientes de nuestro medio con insuficiencia cardiaca, fracción de eyección del ventrículo izquierdo ≤35% y ritmo sinusal, un 26% recibían anticoagulación. Ello no se asoció a menor mortalidad ni incidencia de ictus aunque se observó una reducción de una combinación de eventos cardiacos mayores.
Palabras clave
En la insuficiencia cardiaca (IC) con disfunción sistólica del ventrículo izquierdo, hay un incremento del riesgo de eventos tromboembólicos (EvTE), con una incidencia anual del 1-4%1, que contribuye al elevado número de ingresos hospitalarios y a la morbimortalidad de estos pacientes. Algunos autores han señalado la presencia de un estado de hipercoagulabilidad, mediado por un incremento de la activación plaquetaria y marcadores de coagulación, como dímero-D, beta tromboglobulina y complejos trombina-antitrombina III, al que se suma la estasis debida a la disminución del flujo sanguíneo intraventricular que presentan estos pacientes2.
El tratamiento anticoagulante oral (ACO) sólo está indicado en las guías de práctica clínica actuales en pacientes con IC sistólica que además presentan fibrilación auricular, trombos intracavitarios o historia reciente de tromboembolia3.
Es posible que el beneficio del ACO observado en estos pacientes pudiera extenderse a otros subgrupos, como los pacientes con IC y baja fracción de eyección del ventrículo izquierdo (FEVI) en ritmo sinusal (RS). La mayoría de las publicaciones sobre esta estrategia reflejan subestudios post-hoc de ensayos clínicos que analizaron poblaciones de pacientes con IC sistólica, que incluían subgrupos con riesgo tromboembólico aumentado, como fibrilación auricular o prótesis valvulares, por lo que es difícil extraer conclusiones sobre el posible beneficio del ACO en pacientes con IC en RS4, 5, 6. Los escasos ensayos clínicos aleatorizados disponibles adolecen de un tamaño muestral insuficiente, y en algún caso han sido detenidos en forma temprana7, 8, 9. No se conoce si las variables asociadas a incidencia de EvTE en pacientes con fibrilación auricular (recogidas en el acrónimo CHA2DS2-VASc) también predisponen a dichos eventos en pacientes con IC en RS, aunque parece que estas mismas variables pueden asociarse a la incidencia de ictus incluso en pacientes sin fibrilación auricular10.
Entre los inconvenientes que han limitado el uso de la anticoagulación clásica con dicumarínicos figuran el riesgo hemorrágico, las interacciones medicamentosas y la necesidad de monitorización estrecha de la razón internacional normalizada (INR), que, posiblemente en el futuro próximo, los anticoagulantes de nueva generación superarán11, 12, 13.
Por las razones expuestas, la indicación rutinaria de ACO a todo paciente con disfunción ventricular izquierda en RS es controvertida14, sin que por el momento existan unas directrices claras. En las guías de práctica clínica vigentes en la actualidad3 no se menciona esta indicación.
Nuestro objetivo es evaluar la actitud respecto del tratamiento con ACO en una serie amplia y contemporánea de pacientes con IC, FEVI ≤ 35% y RS, determinar las variables asociadas a su indicación, y valorar su efecto sobre mortalidad y otros sucesos cardiovasculares.
MétodosPoblaciónSe realizó un análisis del registro REDINSCOR (Red de Investigación en Insuficiencia Cardiaca), que agrupa 18 centros pertenecientes a 7 comunidades autónomas españolas y recoge múltiples variables analíticas, electrocardiográficas, ecocardiográficas y terapéuticas, obtenidas en forma basal y en el seguimiento. Es un estudio de cohorte, prospectivo, que incluye a pacientes mayores de 18 años con IC sintomática (clase funcional [CF] II-IV de la New York Heart Association [NYHA]), que hayan estado hospitalizados durante 24 h en los 12 meses previos a su inclusión, y que presenten alguna de las siguientes alteraciones ecocardiográficas: FEVI <40%, diámetro telediastólico >60mm, grosor del septum y/o pared posterior >14mm, o alteraciones de la relajación ventricular. La base de datos está disponible en internet (www.redinscor.org), y dispone de un módulo de gestión con estadísticas online y un generador de informes. Su estructura organizativa comprende una unidad de información (constituida por un epidemiólogo y un estadístico, que diseñan y mantienen la base de datos, controlan la calidad de los datos, valores extremos, incoherencias internas y veracidad de la información), un comité de mortalidad y cierre de casos (analiza casos de fallecimiento catalogando tipos de muerte y conflictos respecto al cierre de casos y pérdidas de seguimiento), y un comité científico15. El seguimiento de los pacientes se realiza en la consulta de cardiología de los hospitales participantes.
Para este estudio, se seleccionaron los pacientes con FEVI ≤ 35% y RS, sin otras indicaciones de ACO, como antecedentes de tromboembolia pulmonar, prótesis valvulares, trombos intracavitarios, u otros fenómenos tromboembólicos. Dentro de este grupo se comparó a los pacientes que recibían ACO (grupo I) frente a los que no (grupo II).
Eventos consideradosSe establecieron las siguientes variables de desenlace:
• Mortalidad total.
• Evento combinado de mortalidad cardiaca y trasplante cardiaco (TC).
• Ingresos por IC.
• Revascularización coronaria.
• Ictus.
• Evento combinado de mortalidad cardiaca, TC, revascularización coronaria e ingresos de causa cardiovascular.
• Muerte súbita e ictus.
Si bien las variables de desenlace combinadas no estaban incluidas en el registro REDINSCOR en el momento de recogida de los datos, sí se predefinieron para nuestro estudio.
Análisis estadísticoLas variables continuas con distribución normal se describieron como media ± desviación o, en caso contrario, mediana (intervalo). Las variables dicotómicas se expresaron como porcentajes. Las características de ambos grupos se compararon utilizando el test de la t de Student para variables continuas y el de la χ2 para categóricas. Las variables continuas que no presentaban distribución normal se compararon con la prueba de la U de Mann-Whitney.
Por asimilación a lo establecido para las indicaciones de ACO en la fibrilación auricular, se calculó el score de CHA2DS2-VASC para cada grupo según las características basales de cada paciente16.
Dada la naturaleza no aleatorizada del estudio, y los múltiples factores que pueden influir en que cada paciente recibiese un tipo de tratamiento, se realizó un análisis de propensity score17 mediante una regresión logística para la utilización de ACO, que se realizó en función de 33 variables con el objetivo de eliminar diferencias en las características basales de los pacientes que pudieran afectar su comparación en relación a los eventos. Para la creación del propensity score se utilizaron variables que tuvieran menos del 10% de missings (valores ausentes en la base de datos), por lo que no se pudo utilizar la fracción aminoterminal del péptido natriurético cerebral (NT-proBNP) ni el diámetro auricular izquierdo. El área bajo la curva fue de 0,75 (0,71-0,78); p<0,0001. Las variables incluidas en el propensity score fueron: etiología isquémica diabetes mellitus, hipertensión arterial, infarto de miocardio previo, revascularización, CF de la NYHA, duración del QRS, FEVI, sexo, tabaquismo, dislipemia, hemoglobina, tasa de filtrado glomerular, edad, presión arterial sistólica, presión arterial diastólica, IC descompensada, inhibidores de la enzima de conversión del receptor de la angiotensina II, antagonistas de la angiotensina, bloqueadores beta, antagonistas del calcio, estatinas, antidiabéticos, diuréticos de asa, diuréticos tiazídicos, antialdosterónicos, inotrópicos orales, inotrópicos intravenosos, antiarrítmicos, nitratos, hidralazina, hierro y hospital prescriptor del tratamiento con ACO.
Para establecer la asociación entre la utilización de ACO y eventos se realizó un análisis multivariable con regresión de riesgos proporcionales de Cox. Todos los modelos se ajustaron por la covariable propensity score excepto para el evento «ictus», debido al escaso número de eventos.
Las curvas de supervivencia se analizaron y representaron utilizando la regresión de riesgos proporcionales de Cox ajustada por propensity score y se compararon con la hazard ratio (HR) (intervalo de confianza del 95% [IC95%], valor de p). Además se evaluó el supuesto de proporcionalidad de los modelos de Cox.
Por último, se realizaron modelos de riesgos proporcionales de Cox ajustados por la covariable propensity score con interacciones de variables que caracterizaban subgrupos, para determinar si estas variables eran factores de modificación de la asociación entre la utilización de ACO y los diferentes eventos. Para ello se valoró la interacción del tratamiento con la FEVI como variable continua y los siguientes subgrupos:
• FEVI ≥20% frente a FEVI <20%.
• NYHA CF II frente a III-IV.
• Etiología isquémica frente a no isquémica.
Este análisis se repitió para cada evento estudiado, excepto para los eventos «procedimientos de revascularización coronaria» e «ictus», en los que no se valoraron interacciones debido al bajo número de eventos.
El nivel de significación estadística se fijó en un valor de p<0,05. Para el análisis estadístico se utilizó SPSS versión 17.
ResultadosEntre 2007 y 2010, se incluyó a 2.263 pacientes en el registro REDINSCOR, de los que 902 tenían una FEVI ≤35% y estaban en RS. De ellos, 237 pacientes (26%) recibían ACO (grupo I); 153 pacientes recibían ACO solamente y 84 ACO+tratamiento antiagregante. La Tabla 1 muestra el porcentaje de ACO prescripto en cada hospital. Las características globales y la comparación entre ambos grupos se pueden observar en la Tabla 2. Antes del ajuste con propensity score, los pacientes que recibían ACO tenían menor FEVI, menor frecuencia de etiología isquémica, CF más avanzada, mayor anchura del QRS y mayor diámetro auricular izquierdo. La prevalencia de hipertensión arterial, diabetes y score CHA2DS2VASC fueron menores en el grupo I. El porcentaje de ACO era diferente en los distintos hospitales participantes del registro (p<0,001). No hubo diferencias significativas entre ambos grupos en el tratamiento estándar de la IC ni en las concentraciones de NT-proBNP.
Tabla 1. Tratamiento anticoagulante en cada hospital
| Hospital | n (%) |
| Hospital Universitario Puerta de Hierro | 41 (52) |
| Hospital Universitari Joan XXIII | 9 (18) |
| Hospital Clínic de Barcelona | 29 (32) |
| Hospital de la Santa Creu i Sant Pau | 23 (36) |
| Hospital Clínico Universitario de Santiago | 7 (15) |
| Hospital Clínico San Carlos | 13 (30) |
| Hospital 12 de Octubre | 21 (39) |
| Hospital Universitario Virgen de la Arrixaca | 6 (12) |
| Hospital Universitario Nuestra Señora de Valme | 18 (17) |
| Hospital Universitari Arnau de Vilanova | 7 (23) |
| Hospital Universitario La Fe | 14 (33) |
| Hospital Universitario Virgen Macarena | 3 (30) |
| Hospital de Guadarrama | 1 (50) |
| Hospital Universitario Son Dureta | 20 (26) |
| Hospital Francesc de Borja | 3 (19) |
| Hospital Municipal de Badalona | 3 (43) |
| Hospital General Universitario Morales Meseguer | 0 (0) |
| Hospital Universitario Puerta del Mar | 19 (16) |
p<0,001. p después del ajuste por propensity score: 1.
Tabla 2. Características basales y diferenciales entre ambos grupos
| Total (n=902) | Grupo I (ACO) (n=237) | Grupo II (n=665) | p | Tras ajuste por propensity score, p | |
| Sexo masculino | 689 (76,3) | 178 (75) | 511 (77) | 0,500 | 0,999 |
| Edad (años) | 64,5±12,5 | 63,7±13 | 65±12,5 | 0,174 | 0,998 |
| Hipertensión arterial | 559 (61,9) | 134 (57) | 425 (64,4) | 0,050 | 0,995 |
| Diabetes | 364 (40,3) | 78 (33) | 286 (43) | 0,007 | 0,994 |
| Etiología isquémica | 483 (53,5) | 109 (46) | 374 (56) | 0,007 | 0,991 |
| Revascularización previa | 328 (36,3) | 72 (30,5) | 256 (38,6) | 0,026 | 0,996 |
| Infarto previo | 473 (52,4) | 91 (39) | 382 (42,9) | 0,140 | 0,997 |
| CF III-IV NYHA | 505 (55,9) | 147 (62) | 358 (53,6) | 0,025 | 0,994 |
| FEVI (%) | 26,3±6 | 25,6±6,4 | 26,6±6 | 0,020 | 0,995 |
| Diámetro AI (mm) | 46±7 | 47,3±7 | 45,3±7 | 0,001 | - |
| NT-proBNP (pmol/l) | 197 (79-485) | 199 (77-529) | 195 (80-463) | 0,900 | - |
| Duración del QRS (ms) | 125,4±33 | 129,6±32 | 124±33,4 | 0,020 | 0,994 |
| Filtrado glomerular (ml/min/1,73 m2) | 60,7±22,5 | 69,4±24,3 | 72±26,4 | 0,200 | 0,996 |
| Bloqueadores beta | 781 (86,5) | 206 (86,9) | 575 (86,7) | 0,940 | 1,000 |
| IECA/ARA II | 631 (69,9)/157(17,4) | 172 (73)/33 (14) | 459 (69)/124 (19) | 0,330/0,096 | 0,998/0,999 |
| Antialdosterónicos | 574 (63,6) | 161 (67,9) | 413 (62,2) | 0,115 | 0,996 |
| CHAD2DS2VASC | 3,5±1,5 | 3,3±1,6 | 3,6±1,4 | 0,020 |
ACO: anticoagulante oral; AI: aurícula izquierda; ARA II: antagonistas de los receptores de angiotensina II; CF: clase funcional; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; NYHA: New York Heart Association.
Los datos se expresan como n (%) o media ± desviación estándar (percentiles 25-75).
Después del ajuste, las características basales de ambos grupos quedaron equilibradas, excepto para el diámetro auricular izquierdo y el NT-proBNP, no incluidas en el propensity score.
La mediana de seguimiento fue de 21,1 (11,4-32,2) meses. La Tabla 3 muestra los resultados. Ocurrieron 116 (12,8%) muertes totales, 120 eventos (13,3%) de la combinación «mortalidad cardiaca y TC», 167 (18,5%) ingresos por IC, 27 (3%) procedimientos de revascularización coronaria, 8 (0,9%) ictus, 337 eventos (37,4%) de la variable de desenlace «mortalidad cardiaca, TC, revascularización coronaria e ingresos de causa cardiovascular» y 32 (3,5%) de «muerte súbita e ictus».
Tabla 3. Eventos totales y de cada grupo: resultados del análisis univariable y multivariable
| Total (n=902) | Grupo I (ACO) (n=237) | Grupo II (n=665) | p | Análisis multivariado ajustado por la covariable propensity scoreHR (IC95%); p | |
| Mortalidad total | 116 (12,8%) | 33 (14%) | 83 (12,5%) | 0,56 | 0,91 (0,59-1,42); 0,69 |
| Mortalidad cardiaca y TC | 120 (13,3%) | 33 (13,9%) | 87 (13,1%) | 0,74 | 0,76 (0,49-1,18); 0,21 |
| Ingresos por IC | 167 (18,5%) | 44 (18,6%) | 123 (18,5%) | 0,98 | 0,98 (0,67-1,44); 0,93 |
| Revascularización coronaria | 27 (3%) | 3 (1,3%) | 24 (3,6%) | 0,07 | 0,43 (0,12-1,52); 0,19 |
| Ictus | 8 (0,9%) | 2 (0,8%) | 6 (0,9%) | 1 | 0,90 (0,18-4,45); 0,90 * |
| Mortalidad cardiaca, TC, revascularización coronaria e ingresos de causa cardiovascular | 337 (37,4%) | 87 (36,7%) | 250 (37,6%) | 0,81 | 0,74 (0,56-0,97); 0,03 |
| Muerte súbita e ictus | 32 (3,5%) | 6 (2,5%) | 26 (3,9%) | 0,32 | 0,60 (0,23-1,53); 0,28 |
ACO: anticoagulante oral; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; TC: trasplante cardiaco.
* No ajustado por la variable propensity score debido al bajo número de eventos.
En el análisis univariable, no se observaron diferencias significativas entre ambos grupos. El análisis de regresión logística multivariable ajustado por propensity score mostró una reducción del evento combinado de «mortalidad cardiaca, TC, revascularización coronaria e ingreso de causa cardiovascular» (HR = 0,74; IC95%, 0,56-0,97; p=0,03). No se observó asociación entre la variable ACO y el resto de los eventos analizados.
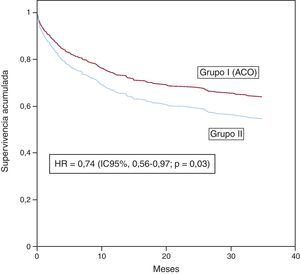
La Figura 1 muestra la curva de supervivencia libre de evento combinado: «mortalidad cardiaca, TC, revascularización coronaria e ingresos de causa cardiovascular».
Figura 1. Análisis multivariable ajustado por la covariable propensity score para el evento combinado de mortalidad cardiaca, trasplante cardiaco, revascularización coronaria e ingresos de causa cardiovascular. Se observa que el tratamiento angicoagulante oral redujo dicho evento con una hazard ratio de 0,74 (intervalo de confianza del 95%, 0,56-0,97); p = 0,03. ACO: anticoagulante oral; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
En cuanto al análisis preespecificado de subgrupos ajustado también por propensity score (Tabla 4), se observó que la anticoagulación se asoció a una reducción de «muerte cardiaca y TC» en los pacientes de etiología isquémica (HR = 0,47; IC95%, 0,25-0,90; p=0,02). Para el resto de posibles factores modificadores analizados la asociación entre el uso de ACO y los diferentes eventos estudiados fue homogénea. Tampoco se observaron interacciones estadísticamente significativas cuando se analizó la FEVI como variable continua. No se realizó el análisis de factores modificadores para revascularización coronaria ni ictus debido al bajo número de eventos.
Tabla 4. Análisis de interacciones de subgrupos («efecto del tratamiento anticoagulante en el análisis de subgrupos»)
| FEVI como variable continuaHR (IC95%) | p * | FEVI <20%HR (IC95%) | Eventos | p * | CF III-IVHR (IC95%) | Eventos | p * | Etiología isquémicaHR (IC95%) | Eventos | p * | |
| Mortalidad total | 0,91 (0,58-1,42) | 0,86 | 1,40 (0,64-3,06) | 28 | 0,20 | 0,77 (0,46-1,28) | 88 | 0,18 | 0,72 (0,40-1,30) | 70 | 0,20 |
| Mortalidad cardiaca y TC | 0,71 (0,44-1,14) | 0,44 | 0,99 (0,49-2,02) | 39 | 0,31 | 0,61 (0,36-1,00) | 93 | 0,06 | 0,47 (0,25-0,90) | 70 | 0,02 |
| Ingresos por IC | 0,98 (0,67-1,44) | 0,61 | 1,35 (0,60-3,04) | 29 | 0,39 | 0,98 (0,63-1,53) | 115 | 0,96 | 0,85 (0,51-1,43) | 96 | 0,41 |
| Mortalidad cardiaca, TC, revascularización coronaria e ingresos de causa cardiovascular | 0,73 (0,55-0,96) | 0,55 | 0,98 (0,59-1,63) | 79 | 0,20 | 0,72 (0,52-0,99) | 221 | 0,83 | 0,60 (0,42-0,87) | 196 | 0,10 |
| Muerte súbita e ictus | 0,64 (0,24-1,69) | 0,70 | 1,06 (0,25-4,48) | 9 | 0,33 | 0,25 (0,06-1,12) | 20 | 0,05 | 0,71 (0,23-2,22) | 20 | 0,61 |
CF: clase funcional; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; TC: trasplante cardiaco.
* Evaluación de la interacción en los siguientes subgrupos: FEVI <20 frente a ≥20%; CF III-IV frente a II; etiología isquémica frente a no isquémica.
Nuestro estudio incluye una serie amplia y actual de pacientes con IC adecuadamente tratados según las guías de práctica clínica3 pertenecientes a una red de investigación en IC. Se incluyó a los pacientes entre 2007 y 2010 desde 18 servicios de cardiología de centros de nivel terciario y secundario, pertenecientes a 7 comunidades autónomas españolas, por lo que creemos reflejan razonablemente la práctica clínica actual de los cardiólogos de nuestro medio. Con una mediana de seguimiento de 21 meses, la mortalidad total del 12,8% puede parecer una cifra relativamente baja, teniendo en cuenta las características de esta población, con FEVI media del 26%, 54% de etiología isquémica, y 56% de CF III-IV de la NYHA. Debido a la buena calidad de los datos (cumplimentados en >95% de las variables clínicas y de seguimiento) y a la realización de al menos un seguimiento cada 6 meses, es poco probable que no se hayan registrado eventos significativos. Una posible explicación para esta baja incidencia en la mortalidad puede estar en la media de edad, que era de 64,5 años, es decir, que se trata de una población jóven, y en la elevada proporción de pacientes que recibían tratamiento según las evidencias actuales3 (Tabla 1).
En nuestra serie hemos constatado que un 26% de los pacientes con IC y FEVI ≤35% en RS, sin otros factores de riesgo embólico, fueron anticoagulados por sus cardiólogos. Esta tasa de anticoagulación es similar a la del 28% comunicada tanto en el estudio SAVE6(Survival and Ventricular Enlargement) como en un análisis del estudio SCD-HeFT18(Sudden Cardiac Death-Heart Failure Trial), y al 29% del subestudio del ensayo BEST19(Beta Blocker Evaluation of Survival Trial) y supera a las de los ensayos SOLVD4(Studies of Left Ventricular Dysfunction) (9%), V-HeFT 1 (19%) y V-HeFT 2 (21%)5. Sin embargo, el porcentaje de ACO difirió en los distintos hospitales participantes del registro, entre el 12 y el 52%. Si bien desconocemos las razones, esto evidencia diferentes criterios a la hora de anticoagular a los pacientes. Entre los factores que se asociaron al empleo de ACO en nuestro estudio figuran una CF más avanzada, mayor anchura del QRS y mayor dilatación auricular izquierda, que reflejan un estadio más avanzado de la enfermedad, mayor dilatación de cavidades y mayor estasis sanguínea. En nuestra serie, los pacientes que recibían ACO tenían con menor frecuencia etiología isquémica y menor historia de revascularizaciones e infarto agudo de miocardio previo, quizás debido a la sistemática utilización de antiagregación plaquetaria con ácido acetilsalicílico-clopidogrel durante un año después del evento. Por otro lado, entre las características que se asociaron al uso de ACO en nuestra serie figuran menor FEVI, y un menor porcentaje de diabetes e hipertensión arterial, hallazgos similares a los del aludido subestudio BEST19.
Llama la atención el hecho de que, al revisar la puntuación del baremo CHA2DS2VASC, al contrario de lo esperable, los pacientes anticoagulados tenían una menor puntuación. Este hecho es preocupante, ya que parece que los factores componentes de este baremo aumentan el riesgo de ictus isquémico tanto mediado por la fibrilación auricular como por otros factores presentes en la población general10 y ello aconsejaría la indicación de ACO. La cuestión sólo podrá clarificarse con datos derivados de series amplias de pacientes con IC sistólica en RS y seguimientos prolongados. Si estos factores se confirman como predictores de EvTE en población sin fibrilación auricular, sería necesario un cambio radical en la tendencia observada en la práctica cardiológica actual.
Para el estudio de eventos surgidos en el seguimiento, dado el carácter no aleatorizado del estudio y con el objetivo de hacer comparables los dos grupos, se utilizó el análisis multivariable de regresión logística, introduciendo como covariable de ajuste el propensity score17. Esto ha permitido que las características basales se equilibren de forma estadística y se reduzca la influencia de otras variables diferentes del propio ACO. El porcentaje de ACO de cada centro fue una de las variables que más mejoró la capacidad de ajuste del propensity score, evidenciado por un aumento del área bajo la curva al introducir esta variable, que mostró una capacidad de discriminación en algunos casos superior a la de ciertas variables clínicas.
Tras este análisis, la anticoagulación no se asoció a menores mortalidad e ictus, aunque se observó una reducción en la combinación de «mortalidad cardiaca, TC, revascularización coronaria e ingresos cardiovasculares». Tampoco hubo diferencias en el resto de los eventos analizados.
En el análisis preespecificado de subgrupos, observamos que el tratamiento con ACO se asoció a una reducción de «mortalidad cardiaca y TC» en los pacientes con cardiopatía isquémica lo que, de confirmarse en estudios aleatorizados con seguimientos prolongados, podría ser útil en la toma práctica de decisiones para el paciente individual.
En nuestra serie no encontramos influencia de la FEVI en un posible efecto beneficioso del tratamiento con ACO. Por contraste, en el estudio SAVE6 se observó que el riesgo de ictus aumentaba a medida que la FEVI disminuía (4,1% con FEVI >35%; 7,8% con FEVI entre 29-35%, y 8,9% con FEVI <28% y, a menor FEVI, mayor beneficio del ACO.
Cabe destacar que en nuestro estudio la tasa de accidente cerebrovascular ha sido baja, del 0,9% y sin diferencias significativas entre ambos grupos. De manera que, si la única razón para la utilización de ACO es la reducción de ictus, parece extremadamente difícil reducir aún más una incidencia tan baja. De hecho, los primeros ensayos realizados en la década de los cincuenta20, 21 que valoraron este aspecto y mostraron beneficios, lo han hecho en determinadas poblaciones de pacientes con IC, en general con fibrilación auricular y enfermedad cardiaca reumática, en los que la incidencia de EvTE es superior.
La evidencia más reciente es controvertida y se basa en subanálisis post hoc de ensayos aleatorizados y en tres pequeños ensayos aleatorizados (Tabla 5).
Tabla 5. Resumen de la evidencia disponible sobre tratamiento anticoagulante en insuficiencia cardiaca
| Estudio | Año | Diseño | N | Población | Etiología isquémica | Seguimiento | Tratamiento | Puntos finales | Resultados | Sangrado | Comentarios |
| Subestudio SOLVD 4 | 1998 | Observacional retrospectivo | 6.378 | IC con FA (24%), ictus (19%), TEV (2,1%) | 70% | 39 meses | Warfarina (9%), AAS | Muerte | HR = 0,76; IC95%, 0,65-0,89 | No comunicada | Más pacientes del grupo warfarina tenían FA (19,3 frente a 4,5%) y enfermedad cerebrovascular (13,8 frente a 5,5%) |
| Muerte o ingresos por IC | HR = 0,82; IC95%, 0,72–0,93 | ||||||||||
| Muerte cardiovascular | HR = 0,72; IC95%, 0,61-0,86 | ||||||||||
| SubestudioV HeFT 1 5 | 1993 | Observacional retrospectivo | 642 | IC con FA (16%), prótesis valvulares | 44,2% | 27 meses | Warfarina (19%), AAS | EvTE | Neutro: (2.9/100 pacientes/año frente a 2,7/100 pacientes/año; p=NS) | No comunicada | Más EvTE en pacientes con FA y válvulas protésicas |
| SubestudioV HeFT 2 5 | 1993 | Observacional retrospectivo | 804 | IC con FA (15%), prótesis valvulares | 53% | 30 meses | Warfarina (21%), AAS | EvTE | Reducción de EvTE con warfarina (4,9/100 pacientes/año frente a 2,1/100 pacientes/año); p=0,01 | No comunicada | Más EvTE en pacientes con FA y válvulas protésicas |
| SubestudioSAVE 6 | 1997 | Observacional retrospectivo | 2.231 | IC con FA (10%), prótesis valvulares | No comunicada | 41 meses | Warfarina (28%) | Ictus | FEVI 28%; RR 0,17; p=0,001FEVI 29-35%; RR, 0,14; p=0,001FEVI > 35%; RR, 0,23; p=0,001 | No comunicada | Más EvTE en pacientes con FA y válvulas protésicas |
| SubestudioBEST 19 | 2011 | Observacional | 2.708 | IC en RS sin indicación de ACO | 56,5% | 25 meses | Warfarina (29%) | Mortalidad total | HR = 0,86 (IC95%, 0,62-1,19) | No comunicada | |
| Mortalidad cardiovascular | HR = 0,97 (IC95%, 0,68-1,38) | ||||||||||
| Hospitalizaciones por IC | HR = 1,09 (IC95%, 0,82-1,44) | ||||||||||
| WASH 7 | 2004 | Aleatorizado, abierto | 279 | IC en RS sin indicación de ACO | 60% | 27 meses | Warfarina, AAS o control | Combinación de muerte, infarto o ictus | 26% en warfarina y en control; p=NS | 5 H mayores con warfarina.17 frente a 5% H menores; p=0,03 | Detenido precozmente por bajo reclutamiento |
| WATCH8 | 2009 | Aleatorizado | 1.587 | IC en RS sin indicación de ACO | 70% | 23 meses | Warfarina, AAS o clopidogrel | Combinación de muerte, infarto o ictus | 19,6% en warfarina; 20,7% en AAS; 21,6% en clopidogrel; p=NSReducción de ictus no fatales con warfarina | 7 H mayores con warfarina | Planeado para incluir 3.000 pacientes |
| HELAS9 | 2006 | Aleatorizado | 197 | IC en RS sin indicación de ACO | 58% | 24 meses | Warfarina-AASwarfarina-placebo | Combinación de muerte, ictus, embolia, infarto, rehospitalización, IC | Etiología isquémica: 8,9% con warfarina frente a 14,9% con AAS; p=NSIdiopáticos: 8,9 con warfarina frente a 14,8% con placebo; p no comunicada | 7 H mayores con warfarina | Análisis separado etiología isquémica idiopáticos, bajo reclutamiento |
| REDINSCOR | 2011 | Observacional | 2.234 | IC en RS sin indicación de ACO | 53,5% | 21 meses | Acenocumarol (26%) | Mortalidad total | HR = 0,84 (IC95%, 0,50-1,30); p = 0,45 | No disponible | |
| Mortalidad cardiaca y TC | HR = 0,71 (IC95%, 0,46-1,11); p = 0,14 | ||||||||||
| Ingresos por IC | HR = 0,89 (IC95%, 0,61-1,29); p = 0,56 | ||||||||||
| Revascularización coronaria | HR = 0,33 (IC95%, 0,10-1,10); p = 0,07 | ||||||||||
| Ictus | HR = 0,89 (IC95%, 0,18-4,40); 0,89 | ||||||||||
| Mortalidad cardiaca, TC, revascularización e ingresos cardiovasculares | HR = 0,74 (IC95%, 0,55-0,99); p = 0,04 | ||||||||||
| Muerte súbita e ictus | HR = 0,52 (IC95%, 0,21-1,32); p = 0,17 |
AAS: ácido acetilsalicílico; ACO: tratamiento anticoagulante oral; EvTE: eventos tromboembólicos; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; H: hemorragia; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; NS: no significativo; RR: riesgo relative; RS: ritmo sinusal; TC: trasplante cardiaco; TEV: tromboembolia venosa.
Los primeros fueron subanálisis post-hoc de los ensayos aleatorizados SOLVD4, V-HeFT 1 y 25 y SAVE6, donde la utilización de ACO fue a discreción del investigador. En general, todos concuerdan en la indicación de ACO en pacientes con fibrilación auricular y prótesis valvulares, pero es escaso el aporte en cuanto a la utilidad de ACO en pacientes en RS, por lo que sus hallazgos no pueden extrapolarse a pacientes sin indicaciones de ACO según las guías de práctica clínica.
El último subestudio publicado de este tipo fue un análisis del estudio BEST19, que incluyó una población similar a la nuestra, aunque con un grado sintomático de IC más avanzado (93% de pacientes en CF III de la NYHA). Sus resultados son coincidentes con los nuestros, ya que el tratamiento con ACO no se asoció a una reducción en mortalidad total (HR = 0,86; IC95%, 0,62-1,19), mortalidad cardiovascular (HR = 0,97; IC95%, 0,68-1,38) y hospitalizaciones por IC (HR = 1,09; IC95%, 0,82-1,44).
Los tres ensayos clínicos aleatorizados dirigidos específicamente a valorar el efecto de los ACO en pacientes con IC en RS responden a las siglas WASH7(Warfarin/Aspirin Study in Heart Failure), WATCH8(Warfarin and Antiplatelet Therapy in Chronic Heart Failure) y HELAS9(Heart failure Long-term Antithrombotic Study). En ninguno de los tres ensayos se detectaron diferencias significativas en los eventos analizados. Sin embargo, el número de pacientes incluidos fue en conjunto escaso y en algún caso el seguimiento se detuvo precozmente, lo que limita su poder real para generar evidencia. Un metaanálisis realizado con los datos de los ensayos WATCH y WASH, también mostró resultados neutros en mortalidad (HR = 0,91; IC95%, 0,67-1,22)22. Sin embargo, estos resultados vienen dados primariamente por el estudio WATCH por su mayor tamaño muestral (1.587 frente a 279 pacientes).
Por sus limitaciones, sus resultados deben tomarse como preeliminares hasta la publicación del ensayo WARCEF23(Warfarin versus Aspirin in Reduced Cardiac Ejection Fraction), prospectivo, con diseño a doble ciego, que aleatoriza pacientes con FEVI <35% en RS a recibir warfarina o placebo y cuyo objetivo primario es determinar diferencias en la incidencia conjunta de muerte o accidente cerebrovascular.
Las complicaciones durante el tratamiento con ACO pueden ser significativas y ocasionar riesgos importantes, lo que debe sopesarse antes de tomar la decisión de recomendar ACO para paciente individual. La principal complicación, lógicamente, es el sangrado, cuya incidencia es variable y se ha cuantificado entre 10 y 17 eventos por 100 pacientes-año en el caso de sangrado en general, y entre 2 y 5 por 100 pacientes-año para sangrado mayor24. Cabe destacar que en ninguno de los análisis post hoc se comunican las tasas de sangrado. En los ensayos aleatorizados7, 8, 9, entre el 1-7% de los pacientes tratados con ACO presentaron episodios de hemorragias definidas como mayores, cifras siempre superiores a las de los grupos sin ACO.
Debe tenerse en cuenta que en esta población los pacientes tienen generalmente edad avanzada, diferentes comorbilidades, posible disfunción hepática secundaria a congestión y susceptibilidad a interacciones medicamentosas, factores que pueden complicar la estrecha franja terapéutica en el que debe manejarse el tratamiento con ACO. Otros aspectos que hay que considerar son la disposición del paciente para las visitas de control estrecho de INR, el riesgo de caídas y la necesidad de modificaciones en la dieta. Algunos de estos inconvenientes se obviarán con la introducción de fármacos anticoagulantes orales alternativos actualmente en etapa de desarrollo e introducción en el mercado, cuyo papel en esta población se deberá definir en estudios futuros25.
LimitacionesLas limitaciones de nuestro trabajo están principalmente vinculadas al diseño observacional y el escaso poder estadístico de algunos de los resultados. Si bien la utilización del propensity score como herramienta de análisis nos ha permitido disminuir los sesgos del efecto del tratamiento, esto no excluye que la capacidad de ajuste sea insuficiente. Por otro lado, se desconocen las razones por las que los médicos prescribieron ACO, lo que pudo haber influido en los resultados. También señalamos como limitación que no se hayan registrado los valores de INR ni las tasas de sangrado en el seguimiento de los pacientes.
ConclusionesEn esta serie de pacientes con IC, disfunción ventricular izquierda severa y RS, sin otras indicaciones de ACO, la prevalencia de tratamiento anticoagulante fue de un 26%. Estos pacientes presentaban menor FEVI, CF más avanzada, mayor anchura del QRS y dilatación auricular izquierda y menor prevalencia de diabetes e hipertensión arterial que los no anticoagulados. La presencia de factores integrados en el sistema CHA2DS2-VASc no influyó en la decisión de anticoagular a estos pacientes, que fue significativamente diferente en los distintos centros participantes del registro.
Si bien en nuestra serie la anticoagulación se asoció a una reducción de la variable combinada «mortalidad cardiaca, TC, revascularización coronaria e ingresos cardiovasculares», no redujo la incidencia de mortalidad ni de ictus.
Nuestros resultados, sumados a la evidencia actualmente disponible parecen no sustentar la necesidad de anticoagulación sistemática para pacientes con disfunción ventricular grave en RS, sin otras indicaciones. Entre los subgrupos que podrían verse beneficiados por este tratamiento están los pacientes con cardiopatía de origen isquémico.
FinanciaciónTrabajo realizado por REDINSCOR, red temática del Instituto de Salud Carlos III, Ministerio de Ciencia y Tecnología.
La Dra. Patricia Avellana ha obtenido financiación de una beca de Fundación Carolina-BBVA.
Conflicto de interesesNinguno.
Recibido 11 Octubre 2011
Aceptado 17 Noviembre 2011
Autor para correspondencia: Unidad de Insuficiencia Cardiaca, Trasplante e Hipertensión Pulmonar, Servicio de Cardiología, Hospital Universitario Puerta de Hierro de Majadahonda, C/ Manuel de Falla 2, 28222 Majadahonda, Madrid, España. patriciaavellana@yahoo.com.ar