El sodio urinario (UNa+) ha surgido como un biomarcador útil para predecir eventos clínicos desfavorables en pacientes con insuficiencia cardiaca aguda (ICA). En este estudio pretendemos evaluar: a) la utilidad de una única determinación precoz de UNa+ para predecir eventos adversos en pacientes con ICA e insuficiencia renal (IR) concomitante, y b) si los cambios en el UNa+ a las 24 horas (ΔUNa24h) añaden información pronóstica adicional sobre los valores basales.
MétodosAnálisis post-hoc del ensayo clínico multicéntrico, abierto y paralelo (IMPROVE-HF), (ClinicalTrials.gov NCT02643147) en el que 160 pacientes con ICA e IR concomitante al ingreso fueron aleatorizados a: a) estrategia diurética convencional, o b) estrategia basada en los niveles del antígeno carbohidrato 125. El objetivo primario fue la mortalidad total y el número total de ingresos recurrentes.
ResultadosLa edad media fue 78±8 años, y la tasa media de filtrado glomerular fue 34,0±8,5ml/min/1,73 m2. La mediana de UNa+ fue 90 mmol/L (65-111). Tras una mediana de seguimiento de 1,73 años [IQR 0,48-2,35], se registraron 83 muertes (51,9%) y 263 rehospitalizaciones totales en 110 patientes. El UNa+ se asoció de forma independiente con la mortalidad por todas las causas (HR=0,75, IC95%, 0,65-0,87; p <0,001), y con las rehospitalizaciones totales (HR=0,92; IC95%, 0,88-0,96; p <0,001). El efecto pronóstico del ΔUNa24h varió de acuerdo con el UNa+ al ingreso (p para la interacción <0,05). El ΔUNa24h se asoció de manera inversa con ambos eventos clínicos solo en el subgrupo de pacientes con valores basales de UNa+ ≤ 50 mmol/l. Por el contrario, no se encontró ningún efecto en el grupo de pacientes con UNa+> 50 mmol/l.
ConclusionesEn pacientes con ICA e IR, una única determinación precoz de UNa+ ≤ 50 mmol/l identifica a pacientes con mayor riesgo de muerte por todas las causas y hospitalizaciones recurrentes. El ΔUNa24h añade información pronóstica adicional sobre los valores basales solo cuando el UNa+ al ingreso es ≤ 50 mmol/l.
Palabras clave
Los diuréticos del asa intravenosos son la piedra angular del tratamiento de los síndromes de insuficiencia cardiaca aguda (ICA)1. No obstante, y teniendo en cuenta la gran heterogeneidad de la sobrecarga de volumen, el ajuste de dosis y la monitorización de la descongestión continúan siendo un problema clínico sin resolver1. En la práctica diaria, el control de la descongestión se basa mayormente en los cambios clínicos (signos/síntomas de congestión), peso y volumen de diuresis. Sin embargo, estos parámetros tienen poca capacidad para evaluar la idoneidad de la respuesta al tratamiento2. En esta situación, el sodio urinario (UNa+) ha surgido como un potencial biomarcador para identificar a los pacientes con riesgo de resistencia a los diuréticos y peores desenlaces clínicos3–7. Por lo tanto, parece lógico suponer que la evaluación seriada del UNa+ durante una descompensación podría aportar información clínica relevante a la evaluación de la respuesta diurética8. De hecho, un reciente documento de consenso recomienda la evaluación precoz del UNa+ durante el curso de una descompensación para monitorizar la respuesta y adaptar la intensidad del tratamiento diurético1. Sin embargo, los datos que avalan la utilidad clínica de la determinación seriada del UNa+ en pacientes con disfunción renal concomitante son escasos o incluso inexistentes.
En este estudio se pretende evaluar: a) la utilidad clínica de una única determinación puntual del UNa+ para predecir la mortalidad total y las rehospitalizaciones totales en pacientes con ICA y disfunción renal al ingreso, y b) si los cambios en el UNa+ a las 24 h (ΔUNa24 h) ofrecen alguna ventaja pronóstica adicional a la de los valores basales.
MÉTODOSPoblación de estudioEste estudio es un análisis post-hoc de un ensayo aleatorizado, paralelo, multicéntrico y abierto (IMPROVE-HF). En el estudio principal, se aleatorizó 1:1 a los pacientes con ICA y disfunción renal al ingreso a: a) una dosis estándar de diuréticos del asa basada en la evaluación clínica habitual, o b) tratamiento guiado por la concentración plasmática del antígeno carbohidrato 125 (CA125). Los criterios de inclusión y exclusión se presentan en la . Este estudio se registró en ClinicalTrials.gov (NCT02643147). Los resultados principales y la descripción detallada del diseño se han publicado previamente2,9.
El estudio se realizó según los principios de la Declaración de Helsinki y la Conferencia Internacional sobre Pautas de Armonización de Buenas Prácticas Clínicas, y se ajustó plenamente a la normativa nacional vigente. El Comité de Ética del Hospital Clínico Universitario de Valencia y la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) aprobaron el protocolo, el formulario de consentimiento informado, la hoja de información del participante y todos los documentos pertinentes. Todos los pacientes dieron su consentimiento informado por escrito. Una empresa independiente (MedStats Consulting, Estados Unidos) realizó todos los análisis.
ProcedimientosUna vez confirmado el diagnóstico de ICA, se seleccionaba y se aleatorizaba a los pacientes en las primeras 24 h. Durante esta visita, se evaluaban las características clínicas y los biomarcadores. Las visitas de seguimiento programadas se realizaron a las 24 y las 72 h y a los 30 días de la aleatorización (visita final).
Se aleatorizó a los pacientes seleccionados a recibir diuréticos intravenosos con la dosis basada en la evaluación clínica convencional o en los valores del CA125. En el grupo de evaluación clínica convencional, la estrategia de diuréticos se basó en la existencia de síntomas y signos de congestión sistémica según las recomendaciones de las guías de práctica clínica vigentes en el momento de la inclusión10. En el grupo activo, se recomendaron dosis de diuréticos más altas para los pacientes con CA125 > 35 U/ml. En contraposición, se recomendaron dosis más bajas con CA125 ≤ 35 U/ml. Las estrategias de diuréticos de ambos grupos se resumen en la .
Determinación del UNa+El UNa+ se midió en el momento de aleatorizar a los pacientes y a las 24 h. La media de tiempo desde el ingreso hasta la aleatorización fue 6±3 h y la mediana [intervalo intercuartílico] de furosemida intravenosa recibida antes de la aleatorización fue de 40 [20-60] mg. Con base en estudios previos3,8,11, el UNa+ al ingreso se dicotomizó en 50 mmol/l (≤ 50 frente a > 50 mmol/l).
Seguimiento y objetivosEl objetivo primario fue evaluar si una sola determinación del UNa+ al ingreso predice la mortalidad por cualquier causa y el número total de reingresos. Además, se pretendía evaluar si los ΔUNa24h ofrecían alguna ventaja pronóstica adicional a la de los valores basales de UNa+. Con este propósito, el ΔUNa24h se evaluó frente a los objetivos clínicos según el UNa+ fuera ≤ 50 o > 50 mmol/l (UNa+50). El seguimiento ambulatorio se realizó en las unidades de insuficiencia cardiaca de cada centro. Los objetivos se adjudicaron tras revisar los informes electrónicos de alta de nuestro sistema regional de atención sanitaria. Solo se incluyeron los reingresos no planificados. Los reingresos relacionados con la insuficiencia cardiaca fueron aquellos con diagnóstico principal al alta de ICA o IC descompensada. Los investigadores responsables de la adjudicación de eventos no conocían la variable de exposición.
Análisis estadísticoLas características basales continuas según UNa+50 se presentan como la media±desviación estándar o mediana [intervalo intercuartílico] según corresponda; las variables cualitativas se presentan como frecuencias y porcentajes. Las variables continuas se compararon según UNa+50 con la prueba de la t de Student o la prueba de suma de rangos para muestras independientes según la distribución de variables. Las variables discretas se compararon mediante la prueba de la χ2.
Selección de variables para modelos de regresiónLas covariables se eligieron en función de los conocimientos médicos previos, independientemente de sus valores de p. Se extrajo un modelo reducido y parsimonioso mediante la eliminación hacia atrás. Durante este proceso de selección, se probó el supuesto de linealidad para las variables continuas y se transformaron, si procedía, en polinomiales12.
En todos los análisis, el centro hospitalario se incluyó como factor de estratificación y se forzó la inclusión de la variable de aleatorización del ensayo original como covariable.
Asociación con objetivos clínicosSe utilizó una regresión binomial negativa bivariante para determinar la dirección y la fuerza de la asociación de las variables de exposición (UNa+ e interacción de UNa+50 con ΔUNa24h) con las rehospitalizaciones totales y mortalidad total. Los coeficientes de este método se estiman teniendo en cuenta la correlación positiva entre el evento recurrente y la muerte como un evento terminal al vincular las 2 ecuaciones simultáneas (recuento de reingresos y muertes)13. Además, el tiempo de seguimiento de cada paciente se utilizó como variable de compensación en los modelos para tener en cuenta las diferencias en el seguimiento. Al final, cuando se utiliza esta metodología, se reduce el potencial de sesgo a causa de la muerte como censura informativa, un problema observado con frecuencia en los estudios de ICA. Las estimaciones de riesgo de este método se presentan como razones de tasas de incidencia (RTI) e intervalos de confianza del 95% (IC95%). Las covariables que aparecen en cada modelo se presentan con los correspondientes pies de figura. La integridad de los datos del seguimiento se calculó con el índice Clark o C de integridad (95,3%).
La forma y la dirección de la trayectoria de asociación del ΔUNa24h (como RTI) se representan a lo largo de su continuo y se estratifican según el UNa+ (UNa+ ≤ 50 frente a > 50 mmol/l). La trayectoria por encima o por debajo de 1 en el eje de ordenadas se consideró significativa.
Se estableció un valor de p bilateral de <0,05 como umbral de significación estadística. Se utilizó Stata 15.1 (software estadístico Stata, versión 15 [2017]; Stata Corp LP, Estados Unidos) para el análisis primario. Los análisis de reclasificación de riesgos (módulos survIDINRI y SurvC1) se implementaron en R (versión 3.5.2; R Foundation for Statistical Computing, Austria).
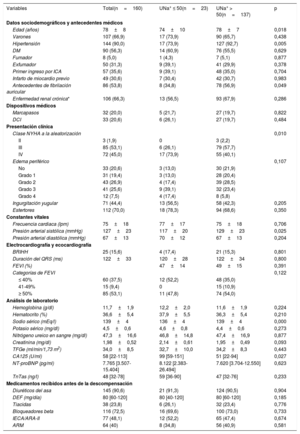
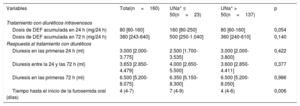
RESULTADOSPacientesSe incluyó a un total de 160 pacientes en este estudio realizado entre marzo de 2015 y diciembre de 2016 en 9 centros de España. La media de edad de la población de estudio era 78±8 años, el 66,9% eran varones y el 46,9% tenía una fracción de eyección del ventrículo izquierdo < 50%. Las medianas de la fracción aminoterminal del propéptido natriurético cerebral y el CA125 fueron 7.765 [3.507-15.404] pg/ml y 58 [22-113] U/ml respectivamente. Las medias de nitrógeno ureico y creatinina en sangre y de la tasa de filtrado glomerular estimada (TFGe) fueron 47,3±16,6mg/dl, 1,98±0,52mg/dl y 34±8,5ml/min/1,73 m2. Todos los pacientes presentaban disfunción renal (TFGe <60ml/min/1,73 m2) y 50 (31,3%) tenían una TFGe < 30ml/min/1,73 m2 al ingreso. Un total de 106 pacientes (66,3%) presentaban enfermedad renal crónica establecida (TFGe <60ml/min/1,73 m2 según la creatinina sérica obtenida en la última consulta ambulatoria disponible antes del ingreso y evaluada durante una fase estable de la enfermedad). Todos los pacientes recibieron furosemida intravenosa al ingreso y la mediana de dosis fue de 40 [20-60] mg. Las dosis acumuladas a las 24 y las 72 h de la aleatorización fueron 190 [120-320] y 410 [250-640] mg. Las características detalladas de la población de estudio se presentan en la tabla 1.
Características basales según el contenido de sodio urinario al ingreso
| Variables | Total(n=160) | UNa+ ≤ 50(n=23) | UNa+ > 50(n=137) | p |
|---|---|---|---|---|
| Datos sociodemográficos y antecedentes médicos | ||||
| Edad (años) | 78±8 | 74±10 | 78±7 | 0,018 |
| Varones | 107 (66,9) | 17 (73,9) | 90 (65,7) | 0,438 |
| Hipertensión | 144 (90,0) | 17 (73,9) | 127 (92,7) | 0,005 |
| DM | 90 (56,3) | 14 (60,9) | 76 (55,5) | 0,629 |
| Fumador | 8 (5,0) | 1 (4,3) | 7 (5,1) | 0,877 |
| Exfumador | 50 (31,3) | 9 (39,1) | 41 (29,9) | 0,378 |
| Primer ingreso por ICA | 57 (35,6) | 9 (39,1) | 48 (35,0) | 0,704 |
| Infarto de miocardio previo | 49 (30,6) | 7 (30,4) | 42 (30,7) | 0,983 |
| Antecedentes de fibrilación auricular | 86 (53,8) | 8 (34,8) | 78 (56,9) | 0,049 |
| Enfermedad renal crónica* | 106 (66,3) | 13 (56,5) | 93 (67,9) | 0,286 |
| Dispositivos médicos | ||||
| Marcapasos | 32 (20,0) | 5 (21,7) | 27 (19,7) | 0,822 |
| DCI | 33 (20,6) | 6 (26,1) | 27 (19,7) | 0,484 |
| Presentación clínica | ||||
| Clase NYHA a la aleatorización | 0,010 | |||
| II | 3 (1,9) | 0 | 3 (2,2) | |
| III | 85 (53,1) | 6 (26,1) | 79 (57,7) | |
| IV | 72 (45,0) | 17 (73,9) | 55 (40,1) | |
| Edema periférico | 0,107 | |||
| No | 33 (20,6) | 3 (13,0) | 30 (21,9) | |
| Grado 1 | 31 (19,4) | 3 (13,0) | 28 (20,4) | |
| Grado 2 | 43 (26,9) | 4 (17,4) | 39 (28,5) | |
| Grado 3 | 41 (25,6) | 9 (39,1) | 32 (23,4) | |
| Grado 4 | 12 (7,5) | 4 (17,4) | 8 (5,8) | |
| Ingurgitación yugular | 71 (44,4) | 13 (56,5) | 58 (42,3) | 0,205 |
| Estertores | 112 (70,0) | 18 (78,3) | 94 (68,6) | 0,350 |
| Constantes vitales | ||||
| Frecuencia cardiaca (lpm) | 75±18 | 77±17 | 75±18 | 0,706 |
| Presión arterial sistólica (mmHg) | 127±23 | 117±20 | 129±23 | 0,025 |
| Presión arterial diastólica (mmHg) | 67±13 | 70±12 | 67±13 | 0,204 |
| Electrocardiografía y ecocardiografía | ||||
| BRIHH | 25 (15,6) | 4 (17,4) | 21 (15,3) | 0,801 |
| Duración del QRS (ms) | 122±33 | 120±28 | 122±34 | 0,800 |
| FEVI (%) | 47±14 | 49±15 | 0,391 | |
| Categorías de FEVI | 0,122 | |||
| ≤ 40% | 60 (37,5) | 12 (52,2) | 48 (35,0) | |
| 41-49% | 15 (9,4) | 0 | 15 (10,9) | |
| ≥ 50% | 85 (53,1) | 11 (47,8) | 74 (54,0) | |
| Análisis de laboratorio | ||||
| Hemoglobina (g/dl) | 11,7±1,9 | 12,2±2,0 | 11,6±1,9 | 0,224 |
| Hematocrito (%) | 36,6±5,4 | 37,9±5,5 | 36,3±5,4 | 0,210 |
| Sodio sérico (mEq/l) | 139±4 | 136±4 | 139±4 | 0,000 |
| Potasio sérico (mg/dl) | 4,5±0,6 | 4,6±0,8 | 4,4±0,6 | 0,273 |
| Nitrógeno ureico en sangre (mg/dl) | 47,3±16,6 | 46,8±14,8 | 47,4±16,9 | 0,877 |
| Creatinina (mg/dl) | 1,98±0,52 | 2,14±0,61 | 1,95±0,49 | 0,093 |
| TFGe (ml/min/1,73 m2) | 34,0±8,5 | 32,7±10,0 | 34,2±8,3 | 0,443 |
| CA125 (U/ml) | 58 [22-113] | 99 [59-151] | 51 [22-94] | 0,027 |
| NT-proBNP (pg/ml) | 7.765 [3.507-15.404] | 8.122 [2.383-26.494] | 7.620 [3.704-12.550] | 0,623 |
| TnTas (ng/l) | 48 [32-78] | 59 [36-90] | 47 [32-76] | 0,233 |
| Medicamentos recibidos antes de la descompensación | ||||
| Diuréticos del asa | 145 (90,6) | 21 (91,3) | 124 (90,5) | 0,904 |
| DEF (mg/día) | 80 [60-120] | 80 [40-120] | 80 [60-120] | 0,185 |
| Tiacidas | 38 (23,8) | 6 (26,1) | 32 (23,4) | 0,776 |
| Bloqueadores beta | 116 (72,5) | 16 (69,6) | 100 (73,0) | 0,733 |
| IECA/ARA-II | 77 (48,1) | 12 (52,2) | 65 (47,4) | 0,674 |
| ARM | 64 (40) | 8 (34,8) | 56 (40,9) | 0,581 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; BRIHH: bloqueo de la rama izquierda del haz de His; CA125: antígeno carbohidrato 125; DCI: desfibrilador-cardioversor implantable; DEF: dosis equivalente de furosemida; DM: diabetes mellitus; FEVI: fracción de eyección del ventrículo izquierdo; ICA: insuficiencia cardiaca aguda; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; TFGe: tasa de filtrado glomerular estimada; TnTas: troponina T de alta sensibilidad; UNa+: sodio urinario.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
La mediana de UNa+ en el momento de la aleatorización fue de 90 [65-111] mmol/l y 23 pacientes (14,4%) tenían el UNa+ ≤ 50 mmol/l. Los pacientes con UNa+ ≤ 50 mmol/l eran más jóvenes, con peor clase funcional de la New York Heart Association (NYHA) y mayores cifras basales de CA125. Sin embargo, no se encontraron diferencias significativas en los péptidos natriuréticos o los signos clínicos de congestión en comparación con aquellos con UNa+ > 50 mmol/l (tabla 1). Además, los 2 grupos estaban equilibrados respecto al tratamiento diurético previo (tabla 1). El tratamiento con diuréticos intravenosos según el UNa+50 se presenta en la tabla 2. Hubo una tendencia estadística hacia una dosis equivalente de furosemida (DEF) intravenosa más alta durante las primeras 24 h entre los pacientes con UNa+ ≤ 50 mmol/l. No se encontraron diferencias a las 72 h. La diuresis acumulada durante las primeras 24 y 72 h no se diferenciaba considerablemente según el UNa+50. El tiempo hasta la interrupción de la furosemida intravenosa fue más largo para los pacientes con UNa+ ≤ 50 mmol/l (tabla 2).
Tratamiento con diuréticos intravenosos y respuesta al tratamiento con diuréticos
| Variables | Total(n=160) | UNa+ ≤ 50(n=23) | UNa+ > 50(n=137) | p |
|---|---|---|---|---|
| Tratamiento con diuréticos intravenosos | ||||
| Dosis de DEF acumulada en 24 h (mg/24 h) | 80 [60-160] | 160 [80-250] | 80 [60-160] | 0,054 |
| Dosis de DEF acumulada en 72 h (mg/24 h) | 380 [243-640] | 500 [250-1.040] | 360 [240-610] | 0,140 |
| Respuesta al tratamiento con diuréticos | ||||
| Diuresis en las primeras 24 h (ml) | 3.000 [2.000-3.775] | 2.500 [1.700-3.535] | 3.000 [2.000-3.800] | 0,422 |
| Diuresis entre la 24 y las 72 h (ml) | 3.653 [2.850-4.479] | 4.000 [2.650-5.500] | 3.600 [2.850-4.411] | 0,377 |
| Diuresis en las primeras 72 h (ml) | 6.500 [5.200-8.075] | 6.350 [5.150-8.300] | 6.500 [5.200-8.050] | 0,986 |
| Tiempo hasta el inicio de la furosemida oral (días) | 4 (4-7) | 7 (4-9) | 4 (4-6) | 0,006 |
DEF: dosis equivalente de furosemida; UNa+: sodio urinario.
Los valores expresan n (%), media (intervalo) o mediana [intervalo intercuartílico].
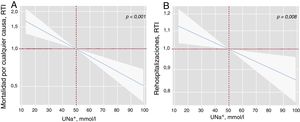
Tras una mediana de seguimiento de 1,73 [0,48-2,35] años, se registraron 83 muertes por cualquier causa (51,9%): 51 (61,45%) correspondieron a muertes relacionadas con insuficiencia cardiaca; 8 (9,64%), a otras causas cardiovasculares y 24 (28,92%), a muertes no cardiovasculares. El UNa+ se asoció de manera significativa, inversa y lineal con mayor riesgo de mortalidad (figura 1A). De hecho, por cada aumento del UNa+ de 20 mmol/l, hubo una disminución del 25% en la incidencia de muerte (tabla 3). Un análisis de sensibilidad reveló que el UNa+ también se asoció de manera inversa e independiente con mayor riesgo de muerte relacionada con insuficiencia cardiaca y causas cardiovasculares ().
Determinación precoz de UNa+ y riesgo de resultados clínicos adversos. A: determinación precoz de UNa+ y mortalidad por cualquier causa a largo plazoa. B: determinación precoz de UNa+ y reingresos totales a largo plazob. aModelo ajustado por centro hospitalario, edad, sexo, variable de aleatorización, ingreso anterior por insuficiencia cardiaca aguda, cardiopatía isquémica, presión arterial sistólica, tasa de filtrado glomerular, nitrógeno ureico en sangre, fracción aminoterminal del propéptido natriurético cerebral y dosis equivalente de furosemida antes de la aleatorización (mg/24h). bModelo ajustado por centro hospitalario, variable de aleatorización, ingreso anterior por insuficiencia cardiaca aguda, cardiopatía isquémica, presión arterial sistólica, tasa de filtrado glomerular, nitrógeno ureico en sangre, fracción aminoterminal del propéptido natriurético cerebral, hemoglobina, fracción de eyección del ventrículo izquierdo y dosis equivalente de furosemida antes de la aleatorización (mg/24h). RTI: razón de tasa de incidencias; UNa+: sodio urinario.
Eventos clínicos según la determinación puntual del sodio urinario
| UNa+ (cada aumento de 20 mmol/l) | Razón de tasas de incidencia | IC95% | p |
|---|---|---|---|
| aMortalidad total | 0,75 | 0,65-0,87 | <0,001 |
| bReingresos totales | 0,92 | 0,88-0,96 | <0,001 |
| cReingresos por causa cardiovascular | 0,92 | 0,86-0,99 | 0,023 |
IC95%: intervalo de confianza del 95%; UNa+: sodio urinario.
Covariables del modelo: centro hospitalario, edad, sexo, variable de aleatorización, ingreso previo por insuficiencia cardiaca aguda, cardiopatía isquémica, presión arterial sistólica, tasa de filtrado glomerular, nitrógeno ureico en sangre, fracción aminoterminal del propéptido natriurético cerebral y dosis equivalente de furosemida antes de la aleatorización (mg/24h).
Covariables del modelo: centro hospitalario, variable de aleatorización, ingreso previo por insuficiencia cardiaca aguda, cardiopatía isquémica, presión arterial sistólica, tasa de filtrado glomerular, nitrógeno ureico en sangre, fracción aminoterminal del propéptido natriurético cerebral, hemoglobina, fracción de eyección del ventrículo izquierdo y dosis equivalente de furosemida antes de la aleatorización (mg/24h).
Covariables del modelo: centro hospitalario, edad, sexo, variable de aleatorización, ingreso previo por insuficiencia cardiaca aguda, cardiopatía isquémica, presión arterial sistólica, tasa de filtrado glomerular, nitrógeno ureico en sangre, fracción aminoterminal del propéptido natriurético cerebral y dosis equivalente de furosemida antes de la aleatorización (mg/24h).
Durante el seguimiento, se registraron 263 reingresos por cualquier causa de 110 pacientes, así como 160 reingresos por insuficiencia cardiaca de 81 pacientes. La distribución de reingresos por cualquier causa por paciente fue de 1, 2, 3 y > 3 en, respectivamente, 45, 24, 18 y 23 pacientes. Respecto a los reingresos por insuficiencia cardiaca, la distribución por paciente fue 1, 2, 3 y > 3 en 40, 24, 6 y 11 pacientes.
Como se muestra en la figura 1B, el UNa+ se asoció de manera independiente e inversa con el riesgo de reingresos por cualquier causa. Por cada aumento de 20 mmol/l, se observó una disminución asociada del 8% en los reingresos por cualquier causa (tabla 3). Asimismo, el UNa+ se asoció de manera inversa con el riesgo de reingreso recurrente por insuficiencia cardiaca (tabla 3).
Valor pronóstico adicional de ΔUNa24hLa TFGe media aumentó considerablemente a las 24 h (34,0±8,5 frente a 35,4±8,5ml/min/1,73 m2; p=0,004). Del mismo modo, la media de UNa+ disminuyó frente al basal: mediana de cambio, −5,5 [−25 a 12,6] mmol/l. En 98 pacientes (61,3%) el ΔUNa24h disminuyó o se mantuvo sin cambios. Este subgrupo tuvo una tendencia a tasas de mortalidad más altas (3,9 frente a 2,6/10 personas-año; p=0,094), pero no a reingresos por cualquier causa (17,9 frente a 14,0/10 personas-año; p=0,279).
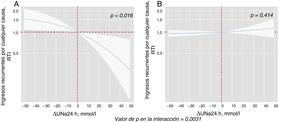
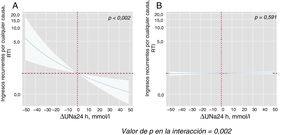
Al modelar el efecto de ΔUNa24h en el riesgo de mortalidad y reingresos, se encontró una importante interacción con los valores basales de UNa+50. El ΔUNa24h se asoció de manera inversa con la mortalidad por cualquier causa solo en el grupo con UNa+ al ingreso ≤ 50 mmol/l. Por el contrario, no se encontró efecto alguno en el grupo con UNa+ > 50 mmol/l (figura 2). Se encontró el mismo efecto diferencial en los reingresos totales (figura 3). La interacción entre el ΔUNa24h y el UNa+ basal no fue significativa cuando los valores basales de UNa+ se establecieron en 60 mmol/l (pinteracción=0,080) y 70 mmol/l (pinteracción=0,837).
Efectos diferenciales de ΔUNa24h en la mortalidad por cualquier causa según los valores basales de UNa+. Representación de la RTI a lo largo de todo el proceso de ΔUNa24h según los 2 valores basales de UNa+.El ΔNaU24h se ha modelado con polinomiales [3] y centrado en el valor «0». El valor general para la interacción fue p=0,031. El análisis se ajustó por centro hospitalario, variable de aleatorización, edad, sexo, presión arterial sistólica, tasa de filtrado glomerular, fracción aminoterminal del propéptido natriurético cerebral, volumen de orina a las 24 h y DEF a las 24 h. A: valores basales de UNa+ ≤ 50 mmol/l. B: valores basales de UNa+ > 50 mmol/l. ΔUNa24h: cambio en el UNa+ a las 24 h; DEF: dosis equivalente de furosemida; RTI: razón de tasa de incidencias; UNa+: sodio urinario.
Efectos diferenciales del ΔUNa24h en los reingresos por cualquier causa según los valores basales de UNa+. Representación de la RTI a lo largo de todo el continuo de ΔUNa24h según los 2 valores basales de UNa+. El ΔNaU24h se ha modelado con polinomiales [0] y centrado en el valor «0». El valor general para la interacción fue p=0,002. Análisis ajustado por centro hospitalario, variable de aleatorización, ingreso anterior por insuficiencia cardiaca, etiología isquémica, presión arterial sistólica, tasa de filtrado glomerular, nitrógeno ureico en sangre, hemoglobina, fracción aminoterminal del propéptido natriurético cerebral, volumen de orina a las 24 h y DEF a las 24 h. A: valores basales de UNa+ ≤ 50 mmol/l. B: valores basales de UNa+ > 50 mmol/l. ΔUNa24h: cambio en el UNa+ a las 24 h; DEF: dosis equivalente de furosemida; RTI: razón de tasas de incidencia; UNa+: sodio urinario.
Los principales hallazgos de este estudio en pacientes con ICA y disfunción renal concomitante confirman el valor pronóstico de una determinación precoz del UNa+ para predecir el riesgo de muerte por cualquier causa. Además, este es el primer estudio que muestra una asociación entre valores bajos de UNa+ y mayor carga de rehospitalizaciones. Cabe resaltar que las estimaciones de riesgo se ajustaron por covariables con contrastado valor pronóstico y por el régimen de diuréticos previo. Es interesante que se hallara que la trayectoria del UNa+ tras 24 h de tratamiento con diuréticos ofrece información pronóstica adicional a la de los valores basales solo en el subgrupo de pacientes con menor contenido de UNa+ al ingreso (UNa+ absoluto ≤ 50 mmol/l). En su conjunto, estos hallazgos indican que una sola medición de UNa+ al ingreso puede ser suficiente para identificar a los pacientes con alto riesgo de eventos adversos. El control seriado de UNa+ durante la hospitalización parece ofrecer información pronóstica adicional, sobre todo en pacientes con valores de UNa+ bajos al ingreso.
Valor pronóstico del UNa+ soloEl UNa+ ha surgido como un biomarcador prometedor en pacientes con insuficiencia cardiaca3–7. Desde un punto de vista fisiopatológico, es posible observar bajas concentraciones de UNa+ en pacientes con disminución en la TFGe14. No obstante, la evidencia disponible indica que los valores bajos de UNa+ identifican principalmente a pacientes con desregulación tubular renal secundaria a la activación neurohormonal15,16. Por lo tanto, se ha demostrado que valores más bajos de UNa+ identifican a los pacientes con mayor riesgo de eventos adversos y resistencia diurética3–7. El presente estudio confirma estos hallazgos, y además añade información adicional al demostrar una relación significativa entre el solo UNa+ al ingreso y la carga de hospitalizaciones totales.
Aunque no podemos comparar la precisión discriminativa del UNa+ solo al ingreso frente al UNa24h, creemos que las determinaciones puntuales ofrecen ventajas importantes sobre el UNa24h. En primer lugar, la evaluación puntual podría ofrecer información clínica precoz con posibles implicaciones pronósticas y terapéuticas. En segundo lugar, medir el UNa+ puntualmente al ingreso o en los momentos iniciales del ingreso es mucho más fácil de implementar en la práctica clínica diaria.
Valor pronóstico de la trayectoria precoz del UNa+ en la ICASe ha señalado que la evaluación seriada del UNa+ durante una hospitalización por ICA es útil para monitorizar la respuesta y guiar la intensidad del tratamiento reductor. De hecho, un reciente consenso de expertos de la Asociación de Insuficiencia Cardiaca de la Sociedad Europea de Cardiología (ESC-HF) recomienda la medición del UNa+ como parte de un algoritmo escalonado1 para pacientes con ICA y congestión. Según ese documento, un UNa+ aislado < 50-70 mmol/l 2 h después de la dosis inicial de diuréticos del asa debería alertar a los médicos sobre el riesgo de resistencia al tratamiento diurético y motivar intervenciones rápidas1. Aunque esta «prueba de esfuerzo tubular» es atractiva desde un punto de vista fisiopatológico, hay poca evidencia que respalde el papel clínico de la medición seriada del UNa+ en pacientes con ICA. Biegus et al.8 han comunicado recientemente que el análisis longitudinal del UNa+ durante el curso del tratamiento diurético ofrece información clínica y pronóstica adicional. En este estudio, los pacientes con excreción de UNa+ reducida/sin cambios a las 48 h presentaban una descongestión menos efectiva, menor eficacia del tratamiento diurético y mayor riesgo de mortalidad a 1 año. No obstante, es importante mencionar varios aspectos relevantes al interpretar la dinámica longitudinal del UNa+. En primer lugar, la composición urinaria se caracteriza por una disminución progresiva del UNa+ a lo largo del tratamiento con diuréticos7. Una vez que se ha reducido la sobrecarga de volumen extracelular, la natriuresis también disminuye para permitir que la excreción de sodio vuelva a ser igual a la ingesta17. Aunque este fenómeno es frecuentemente desadaptativo en pacientes con ICA (retención de sodio en el contexto de una congestión persistente), puede ser difícil determinar si la disminución del UNa+ observada indica resistencia al tratamiento diurético o, por el contrario, representa una respuesta fisiológica a la contracción del volumen extracelular. Además, e independientemente de su utilidad pronóstica, puede resultar difícil implementar la evaluación seriada del UNa+ en la práctica clínica diaria. Por el contrario, la evaluación aislada del UNa+ durante las primeras horas o días de una descompensación ofrece información pronóstica útil, como se comunica en este y otros estudios8,18,19.
Según los resultados de este estudio, los cambios precoces del UNa+ pueden ofrecer información pronóstica relevante de pacientes con valores basales de UNa+ bajos. En este subgrupo de pacientes, la monitorización del UNa+ puede ofrecer información pronóstica adicional sobre la respuesta al tratamiento. Por el contrario, en aquellos con el UNa+ > 50 mmol/l, los cambios precoces no ofrecen información adicional para definir mejor el riesgo del paciente. Es necesaria más evidencia para confirmar los resultados actuales y, lo que es más importante, dilucidar el papel del UNa+ como diana terapéutica.
Se debe reconocer varias limitaciones del presente estudio. En primer lugar, este fue un análisis post-hoc del ensayo IMPROVE-HF, que no se diseñó para evaluar el valor pronóstico del UNa+ en la ICA. Por lo tanto, todos los resultados deben considerarse exploratorios y generadores de hipótesis. En segundo lugar, a causa del pequeño tamaño de la muestra, algunos de los resultados negativos podrían explicarse por un error de tipo II (potencia estadística insuficiente). Tercero, la cohorte del IMPROVE-HF estaba compuesta sobre todo por pacientes con ICA y disfunción renal concomitante. Por ello, no está claro cómo se aplicarían los resultados a una población más amplia de pacientes con ICA. Además, con los datos actuales, no se puede distinguir con precisión entre pacientes con disfunción renal aguda y pacientes con disfunción renal crónica. Cuarto, aunque se reclutó a los pacientes en 9 centros de España y un equipo multidisciplinario (cardiólogos y especialistas en medicina interna) realizó el seguimiento, se desconoce cómo estos resultados se aplicarían a otros sistemas sanitarios con una organización de gestión de la insuficiencia cardiaca diferente20. Quinto, no se evaluó el efecto del UNa+ en otros marcadores indirectos de la descongestión, como el peso y las presiones venosas. Sexto, no se pudo controlar las diferencias en la ingesta de sodio antes del ingreso o durante la descompensación. Así pues, no se pudo evaluar su efecto como factor de confusión. Séptimo, se utilizaron muestras de orina puntuales, y no muestras de orina de 24 h. Por lo tanto, no se puede comparar el valor pronóstico de la muestra puntual frente a la de 24 h. Octavo, los valores basales de UNa+ pueden estar influidos por el momento de la medición y la última administración de diuréticos intravenosos. Este intervalo no se registró en este estudio. Por último, el umbral para la identificación de una mala respuesta natriurética continúa siendo arbitrario. Otros estudios deberían confirmar los valores de corte óptimos.
CONCLUSIONESEn pacientes con ICA y disfunción renal, una determinación única y precoz del UNa+ identifica a un subgrupo de pacientes con mayor riesgo de mortalidad por cualquier causa y reingresos. El ΔUNa24h aporta información pronóstica sobre los valores de referencia cuando el UNa+ a la presentación es ≤ 50 mmol/l.
FINANCIACIÓNEste estudio ha sido financiado por el Proyecto PI13/01519 en colaboración con la Plataforma de Unidades de Investigación Clínica y Ensayos Clínicos (SCReN) (PT13/0002/0031) y cofinanciado por Fondos FEDER; por subvenciones de valor indeterminado de Proyectos de Investigación de Insuficiencia Cardiaca de la Sección de Insuficiencia Cardiaca 2015 y Beca Mutual Médica 2014, y por los números de subvención PIE15/00013 y CIBER CV 16/11/00420 y 16/11/00403.
- –
El UNa+ se ha convertido en un marcador pronóstico fiable y ampliamente disponible en la ICA, e identifica a los pacientes con mayor riesgo de eventos adversos.
- –
La evidencia actual indica que la respuesta diurética y natriurética al tratamiento con diuréticos del asa se puede predecir con precisión a partir de una muestra puntual de orina obtenida 1-2 h después de la administración de diuréticos del asa.
- –
Este estudio muestra una relación independiente entre valores bajos del UNa+ al ingreso y una mayor carga de rehospitalizaciones de pacientes con ICA y disfunción renal concomitante.
- –
Además, se propone que la trayectoria de la excreción de UNa+ tras 24 h de tratamiento con diuréticos ofrece información pronóstica adicional a la de los valores basales, sobre todo de pacientes con UNa+ al ingreso ≤ 50 mmol.
Los autores declaran no tener ningún tipo de conflicto de intereses.



![Efectos diferenciales de ΔUNa24h en la mortalidad por cualquier causa según los valores basales de UNa+. Representación de la RTI a lo largo de todo el proceso de ΔUNa24h según los 2 valores basales de UNa+.El ΔNaU24h se ha modelado con polinomiales [3] y centrado en el valor «0». El valor general para la interacción fue p=0,031. El análisis se ajustó por centro hospitalario, variable de aleatorización, edad, sexo, presión arterial sistólica, tasa de filtrado glomerular, fracción aminoterminal del propéptido natriurético cerebral, volumen de orina a las 24 h y DEF a las 24 h. A: valores basales de UNa+ ≤ 50 mmol/l. B: valores basales de UNa+ > 50 mmol/l. ΔUNa24h: cambio en el UNa+ a las 24 h; DEF: dosis equivalente de furosemida; RTI: razón de tasa de incidencias; UNa+: sodio urinario. Efectos diferenciales de ΔUNa24h en la mortalidad por cualquier causa según los valores basales de UNa+. Representación de la RTI a lo largo de todo el proceso de ΔUNa24h según los 2 valores basales de UNa+.El ΔNaU24h se ha modelado con polinomiales [3] y centrado en el valor «0». El valor general para la interacción fue p=0,031. El análisis se ajustó por centro hospitalario, variable de aleatorización, edad, sexo, presión arterial sistólica, tasa de filtrado glomerular, fracción aminoterminal del propéptido natriurético cerebral, volumen de orina a las 24 h y DEF a las 24 h. A: valores basales de UNa+ ≤ 50 mmol/l. B: valores basales de UNa+ > 50 mmol/l. ΔUNa24h: cambio en el UNa+ a las 24 h; DEF: dosis equivalente de furosemida; RTI: razón de tasa de incidencias; UNa+: sodio urinario.](https://static.elsevier.es/multimedia/03008932/0000007400000007/v1_202106190918/S0300893220303316/v1_202106190918/es/main.assets/thumbnail/gr2.jpeg?xkr=eyJpdiI6IjZQRlRPemV6ak5LZHBJU0t0emZFOXc9PSIsInZhbHVlIjoiK3oreHRySmkxQUJTazV3NzFCK0JRWHVIY0poVmswT0ttbTBOT2dPRnROOD0iLCJtYWMiOiI2M2EwODlkMjNjMGZlZDdjNjY5ZmJiYjhmOWUxZmJiZWRjZGZhOGQzYmZiZjJiNjNiODM3YjllMGNiOTg1YzNhIiwidGFnIjoiIn0=)
![Efectos diferenciales del ΔUNa24h en los reingresos por cualquier causa según los valores basales de UNa+. Representación de la RTI a lo largo de todo el continuo de ΔUNa24h según los 2 valores basales de UNa+. El ΔNaU24h se ha modelado con polinomiales [0] y centrado en el valor «0». El valor general para la interacción fue p=0,002. Análisis ajustado por centro hospitalario, variable de aleatorización, ingreso anterior por insuficiencia cardiaca, etiología isquémica, presión arterial sistólica, tasa de filtrado glomerular, nitrógeno ureico en sangre, hemoglobina, fracción aminoterminal del propéptido natriurético cerebral, volumen de orina a las 24 h y DEF a las 24 h. A: valores basales de UNa+ ≤ 50 mmol/l. B: valores basales de UNa+ > 50 mmol/l. ΔUNa24h: cambio en el UNa+ a las 24 h; DEF: dosis equivalente de furosemida; RTI: razón de tasas de incidencia; UNa+: sodio urinario. Efectos diferenciales del ΔUNa24h en los reingresos por cualquier causa según los valores basales de UNa+. Representación de la RTI a lo largo de todo el continuo de ΔUNa24h según los 2 valores basales de UNa+. El ΔNaU24h se ha modelado con polinomiales [0] y centrado en el valor «0». El valor general para la interacción fue p=0,002. Análisis ajustado por centro hospitalario, variable de aleatorización, ingreso anterior por insuficiencia cardiaca, etiología isquémica, presión arterial sistólica, tasa de filtrado glomerular, nitrógeno ureico en sangre, hemoglobina, fracción aminoterminal del propéptido natriurético cerebral, volumen de orina a las 24 h y DEF a las 24 h. A: valores basales de UNa+ ≤ 50 mmol/l. B: valores basales de UNa+ > 50 mmol/l. ΔUNa24h: cambio en el UNa+ a las 24 h; DEF: dosis equivalente de furosemida; RTI: razón de tasas de incidencia; UNa+: sodio urinario.](https://static.elsevier.es/multimedia/03008932/0000007400000007/v1_202106190918/S0300893220303316/v1_202106190918/es/main.assets/thumbnail/gr3.jpeg?xkr=eyJpdiI6IllmeTBxK2Npd1ZqWGNBbW1MMXdKR2c9PSIsInZhbHVlIjoiNDc0Q0YzaUtSQTJJck43MjA1UG9aaXdPWndHRVIzdjRFUGxad3M3dGxmOD0iLCJtYWMiOiIwNWYxZWEzYmEwNjY2YjM1NDhkMjM2ZjNjMmNlYzRiZDdkNWU4ZjM3ZTI3MTY3NjU0ZTk1ODkwODczNzg0OGE2IiwidGFnIjoiIn0=)