Nuestro objetivo es describir los resultados clínicos del uso del sistema de asistencia circulatoria mecánica CentriMag como puente a trasplante cardiaco (TxC) urgente.
MétodosSe realizó un análisis descriptivo de los desenlaces clínicos de los pacientes incluidos en un registro multicéntrico de 16 hospitales españoles tratados con el dispositivo Centrimag, configurado para asistencia ventricular izquierda (AVI) o biventricular (ABV). Todos los pacientes estaban en lista de espera para TxC urgente durante el periodo 2010-2020. Se excluyó a los pacientes con solo asistencia ventricular derecha u oxigenador extracorpóreo de membrana sin AVI. El objetivo principal del estudio fue la supervivencia a 1 año del TxC.
ResultadosSe estudió a 213 pacientes tratados con ABV y 145 con AVI como puente a TxC urgente. En total, se trasplantó a 303 pacientes (84,6%), y 53 (14,8) fallecieron antes de obtener un donante. El tiempo en asistencia fue una mediana de 15 días y> 30 días en 66 pacientes (18,6%). La supervivencia a 1 año del TxC fue del 77,6%. No se observaron diferencias estadísticamente significativas en la supervivencia entre los pacientes con ABV y AVI. Los pacientes tratados con AVS presentaron mayores tasas de sangrado, necesidad de transfusiones, hemólisis e insuficiencia renal que los tratados con AVI, mientras que este último grupo mostró mayor incidencia de ictus isquémico.
ConclusionesEn un contexto de priorización de candidatos con tiempos en lista de espera cortos, el empleo de CentriMag como puente a TxC fue factible y se asoció con resultados aceptables tanto antes como después del TxC.
Palabras clave
Los recientes cambios en las políticas de asignación de donantes de órganos han llevado a un uso creciente de la asistencia circulatoria mecánica transitoria como puente al trasplante cardiaco (TxC)1, como resultado de la priorización de estos candidatos en las listas de espera2. En la actualidad, aproximadamente entre un 30 y un 50% del total de TxC llevados a cabo anualmente en España corresponden a candidatos en los que se han utilizado dispositivos de asistencia de corta duración como puente al trasplante3, como el balón de contrapulsación intraaórtico, los dispositivos de asistencia ventricular (DAV) percutáneos, el oxigenador extracorpóreo de membrana (ECMO) y los DAV extracorpóreos de corta duración de inserción quirúrgica4. Dentro de este último grupo, goza de especial popularidad el sistema Abbot CentriMag (Abbott, Estados Unidos).
El sistema de asistencia circulatoria aguda Abbot CentriMag (anteriormente denominado Levitronix CentriMag o Thoratec CentriMag) utiliza una bomba centrífuga de levitación magnética que puede proporcionar un flujo sanguíneo de hasta 10 l/min en condiciones de carga óptimas5. Este sistema fue aprobado como método extracorpóreo para proporcionar hasta 30 días de asistencia ventricular izquierda (AVI), asistencia ventricular derecha o asistencia biventricular (ABV) en pacientes hospitalizados. Sin embargo, se han descrito buenos resultados incluso después de periodos de uso más prolongados6. Esta bomba puede usarse también como parte de circuitos de ECMO, con o sin AVI simultánea7. El dispositivo se implanta la mayoría de las veces como puente a la recuperación cardiaca o, si esto no es posible, como puente a una decisión terapéutica definitiva, como un TxC o un implante de DAV de larga duración.
El abordaje quirúrgico clásico para implantar un circuito CentriMag extracorpóreo implica la realización de una esternotomía media completa y la canulación directa de los grandes vasos torácicos y las cámaras cardiacas. Sin embargo, pueden utilizarse técnicas menos invasivas. La AVI puede proporcionarse mediante una cánula de flujo de entrada colocada en el ventrículo o la aurícula izquierdos a través de una toracotomía lateral, combinada con la colocación de una cánula de flujo de salida en la arteria subclavia/axilar o en la arteria femoral8,9; incluso se pueden evitar por completo las incisiones torácicas guiando la cánula de flujo de entrada hacia la aurícula izquierda a través del tabique interauricular utilizando una vía de acceso venoso transfemoral10. Para proporcionar asistencia ventricular derecha, puede canularse la arteria pulmonar a través de un único acceso venoso transyugular11. Todavía no se sabe si el empleo de abordajes menos invasivos para el implante del CentriMag pueden proporcionar beneficios clínicos en comparación con el método de implante clásico.
El objetivo de nuestro estudio es describir los desenlaces clínicos de los pacientes en los que se utilizó el sistema CentriMag configurado para AVI o para ABV como puente al TxC. Para ello, se analizó la información clínica recogida en una base de datos retrospectiva multicéntrica de España4.
MÉTODOSDescripción del estudioEl estudio ASIS-TC es un registro retrospectivo llevado a cabo en 16 centros de TxC de España4,12 (ver anexo 1). Se incluyó en el registro a los pacientes adultos consecutivos en lista de espera para TxC urgente mientras recibían asistencia circulatoria mecánica de corta duración con balón de contrapulsación intraaórtico, ECMO, DAV percutáneo o DAV extracorpóreo de inserción quirúrgica entre el 1 de enero de 2010 y el 31 de diciembre de 2020. Se excluyó del estudio a los pacientes en lista de espera para un segundo TxC o para un trasplante multiorgánico. El proyecto de investigación fue aprobado por el comité de ética para investigación clínica de la Comunidad Autónoma de Galicia (España). Se eximió al estudio del consentimiento informado, dado su diseño retrospectivo.
Para el presente análisis, se seleccionó de la base de datos del estudio ASIS-TC a todos los pacientes en lista de espera para TxC urgente mientras recibían asistencia con un sistema de asistencia circulatoria extracorpórea que utilizaba una bomba CentriMag, configurado para proporcionar AVI o ABV. Se excluyó a los pacientes tratados con asistencia ventricular solo derecha o con ECMO venoarterial sin AVI.
Según el protocolo de asignación de órganos de España, a los pacientes en puente a TxC tratados con AVI o ABV mediante el sistema CentriMag se les asignaba el grado máximo de prioridad en la lista de espera, al que se designa como «urgencia 0», a lo largo de todo el periodo del estudio4. El nivel de urgencia 0 implica prioridad para la asignación del primer donante de corazón apropiado obtenido en toda España. Los criterios específicos para la priorización en la lista de espera en España durante el periodo de estudio se detallan en la tabla 1 del material adicional.
Seguimiento y desenlaces del estudioSe siguió a los pacientes durante 1 año tras el TxC o, si eran dados de alta con vida y sin que se les hubiera practicado el TxC, 1 año después del alta hospitalaria. Se dispuso de información sobre la supervivencia al final del seguimiento de todos los pacientes.
Se analizó la incidencia de los resultados clínicos de interés tras el periodo de asistencia circulatoria: TxC, muerte sin TxC, alta hospitalaria sin TxC y transición a otros modos de asistencia circulatoria mecánica. También se evaluó la incidencia de eventos adversos clínicos relacionados con la asistencia circulatoria mecánica, como infección, disfunción del dispositivo, hemorragias, tromboembolias, ictus, reintervención cardiaca, hemolisis e insuficiencia renal, así como el desenlace posoperatorio hospitalario tras el TxC. En el material adicional del artículo se detallan las definiciones específicas de los desenlaces clínicos del estudio. Los desenlaces clínicos fueron evaluados por los investigadores locales.
Análisis estadísticoLas variables continuas se presentan en forma de media ± desviación estándar o, cuando muestran una asimetría notable, mediana [intervalo intercuartílico]. Las variables discretas se presentan mediante proporciones. Las comparaciones estadísticas se hicieron mediante la prueba de la χ2, la prueba de la t de Student o la prueba de la U de Mann-Whitney según correspondiera.
Se utilizó un modelo de regresión logística multivariable para el control del efecto de los posibles factores de confusión en la asociación entre el tipo de asistencia circulatoria (ABV frente a AVI) y el riesgo de muerte sin TxC. Teniendo en cuenta el número de eventos registrados (n=53), se introdujo en el modelo un máximo de 5 covariables, seleccionadas con base en la bibliografía previa, el conocimiento clínico y su distribución asimétrica entre los 2 grupos de estudio: edad, cardiopatía isquémica, esternotomías previas, asistencia circulatoria mecánica antes del implante del CentriMag y clasificación del Interagency Registry for Mechanically Assisted Circulatory Support.
La supervivencia durante el año siguiente al trasplante se evaluó con el método de Kaplan-Meier. Las comparaciones de los grupos se realizaron con la prueba de orden logarítmico (log-rank test). Se utilizó una regresión de Cox multivariable para el control del efecto de los posibles factores de confusión en la asociación entre el tipo de asistencia (ABV frente a AVI) y la mortalidad hasta 1 año después del trasplante. Teniendo en cuenta el número de eventos registrados (n=68), se introdujo en el modelo un máximo de 7 covariables, seleccionadas con base en la bibliografía previa, el conocimiento clínico y su distribución asimétrica entre los grupos de estudio: edad, cardiopatía isquémica, esternotomías previas, clasificación del Interagency Registry for Mechanically Assisted Circulatory Support, diabetes, enfermedad pulmonar obstructiva crónica y cáncer.
También se llevó a cabo una comparación exploratoria de los resultados previos y posteriores al trasplante en los pacientes a los que se implantó el dispositivo mediante una esternotomía media completa frente a abordajes menos invasivos.
Los análisis estadísticos se realizaron con el programa SPSS 25. La significación estadística se fijó en un valor de p <0,05.
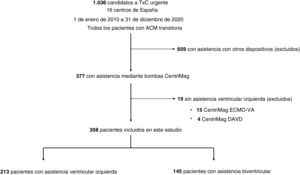
RESULTADOSPacientes y dispositivosEn el registro ASIS-TC se incluyó a 1.036 pacientes en la lista de espera para TxC urgente en 16 centros de España entre 2010 y 2020. De ellos, se trató a 377 con sistemas de asistencia circulatoria extracorpórea que empleaban la bomba CentriMag. Se excluyó a 15 pacientes tratados con ECMO venoarterial sin AVI y a 4 tratados con asistencia ventricular derecha. Así pues, formaron la población del estudio 358 pacientes. En la figura 1 se presenta un diagrama de flujo que detalla el proceso de selección de la población del estudio.
El sistema CentriMag se utilizó para proporcionar AVI a 213 pacientes (59,5%) y ABV a 145 (40,5%). El circuito de ABV incluyó un oxigenador en 9 pacientes.
Los dispositivos se implantaron mediante una esternotomía media completa en 277 pacientes (77,4%) y de forma menos invasiva en 81 (22,6%): por medio de toracotomías en 79 y sin incisiones torácicas en 2 (abordaje transeptal). Se colocó una cánula de flujo de entrada sistémico en el ventrículo izquierdo de 222 pacientes (62%) y en la aurícula izquierda de 136 (38%). La canulación del flujo de salida arterial fue central, a través de la aorta torácica, en 292 pacientes (81,6%) y periférica en 66 (18,4%): en la arteria subclavia/axilar en 60 (16,7%) y en la arteria femoral en 6 (1,7%). Se colocó una cánula arterial distal para la perfusión anterógrada de la extremidad en 3 de los pacientes con canulación arterial periférica.
De los 145 pacientes que requirieron ABV, en 136 (93,8%) se colocó una cánula de flujo de entrada venoso directamente en la aurícula derecha/vena cava torácica y en 9 (6,2%) se guio hasta el mismo sitio por una vía de acceso venoso transfemoral. Se colocó una cánula de flujo de salida pulmonar directamente en la arteria pulmonar en 144 pacientes (99,3%), mientras que en 1 (0,7%) se guio hasta la misma ubicación anatómica por una vía de acceso venoso transyugular.
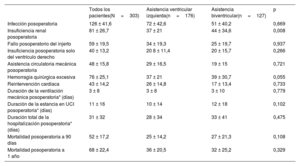
Características clínicas basalesEn la tabla 1 se muestran las características clínicas basales de los pacientes del estudio antes del implante del dispositivo.
Características clínicas basales y situación clínica de los pacientes del estudio antes del implante del dispositivo CentriMag según el tipo de asistencia mecánica empleado
| Todos los pacientes(N=358) | Asistencia ventricular izquierda(n=213) | Asistencia biventricular(n=145) | p | |
|---|---|---|---|---|
| Técnica quirúrgica | ||||
| Abordaje quirúrgico | <0,001 | |||
| Esternotomía media completa | 277 ± 77,4 | 142 ± 66,7 | 135 ± 93,1 | |
| Toracotomía | 79 ± 22,1 | 69 ± 32,4 | 10 ± 6,9 | |
| Sin incisiones torácicas (abordaje transeptal) | 2 ± 0,6 | 2 ± 0,9 | 0 | |
| Localización de la cánula de flujo de entrada sistémico | 0,189 | |||
| Aurícula izquierda | 136 ± 38 | 75 ± 35,2 | 61 ± 42,1 | |
| Ventrículo izquierdo | 222 ± 62 | 138 ± 64,8 | 84 ± 57,9 | |
| Localización de la cánula de flujo de salida arterial | <0,001 | |||
| Aorta torácica | 292 ± 81,6 | 158 ± 74,2 | 134 ± 92,4 | |
| Arteria axilar/subclavia | 60 ± 16,8 | 53 ± 24,9 | 7 ± 4,8 | |
| Arteria femoral | 6 ± 1,7 | 2 ± 0,9 | 4 ± 2,8 | |
| Antecedentes clínicos | ||||
| Edad (años) | 52,4±11,8 | 53,611,5 | 50,7±12,2 | 0,021 |
| Índice de masa corporala | 25,9±4 | 25,9±3,8 | 25,9±4,4 | 0,914 |
| Mujeres | 61 ± 17 | 34 ± 16 | 27 ± 18,6 | 0,511 |
| Inclusión previa en lista de espera para trasplante de corazón | 137 ± 38,3 | 79 ± 37,1 | 58 ± 40 | 0,578 |
| Diabetes | 73 ± 20,4 | 37 ± 17,4 | 36 ± 24,8 | 0,086 |
| Hipertensión | 241 ± 67,3 | 145 ± 68,1 | 96 ± 66,2 | 0,711 |
| Hipercolesterolemia | 237 ± 66,2 | 137 ± 64,3 | 100 ± 69 | 0,362 |
| Fumador actual o exfumador | 202 ± 56,4 | 125 ± 58,7 | 77 ± 53,1 | 0,296 |
| Cardiopatía isquémica | 163 ± 45,5 | 81 ± 38 | 82 ± 56,6 | 0,001 |
| Shockcardiogénico debido a infarto agudo de miocardio | 120 ± 33,5 | 85 ± 39,9 | 35 ± 24,1 | 0,002 |
| Shock cardiogénico tras cirugía cardíaca | 19 ± 5,3 | 6 ± 2,8 | 13 ± 9 | 0,011 |
| Esternotomía previa | 32 ± 8,9 | 12 ± 5,6 | 20 ± 13,8 | 0,008 |
| Desfibrilador implantable | 154 ± 43 | 95 ± 44,6 | 59 ± 40,7 | 0,463 |
| Terapia de resincronización cardiaca | 50 ± 14 | 27 ± 12,7 | 23 ± 15,9 | 0,393 |
| Antecedentes de taquicardia ventricular | 120 ± 33,5 | 69 ± 32,4 | 51 ± 35,2 | 0,585 |
| Antecedentes de parada cardiaca | 67 ± 18,7 | 33 ± 15,5 | 34 ± 23,4 | 0,058 |
| Antecedentes de fibrilación auricular | 81 ± 22,6 | 49 ± 23 | 32 ± 22,1 | 0,835 |
| Enfermedad pulmonar obstructiva crónica | 26 ± 7,3 | 20 ± 9,4 | 6 ± 4,1 | 0,060 |
| Ictus previo | 19 ± 5,3 | 11 ± 5,2 | 8 ± 5,5 | 0,844 |
| Enfermedad arterial periférica | 11 ± 3,1 | 8 ± 3,8 | 3 ± 2,1 | 0,364 |
| Cáncer | 16 ± 4,5 | 5 ± 2,3 | 11 ± 7,6 | 0,019 |
| Estado clínico antes del implante del dispositivo | ||||
| Perfil INTERMACS | 0,023 | |||
| INTERMACS 1 | 109 ± 30,4 | 54 ± 25,4 | 55 ± 37,9 | |
| INTERMACS 2 | 159 ± 44,4 | 96 ± 45,1 | 63 ± 43,4 | |
| INTERMACS 3 | 81 ± 22,6 | 58 ± 27,2 | 23 ± 15,9 | |
| INTERMACS 4 | 9 ± 2,5 | 5 ± 2,3 | 4 ± 2,8 | |
| Frecuencia cardiaca en reposo (lpm)a | 93,8±18,7 | 92,5±20,2 | 95,6±16,3 | 0,160 |
| Presión arterial sistólica (mmHg)a | 97,5±14,7 | 98,2±15,2 | 96,5 ±14,1 | 0,331 |
| Infección activa que requiere antibióticos i.v. | 40 ± 11,2 | 20 ± 9,4 | 20 ± 13,8 | 0,194 |
| Ventilación mecánica invasiva | 166 ± 46,4 | 95 ± 44,6 | 71 ± 49 | 0,416 |
| Fármacos inotrópicos | 271 ± 75,7 | 167 ± 71,1 | 104 ± 78,4 | 0,148 |
| Vasopresores | 152 ± 42,5 | 86 ± 40,4 | 66 ± 45,5 | 0,334 |
| Tratamiento de sustitución renal | 30 ± 8,4 | 13 ± 6,1 | 17 ± 11,7 | 0,060 |
| Asistencia circulatoria mecánica | 192 ± 53,6 | 105 ± 49,3 | 87 ± 60 | 0,046 |
| Balón intraaórtico | 156 ± 43,6 | 83 ± 39 | 63 ± 43,4 | |
| Impella | 18 ± 5 | 8 ± 3,7 | 10 ± 6,9 | |
| ECMO venoarterial | 70 ± 19,5 | 33 ± 15,5 | 37 ± 25,5 | |
| Berlinheart Excor | 1 ± 0,3 | 0 | 1 ± 0,7 | |
| Parámetros hemodinámicos | ||||
| FEVI (%)a | 21,8±10,5 | 21,8±10,7 | 21,7±10,2 | 0,934 |
| TAPSE (mm)a | 15,2±4,1 | 15,7±4 | 14,4±4,2 | 0,034 |
| Índice cardiaco (l/min/m2)a | 2,2±0,8 | 2,3±0,6 | 2,2±1 | 0,502 |
| Presión venosa central (mmHg)a | 12,6±5,8 | 11,6±5,2 | 14±6,3 | 0,002 |
| Presión pulmonar enclavada (mmHg)a | 21,8±8,5 | 21,1±8,6 | 23,1±8,3 | 0,110 |
| Presión pulmonar media (mmHg)a | 30,4±12 | 29,3±11,7 | 32,2±12,4 | 0,088 |
| Resistencia vascular pulmonar (unidades Wood)a | 2,7±1,7 | 2,6±1,6 | 2,9±1,9 | 0,266 |
| Valores analíticos | ||||
| Hemoglobina (g/dl)a | 11,2±2,3 | 11,4±2,4 | 10,8±2,3 | 0,030 |
| Leucocitos (×109/l)a | 12±5,9 | 11,7±5,9 | 12,5±5,9 | 0,256 |
| Plaquetas (×109/l)a | 198,3±95,1 | 206,4±90,6 | 186,6±100,5 | 0,059 |
| Creatinina (mg/dl)a | 1,3±0,7 | 1,3±0,7 | 1,3±0,7 | 0,673 |
| Bilirrubina (mg/dl)a | 1,4±1,2 | 1,3±1,1 | 1,5 ± 1,3 | 0,090 |
| Albúmina (g/dl)a | 3,2±0,7 | 3,4±0,7 | 3,1±0,6 | 0,030 |
| AST (UI/l)a | 249,2±1.187,2 | 208,1±1.370,1 | 306,6±873 | 0,491 |
| ALT (UI/l)a | 179±636,4 | 135±617,3 | 241,8±660,2 | 0,164 |
| pHa | 7,42±0,7 | 7,42±0,7 | 7,42±0,8 | 0,828 |
| Características del donanteb | ||||
| Donante mujer | 57 ± 18,8 | 33 ± 18,8 | 24 ± 18,9 | 0,974 |
| Edad del donante (años) | 43,5±12,3 | 43,5±12,6 | 43,5±11,9 | 0,987 |
| Tiempo de isquemia fría (min) | 209,4 ± 61,2 | 204,7 ± 63,5 | 215,9 ± 57,4 | 0,116 |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; ECMO: oxigenador extracorpóreo de membrana; FEVI: fracción de eyección del ventrículo izquierdo; INTERMACS: Interagency Registry for Mechanically Assisted Circulatory Support; TAPSE: excursión sistólica del anillo tricuspídeo.
Valores no disponibles: frecuencia cardiaca en reposo (n=75), presión arterial sistólica (n=79), índice de masa corporal (n=38), FEVI (n=16), TAPSE (n=173), índice cardiaco (n=169), presión venosa central (n=123), presión pulmonar enclavada (n=154), presión pulmonar media (n=131), resistencia vascular pulmonar (n=189), hemoglobina (n=14), leucocitos (n=16), plaquetas (n=19), creatinina (n=14), bilirrubina (n=77), albúmina (n=190), AST (n=73), ALT (n=67) y pH (n=83).
Los pacientes tratados con AVI eran de más edad y tenían mayores prevalencias de cardiopatía isquémica y shock cardiogénico asociado con infarto de miocardio, en comparación con lo observado en los pacientes tratados con ABV. Los pacientes que necesitaron ABV presentaban mayores prevalencias de shock poscardiotomía, esternotomía previa, cáncer y nivel 1 en la clasificación del Interagency Registry for Mechanically Assisted Circulatory Support.
Los pacientes tratados con ABV tenían valores superiores de presión venosa central y valores inferiores de extrusión sistólica del anillo tricuspídeo en comparación con los tratados con AVI, así como valores inferiores de hemoglobina y albúmina sérica.
Los abordajes quirúrgicos menos invasivos se usaron en 71 pacientes (33,3%) tratados con AVI y en 10 (6,9%) tratados con ABV (p <0,001). La canulación arterial periférica del flujo de salida fue más frecuente en el grupo de AVI (n=55, 25,8%) que en el de ABV (n=11, 7,6%; p <0,001).
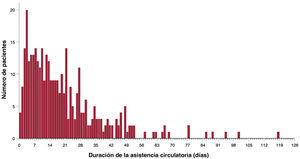
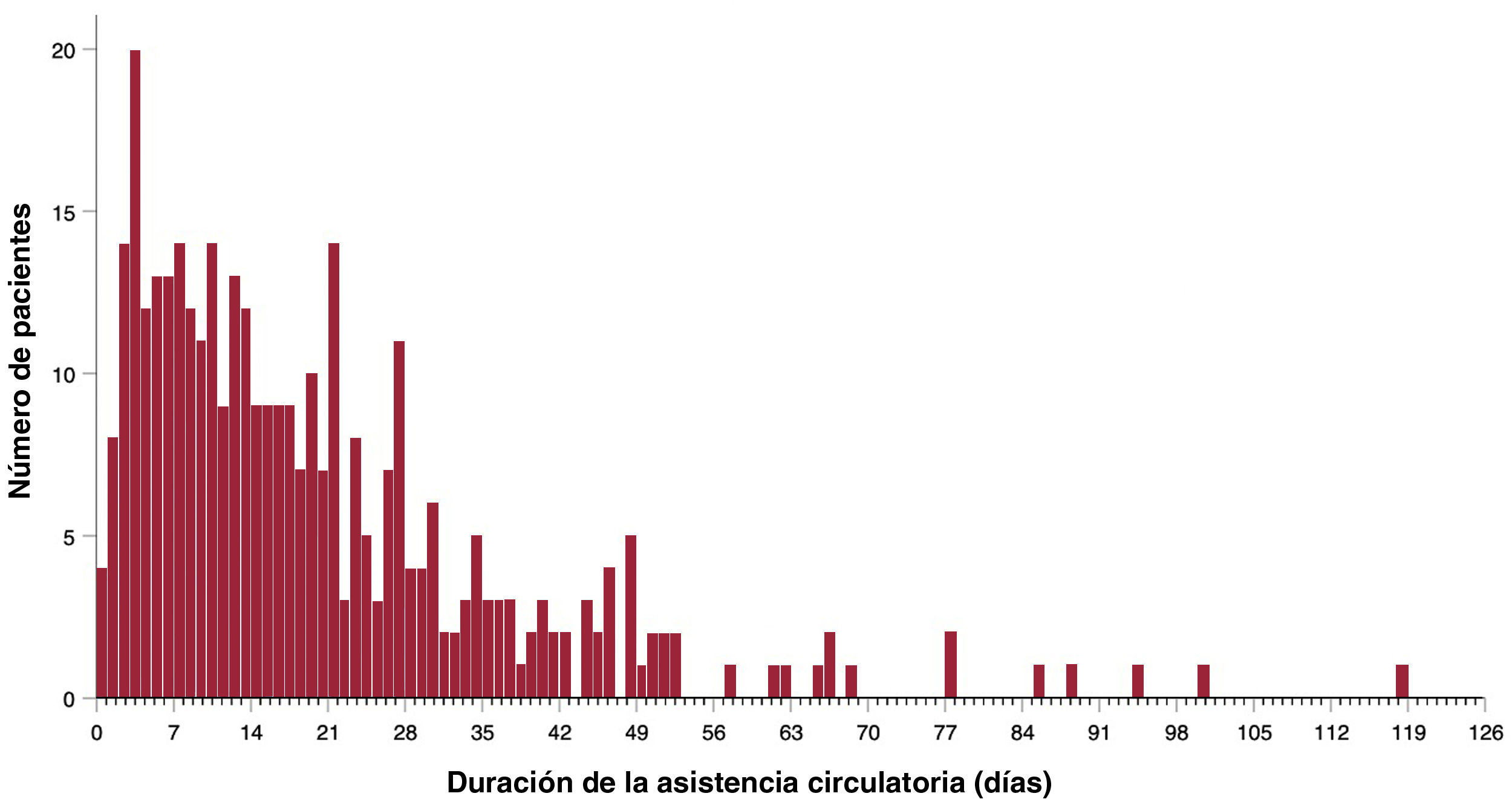
Resultados de la asistencia circulatoria mecánicaLa mediana de duración de la asistencia fue de 15 [0-118] días, sin que se observaran diferencias significativas en función del tipo de asistencia utilizado (grupo de AVI, 15 días frente a grupo de ABV, 15 días; p=0,926). La asistencia de 66 pacientes (18,6%) fue > 30 días y 5 de ellos se sometieron a reemplazo electivo de una bomba funcionante. En la figura 2 se muestra la distribución de la duración de la asistencia en la población del estudio.
Durante el periodo de hospitalización tras el implante del dispositivo, 303 pacientes (84,6%) se sometieron a TxC y 53 (14,8%) fallecieron sin trasplante. Se cambió a 4 pacientes de AVI CentriMag a ABV CentriMag; de ellos, solo 1 fue trasplantado, mientras que 3 fallecieron con asistencia circulatoria.
Se explantó el dispositivo CentriMag antes de que se encontrara un donante en 5 pacientes (1,4%), de los que 1 falleció poco después de la retirada del dispositivo, mientras que 2 pasaron a otros tipos de asistencia circulatoria mecánica: 1 paciente al sistema HVAD (Medtronic, Irlanda) y otro al ECMO venoarterial Cardiohelp (Maquet, Alemania), pero ambos pacientes fallecieron durante el ingreso hospitalario. Tan solo 2 pacientes (0,6%) fueron dados de alta del hospital con vida tras el explante del dispositivo CentriMag, y ambos fallecieron antes de 1 año.
La tasa acumulada de TxC durante la hospitalización índice fue del 83,1% en el grupo de AVI y del 86,9% en el grupo de ABV (p=0,328), mientras que la tasa acumulada de muerte hospitalaria sin TxC fue del 16% en el grupo de AVI y del 13,1% en el de ABV (p=0,455). No se observó una diferencia estadísticamente significativa en la tasa de muerte hospitalaria sin TxC entre los pacientes a los que se implantó el dispositivo mediante una esternotomía media completa y aquellos con abordajes quirúrgicos menos invasivos (el 14,1 frente al 17,3%; p=0,475).
En la regresión logística multivariable, se estimó la odds ratio ajustada por lo que respecta a la muerte hospitalaria sin TxC de los pacientes con ABV frente a AVI de 0,94 (intervalo de confianza del 95% [IC95%], 0,50-1,78).
Eventos clínicos adversos asociados con la asistencia circulatoria mecánicaEn la tabla 2 se muestra la incidencia acumulada de eventos clínicos adversos mayores asociados a la asistencia circulatoria mecánica. Los pacientes con ABV presentaron tasas significativamente superiores de hemorragia (AVI, el 31% frente a ABV, el 44,1%; p=0,011), necesidad de transfusiones de sangre (AVI, el 67,4% frente a ABV, el 84,1%; p <0,001), hemolisis (AVI, el 1,9% frente a ABV, eñ 7,6%; p=0,008) e insuficiencia renal con necesidad de diálisis (AVI, el 16% frente a ABV, el 29%; p=0,003) en comparación con los pacientes tratados con AVI. La incidencia de eventos cerebrovasculares fue significativamente mayor en el grupo de AVI (AVI, el 14,6% frente a ABV, el 7,6%; p=0,044).
Incidencia acumulada de eventos adversos clínicos relacionados con la asistencia circulatoria mecánica en la población del estudio según el tipo de asistencia aplicada
| Todos los pacientes (N=358) | Asistencia ventricular izquierda(n=213) | Asistencia biventricular (n=145) | p | |
|---|---|---|---|---|
| Necesidad de transfusiones de sangre | 266 ± 74,3 | 144 ± 67,6 | 122 ± 84,1 | <0,001 |
| Infección | 158 ± 44,1 | 94 ± 44,1 | 64 ± 44,1 | 0,999 |
| Evento hemorrágico | 130 ± 36,3 | 66 ± 31 | 64 ± 44,1 | 0,011 |
| Torácico | 104 ± 29,1 | 56 ± 26,3 | 48 ± 33,1 | |
| Relacionado con el lugar de acceso vascular | 32 ± 8,9 | 18 ± 8,5 | 14 ± 9,7 | |
| Intracraneal | 4 ± 1,1 | 1 ± 0,5 | 3 ± 2,1 | |
| Gastrointestinal | 13 ± 3,6 | 8 ± 3,8 | 5 ± 3,4 | |
| Otros | 25 ± 7 | 11 ± 5,2 | 14 ± 9,7 | |
| Evento tromboembólico | 56 ± 15,6 | 39 ± 18,3 | 17 ± 11,7 | 0,092 |
| Accidente isquémico transitorio cerebral | 8 ± 2,2 | 8 ± 3,8 | 0 | |
| Ictus isquémico | 34 ± 9,5 | 25 ± 11,7 | 9 ± 6,2 | |
| Tromboembolia arterial no cerebral | 6 ± 1,7 | 0 | 6 ± 4,1 | |
| Tromboembolia venosa | 4 ± 1,1 | 3 ± 1,4 | 1 ± 0,7 | |
| Trombosis del dispositivo | 11 ± 2,8 | 7 ± 3,3 | 3 ± 2,1 | |
| Trombosis intracardiaca | 5 ± 1,4 | 2 ± 0,9 | 3 ± 2,1 | |
| Evento cerebrovascular | 42 ± 11,7 | 31 ± 14,6 | 11 ± 7,6 | 0,044 |
| Insuficiencia renal que requiere diálisis | 76 ± 21,2 | 34 ± 16 | 42 ± 29 | 0,003 |
| Reintervención cardiaca | 82 ± 23 | 47 ± 22,2 | 35 ± 24,1 | 0,664 |
| Complicación de herida quirúrgica | 11 ± 3,1 | 7 ± 3,3 | 4 ± 2,8 | 0,776 |
| Hemolisis | 15 ± 4,2 | 4 ± 1,9 | 11 ± 7,6 | 0,008 |
| Derrame pleural o neumotórax | 62 ± 17,3 | 31 ± 14,6 | 31 ± 21,4 | 0,098 |
| Derrame pericárdico | 55 ± 15,4 | 33 ± 15,5 | 22 ± 15,2 | 0,943 |
| Mal funcionamiento del dispositivo | 18 ± 5 | 14 ± 6,6 | 4 ± 2,8 | 0,105 |
| Relacionado con la bomba | 3 ± 0,8 | 3 ± 1,4 | 0 | |
| Relacionado con las cánulas | 15 ± 4,2 | 11 ± 5,2 | 4 ± 2,8 |
Los valores expresan n (%).
Los pacientes con un implante de dispositivo menos invasivo tuvieron tasas de hemorragia inferiores (esternotomía completa frente a abordaje menos invasivo, el 39,7 frente al 24,7%; p=0,013), necesidad de transfusiones (el 83,4 frente al 43,2%; p <0,001) y reintervención cardiaca (el 26,4 frente al 11,1%; p=0,004) (tabla 2 del material adicional).
Disfunción del dispositivoPresentaron disfunción del dispositivo de 18 pacientes (5%); 3 casos se debieron a un fallo electromecánico de la bomba y los 15 restantes estuvieron relacionados con las cánulas: 9 casos de trombosis, 3 de desplazamiento y 3 de drenaje sanguíneo insuficiente.
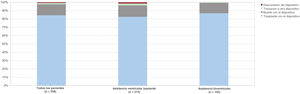
No se observaron diferencias estadísticamente significativas en cuanto a la incidencia de disfunción del dispositivo entre los pacientes tratados con ABV y los tratados con AVI (el 2,8 frente al 6,6%; p=0,105). Sin embargo, los pacientes con un método de implante menos invasivo presentaron una tasa acumulada de disfunción del dispositivo superior a la de aquellos con una esternotomía media completa (el 9,9 frente al 3,6%; p =0,023) (figura 3).
En total, 8 (44,4%) de los 18 pacientes en los que hubo disfunción del dispositivo fallecieron sin llegar al trasplante. Puede consultarse la información detallada específica de los episodios de disfunción del dispositivo en la tabla 3 del material adicional.
Supervivencia después del trasplanteEn total, 303 pacientes se sometieron a TxC urgente durante el ingreso hospitalario índice. Durante la cirugía de TxC, 176 pacientes (58,1%) fueron tratados con AVI CentriMag y 127 (41,9%) con ABV CentriMag. La media ± desviación estándar de la edad de los donantes fue 43,5±12,3 años; 57 (18,8%) eran mujeres. La media de tiempo de isquemia fue de 209,4 ± 61,2min. No hubo diferencias estadísticamente significativas entre los pacientes tratados con ABV y los tratados con AVI por lo que respecta a las características de los donantes (tabla 1).
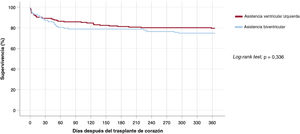
Durante el primer año siguiente al trasplante fallecieron 68 pacientes (22,4%), 36 (20,5%) del grupo de AVI y 32 (25,2%) del de ABV. En la figura 4 se presentan las curvas de supervivencia durante el año posterior al trasplante.
No se observaron diferencias estadísticamente significativas en la supervivencia a 1 año tras el trasplante entre los candidatos que recibieron un tratamiento puente al trasplante con AVI o con ABV, según lo indicado por la prueba de orden logarítmico (p=0,336). No hubo diferencias estadísticamente significativas en la supervivencia a 1 año después del trasplante entre los pacientes a los que se implantó el dispositivo mediante una esternotomía media y aquellos con abordajes quirúrgicos menos invasivos (el 78,8 frente al 73,1%; p=0,325) ni entre la asistencia circulatoria > 30 días y la ≤ 30 días (el 75,4 frente al 78%; p=0,670).
La regresión de Cox multivariable estimó una hazard ratio ajustada para la mortalidad a 1 año después del trasplante en los pacientes tratados con ABV en comparación con los tratados con AVI de 1,16 (IC95%, 0,69-1,94).
Otros resultados posoperatorios del trasplanteEn la tabla 3 se muestra la incidencia de eventos clínicos adversos mayores durante el periodo de hospitalización posoperatoria del TxC. Los pacientes con puente al trasplante mediante ABV presentaron una incidencia de insuficiencia renal posoperatoria significativamente superior a la de aquellos con puente al trasplante con AVI (el 34,6 frente al 21%; p=0,008). No se observaron diferencias significativas entre los 2 grupos por lo que respecta a la incidencia de otros desenlaces en la hospitalización posterior al trasplante.
Resultados posoperatorios durante el periodo de hospitalización tras el trasplante cardiaco según el tipo de asistencia circulatoria
| Todos los pacientes(N=303) | Asistencia ventricular izquierda(n=176) | Asistencia biventricular(n=127) | p | |
|---|---|---|---|---|
| Infección posoperatoria | 126 ± 41,6 | 72 ± 42,6 | 51 ± 40,2 | 0,669 |
| Insuficiencia renal posoperatoria | 81 ± 26,7 | 37 ± 21 | 44 ± 34,6 | 0,008 |
| Fallo posoperatorio del injerto | 59 ± 19,5 | 34 ± 19,3 | 25 ± 19,7 | 0,937 |
| Insuficiencia posoperatoria solo del ventrículo derecho | 40 ± 13,2 | 20 8 ± 11,4 | 20 ± 15,7 | 0,266 |
| Asistencia circulatoria mecánica posoperatoria | 48 ± 15,8 | 29 ± 16,5 | 19 ± 15 | 0,721 |
| Hemorragia quirúrgica excesiva | 76 ± 25,1 | 37 ± 21 | 39 ± 30,7 | 0,055 |
| Reintervención cardiaca | 43 ± 14,2 | 26 ± 14,8 | 17 ± 13,4 | 0,733 |
| Duración de la ventilación mecánica posoperatoria* (días) | 3 ± 8 | 3 ± 8 | 3 ± 10 | 0,779 |
| Duración de la estancia en UCI posoperatoria* (días) | 11 ± 16 | 10 ± 14 | 12 ± 18 | 0,102 |
| Duración total de la hospitalización posoperatoria* (días) | 31 ± 32 | 28 ± 34 | 33 ± 41 | 0,475 |
| Mortalidad posoperatoria a 90 días | 52 ± 17,2 | 25 ± 14,2 | 27 ± 21,3 | 0,108 |
| Mortalidad posoperatoria a 1 año | 68 ± 22,4 | 36 ± 20,5 | 32 ± 25,2 | 0,329 |
UCI: unidad de cuidados intensivos.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
No hubo diferencias estadísticamente significativas en la incidencia de los resultados adversos posoperatorios del TxC entre los pacientes con un implante convencional y los tratados con un implante menos invasivo (tabla 4 del material adicional).
DISCUSIÓNHasta donde nosotros sabemos, este es el estudio más amplio realizado que se haya centrado en el uso del sistema de asistencia circulatoria aguda CentriMag con indicación principal como puente al TxC. Nuestros resultados respaldan la viabilidad de esta estrategia, que mostró unos resultados clínicos bastante satisfactorios, con independencia de cuál fuera el método de asistencia utilizado (AVI o ABV) o del tipo de abordaje quirúrgico para el implante del dispositivo.
Se han publicado varias series de pacientes tratados con el sistema CentriMag desde que Mueller et al.13 presentaran su experiencia inicial hace 2 décadas. Hasta el momento, la experiencia más amplia, de un solo centro, era la descrita por el grupo de Columbia14,15. En un contexto de uso como puente a la decisión, estos autores observaron una frecuencia de recuperación miocárdica de ∼30 y una frecuencia de uso como puente al tratamiento de sustitución cardiaco (TxC o implante de DAVI) de ∼35, así como una tasa de supervivencia global a 1 año de ∼50. En una revisión sistemática de 53 estudios de observación con la inclusión de 999 pacientes tratados con CentriMag, Borisenko et al.7 describieron una supervivencia general con la asistencia circulatoria de entre 62 y 83 según el estado cardiaco subyacente, de tal manera que el peor resultado era el observado en los subgrupos de pacientes con shock poscardiotomía o con fallo primario del órgano después del trasplante.
En nuestra cohorte, la supervivencia durante la asistencia circulatoria tras el implante del dispositivo CentriMag alcanzó ∼85%, y este resultado global parece superior al de las experiencias previas7,14–17. Sin embargo, este resultado se ve influido por un sesgo de selección, ya que los pacientes incluidos en nuestro estudio eran considerados candidatos adecuados para el TxC y, de hecho, todos ellos estaban en lista de espera con una prioridad alta. Hasta la fecha, un pequeño estudio de Def et al.18 ha sido el único que ha evaluado los resultados del sistema CentriMag en un contexto específico de puente al trasplante. Estos autores describieron una tasa de supervivencia a 1 año notable, del 89%, en una cohorte unicéntrica de 27 candidatos a TxC consecutivos en los que se usó el dispositivo como tratamiento puente. Sin embargo, en esta publicación anterior no se presentaron datos específicos sobre la distribución de las muertes antes y después del trasplante.
En un contexto de tiempos en lista de espera breves, como el que se da en España4, el uso del sistema CentriMag es una estrategia atractiva como puente al TxC urgente para candidatos en un estado de deterioro agudo. Este dispositivo para uso de corta duración está ampliamente disponible, es fácil de implantar y proporciona una asistencia circulatoria completa que puede mantenerse de manera segura durante periodos más largos que los que proporcionan el ECMO o los DAV percutáneos, lo cual favorece la recuperación de la función de los órganos diana y la rehabilitación física. El periodo aprobado oficialmente de 30 días para el uso del sistema CentriMag a menudo basta para esperar a que se disponga de un órgano; de todos modos, casi un 20% de los pacientes de nuestra cohorte necesitaron la asistencia circulatoria durante lapsos más largos, y los resultados observados fueron comparables. Otros autores han descrito una buena experiencia clínica con el sistema CentriMag durante más de 30 días de asistencia circulatoria6.
Conceptualmente, el sistema CentriMag está destinado a proporcionar asistencia circulatoria a pacientes con shock cardiogénico en estado crítico. Sin embargo, en nuestra cohorte el dispositivo se implantó a unos pocos candidatos a trasplante cuyo estado clínico era menos grave, como en el caso de los pacientes con perfiles de nivel 3 o 4 del Interagency Registry for Mechanically Assisted Circulatory Support (INTERMACS). A primera vista, esto podría ser contraintuitivo, ya que cabría prever que, al deteriorarse su estado, estos pacientes necesitaran el implante de un DAV de larga duración como primera opción. Esta decisión se vio influida probablemente por el buen rendimiento del sistema de obtención de donantes de órganos de España, que hace que sea sumamente probable asignar un corazón para trasplante a los candidatos de urgencia 0 en un plazo inferior a las 2 semanas. Es de destacar que el número de DAV de larga duración implantados como puente a TxC se redujo bruscamente en Estados Unidos después de 2018, cuando se adoptó un nuevo protocolo de asignación de donantes de órganos que da prioridad a los candidatos a TxC que están en asistencia circulatoria mecánica de corta duración19.
En nuestro estudio, la supervivencia a 1 año después del trasplante fue de ∼78%. Este resultado es ligeramente inferior al de los pacientes a los que se practicó un TxC sin asistencia circulatoria mecánica en España en un periodo contemporáneo3, pero esto debe interpretarse en el contexto del estado crítico de los candidatos a TxC urgente, así como el uso frecuente de donantes subóptimos de edad avanzada y largos tiempos de isquemia fría. De hecho, los resultados en los pacientes con CentriMag como puente a trasplante parecen similares a los de otros candidatos a TxC urgente en los que se empleó como puente un DAV percutáneo como Impella (Abiomed, Estados Unidos) y algo mejores que aquellos con ECMO venoarterial4. La cuestión de si dar prioridad a los candidatos a TxC en los que se están usando dispositivos transitorios es o no una estrategia razonable continúa siendo motivo de controversia. Nosotros creemos que esta estrategia sí es razonable. Aunque la mortalidad de estos pacientes después del trasplante puede aumentar, es probable que sean el subgrupo con una relación riesgo-beneficio del TxC más favorable, dada la elevada mortalidad prevista si no reciben un trasplante20.
Los eventos adversos clínicos, tanto si están relacionados con el dispositivo en sí como si se deben al estado crítico del paciente, son el talón de Aquiles de la asistencia circulatoria mecánica. Las complicaciones registradas con más frecuencia son las trombóticas, las hemorrágicas y las infecciosas15, y se dieron también con frecuencia en nuestra cohorte. Las tasas de ictus isquémico, eventos hemorrágicos e infección fueron del ∼10, el ∼36 y el ∼44%, lo cual concuerda con lo indicado en la literatura médica6,15. Los casos de mal funcionamiento del dispositivo que causaron un fallo de la asistencia fueron muy poco frecuentes y la mayoría de ellos se debieron a una trombosis o desplazamiento de las cánulas. La incidencia del fallo de la bomba fue baja (< 1%), y ello respalda la seguridad del sistema.
La tasa de ictus isquémico fue mayor en los pacientes tratados con AVI que en los tratados con ABV. Este resultado se vio influido por el uso más frecuente de la AVI en los pacientes con enfermedad coronaria y un infarto de miocardio reciente, que teóricamente son más propensos a sufrir eventos cerebrovasculares. El ictus isquémico puede ser consecuencia de la manipulación o la canulación arteriales, la formación de un trombo en la bomba o a lo largo de la cánula o la presencia de un trombo intracardiaco. No está claro si el uso más frecuente de la canulación periférica (principalmente axilar o subclavia) en los pacientes en puente con AVI podría haber contribuido a producir este fenómeno, ya que en otros estudios no hubo una asociación clara con un exceso de complicaciones tromboembólicas8.
Por otro lado, los pacientes que necesitaron ABV presentaron unas tasas acumuladas de hemolisis superiores a las de los tratados con AVI, y es probable que ello esté relacionado con un aumento de la tensión tangencial y la destrucción de hematíes que es inherente al uso de sistemas circulatorios más complejos, que generalmente requieren 2 bombas y 3 o 4 cánulas vasculares. El alto riesgo de insuficiencia renal observado en los pacientes que necesitaron ABV a veces puede ser consecuencia de la hemolisis; sin embargo, es probable que se explique con más frecuencia por el efecto nocivo de la insuficiencia del ventrículo derecho en la función renal21.
Los eventos hemorrágicos asociados a la ACM suelen producirse en los primeros días siguientes al implante del dispositivo15 y están relacionados principalmente con la agresión tisular quirúrgica y la coagulopatía intrínseca, que es frecuente en los pacientes con una insuficiencia cardiaca avanzada y puede agravarse por el bypass cardiopulmonar y el uso de fármacos antitrombóticos. En nuestra serie, la tasa de eventos hemorrágicos fue mayor en los pacientes que necesitaron ABV en comparación con los tratados con AVI; esta observación probablemente se deba a la mayor invasividad quirúrgica en el primer grupo8, influida también por un mayor deterioro de la función hepática como resultado de la congestión sistémica.
En nuestra cohorte se utilizaron técnicas quirúrgicas menos invasivas principalmente para el implante de circuitos de AVI y ello se asoció con menores tasas acumuladas de hemorragia quirúrgica, transfusiones de sangre y reintervenciones cardiacas. Sin embargo, el posible beneficio de estos nuevos métodos de abordaje en cuanto a la reducción de la pérdida hemática preoperatoria puede verse contrarrestado por un aumento del riesgo de mal funcionamiento del dispositivo que cause un fallo de la asistencia circulatoria; en nuestra cohorte, esto se debió la mayoría de las veces a problemas con las cánulas, como trombosis, desplazamiento accidental o drenaje sanguíneo insuficiente. De hecho, el implante menos invasivo del CentriMag no tuvo una repercusión significativa en la supervivencia previa o posterior al implante en nuestro estudio. Estos resultados deben interpretarse con precaución, dado que el número de intervenciones menos invasivas fue relativamente bajo en nuestra cohorte y que el periodo de estudio incluyó probablemente la curva de aprendizaje de la técnica quirúrgica en la mayoría de los centros participantes; ambas circunstancias podrían haber llevado a un número de eventos adversos clínicos superior al esperado en los pacientes con un implante menos invasivo.
LimitacionesLa presente investigación tiene varias limitaciones. En primer lugar, nuestro análisis se basó en un registro general de los pacientes candidatos a TxC urgente que no se diseñó con la finalidad específica del estudio. En segundo lugar, nuestros resultados pueden estar influidos por los sesgos de selección, observación, información y confusión inherentes a los estudios observacionales. En tercer lugar, el registro no contó con una supervisión externa y la asignación de los resultados clínicos adversos se dejó al criterio de los investigadores locales. En cuarto lugar, se analizó una población heterogénea de pacientes candidatos a TxC de varios centros distintos de España, con protocolos locales y experiencia clínica diversos y un periodo de inclusión prolongado, por lo que los resultados pueden estar afectados por una heterogeneidad significativa. Es de destacar que nos centramos específicamente en un contexto de puente al trasplante, y que todos los pacientes incluidos en este estudio estaban en lista de espera con alta prioridad mientras eran tratados con asistencia circulatoria mecánica transitoria. Por último, dadas las peculiaridades de nuestra red nacional común de órganos, que se caracteriza por unos tiempos de espera muy breves para los candidatos a TxC priorizados, no se puede asegurar que nuestros resultados sean reproducibles en otras circunstancias.
CONCLUSIONESEl presente estudio respalda la viabilidad del uso del dispositivo CentriMag como puente al TxC para pacientes candidatos de alta prioridad, en un contexto de tiempos breves en lista de espera. Los resultados de esta estrategia durante el uso del dispositivo y después del trasplante fueron aceptables, con independencia de que el paciente necesitara una asistencia solo izquierda o una ABV.
- –
El trasplante cardiaco urgente es una opción que debe tenerse en cuenta para los pacientes con insuficiencia cardiaca avanzada en estado crítico que no pueden ser desconectados de una asistencia circulatoria mecánica transitoria.
- –
El sistema CentriMag es un dispositivo extracorpóreo, de flujo continuo e implante quirúrgico que tiene como finalidad proporcionar hasta 30 días de asistencia circulatoria ventricular izquierda, ventricular derecha o biventricular a pacientes en shock cardiogénico.
- –
En España es bastante frecuente el uso del dispositivo CentriMag como puente directo al trasplante cardiaco. Sin embargo, falta información sobre los resultados de esta estrategia terapéutica.
- –
Hasta donde nosotros sabemos, este es el estudio multicéntrico más amplio realizado hasta la fecha en el que se presenten los resultados del uso del dispositivo CentriMag como puente directo al trasplante cardiaco.
- –
Nuestro estudio respalda la viabilidad de esta estrategia, que se asoció con unos resultados clínicos aceptables, con independencia de que el dispositivo se utilizara para asistencia ventricular izquierda o asistencia biventricular.
El registro ASIS-TC fue financiado por la Fundación Mutua Madrileña (Madrid, España) a través de 2 subvenciones de investigación competitivas (Ayudas para Investigación en Salud, convocatorias anuales X y XIV, años 2014 y 2018), concedidas a E. Barge-Caballero, autor sénior de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORESG. Cabezón-Villalba y E. Barge-Caballero contribuyeron por igual a este manuscrito.
G. Cabezón-Villalba: conceptualización, redacción de la propuesta inicial del manuscrito y obtención de los datos. E. Barge-Caballero: conceptualización, redacción de la propuesta inicial del manuscrito, obtención de los datos, obtención de financiación, análisis estadístico, coordinación y supervisión. L. de la Fuente-Galán: conceptualización, obtención de los datos y corrección del manuscrito. M.G. Crespo-Leiro: obtención de financiación, obtención de los datos, corrección del manuscrito, coordinación y supervisión. J. Muñiz: obtención de financiación, análisis estadístico y corrección del manuscrito. Todos los demás autores: obtención de los datos y corrección del manuscrito.
CONFLICTO DE INTERESESE. Barge-Caballero recibió una subvención académica de Abbot Vascular para realizar el Postgraduate Course in Heart Failure 2016-2017 de la Universidad de Zurich, así como subvenciones de viaje, pagos por consultoría y pagos por conferencias de Abbot Vascular. J. González-Costello recibió subvenciones para viajes, pagos por consultoría y pagos por conferencias de Abbot Vascular. M.G. Crespo-Leiro recibió subvenciones para viajes de Abbot Vascular. M.D. García-Cosío Carmena recibió pagos por conferencias de Abbot Vascular y una subvención para viaje de Epycardio. S. Mirabet-Pérez recibió subvenciones para viajes de Abbot Vascular. M.Á. Castel-Lavilla recibió pagos por conferencias de Microport CRM, Cuquerella Medical Communication y AstraZeneca y subvenciones para viajes de Abbot Vascular, Epycardio, Novartis y AstraZeneca.
Los autores de este manuscrito garantizan que los siguientes investigadores son responsables de los datos publicados en este estudio:
Eduardo Barge-Caballero (Complejo Hospitalario Universitario de A Coruña); José Luis Lambert-Rodríguez (Hospital Universitario Central de Asturias); María Ángeles Castel-Lavilla (Hospital Clínic de Barcelona); José González-Costello (Hospital Universitario de Bellvitge); Francisco González-Vílchez (Hospital Universitario Marqués de Valdecilla); Luis de la Fuente-Galán (Hospital Clínico Universitario de Valladolid); Juan Delgado-Jiménez (Hospital Universitario 12 de Octubre); Luis Almenar-Bonet (Hospital Universitario y Politécnico La Fe); Iris Garrido-Bravo (Hospital Universitario Virgen de la Arrixaca); Sonia Mirabet-Pérez (Hospital Universitario Santa Creu i Sant Pau); Teresa Blasco-Peiró (Hospital Universitario Miguel Servet); Gregorio Rábago Juan-Aracil (Clínica Universidad de Navarra); Diego Rangel-Sousa (Hospital Universitario Virgen del Rocío); Daniela Hervás-Sotomayor (Hospital Universitario Reina Sofía); Manuel Martínez-Sellés (Hospital Universitario Gregorio Marañón); Manuel Gómez-Bueno (Hospital Universitario Puerta de Hierro).