La infección por citomegalovirus (CMV) se asocia a una importante morbilidad y a un resultado clínico desfavorable en los pacientes receptores de trasplantes. La resistencia clínica a los fármacos clásicos utilizados contra el CMV (ganciclovir, valganciclovir, foscarnet y las combinaciones de estos) y la aparición de acontecimientos adversos inaceptables pueden hacer que los médicos responsables de estos pacientes tengan que afrontar situaciones complejas aparentemente sin solución. El maribavir, un nuevo fármaco antiviral benzimidazólico, puede ser útil en este contexto.
Presentamos el caso de un varón de 45 años de edad a quien se le practicó un trasplante de corazón con CMV D−/R+. La inmunosupresión consistió en una inducción con basiliximab (2 dosis) y una terapia triple con tacrolimus, micofenolato mofetilo y prednisona. Dado que no se trataba de un paciente con un riesgo alto de CMV, se programó una estrategia de tratamiento de anticipación.
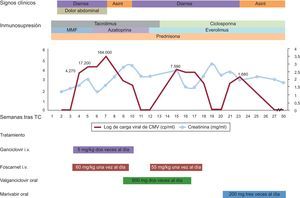
Cuatro semanas después del trasplante de corazón, el paciente presentó febrícula, dolor abdominal y diarrea. La exploración física reveló la presencia de esplenomegalia. La carga viral de CMV (COBAS® AmpliPrep/COBAS® TaqMan® CMV test) fue de 4.270 copias/ml. Se trató al paciente con ganciclovir por vía intravenosa (5mg/kg, 2 veces al día) durante 3 semanas, sin que hubiera mejoría de los síntomas o de la viremia. Se añadió al tratamiento foscarnet (60mg/kg, una vez al día, por vía intravenosa), y se cambió el micofenolato mofetilo por azatioprina para reducir la diarrea.
Después de otras 3 semanas de tratamiento combinado anti-CMV hubo mejoría clínica, con resolución de la diarrea y dos valores de carga de CMV bajos-indeterminados (< 150 copias/ml). La presencia de calambres musculares generalizados de intensidad moderada y de hipocalcemia se atribuyó al foscarnet. Se cambió el tratamiento a valganciclovir por vía oral (900mg, 2 veces al día). A las 2 semanas reapareció la diarrea, con unas cargas de CMV mediante reacción en cadena de la polimerasa (PCR) persistentemente bajas. La colonoscopia confirmó una colitis por CMV (figura), y la carga viral aumentó a 7.500 copias/ml. Se modificó la inmunosupresión basal: el tacrolimus y la azatioprina se reemplazaron por una combinación de ciclosporina y everolimus. Se añadió foscarnet (55mg/kg, una vez al día, por vía intravenosa) al tratamiento oral con valganciclovir. Aparecieron de nuevo calambres musculares e hipocalcemia, con un empeoramiento de la función renal (creatinina: 3mg/dl) y neutropenia (2.200 leucocitos/mm3) de manera asociada al uso de foscarnet y valganciclovir. Dada la resistencia clínica a diferentes combinaciones de tratamientos anti-CMV durante 10 semanas y la toxicidad de los fármacos utilizados, se optó por iniciar un tratamiento con maribavir por vía oral (200mg/8h) como tratamiento fuera de las indicaciones autorizadas; la carga viral basal en ese momento era de 1.680 copias/ml. Tres semanas después, los recuentos de CMV mediante PCR se redujeron a < 150 copias/ml y la diarrea desapareció. El tratamiento con maribavir se mantuvo durante otras 2 semanas, sin que hubiera efectos adversos significativos. El paciente se mantuvo asintomático y las determinaciones de CMV mediante PCR fueron negativas durante los 6 meses siguientes.
Evolución temporal de los resultados clínicos, el tratamiento y la carga viral de citomegalovirus. Se presentan, en forma de valores semanales, la carga viral de citomegalovirus en plasma y la función renal. Asint: asintomático; CMV: citomegalovirus; i.v.: intravenoso; MMF: micofenolato mofetilo; TC: trasplante cardiaco.
La infección por CMV es frecuente después de un trasplante de órgano sólido y puede comportar una importante morbilidad, la pérdida del órgano trasplantado y acontecimientos adversos. Tal como ilustra este caso, la sospecha de afectación gastrointestinal (diarrea) debe motivar la realización de una endoscopia con obtención de muestras de la mucosa, puesto que la carga viral puede ser indetectable en sangre periférica.
Se sospecha resistencia a los fármacos antivirales cuando no hay mejoría (o cuando hay recaídas) de la viremia de CMV ni de los síntomas clínicos después de un tratamiento antiviral prolongado (≥ 6 semanas)1. En la actualidad, la mayoría de los casos de resistencia a la medicación pueden explicarse por mutaciones en genes que codifican la ADN cinasa UL97 y la ADN polimerasa UL54, que son enzimas que intervienen en la replicación del virus. Sin embargo, solo una minoría de ellos se confirman genéticamente, ya que estas pruebas son caras y no están disponibles en todos los centros.
Algunos fármacos anti-CMV experimentales se utilizan en casos de infección por CMV resistente a los medicamentos tradicionales. El maribavir es uno de estos fármacos que inhibe de manera directa la cinasa UL97, ejerce una intensa actividad frente a CMV, tiene una buena biodisponibilidad oral y presenta un perfil de toxicidad favorable. Hay series de casos2,3 que han descrito el uso con éxito de dosis altas de maribavir (800-1.600mg/día) para la infección resistente a los fármacos tradicionales en pacientes con trasplantes de órganos sólidos, con casos ocasionales de resistencia. El efecto secundario descrito con más frecuencia es la alteración del gusto (sabor amargo), y los efectos menos frecuentes son los gastrointestinales (diarrea, náuseas y vómitos) y la erupción, que han motivado la retirada del tratamiento en algunos casos.
El letermovir es un inhibidor de la UL56 que inhibe la replicación del virus y tiene actividad anti-CMV in vitro. Se ha publicado un único caso4 de un trasplante bipulmonar con una enfermedad por CMV multirresistente invasiva en el que se utilizó con éxito letermovir sin que hubiera efectos adversos.
Se ha demostrado que la leflunomida, un fármaco que se emplea en la artritis reumatoide, tiene actividad anti-CMV, además de su acción inmunosupresora. Se ha descrito el empleo con éxito de leflunomida5, principalmente en casos de carga viral baja y sin enfermedad grave. No se conoce la dosis óptima y los principales efectos adversos son diarrea, anemia e hipertransaminasemia.
El CMX001 produce unas concentraciones intracelulares elevadas del fármaco antiviral activo difosfato de cidofovir, con efectos anti-CMV in vitro6 y en los receptores de trasplante de células hematopoyéticas, sin causar la nefrotoxicidad del cidofovir. No se ha determinado todavía la dosis óptima, y la diarrea es un efecto adverso limitante de la dosis.
Hay otros fármacos experimentales con actividad anti-CMV in vitro y que tienen un buen perfil de seguridad: BAY384766 y GW275175X.
Tal como pone de manifiesto este caso, el maribavir es una buena alternativa cuando los fármacos tradicionales no dan resultado en el tratamiento de la infección por CMV farmacorresistente, en combinación con cambios de la inmunosupresión (introducción de everolimus y reducción de la potencia inmunosupresora global).