La miocardiopatía hipertrófica (MCH) es una enfermedad de origen genético causada por mutaciones en al menos 11 genes que codifican mayoritariamente proteínas sarcoméricas cardiacas1. Clásicamente, el manejo de esta enfermedad implica la evaluación sistemática y durante años de los familiares de primer grado del individuo afecto1,2. Desde que en 1990 se describiera la primera mutación asociada a MCH, la realización de estudios genéticos ha avanzado desde la investigación a la clínica. Actualmente, conocer la mutación causal en un individuo con MCH no suele implicar cambios en su actitud terapéutica. Sin embargo, conocer el defecto genético puede tener otras implicaciones importantes, ya que permite brindar a pacientes y familiares un consejo genético eficaz2. Además, objetivar precozmente la mutación en familiares permite estrechar el seguimiento y detectar antes las complicaciones. Por último, a los familiares no portadores de la mutación se los podrá dar de alta, evitando así seguimientos innecesarios1,2. Se ha demostrado que la realización sistemática de estudios genéticos en la MCH es coste-efectiva en modelos teóricos aplicados en países anglosajones3, pero no existen datos en nuestro medio.
El objetivo de nuestro trabajo es evaluar el impacto clínico y económico del estudio genético de familias con MCH en nuestro país. Para ello, realizamos un estudio observacional de las familias con MCH sometidas a análisis genético (2008-2011) en dos unidades de cardiopatías familiares.
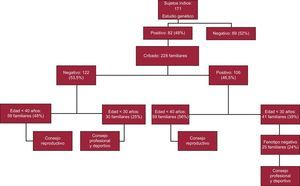
Se evaluó la utilidad clínica del análisis genético (consejo reproductivo, profesional y deportivo) y el ahorro económico directo derivado del cese de seguimiento de familiares con resultado genético negativo. Durante el periodo analizado, se realizó estudio genético a 171 pacientes índice con MCH (118 [68%] varones; media de edad, 52±17 años). En todos los casos, se analizaron mediante secuenciación Sanger los exones y las regiones intrónicas flanqueantes de los 5 genes más frecuentemente implicados en la MCH (MYH7, MYBPC3, TPM1, TNNI3 y TNNT2). En 43 sujetos índice (25%), se analizaron además otros 4 genes (ACTC, MYL2, MYL3 y TNNC1) y en 4 pacientes se analizaron también los genes PRKAG2 y LAMP2. Se identificó la mutación causal en 82 pacientes índice (48%). Se excluyó a los sujetos con variantes de significado incierto.
A continuación se realizó evaluación clínica (con electrocardiograma y ecocardiograma) más cribado genético en cascada de los familiares que así lo desearon. En total, se evaluó a 228 familiares (2,8 familiares/paciente índice; media de edad, 39±19 años). De estos, 106 familiares (46,5%) eran portadores de la misma mutación que el paciente índice (genotipo positivo). En cambio, 122 familiares (53,5%) no presentaban la mutación (genotipo negativo) y, tras recibir consejo genético, se los dio de alta definitivamente (figura).
El consejo genético incluye asesoramiento reproductivo, profesional y deportivo. El equipo asesor debe contar con profesionales experimentados. Se debe explicar con claridad a pacientes y familiares los riesgos y beneficios del test, así como las implicaciones clínicas, psicológicas y sociales. Idealmente, el consejo reproductivo debe realizarse antes de la gestación. Se debe tratar aspectos como patrón de herencia, penetrancia, expresividad e historia familiar. Se debe informar de las alternativas reproductivas a todo sujeto portador de una mutación causal.
Con el fin de evaluar a los sujetos que en nuestro estudio se beneficiaron de consejo reproductivo, fijamos el fin de la edad reproductiva a los 40 años. Así, el 42% de los sujetos con mutación (78 pacientes) eran menores de 40 años y recibieron asesoramiento reproductivo. También se han beneficiado de consejo reproductivo los familiares no portadores. Así, en nuestro trabajo, casi la mitad (48%) de los familiares con genotipo negativo (59 familiares) eran menores de 40 años y se les informó de que sus descendientes no sufrirán la enfermedad (figura).
En cuanto al consejo laboral y deportivo, la Sociedad Europea de Cardiología desaconseja la actividad deportiva competitiva a los sujetos con genotipo positivo y fenotipo negativo4, pero no establece recomendaciones acerca del consejo profesional. Sin embargo, dada la alta probabilidad de que los portadores genéticos desarrollen el fenotipo a lo largo de su vida, parece razonable desaconsejar profesiones que limiten su desempeño a pacientes con MCH (policía, bombero, piloto, etc.), así como la participación en deportes competitivos que impliquen actividad física intensa.
En nuestra población, 25 familiares con genotipo positivo y fenotipo negativo (24%) y 30 familiares con genotipo negativo (25%) eran menores de 30 años, por lo que se les pudo orientar acerca de su carrera profesional y su práctica deportiva (figura).
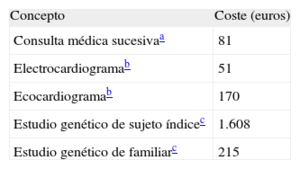
Finalmente, determinamos el coste económico de realizar estudios genéticos como la diferencia entre el coste del análisis genético y el ahorro de consultas, electrocardiogramas y ecocardiogramas en familiares de genotipo negativo que cesan el seguimiento periódico que recomiendan las guías de práctica clínica1,2. Los costes del estudio genético y las pruebas se han calculado a partir de la media de las tarifas de dos empresas y de los costes oficiales de nuestras comunidades autónomas (tabla)5,6.
Tras un estudio clínico detallado para identificar posibles familias con mutaciones múltiples, se dio el alta definitiva a 122 familiares con genotipo negativo.
En total, la realización de estudios genéticos supuso un gasto calculado de 323.988 euros. Como el ahorro derivado de cesar el seguimiento en familiares con genotipo negativo supone 300.913 euros (3.167±1.906 por familiar dado de alta) (tabla)5,6, el cálculo del coste directo de realizar estudio genético (coste del análisis genético menos el ahorro sanitario directo) asciende a 23.075 euros (135 euros por cada familia sometida a estudio genético).
En el presente trabajo mostramos la utilidad tanto clínica como económica del estudio genético en la MCH en nuestro medio. Nuestro estudio no ha considerado el posible ahorro en otras pruebas (resonancias magnéticas cardiacas para casos dudosos) ni otros beneficios indirectos (ausencias laborales, alivio de la ansiedad) que también se derivan del cese de seguimientos. Tampoco se ha considerado el ahorro de costes que implica realizar estudios genéticos de manera no externalizada. Finalmente, el estudio se ha realizado con base en la tecnología de estudio genético disponible en los años analizados. Es previsible que las nuevas técnicas de ultrasecuenciación, que permiten analizar más genes a un coste menor, hagan todavía más favorable el balance económico y la utilidad clínica presentados en este trabajo.
FINANCIACIÓNEste trabajo se ha realizado parcialmente con financiación del Instituto de Salud Carlos III (PI11/0699, RD12/0042/0066 y RD12/0042/0069).