La miocardiopatía por sobrecarga de hierro es frecuente en los pacientes con síndrome mielodisplásico (SMD) de bajo riesgo que requieren transfusiones repetidas de concentrados de hematíes (CH). El diagnóstico precoz es esencial para instaurar un tratamiento eficaz con quelantes del hierro y mejorar la supervivencia de estos pacientes1, y la detección de la sobrecarga férrica miocárdica modifica la estrategia por intensificación del tratamiento.
El tiempo de relajación T2* mediante cardiorresonancia magnética (CRM) es el patrón de referencia para el diagnóstico de la sobrecarga férrica miocárdica. Recientemente, pequeños estudios llevados a cabo en pacientes con talasemia mayor (TM) han indicado la utilidad de nuevas técnicas de imagen como el mapeo T1, cuyos tiempos se muestran reducidos en pacientes con siderosis cardiaca2,3.
Por ello, se llevó a cabo un estudio observacional prospectivo para analizar la utilidad del mapeo T1 y T2 en la evaluación de los pacientes con SMD de bajo riesgo en asistencia transfusional crónica (incluidos los grupos de riesgo muy bajo, bajo o intermedio de la clasificación Revised-International Prognostic Scoring System [IPSS-R]), de edad > 18 años, que dieron su autorización para ello mediante la firma de un documento de consentimiento informado. Los criterios de exclusión fueron el SMD perteneciente a los grupos de riesgo muy alto o alto según la clasificación IPSS-R y los pacientes a los que nunca se habían administrado transfusiones. El estudio fue aprobado por el comité de ética de investigación local.
Entre enero de 2016 y febrero de 2017, se incluyó a 31 pacientes con SMD de bajo riesgo (tabla 1). Se estudió a los pacientes mediante una CRM de 1,5 T (Philips Healthcare, Países Bajos), que incluyó una evaluación de la morfología y la función cardiacas, realce tardío de gadolinio, mapeo T2* miocárdico y hepático (secuencias de gradiente multieco con 15 tiempos de eco de 1-16 ms), mapeo nativo T1 (secuencia MOLLI [modified look locker inversion] con un esquema de adquisición de 5(3)3) y T2 (secuencia de gradiente-espín-eco multi-eco) siguiendo las recomendaciones actuales4. El posprocesado del mapeo se realizó mediante el programa informático Medis 2.1, trazando la región de interés (ROI) en la región medioseptal en eje corto del ventrículo izquierdo.
Características basales, principales resultados de la evaluación mediante cardiorresonancia magnética y evolución
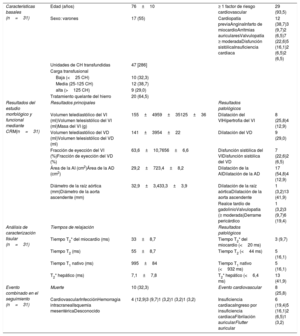
| Características basales (n=31) | Edad (años) | 76±10 | ≥ 1 factor de riesgo cardiovascular | 29 (93,5) |
| Sexo: varones | 17 (55) | Cardiopatía previaAnginaInfarto de miocardioArritmias auricularesValvulopatía ≥ moderadaDisfunción sistólicaInsuficiencia cardiaca | 12 (38,7)3 (9,7)2 (6,5)7 (22,6)5 (16,1)2 (6,5)2 (6,5) | |
| Unidades de CH transfundidas | 47 [286] | |||
| Carga transfusional | ||||
| Baja (<25 CH) | 10 (32,3) | |||
| Media (25-125 CH) | 12 (38,7) | |||
| alta (>125 CH) | 9 (29,0) | |||
| Tratamiento quelante del hierro | 20 (64,5) | |||
| Resultados del estudio morfológico y funcional mediante CRM(n=31) | Resultados principales | Resultados patológicos | ||
| Volumen telediastólico del VI (ml)Volumen telesistólico del VI (ml)Masa del VI (g) | 155±4959±35125±36 | Dilatación del VIHipertrofia del VI | 8 (25,8)4 (12,9) | |
| Volumen telediastólico del VD (ml)Volumen telesistólico del VD (ml) | 141±3954±22 | Dilatación del VD | 9 (29,0) | |
| Fracción de eyección del VI (%)Fracción de eyección del VD (%) | 63,6±10,7656±6,6 | Disfunción sistólica del VIDisfunción sistólica del VD | 7 (22,6)2 (6,5) | |
| Área de la AI (cm2)Área de la AD (cm2) | 29,2±723,4±8,2 | Dilatación de la AIDilatación de la AD | 17 (54,8)4 (12,9) | |
| Diámetro de la raíz aórtica (mm)Diámetro de la aorta ascendente (mm) | 32,9±3,433,3±3,9 | Dilatación de la raíz aórticaDilatación de la aorta ascendente | 1 (3,2)13 (41,9) | |
| Realce tardío de gadolinioValvulopatía (≥ moderada)Derrame pericárdico | 1 (3,2)3 (9,7)6 (19,4) | |||
| Análisis de caracterización tisular (n=31) | Tiempos de relajación | Resultados patológicos | ||
| Tiempo T2* del miocardio (ms) | 33±8,7 | Tiempo T2* del miocardio (<20 ms) | 3 (9,7) | |
| Tiempo T2 (ms) | 55±8,7 | Tiempo T2 (<44 ms) | 5 (16,1) | |
| Tiempo T1 nativo (ms) | 995±84 | Tiempo T1 nativo (<932 ms) | 5 (16,1) | |
| T2* hepático (ms) | 7,1±7,8 | T2* hepático (<6,4 ms) | 13 (41,9) | |
| Evento combinado en el seguimiento (n=31) | Muerte | 10 (32,3) | Evento cardiovascular | 8 (25,8) |
| CardiovascularInfecciónHemorragia intracranealIsquemia mesentéricaDesconocido | 4 (12,9)3 (9,7)1 (3,2)1 (3,2)1 (3,2) | Insuficiencia cardiacaIngreso por insuficiencia cardiacaFibrilación auricularFlutter auricular | 6 (19,4)5 (16,1)2 (6,5)1 (3,2) | |
AD: aurícula derecha; AI: aurícula izquierda; CRM: cardiorresonancia magnética; VD: ventrículo derecho; VI: ventrículo izquierdo.
Los valores expresan n (%) o media ± desviación estándar.
Las medidas y los resultados patológicos se basan en los valores normales establecidos4 y, en el caso del mapeo T1 y T2, en los extraídos de una cohorte de 292 controles sanos examinados con la misma técnica local (T1 nativo, 993±62ms; T2, 52±8ms).
La exploración mediante CRM puso de manifiesto una gran prevalencia de cardiopatía estructural no conocida (51,6%) (tabla 1) y hasta un 16,1% de los pacientes mostraron una reducción patológica de los tiempos de relajación (tabla 1).
Se estudió la correlación del mapeo T1 y T2 con los parámetros de sobrecarga de hierro (carga transfusional, parámetros bioquímicos y T2* hepático y miocárdico).
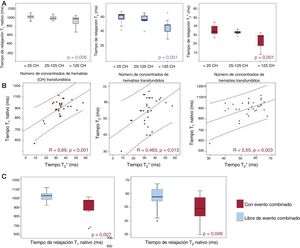
Se objetivó una reducción significativa de los tiempos T2*, T1 nativo y T2 a medida que aumentaba la carga transfusional de CH (figura 1A). Se identificó un valor de corte de 65 CH recibidos para la detección de una reducción patológica del T1 (< 932ms) (área bajo la curva, 0,762; sensibilidad, 80%; especificidad, 66%).
Resultados del mapeo T1, T2 y T2* miocárdico en pacientes con síndrome mielodisplásico de riesgo bajo. A: relación entre los tiempos T1, T2 y T2* y los concentrados de hematíes transfundidos. B: correlación entre los tiempos T1, T2 y T2*. C: asociación entre los tiempos T1 y T2 y el evento combinado de mortalidad por cualquier causa o evento cardiovascular.
Los tiempos T2*, T1 y T2 mostraron también una reducción significativa a medida que aumentaban las concentraciones séricas de ferritina (T2* R=–0,533; p=0,001; T1 R=–0,501; p <0,001; T2 R=–0,36; p=0,039).
Los tiempos T1 y T2 mostraron una correlación positiva con los valores del parámetro de referencia de T2* miocárdico (figura 2B). Además, hubo una correlación positiva estadísticamente significativa de los tiempos T1 y T2. Los pacientes con sobrecarga férrica miocárdica definida por T2* (< 20ms) presentaron unos valores significativamente inferiores de T2 (42 frente a 56ms; p=0,014) y T1 (803 frente a 1.012ms; p <0,001) en comparación con los pacientes con un T2* normal. En cambio, el mapeo de T1 y T2 no mostró correlación con el T2* hepático.
Se analizó la asociación del mapeo T1 y T2 con el evento combinado de mortalidad por cualquier causa o evento cardiovascular (nuevo diagnóstico de insuficiencia cardiaca [IC], arritmia auricular o ventricular) durante el seguimiento.
Tras una mediana de seguimiento de 2,4 [0,7] años, 10 pacientes (32,3%) sufrieron el evento combinado (tabla 1). Un 19,4% de los pacientes presentaron tanto un evento cardiovascular como el posterior fallecimiento.
Todos los pacientes con un T2* <20ms en el momento de la inclusión (3 pacientes; 9,7%) presentaron el evento combinado durante el seguimiento, en comparación con los pacientes con un T2* normal (el 100 frente al 76%; p=0,023). Los pacientes que sufrieron el evento combinado tenían tiempos significativamente inferiores de T1 nativo (974 [131] frente a 1.029 [66] ms; p=0,007), T2 (49 [16] frente a 58 [9] ms; p=0,049) y T2 (30 [15] frente a 33 [5] ms; p=0,047) en comparación con los pacientes libres de eventos (figura 1C).
En nuestro conocimiento, este es el primer estudio realizado en pacientes con SMD en asistencia transfusional en el que se analizan técnicas de caracterización tisular mediante CRM distintas del T2*.
Nuestros resultados resaltan la relación entre los mapas de T1 y T2 y la sobrecarga férrica miocárdica definida por T2*, la carga transfusional y los valores de ferritina sérica. La mayor proporción de pacientes con una reducción patológica de T1 en comparación con la reducción de T2* en nuestra población indica que el T1 podría verse afectado de manera más temprana que el T2* en presencia de siderosis cardiaca, de manera similar a lo descrito en pacientes con TM5. La reducción de los tiempos T1 y T2 probablemente indicarían un depósito incipiente de hierro en los pacientes con un T2* normal y ausencia de otras cardiopatías. La correlación observada entre T1 y el patrón de referencia T2* es más fuerte que en el caso de T2. Además, el valor de corte observado de 65 CH para detectar una reducción patológica del T1 es inferior al valor clásico de 100 CH utilizado para pacientes en potencial riesgo de sobrecarga férrica miocárdica. Esto podría desempeñar un papel en la detección precoz de la miocardiopatía por sobrecarga de hierro y conducir a una optimización del tratamiento quelante del hierro que modificaría el curso de la enfermedad.
Por lo que respecta a la utilidad pronóstica de las técnicas paramétricas, nuestro estudio en la población de pacientes con SMD de bajo riesgo corrobora la relación existente entre el T2* miocárdico patológico y la aparición de eventos adversos, de manera similar a lo que ocurre en los pacientes con TM. Por lo que respecta a los valores nativos de T1 y T2, nuestro trabajo indica por primera vez su relación con los eventos adversos en una enfermedad hematológica con dependencia transfusional. Es probable que la edad, las comorbilidades y el remodelado cardiaco secundario a la anemia crónica contribuyan al desarrollo de la elevada prevalencia de cardiopatía estructural diagnosticada en el estudio basal y la alta incidencia de eventos cardiovasculares que se observó en nuestra población.
Entre las limitaciones de nuestro trabajo se encuentra que se trata de un estudio observacional unicéntrico, con un reducido número de pacientes y seguimiento a corto plazo.
En conclusión, el análisis de caracterización tisular miocárdica mediante el mapeo T1 y T2 en pacientes con SMD de bajo riesgo con dependencia transfusional se relaciona significativamente con la carga transfusional, las concentraciones de ferritina y el T2* miocárdico. Los pacientes que sufrieron el combinado de evento cardiovascular o muerte por cualquier causa en el seguimiento presentaron más frecuentemente un T2* miocárdico < 20ms, así como menores valores de T1 nativo y T2 miocárdicos. El T1 parece verse afectado más precozmente que el T2* y tiene utilidad pronóstica, por lo que podría ser un marcador para indicar un tratamiento de quelación temprano en esta población.
FINANCIACIÓNEste trabajo fue financiado por una subvención de la Gerencia Regional de Salud de Castilla y León (GRS1203/A/15) y un contrato Río Hortega (CM19/00055) financiado por el Instituto de Salud Carlos III de España (financiación conjunta del Fondo Social Europeo «Invierte en tu futuro»).
CONFLICTO DE INTERESESA. Martín-García declara pagos personales de Daichii Sankyo, pagos personales de Bayer, pagos personales de Pfizer, pagos personales de Novartis y apoyo no económico de MSD, sin relación con el trabajo presentado. M. Díez-Campelo declara subvenciones y otros apoyos de NOVARTIS, durante la realización del estudio, así como subvenciones de CELGENE y de TAKEDA, sin relación con el trabajo presentado.
Los autores agradecen la participación desinteresada de todos los pacientes incluidos en el estudio.