Los electrogramas almacenados por los desfibriladores implantables actuales permiten al clínico revisar las alteraciones eléctricas durante los eventos que conducen a la activación del desfibrilador, así como evaluar el resultado de la terapia administrada. En la mayoría de los pacientes, esta información permite efectuar un diagnóstico preciso del tipo de arritmia causante de la activación del dispositivo y, como resultado, optimizar el tratamiento de estos pacientes. Sin embargo, todavía es preciso establecer criterios de discriminación adicionales que nos permitan diferenciar con mayor precisión la etiología de los episodios detectados por el dispositivo. En este artículo se describen: a) los principios básicos para la discriminación de arritmias basado en el análisis del registro de los electrogramas intracavitarios (EGM) de los episodios; b) la utilidad del análisis de los EGM en el tratamiento de pacientes con arritmias ventriculares; c) las principales limitaciones de los métodos empleados, y d) finalmente, se presentan pruebas científicas de la utilidad de nuevos métodos de discriminación.
Palabras clave
desfibrilador automático implantable.
electrograma intracavitario.
fibrilación ventricular.
ritmo sinusal.
taquicardia supraventricular.
taquicardia ventricular.
Los desfibriladores automáticos implantables (DAI) han mejorado significativamente el pronóstico de los pacientes con riesgo de presentar arritmias ventriculares malignas. Sin embargo, su utilización no está exenta de problemas. Así, hasta un 30% de los pacientes experimenta descargas inapropiadas y un 20% puede recibir múltiples descargas, lo que causa deterioro de la calidad de vida, hospitalizaciones, proarritmia e incremento de la mortalidad1-3. La posibilidad de registrar la actividad eléctrica cardiaca durante los eventos que conducen a la activación del DAI puede ayudar a identificar el mecanismo arrítmico causante y contribuir así a mejorar el tratamiento de los pacientes con arritmias ventriculares malignas. Los DAI de primera generación eran meros contadores de eventos, en los que se determinaba lo apropiado de la terapia según la severidad de los síntomas y/o la disponibilidad puramente casual de un registro del electrocardiograma durante el episodio. Por el contrario, los dispositivos implantados en la actualidad almacenan una serie de registros intracardiacos que permiten diagnosticar en un elevado porcentaje de casos el tipo de arritmia que pone en marcha los mecanismos de detección y terapia del DAI. En el presente artículo describiremos: a) los principios básicos para la discriminación de arritmias basada en el análisis del registro de los electrogramas intracavitarios (EGM) de los episodios; b) la utilidad del análisis de los EGM en el tratamiento de pacientes con arritmias ventriculares; c) las principales limitaciones de los métodos empleados, y d) los nuevos métodos de discriminación. La descripción de los fundamentos en los que se basa la detección de los DAI, así como de los algoritmos de discriminación, está más allá de los objetivos de este artículo y puede encontrarse de forma exhaustiva en otros textos4.
PRINCIPIOS BÁSICOS DE LA DETECCIÓN DE LOS DESFIBRILADORES AUTOMÁTICOS IMPLANTABLES. ELECTROGRAMAS INTRACAVITARIOSLa información que los DAI actuales ofrecen respecto a los episodios detectados (tratados o abortados) incluye la fecha y hora del evento, la frecuencia y la estabilidad de los intervalos RR del evento (algunos fabricantes la representan a modo de gráfica de intervalos RR frente a tiempo), el resultado de la terapia, así como los registros intracavitarios del EGM bipolar (campo cercano, sensado o detección) y/o monopolar (campo lejano, desfibrilación o choque) del electrodo ventricular derecho, junto con la interpretación que el dispositivo hace de ellos (canal de marcas) (fig. 1). Los registros del EGM bipolar reflejan las señales que conducen a la terapia del DAI, puesto que son éstos los que utiliza el dispositivo para realizar la clasificación del tipo de arritmia. El EGM monopolar o de campo lejano permite en algunos casos registrar la actividad auricular y, además, aporta datos útiles para determinar el mecanismo causante de la taquicardia, como la anchura y/o el cambio en la morfología de la taquicardia. Aunque en la mayoría de los casos los criterios de morfología del EGM monopolar sólo se utilizan para el análisis posterior del episodio, los DAI de última generación implementan ya nuevos algoritmos basados en criterios morfológicos de discriminación5,6. Además, en determinados casos podemos disponer de la información correspondiente a los electrodos auricular y/o de ventrículo izquierdo.
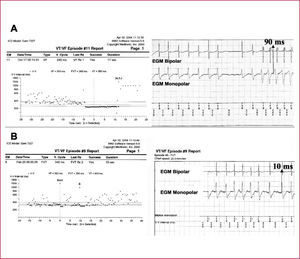
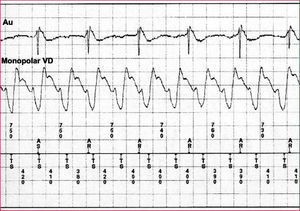
A. El ritmo basal previo altamente irregular característico de una fibrilación auricular (izquierda). El episodio de taquicardia se inicia por secuencia corto-largo-corto seguida de una taquicardia muy rápida (Lc = 240ms) y regular. Obsérvese cómo cambia la morfología tanto del EGM monopolar (patrón S dominante) como del bipolar, y el cambio de la relación temporal entre ellos, siendo mucho más precoz el inicio del EGM monopolar (90ms) (derecha). Todo ello es diagnóstico de TV que es terminada de forma eficaz mediante una descarga (izquierda). B. Fibrilación auricular rápida con fases relativamente regulares, que son detectadas de manera inapropiada por el dispositivo como TV rápidas y tratadas mediante trenes de estimulación. Obsérvese la ausencia de cambios morfológicos del EGM monopolar (patrón R dominante) y la relación temporal monopolar-bipolar estable de 10ms (derecha). Todo ello es diagnóstico de TSV.
EGM: electrogramas intracavitarios; Duration: duración; FTV; taquicardia ventricular rápida; Last Rx: última terapia; Success: éxito; Lc: longitud de ciclo; TSV: taquicardia supraventricular; TV: taquicardia ventricular.
La principal utilidad del análisis de los EGM intracavitarios es establecer el diagnóstico del ritmo causante de la activación del DAI, ya que tanto las taquicardias ventriculares (TV) como las supraventriculares (TSV), cuando superen los criterios de frecuencia establecidos, pueden ser identificadas como arritmias ventriculares por el dispositivo, lo que dará lugar a la administración de una terapia. El análisis visual de los EGM almacenados por el dispositivo es el gold standard para determinar si el ritmo ha sido detectado de forma apropiada o inapropiada. La clasificación a posteriori del tipo de taquicardia detectada se basa en la utilización combinada de los siguientes criterios (fig. 1)7:
- 1.
Intervalo RR medio: se consideran taquicardia ventricular rápida o fibrilación ventricular (FV) aquellos episodios con RR medio ≤ 260ms.
- 2.
Cambios en la morfología de los EGM intracavitarios: al igual que ocurre en el análisis electrocardiográfico de las TV, la presencia de un ritmo con origen en el ventrículo da lugar, en la mayoría de los casos, a un EGM de morfología distinta al generado por un ritmo supraventricular conducido por el sistema específico de conducción8.
- 3.
Criterios de regularidad e inicio súbito: la irregularidad de los ciclos RR (variabilidad > 60ms en 3/10 ciclos) apoyaría el diagnóstico de FV o fibrilación auricular, mientras que la regularidad sería indicativa de TV o TSV.
Este método de clasificación del ritmo ha demostrado ser útil para establecer el ritmo causante de la activación del DAI en la mayoría de los episodios, con una excelente concordancia interobservador (97%)9. Además, ha permitido saber que aproximadamente el 25% de los episodios almacenados por el DAI, tanto si dieron lugar a la administración de una terapia por parte del dispositivo9 como si ésta fue abortada10, fueron debidos a ritmos supraventriculares, fibrilación auricular en casi la mitad de los casos. En esta situación, la instauración de cambios en el tratamiento médico o la reprogramación del dispositivo permitió reducir de forma muy importante el número de episodios detectados inapropiadamente durante el seguimiento9,10. Estos estudios subrayan la enorme importancia clínica que tiene el análisis de los EGM intracavitarios durante el seguimiento de pacientes portadores de DAI para la reducción de las terapias, tanto apropiadas como inapropiadas.
Sin embargo, estos criterios tienen varias limitaciones: a) diversos ritmos supraventriculares pueden en ocasiones alcanzar frecuencias muy altas, con intervalos RR < 260ms; b) la fibrilación auricular puede regularizarse, mientras que otras arritmias supraventriculares, como el aleteo auricular, con frecuencia dan lugar a intervalos RR altamente regulares; c) las TV en ocasiones pueden presentar cierta variabilidad en el ciclo, en especial al inicio o previamente a la terminación11; d) el 10% de los episodios de TV no presenta cambios en la morfología respecto a la del EGM registrado durante RS8, y e) la aparición de bloqueo de rama puede modificar la morfología del EGM bipolar durante TSV12. Así pues, se precisan criterios de discriminación adicionales que nos permitan distinguir con mayor precisión la etiología de los episodios detectados por el DAI.
Reconocimiento de problemas relacionados con el sensado ventricular del desfibrilador automático implantableLos problemas de detección de la señal ventricular pueden ocurrir hasta en el 20% de los pacientes portadores de DAI y se producen por dos mecanismos distintos13. El primero de ellos es consecuencia del empleo del control automático de ganancia que asegura la detección durante la FV de señales de muy baja amplitud. Este método puede, en ocasiones, dar lugar a problemas de infradetección durante la FV, retrasando o inhibiendo la administración de la terapia, mientras que en otras puede dar lugar a estimulación ventricular inapropiada con el consiguiente riesgo de proarritmia (fig. 2B).Esto sucede cuando se producen cambios bruscos en la amplitud del EGM tras la aparición de complejos ventriculares de gran amplitud (extrasístoles ventriculares o estimulación ventricular esporádica) o tras la administración de descargas consecutivas (fig. 2B)14,15. En otras ocasiones, los cambios en la amplitud del complejo ventricular y/o de la onda T durante estimulación o la aparición de bloqueos de rama pueden ocasionar problemas de sobredetección que deriven en descargas inapropiadas16. Recientemente, también se han descrito problemas de sobredetección de la onda T en pacientes con síndrome de Brugada y síndrome de QT corto17. El reconocimiento precoz de este tipo de problemas y la consiguiente reprogramación del dispositivo redujo hasta un 77% los episodios de detección anómala del DAI13.
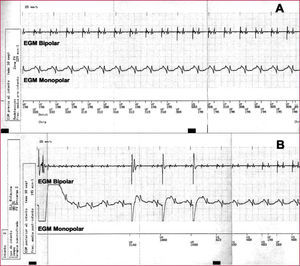
A. Episodio de taquicardia sinusal con sobredetección auricular por un electrodo dedicado (o seudobipolar) próximo al anillo auriculoventricular. Al contabilizar tanto la actividad auricular como ventricular, el dispositivo la interpreta como fibrilación ventricular y se administra una descarga. Obsérvese que el dispositivo utiliza la información del canal bipolar para realizar la detección del episodio. B. Efecto del control automático de ganancia. Tras una descarga, este algoritmo hace que no se detecten más que señales de gran amplitud, haciendo que ante la ausencia de actividad detectada por el dispositivo (véase el canal de marcas) se emiten, de forma inapropiada, 3 impulsos ventriculares, a pesar de haber actividad cardiaca espontánea (no detectada por el dispositivo).
EGM: electrograma intracavitario; VF: fibrilación ventricular; VP: estimulación ventricular; VS: detección ventricular.
El segundo mecanismo que puede originar problemas de sensado en los DAI y que es causa frecuente de terapias inapropiadas, es la sobredetección de ruido como consecuencia de señales externas (biológicas o no) y los problemas con la vía de detección del electrodo ventricular. Los problemas de detección relacionados con el electrodo pueden deberse a: a) dislocación/migración del electrodo (fig. 2A), y b) fractura o pérdida del aislamiento que recubre al electrodo (fig. 3). Aunque mucho más frecuentes en los antiguos electrodos epicárdicos, hasta un 15% de los más modernos electrodos endocárdicos pueden presentar problemas durante el seguimiento18. Debemos sospechar un problema de este tipo: a) ante la ocurrencia de múltiples descargas sucesivas, especialmente cuando éstas se relacionan con cambios de postura o determinados movimientos, en ausencia de otros síntomas cardiológicos o síncope (fig. 4); b) ante la presencia de intervalos RR extremadamente cortos (< 140ms) y episodios de TV no sostenida con intervalos < 200 ms19. Con frecuencia estos problemas pueden reproducirse al manipular la carcasa, puesto que es en este lugar donde con mayor frecuencia se producen las fracturas de electrodo. La identificación del problema y su corrección quirúrgica inmediata pueden salvar la vida del paciente2. Finalmente, la sobredetección de miopotenciales o de otras fuentes externas de ruido puede ocasionar terapias inapropiadas, cuyo diagnóstico suele ser relativamente sencillo tras interrogar al paciente y revisar los EGM, pudiendo corregirse en ocasiones mediante reprogramación de la sensibilidad. Se ha encontrado que puede ser más frecuente en los electrodos integrados (seudobipolares) que en los electrodos bipolares verdaderos (fig. 4)20.
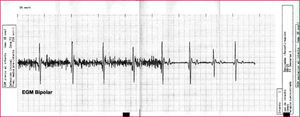
Detección inapropiada como consecuencia de la fractura de un electrodo. El episodio se reproduce al manipular la carcasa y la terapia es abortada al cesar la manipulación y desaparecer las interferencias de la línea de base que son erróneamente interpretadas como fibrilación ventricular por el dispositivo.
EGM: electrograma intracavitario.
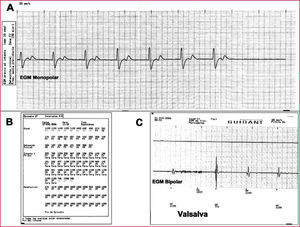
Episodio de descarga mientras el paciente estaba defecando. A. EGM monopolar previo a la descarga del desfibrilador automático implantable, donde se objetiva la ausencia de taquicardia aunque no se registran interferencias. B. Contadores del episodio donde se comprueba que el dispositivo ha detectado intervalos R-R extremadamente cortos (< 140ms). C. EGM bipolar, obtenido durante la realización de maniobras de Valsalva, registra interferencias en la línea de base que son interpretadas como complejos ventriculares por el dispositivo (véase el canal de marcas).
EGM: electrograma intracavitario; VP: estimulación ventricular; VS: detección ventricular.
El análisis de los EGM intracavitarios, además, nos informa de los mecanismos electrofisiológicos causantes de la iniciación de las TV y, por tanto, también pueden ayudarnos a evitar la ocurrencia de nuevos episodios arrítmicos. Marchlinski et al han demostrado que las taquicardias ventriculares rápidas (> 250 lat/min) suelen estar precedidas por intervalos corto-largo-corto (fig. 1A) y el primer latido de la taquicardia suele ser de distinta morfología que el resto de complejos21. Por el contrario, las TV más lentas (< 150 lat/min) están precedidas por taquiarritmias supraventriculares en el 33% de los casos y la morfología del primer latido de la taquicardia es similar a la del resto de complejos. Diversos estudios han demostrado que la presencia concomitante de arritmias supraventriculares incrementa de manera significativa el riesgo de presentar episodios de TV/FV22,23. Por otra parte, la estimulación antitaquicardia administrada de forma inapropiada a taquiarritmias supraventriculares es la causa de la iniciación de hasta el 12% de los episodios de TV/FV21. Finalmente, el análisis de la variabilidad de la frecuencia cardiaca, llevado a cabo a partir de los registros intracavitarios de los DAI, ha permitido a otros autores identificar la presencia de un estado simpático aumentado previo a los episodios de taquiarritmias ventriculares24.
Diversas medidas terapéuticas pueden ser de utilidad para evitar los episodios dependiendo de las características de la iniciación: a) reprogramación y optimización de los algoritmos de detección para evitar terapias inapropiadas; b) prevención y tratamiento de las TSV y, en el caso de la fibrilación auricular, control de la respuesta ventricular mediante fármacos o ablación del nódulo auriculoventricular; c) implementación de los algoritmos de estimulación que prevengan la ocurrencia de pausas e intervalos corto-largo-corto (rate smoothing) con la consiguiente reducción de los episodios de TV (estudio PREVENT)25; d) en el caso de TV rápidas, la ablación tratará de eliminar el extrasístole que actúa como desencadenante de la misma y generalmente se origina lejos del circuito, y e) en las TV lentas, en las que el primer complejo de la taquicardia representa el primer latido de la reentrada, la morfología del EGM puede ayudar a la localización de la salida del circuito mediante maniobras de cartografía de activación.
El estudio de los EGM registrados previamente al fallecimiento de pacientes portadores de un DAI también proporciona información relevante respecto al mecanismo último de la muerte. Grubman et al encontraron que más de la mitad de los pacientes fallecidos de causas cardiacas no tenían ningún EGM registrado en la hora previa a la muerte, lo que indica que ésta no fue el resultado de una taquiarritmia26. En el resto de pacientes se registraron complejos ventriculares significativamente más anchos, indicativos de disociación electromecánica. Por ello, los autores concluyen que, en este contexto, la mayoría de los fallecimientos (> 90%) no fue resultado directo de una taquiarritmia.
Documentación de recurrencias y seguimiento de la eficacia de terapias farmacológicas y/o invasivas para el tratamiento de arritmias ventricularesLos EGM intracavitarios también pueden ser de utilidad para determinar la presencia de recurrencias, su tipo y características, así como para controlar y guiar los resultados de distintos tratamientos, farmacológicos o invasivos. El análisis de los episodios, durante el seguimiento a largo plazo de distintos subgrupos de pacientes portadores de DAI, ha mostrado la existencia de importantes diferencias entre ellos. Un reciente subanálisis del estudio PainFREE II mostró que, en una población con cardiopatía isquémica crónica, la distribución del tipo de arritmias durante el seguimiento fue similar, con independencia de si la indicación de implantación del DAI fue prevención primaria o secundaria (TV, el 52 frente al 54%; TV rápida, el 35 frente al 35%; FV, el 14 frente al 10%, respectivamente)27. Sin embargo, los pacientes en el grupo de prevención secundaria presentaron una mayor proporción de terapias apropiadas (el 26 frente al 18%), mientras que la proporción de terapias inapropiadas fue ligeramente superior en el grupo de paciente de prevención primaria (el 46 frente al 34%). Por el contrario, en el estudio MIRACLE ICD, en el que se incluyó a pacientes con indicación de resincronización cardiaca y cardiopatía de base isquémica en el 60% de los casos, los pacientes con indicación de implantación por prevención primaria presentaron una mayor proporción de episodios de FV en comparación con los pacientes de prevención secundaria (el 40 frente al 14%)28. Además, la proporción de episodios detectados inapropiadamente fue superior en los pacientes del grupo de prevención primaria (el 30 frente al 14%), siendo en este caso debidos con mayor frecuencia a taquicardia sinusal (59%), mientras la fibrilación auricular rápida fue la causa del 46% de los episodios detectados inapropiadamente en el grupo de prevención secundaria.
En otros estudios se han utilizado los EGM intracavitaros de los DAI para definir la eficacia de diversos abordajes terapéuticos para el tratamiento de arritmias ventriculares recurrentes. Así, en el estudio OPTIC se comparó el efecto de la administración de sotalol, betabloqueantes o amiodarona + betabloqueantes en la prevención de descargas del DAI29. El efecto de las terapias antitaquicardia de los DAI en la terminación de los episodios arrítmicos también ha sido evaluado en varios estudios mediante la utilización de los registros intracavitarios para clasificar los distintos tipos de arritmias y analizar el efecto de la terapia27,30,31. También se puede controlar el efecto de la ablación con radiofrecuencia tras la ablación de taquicardia ventriculares rápidas no «mapeables» y tras una tormenta eléctrica con los registros de DAI que tiene implantados la inmensa mayoría de estos pacientes32,33. Finalmente, aunque de manera anecdótica, algunos autores han notificado la utilidad que los EGM intracavitarios para guiar el procedimiento de ablación de las taquicardias ventriculares. Así, la comparación de los EGM intracavitarios de taquicardias inducidas durante el estudio electrofisiológico respecto de los episodios espontáneos permitiría determinar cuál de todas las taquicardias inducidas tiene significación clínica y debe abordarse mediante ablación34.
Utilidad de los electrogramas intracavitarios en los desfibriladores automáticos implantables bicameralesAun en manos de expertos, aproximadamente un 5% de los episodios registrados por los DAI monocamerales es de difícil clasificación9. La utilización de la información aportada por los registros intracavitarios del electrodo auricular puede ser muy útil, tanto para los clínicos encargados del seguimiento de dispositivos como para el diseño de nuevos algoritmos diagnósticos de los DAI. Al igual que ocurre en el análisis de trazados electrocardiográficos de TV, el análisis del ritmo y la frecuencia auricular, así como la relación de la activación auricular respecto de la ventricular, permiten clasificar la gran mayoría de los episodios (fig. 5). Así, en más de la mitad de los episodios, la frecuencia ventricular es mayor que la auricular y se encuentran disociadas, lo que permite establecer de forma rápida el diagnóstico de TV. Sin embargo, cuando este concepto se aplicó al desarrollo de algoritmos diagnósticos de los DAI, los resultados no fueron inicialmente tan satisfactorios. Los primeros estudios fueron incapaces de demostrar una superioridad de los dispositivos bicamerales respecto a los monocamerales en cuanto a su capacidad para discriminar TV de TSV e incluso, en algunos casos, la tasa de terapias inapropiadas fue superior con los dispositivos bicamerales35. En la mayoría de los casos, esto se debió a la presencia de problemas de infradetección auricular, lo que da lugar a una relación V > A y a clasificar erróneamente las TSV como TV. La reducción de los problemas de detección auricular y ventricular, así como el desarrollo de nuevos y sofisticados algoritmos de clasificación, ha permitido demostrar la superioridad de los DAI bicamerales en la discriminación de taquicardias, con el consiguiente impacto clínico que ello supone. Así, el estudio DETECT ha demostrado recientemente que los DAI bicamerales disminuyen de manera significativa los episodios de detección inapropiada de TSV (el 46% monocameral frente al 32% bicameral), lo cual se tradujo en una reducción del 46% en la probabilidad de recibir terapias inapropiadas por TSV36. De igual modo, el estudio DATAS ha demostrado que, en comparación con los DAI monocamerales, los DAI bicamerales reducen la ocurrencia de efectos adversos clínicamente significativos, en especial sobre la base de una reducción de las descargas inapropiadas (el 3% bicamerales frente al 6-12% monocameral verdadero-simulado)37.
Episodio de taquicardia con patrón S dominante en el EGM monopolar. Las aurículas (750ms) se activan a una frecuencia sensiblemente inferior que los ventrículos (400ms) lo que da lugar a una relación V > A y a disociación auriculoventricular, todo ello diagnóstico de taquicardia ventricular.
EGM: electrograma intracavitario; VD: ventrículo derecho.
Los métodos de clasificación expuestos todavía tienen diversas limitaciones que hacen deseable el perfeccionamiento y el desarrollo de nuevos criterios diagnósticos. En primer lugar, hasta un 10% de los episodios de TV no presenta cambios significativos en la morfología del EGM ventricular respecto al EGM en ritmo sinusal (RS)8. Además, la aparición de bloqueos de rama durante la TSV pueden dar lugar a cambios morfológicos del EGM bipolar ventricular y hacer que se asemejen a los de una TV, especialmente cuando el bloqueo de rama es ipsilateral a la localización del electrodo de registro ventricular12. Por otra parte, con frecuencia no es posible comparar los EGM durante taquicardia respecto del EGM en RS inmediatamente después del episodio debido a: a) limitaciones en la memoria del dispositivo; b) la estimulación posdescarga; c) la falta de respuesta a la terapia administrada, y d) las alteraciones morfológicas del EGM que se producen inmediatamente tras la descarga (hiperpolarización). Por último, también los dispositivos bicamerales pueden presentar problemas de clasificación, en especial en aquellas taquicardias ventriculares con una relación VA 1:1. Por tanto, sería deseable disponer de un método que permitiese discriminar el tipo de taquicardia basado de manera exclusiva en las características del EGM durante taquicardia, sin que sea estrictamente necesario disponer de la información aportada por el EGM durante el RS. Nuestro grupo llevó a cabo un estudio cuyo objetivo fue analizar las características morfológicas y la relaciones temporales entre los EGM ventriculares (bipolar y monopolar) durante TV con la intención de diferenciarlas de los ritmos supraventriculares (RS/TSV)38.
MétodosEn primer lugar evaluamos prospectivamente las características de los EGM bipolar y monopolar de ventrículo derecho durante el RS en 93 pacientes consecutivos portadores de un DAI (el 59% Medtronic y el 41% Guidant) pectoral con electrodo endocárdico implantado crónicamente (> 3 meses). Se analizaron las coincidencias morfológicas de los EGM durante el RS, así como los factores que pudiesen influir sobre ellas como, por ejemplo, la cardiopatía de base, la compañía fabricante, la configuración del electrodo (integrado frente a verdadero), y las características del electrocardiograma de superficie (presencia y tipo de bloqueo de rama, presencia y localización de ondas Q de necrosis, duración del complejo QRS). Posteriormente, comparamos los EGM durante RS con los EGM de 49 episodios de TV y 31 episodios de TSV en esos mismos pacientes, obtenidos de forma retrospectiva. Para ello, dos observadores independientes analizaron las características morfológicas de los electrogramas monopolar y bipolar, su duración y la relación temporal entre el EGM bipolar y el monopolar, tanto en RS como durante los episodios de TV y TSV. La morfología de los EGM se clasificó en 2 tipos, según la morfología: patrón R dominante y S dominante. Cuando la amplitud de los componentes positivo y negativo fue similar, se eligió como dominante el más ancho de ellos. La duración de los EGM se midió de forma convencional39. La relación temporal entre el EGM bipolar y el monopolar se calculó midiendo la distancia entre la deflexión intrínseca del EGM bipolar y el inicio de la primera deflexión (positiva o negativa) del EGM monopolar39,40. La concordancia interobservador fue del 91%, y las discordancias fueron resueltas por un tercer investigador.
ResultadosCaracterización morfológica de los electrogramas intracavitarios ventriculares durante el ritmo sinusalEl único factor que influyó en la morfología del EGM unipolar durante RS fue el tipo de fabricante y el tipo de electrodo implantado. Así, mientras los EGM de la compañía Medtronic mostraron un patrón morfológico de R dominante en el 95% de los pacientes durante el RS, el 59% de los EGM obtenidos por el DAI modelo Ventak Prizm de la compañía Guidant presentaban un patrón S dominante. Esto indica que este modelo podría tener una diferente configuración electrónica, por lo que se excluyó en los análisis posteriores. Por el contrario, la morfología de los EGM bipolares se vio influida por un gran número de factores como la presencia y el tipo de bloqueo de rama, el tipo de cardiopatía de base, y la presencia y localización de las ondas q de necrosis. Asimismo, la duración de los EGM, tanto bipolar como unipolar, se vio afectada por variables como la presencia de bloqueo de rama o el eje del QRS. Los factores predictivos independientes de afectación de la morfología del EGM bipolar ventricular durante RS fueron la presencia de bloqueo de rama (odds ratio [OR] = 16,2; intervalo de confianza [IC] del 95%, 2,5-104,6; p = 0,003), cardiopatía subyacente no isquémica ni dilatada (OR = 14,2; IC del 95%, 2,3-86; p = 0,004), y la presencia de ondas Q de necrosis de localización anteroseptal en el electrocardiograma de superficie (OR = 8,6; IC del 95%, 1,05-70,7; p = 0,045).
Análisis de los episodios almacenados por el desfibrilador automático implantableDe un total de 49 episodios de TV y 31 de TSV, 10 y 13, respectivamente, fueron excluidos por tener implantado un dispositivo Ventak PRIZM o carecer de registros simultáneos de los EGM bipolar y unipolar durante el episodio. Cuando comparamos la morfología del EGM monopolar en los distintos ritmos se comprobó que el 59% de los episodios de TV tenía una morfología con patrón S dominante, mientras que este patrón sólo estaba presente en el 4% de los EGM durante RS y el 6% de los EGM durante TSV (p < 0,001) (tabla 1). En todos los pacientes que presentaron un patrón S dominante en el EGM monopolar durante RS (n = 2) se observó un cambio en la configuración dominante durante TV. Por el contrario, cuando comparamos el patrón morfológico del EGM monopolar durante RS y TSV, no observamos cambios significativos en el patrón morfológico dominante (R dominante). Finalmente, la morfología del EGM bipolar fue similar entre los distintos grupos (patrón R dominante del 75% en RS, el 77% en TV y el 80% en TSV; p = NS).
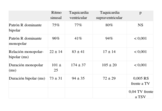
Características morfológicas, duración y relación temporal de los electrogramas monopolar y bipolar
| Ritmo sinusal | Taquicardia ventricular | Taquicardia supraventricular | p | |
| Patrón R dominante bipolar | 75% | 77% | 80% | NS |
| Patrón R dominante monopolar | 96% | 41% | 94% | < 0,001 |
| Relación monopolar-bipolar (ms) | 22 ±14 | 83 ±41 | 17 ±14 | < 0,001 |
| Duración monopolar (ms) | 101 ± 25 | 174 ±37 | 105 ±20 | < 0,001 |
| Duración bipolar (ms) | 73 ±31 | 94 ±35 | 72 ±29 | 0,005 RS frente a TV |
| 0,04 TV frente a TSV |
NS: no significativo; RS: ritmo sinusal; TV: taquicardia ventricular; TSV: taquicardia supraventricular.
Tomada de Atienza F et al38.
El inicio del EGM monopolar precedió al bipolar en 22 ± 14ms durante RS y 83 ± 41ms durante TV (p < 0,001), sin que hubiera diferencias significativas en el caso de TSV (17 ±14; p = NS) (tabla 1). Se produjo un incremento medio en la relación del EGM monopolar-bipolar al pasar de RS a TV en 50 (rango IQ 53) ms. Sólo 3 pacientes presentaron un incremento ≤ 20ms en la relación monopolar-bipolar al pasar de RS a TV, dos de los cuales presentaron un acortamiento de esta relación en 20ms. Por el contrario, no se produjeron cambios significativos en la relación de los EGM monopolar-bipolar durante RS (18 ± 14ms) respecto a TSV (17 ± 14ms). Tanto la duración del EGM monopolar como la del bipolar fueron significativamente mayores durante la TV en comparación con la duración durante el RS y la TSV (tabla 1). El análisis multivariable mostró que el patrón morfológico R dominante del EGM monopolar [OR =11,1; IC del 95%, 1,14-107; p = 0,04) y la relación temporal de los EGM monopolar-bipolar (OR = 1,1; IC del 95%, 1,06-1,15; p < 0,001) fueron predictores independientes del mecanismo causante de la taquicardia.
Cuando se utilizó el siguiente protocolo escalonado para la discriminación de taquicardias: a) patrón S dominante en el EGM monopolar = TV, el 59% de las TV y el 94% de las TSV fueron clasificadas correctamente, y b) relación temporal EGM monopolar-bipolar > 20ms = VT, el 89% de la TV y el 100% de las TSV fueron clasificadas correctamente. Globalmente, este sistema de clasificación de taquicardias mostró una sensibilidad del 97% para detectar TV y una especificidad del 100% para detectar TSV.
DiscusiónLas principales conclusiones de este estudio son las siguientes: a) el EGM ventricular monopolar durante el RS muestra patrón morfológico de R dominante en el 96%, y su morfología no se afectada por la influencia de factores externos como la presencia de bloqueo de rama, ondas Q de necrosis o el tipo de cardiopatía subyacente; b) la morfología del EGM bipolar durante RS está influida por gran número de factores; c) durante la TV, aproximadamente el 60% de los episodios presenta un patrón morfológico de S dominante, mientras que éste sólo está presente en el 6-4% de los registros durante el RS o la TSV, y d) en los episodios que no presentan cambios significativos en la polaridad del EGM monopolar, un incremento > 20ms en la relación monopolar-bipolar durante taquicardia respecto al RS permitió clasificar adecuadamente el 97% de los episodios.
CONCLUSIONESLa posibilidad de registrar la actividad eléctrica cardiaca durante los eventos que conducen a la activación del DAI ha permitido mejorar significativamente el tratamiento de los pacientes con arritmias ventriculares, ha contribuido a mejorar nuestro conocimiento de los factores precipitantes de éstas y ha ayudado a diseñar algoritmos para mejorar la precisión en la discriminación de taquicardias de estos dispositivos.

 EGM monopolar (patrón S dominante) como del bipolar, y el cambio de la relación temporal entre ellos, siendo mucho más precoz el inicio del
EGM monopolar (patrón S dominante) como del bipolar, y el cambio de la relación temporal entre ellos, siendo mucho más precoz el inicio del  EGM: electrograma intracavitario; VF: fibrilación ventricular; VP: estimulación ventricular; VS: detección ventricular.' title='A. Episodio de taquicardia sinusal con sobredetección auricular por un electrodo dedicado (o seudobipolar) próximo al anillo auriculoventricular. Al contabilizar tanto la actividad auricular como ventricular, el dispositivo la interpreta como fibrilación ventricular y se administra una descarga. Obsérvese que el dispositivo utiliza la información del canal bipolar para realizar la detección del episodio. B. Efecto del control automático de ganancia. Tras una descarga, este algoritmo hace que no se detecten más que señales de gran amplitud, haciendo que ante la ausencia de actividad detectada por el dispositivo (véase el canal de marcas) se emiten, de forma inapropiada, 3 impulsos ventriculares, a pesar de haber actividad cardiaca espontánea (no detectada por el dispositivo).
EGM: electrograma intracavitario; VF: fibrilación ventricular; VP: estimulación ventricular; VS: detección ventricular.' title='A. Episodio de taquicardia sinusal con sobredetección auricular por un electrodo dedicado (o seudobipolar) próximo al anillo auriculoventricular. Al contabilizar tanto la actividad auricular como ventricular, el dispositivo la interpreta como fibrilación ventricular y se administra una descarga. Obsérvese que el dispositivo utiliza la información del canal bipolar para realizar la detección del episodio. B. Efecto del control automático de ganancia. Tras una descarga, este algoritmo hace que no se detecten más que señales de gran amplitud, haciendo que ante la ausencia de actividad detectada por el dispositivo (véase el canal de marcas) se emiten, de forma inapropiada, 3 impulsos ventriculares, a pesar de haber actividad cardiaca espontánea (no detectada por el dispositivo).  EGM: electrograma intracavitario.' title='Detección inapropiada como consecuencia de la fractura de un electrodo. El episodio se reproduce al manipular la carcasa y la terapia es abortada al cesar la manipulación y desaparecer las interferencias de la línea de base que son erróneamente interpretadas como fibrilación ventricular por el dispositivo.
EGM: electrograma intracavitario.' title='Detección inapropiada como consecuencia de la fractura de un electrodo. El episodio se reproduce al manipular la carcasa y la terapia es abortada al cesar la manipulación y desaparecer las interferencias de la línea de base que son erróneamente interpretadas como fibrilación ventricular por el dispositivo.  EGM monopolar previo a la descarga del desfibrilador automático implantable, donde se objetiva la ausencia de taquicardia aunque no se registran interferencias. B. Contadores del episodio donde se comprueba que el dispositivo ha detectado intervalos R-R extremadamente cortos (< 140ms). C.
EGM monopolar previo a la descarga del desfibrilador automático implantable, donde se objetiva la ausencia de taquicardia aunque no se registran interferencias. B. Contadores del episodio donde se comprueba que el dispositivo ha detectado intervalos R-R extremadamente cortos (< 140ms). C.  EGM monopolar. Las aurículas (750ms) se activan a una frecuencia sensiblemente inferior que los ventrículos (400ms) lo que da lugar a una relación V > A y a disociación auriculoventricular, todo ello diagnóstico de taquicardia ventricular.
EGM monopolar. Las aurículas (750ms) se activan a una frecuencia sensiblemente inferior que los ventrículos (400ms) lo que da lugar a una relación V > A y a disociación auriculoventricular, todo ello diagnóstico de taquicardia ventricular.