En los servicios de urgencias hospitalarios (SUH), la escala MEESSI estratifica a los pacientes diagnosticados de insuficiencia cardiaca aguda (ICA) según su riesgo de mortalidad a 30 días. Se valida la escala de riesgo MEESSI en una nueva cohorte de pacientes para evaluar su precisión al estratificar el riesgo y compararla en diferentes entornos.
MétodosSe incluyó a los pacientes consecutivos diagnosticados de ICA en 30 SUH durante enero y febrero de 2016. Se calculó la puntuación MEESSI de cada paciente. El estadístico C midió la capacidad discriminatoria para predecir la mortalidad a 30 días del modelo MEESSI completo y los modelos secundarios. Se realizaron comparaciones entre los subgrupos de pacientes de hospitales universitarios y comunitarios, de SUH con actividad alta, media o baja y de SUH que reclutaron o que no reclutaron a pacientes de la cohorte original de derivación de la escala MEESSI.
ResultadosSe analizó a 4.711 pacientes (hospitales universitarios/comunitarios: 3.811/900; SUH alta/media/baja actividad: 2.695/1.479/537; SUH participantes/no participantes en el estudio de derivación original: 3.892/819). La distribución de pacientes según las categorías de riesgo de la escala MEESSI fue: 1.673 (35,5%) de bajo riesgo, 2.023 (42,9%) de riesgo intermedio, 530 (11,3%) de alto riesgo y 485 (10,3%) de muy alto riesgo, con mortalidades a 30 días del 2,0, el 7,8, el 17,9 y el 41,4% respectivamente. El estadístico C para el modelo completo fue 0,810 (IC95%, 0,790-0,830) y varió de 0,731 a 0,785 para los modelos secundarios. La capacidad discriminatoria de la escala de riesgo MEESSI fue similar entre los subgrupos de hospitales, entre SUH de distinta actividad y entre hospitales reclutadores originales y nuevos.
ConclusionesLa escala MEESSI estratifica con éxito a los pacientes con ICA en los SUH según el riesgo de muerte a 30 días, lo cual puede ayudar en urgencias a la toma de decisiones sobre el destino de estos pacientes.
Palabras clave
Vídeo del artículo

Los servicios de urgencias hospitalarios (SUH) desempeñan un papel importante en el tratamiento de la insuficiencia cardiaca aguda (ICA), ya que aproximadamente el 90% de los pacientes con este síndrome acuden a dichos SUH para aliviar los síntomas1. En los SUH, se suele tratar a los pacientes con ICA aumentándoles los diuréticos, con suplementos de oxígeno y, en caso de necesidad, con vasodilatadores y morfina2. Una vez administrados estos tratamientos iniciales y evaluados sus efectos, es necesario decidir si hay que hospitalizar al paciente o darle el alta con el tratamiento apropiado y el seguimiento posterior. En los SUH de Canadá3,4 y Estados Unidos5 se utilizan algunas escalas de riesgo de reciente creación, con la intención de respaldar de modo objetivo este proceso de toma de decisiones, aunque su implementación no se ha generalizado en los SUH españoles. En consecuencia, la decisión de dar el alta a los pacientes directamente desde los SUH sin ingresarlos, que es lo que se hace ahora con aproximadamente un cuarto de los pacientes españoles con ICA2, sigue basándose empíricamente en la evaluación subjetiva de los médicos de urgencias.
Para resolver este problema, recientemente se creó la escala de riesgo MEESSI (Multiple Estimation of risk based on the Spanish Emergency department Score In patients with AHF) para utilizarla en pacientes con ICA en los SUH españoles6. Esta escala demuestra que el riesgo individual de mortalidad a 30 días de los pacientes con ICA que acuden a SUH puede calcularse de manera fiable utilizando 13 ítems fácilmente disponibles. Este instrumento tiene una buena capacidad de discriminación del riesgo (estadístico C=0,836), con una bondad de ajuste del modelo y una validación externa apropiadas, y actualmente se halla disponible online como calculadora web7. La escala de riesgo MEESSI también estratifica a los pacientes en 4 categorías clínicas, que corresponden a los grupos de riesgo bajo, intermedio, alto y muy alto. El uso sistemático de este modelo de riesgo puede servir a los médicos para tratar de modo apropiado el paso por los SUH, sobre todo porque permite identificar de forma fiable a los sujetos con un riesgo bajo que quizá no requieran una posterior hospitalización. No obstante, esta puntuación de riesgo tiene que validarse externamente y hay que comprobar su precisión en una nueva cohorte de pacientes, haciendo especial hincapié en el desempeño de la escala MEESSI en los distintos subgrupos de pacientes en función de las características del hospital y de los SUH. Por lo tanto, el objetivo del presente estudio es validar el desempeño de la escala de riesgo MEESSI en una nueva cohorte de pacientes españoles y en varios subgrupos de hospitales y SUH, así como evaluar su precisión a la hora de estratificar a los pacientes con ICA en función del riesgo.
MÉTODOSContextoSe incluyó a todos los pacientes consecutivos con ICA diagnosticada en los SUH de 30 hospitales españoles (lo que representa el 9% de los hospitales públicos españoles) entre el 1 de enero y el 29 de febrero de 2016, durante el reclutamiento de pacientes (fase 5) del Registro EAHFE (Epidemiology of Acute Heart Failure in Emergency Departments). Del diseño y la dinámica de reclutamiento del Registro EAHFE ya se ha hablado ampliamente en otras publicaciones2,6-8. En resumen, los pacientes empiezan a formar parte del Registro EAHFE cuando, basándose en los criterios diagnósticos de Framingham9, se les diagnostica ICA mientras se encuentran en el SUH. El investigador principal de cada centro lleva a cabo la adjudicación final a partir de una revisión de las historias clínicas y de todas las pruebas complementarias realizadas durante su paso por el SUH y la hospitalización. Siempre que es posible, el diagnóstico se confirma mediante determinación de péptidos natriuréticos o mediante ecocardiografía siguiendo los criterios de la Sociedad Europea de Cardiología10. No obstante, también se incluyó a los pacientes con criterios diagnósticos clínicos pero sin confirmación ecocardiográfica o de la presencia de péptido natriurético, para obtener una cohorte lo más parecida posible a lo que habitualmente se observa en la práctica clínica de urgencias. El único criterio de exclusión fue un diagnóstico de infarto de miocardio por elevación del segmento ST con aparición simultánea de ICA.
La cohorte incluida en el presente estudio es totalmente nueva, formada por los pacientes no incluidos en la creación y la anterior validación de la escala6. La participación de los hospitales en el estudio fue por conveniencia y se corresponde con los SUH que habían participado en la fase 5 del Registro EAHFE. Los hospitales donde se lleva a cabo el reclutamiento de pacientes que participan en un estudio representan el espectro total de centros de asistencia sanitaria españoles que atienden a pacientes con ICA: hospitales universitarios y hospitales comunitarios (n=19/11), así como SUH con niveles de actividad alto (> 300 visitas/día), medio (200-300 visitas/día) y bajo (< 200 visitas/día) (n=12/12/6). Además, los SUH anteriormente involucrados en el estudio de derivación de la escala MEESSI y los nuevos SUH que no habían participado él también estaban representados en esta nueva cohorte (n=20/10).
El presente estudio sigue la Declaración de Helsinki sobre los principios éticos para la investigación médica en seres humanos, y los pacientes dieron su consentimiento informado para participar y el contacto para el seguimiento. El protocolo fue aprobado por el Comité de Ética del Hospital Universitario Central de Asturias (Oviedo) España, con número de referencia 160/15.
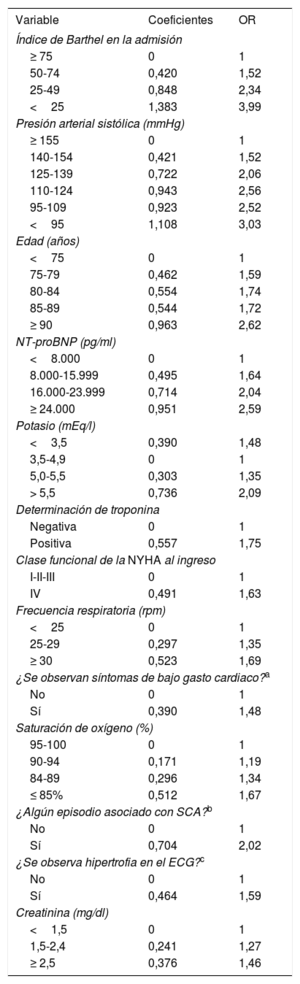
La escala de riesgo MEESSILos detalles relativos a la creación y la validación previa de la escala de riesgo MEESSI ya se han comentado en otra parte6. En resumen, la escala consta de 13 factores de riesgo (tabla 1) identificados en principio a partir de 88 variables de elección para predecir la mortalidad por cualquier causa a 30 días en pacientes con ICA que acudían al SUH. En el modelo final, cada una de las variables continuas se incorporó a varias categorías ordenadas para facilitar su uso en la práctica clínica, y se implementó un sitio web con calculadora para facilitar los cálculos6,7. Además, se crearon otros 7 modelos para estimar la mortalidad a 30 días de los pacientes de los que se carecía de datos relativos al índice de Barthel, concentración de troponina o fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) (en cualquier combinación). Se calculó retrospectivamente la puntuación de la escala MEESSI de cada uno de los pacientes incluidos en el presente estudio, una vez finalizado el tratamiento del paciente en el SUH (véase más adelante).
Variables incluidas en la escala de riesgo MEESSI con las puntuaciones para calcular la puntuación final en el modelo completo y las odds ratio de mortalidad a 30 días para cada subgrupo de pacientes
| Variable | Coeficientes | OR |
|---|---|---|
| Índice de Barthel en la admisión | ||
| ≥ 75 | 0 | 1 |
| 50-74 | 0,420 | 1,52 |
| 25-49 | 0,848 | 2,34 |
| <25 | 1,383 | 3,99 |
| Presión arterial sistólica (mmHg) | ||
| ≥ 155 | 0 | 1 |
| 140-154 | 0,421 | 1,52 |
| 125-139 | 0,722 | 2,06 |
| 110-124 | 0,943 | 2,56 |
| 95-109 | 0,923 | 2,52 |
| <95 | 1,108 | 3,03 |
| Edad (años) | ||
| <75 | 0 | 1 |
| 75-79 | 0,462 | 1,59 |
| 80-84 | 0,554 | 1,74 |
| 85-89 | 0,544 | 1,72 |
| ≥ 90 | 0,963 | 2,62 |
| NT-proBNP (pg/ml) | ||
| <8.000 | 0 | 1 |
| 8.000-15.999 | 0,495 | 1,64 |
| 16.000-23.999 | 0,714 | 2,04 |
| ≥ 24.000 | 0,951 | 2,59 |
| Potasio (mEq/l) | ||
| <3,5 | 0,390 | 1,48 |
| 3,5-4,9 | 0 | 1 |
| 5,0-5,5 | 0,303 | 1,35 |
| > 5,5 | 0,736 | 2,09 |
| Determinación de troponina | ||
| Negativa | 0 | 1 |
| Positiva | 0,557 | 1,75 |
| Clase funcional de la NYHA al ingreso | ||
| I-II-III | 0 | 1 |
| IV | 0,491 | 1,63 |
| Frecuencia respiratoria (rpm) | ||
| <25 | 0 | 1 |
| 25-29 | 0,297 | 1,35 |
| ≥ 30 | 0,523 | 1,69 |
| ¿Se observan síntomas de bajo gasto cardiaco?a | ||
| No | 0 | 1 |
| Sí | 0,390 | 1,48 |
| Saturación de oxígeno (%) | ||
| 95-100 | 0 | 1 |
| 90-94 | 0,171 | 1,19 |
| 84-89 | 0,296 | 1,34 |
| ≤ 85% | 0,512 | 1,67 |
| ¿Algún episodio asociado con SCA?b | ||
| No | 0 | 1 |
| Sí | 0,704 | 2,02 |
| ¿Se observa hipertrofia en el ECG?c | ||
| No | 0 | 1 |
| Sí | 0,464 | 1,59 |
| Creatinina (mg/dl) | ||
| <1,5 | 0 | 1 |
| 1,5-2,4 | 0,241 | 1,27 |
| ≥ 2,5 | 0,376 | 1,46 |
ECG: electrocardiograma; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; OR: odds ratio; SCA: síndrome coronario agudo.
Para calcular la puntuación de la escala MEESSI para un paciente en particular, hay que sumar los 13 coeficientes además del coeficiente de intersección, que es –5,399.
Se registraron 56 variables (incluidas las 13 necesarias para calcular la puntuación de la escala MEESSI): 2 sobre epidemiología, 12 sobre comorbilidad, 10 sobre tratamientos crónicos recibidos en casa, 1 sobre datos ecocardiográficos, 6 sobre los precipitantes del episodio actual de ICA, 6 sobre el estado clínico al llegar al SUH, 4 sobre los resultados del electrocardiograma, 7 sobre datos de laboratorio y 8 sobre el tratamiento y la atención al paciente en el SUH. El proceso de recogida de datos y los protocolos fueron los mismos que los utilizados en los registros EAHFE anteriores2,6-8. Puesto que se trataba de un estudio observacional, ninguna intervención se sometió a prueba; de ahí que esos datos sean un reflejo del tratamiento habitual que recibe el paciente de parte de los médicos que le atienden. Mientras se llevaba a cabo el reclutamiento de pacientes, aún no se disponía de la escala de riesgo MEESSI, y todas las decisiones relativas al tratamiento de los pacientes se tomaban sin saber cuál era su categoría de riesgo. Además de la mortalidad a 30 días, que es el desenlace clínico estimado por la escala MEESSI, también se registraron la hospitalización a 30 días y las nuevas visitas a urgencias a 30 días debidas a ICA.
Análisis estadísticoLas variables cualitativas se expresan como frecuencia y porcentaje y las continuas, como media±desviación estándar o, si la distribución no es normal, como mediana [intervalo intercuartílico]. Se realizaron comparaciones utilizando la prueba de la χ2, el ANOVA (análisis de la varianza) o la prueba de Kruskal-Wallis, respectivamente. Se recurrió a una técnica de imputación múltiple con ecuaciones encadenadas11 para producir 50 juegos de datos imputados que reemplazaban los valores ausentes en las 13 variables incluidas en la escala de riesgo MEESSI. Con los datos imputados, se calculó la puntuación de riesgo individual de la escala MEESSI (x) para cada uno de los pacientes, añadiéndole el coeficiente relevante para cada uno de los factores de riesgo sobre el valor de la intersección (–5,40). Para estimar la probabilidad de muerte dentro del periodo de 30 días, se aplicó la inversa de la función logit [ex / (1+ex)]. Se estratificó a los pacientes en 4 categorías clínicas de riesgo (bajo/intermedio/alto/muy alto), establecidas utilizando umbrales de estratificación del riesgo de la escala MEESSI original y ajustándolos a los 2 quintiles inferiores de mortalidad (riesgo bajo), el tercer y el cuarto quintil (riesgo intermedio) y los deciles noveno y décimo (riesgo alto y riesgo muy alto). Se obtuvo la curva de tiempo transcurrido hasta el primer evento de mortalidad a 30 días para cada categoría de riesgo utilizando el método de Kaplan-Meier, y se comparó utilizando la prueba de rangos logarítmicos. En esta cohorte de validación, se evaluó un modelo de bondad de ajuste trazando el riesgo de mortalidad observado frente al predicho, así como la prueba de Hosmer-Lemeshow. Se calculó para cada categoría de riesgo la frecuencia de visitas a urgencias y la hospitalización a 30 días debidas a ICA. Se realizó una curva característica operativa del receptor (estadístico C) utilizando la puntuación de riesgo de la escala MEESSI como medida del desempeño del clasificador para el modelo completo y para los 7 modelos derivados de la ausencia de puntuación para el índice de Barthel y las concentraciones de troponina o NT-proBNP (en cualquier combinación). Como análisis de la sensibilidad, se repitió este análisis utilizando los datos observados (sin imputar los datos ausentes, análisis de casos completos) y se evaluó el estadístico C para los 8 modelos de esta muestra reducida. Por último, se realizaron análisis estratificados utilizando el modelo completo y aplicando la puntuación de riesgo a los pacientes reclutados en hospitales universitarios y en hospitales comunitarios, a los pacientes reclutados en SUH con niveles de actividad alto, medio y bajo, y a los pacientes incluidos por los SUH que participaron en el reclutamiento de pacientes y los que no participaron para la derivación original de la escala MEESSI. Para los análisis se utilizó el software STATA, versión 13.1 (Stata Corp.; College Station, Texas, Estados Unidos).
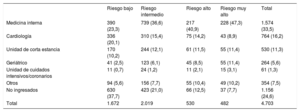
RESULTADOSSe estudió a 4.711 pacientes nuevos (de los 4.713 pacientes originales, se excluyó a 2 por falta de seguimiento) procedentes de 19 hospitales universitarios y 11 hospitales comunitarios (3.811 y 900 casos respectivamente) con SUH con niveles de actividad alto, medio y bajo (2.695, 1.479 y 537 casos) que habían y que no habían participado en la derivación original de la escala MEESSI (3.892 y 819 casos). Cabe destacar que los pacientes eran de edad avanzada (media, 80,8±10,2 años), con múltiples enfermedades —las más frecuentes fueron la hipertensión (83,2%), la fibrilación auricular (50,8%) y la diabetes mellitus (41,8%)—, más de la mitad ya había experimentado eventos de ICA y en dos tercios se constataba una fracción de eyección del ventrículo izquierdo conservada (> 49%). Las demás características clínicas se muestran en la tabla 2. En 50 de las 56 variables clínicas (89,3%), los valores ausentes equivalían a menos de un 10% y solo los datos ecocardiográficos, la frecuencia respiratoria, el índice de Barthel al llegar a urgencias y las concentraciones de potasio, NT-proBNP y troponina mostraban proporciones de ausencia mayores. El destino final de los pacientes tras ser atendidos en urgencias se muestra en la tabla 3; los destinos principales de los pacientes ingresados (el 75,4% de los casos) fueron las áreas de medicina interna y cardiología, aunque la distribución difirió considerablemente en función de la categoría de riesgo (p <0,001).
Características clínicas de los 4.711 nuevos pacientes con insuficiencia cardiaca aguda incluidos en el presente estudio
| Valores ausentes (%) | ||
|---|---|---|
| Datos epidemiológicos | ||
| Edad (años)a | 80,8±10,2 | 1±0,0 |
| Mujeres | 2.544 (54,5) | 23 (0,5) |
| Comorbilidades | ||
| Hipertensión | 3.911 (83,2) | 9 (0,2) |
| Diabetes mellitus | 1.965 (41,8) | 7 (0,1) |
| Cardiopatía isquémica | 1.282 (27,3) | 8 (0,2) |
| Nefropatía crónica (creatinina> 2 mg/dl) | 1.373 (29,2) | 7 (0,1) |
| Enfermedad cerebrovascular | 609 (12,9) | 8 (0,2) |
| Fibrilación auricular | 2.390 (50,8) | 7 (0,1) |
| Valvulopatía cardiaca | 1.163 (24,7) | 9 (0,2) |
| Arteriopatía periférica | 459 (9,8) | 8 (0,2) |
| Enfermedad pulmonar obstructiva crónica | 1.025 (21,8) | 9 (0,2) |
| Demencia | 604 (12,8) | 10 (0,2) |
| Cáncer | 715 (15,2) | 11 (0,2) |
| Episodios previos de insuficiencia cardiaca aguda | 2.677 (57,1) | 20 (0,4 |
| Datos ecocardiográficos (fracción de eyección del ventrículo izquierdo) | 1.814 (38,5) | |
| Reducida (< 40%) | 551 (19,0) | |
| Intermedia (40-49%) | 403 (13,9) | |
| Conservada (49%) | 1.943 (67,1) | |
| Tratamientos crónicos en casa | ||
| Diurético (cualquiera) | 3.599 (76,8) | 23 (0,5) |
| Bloqueadores beta | 2.188 (46,7) | 27 (0,6) |
| Inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II | 2.591 (55,3) | 24 (0,5) |
| Antagonista del receptor de mineralocorticoides | 785 (16,7) | 23 (0,5) |
| Ivabradina | 101 (2,2) | 24 (0,5) |
| Digoxina | 588 (12,5) | 24 (0,5) |
| Amiodarona | 282 (6,0) | 25 (0,5) |
| Antiplaquetarios | 1.648 (35,2) | 24 (0,5) |
| Anticoagulantes (dicumarínicos) | 1.735 (37,0) | 24 (0,5) |
| Anticoagulantes (de acción directa) | 65 (7,8) | 24 (0,5) |
| Desencadenantes del episodio actual | ||
| Infección | 1.709 (38,0) | 213 (4,5) |
| Fibrilación auricular rápida | 693 (15,4) | 210 (4,5) |
| Anemia | 339 (7,5) | 211 (4,5) |
| Crisis hipertensiva | 233 (5,2) | 210 (4,5) |
| Incumplimiento terapéutico (farmacológico o de la dieta) | 183 (4,1) | 210 (4,5) |
| Síndrome coronario agudo (distinto del IAMCEST)a | 63 (1,3) | 0 (0,0) |
| Estado clínico al llegar a urgencias | ||
| Presión arterial sistólica (mmHg) | 139,8±27,2 | 43±0,9 |
| Frecuencia cardiaca (lpm)a | 87,0±23,0 | 65±1,4 |
| Frecuencia respiratoria (rpm)a | 22,4±6,6 | 1.529±32,5 |
| Pulsioximetría con aire ambiental (%)a | 92,6±6,7 | 120±2,5 |
| NYHA> IIa | 4.033 (88,0) | 128±2,7 |
| Estado funcional evaluado por el índice de Barthel (puntos)a | 65±30 | 817±17,3 |
| Electrocardiograma | ||
| Fibrilación auricular | 2.195 (49,1) | 240 (5,1) |
| Hipertrofia del ventrículo izquierdoa | 208 (4,7) | 240 (5,1) |
| Bloqueo de rama izquierda del haz de His | 428 (9,6) | 240 (5.1) |
| Ritmo de marcapasos | 400 (8,9) | 241 (5,1) |
| Datos de laboratorio | ||
| Hemoglobina (g/l) | 119,4±21,2 | 45±1,0 |
| Glucosa (mg/dl) | 149,0±103,3 | 83±1,8 |
| Creatinina (mg/dl)a | 1,3±0,8 | 49±1,0 |
| Sodio (mEq/l) | 138,7±5,1 | 134±2,8 |
| Potasio (mEq/l)a | 4,4±0,7 | 350 (7,4) |
| NT-proBNP (pg/ml)a | 7.738 [6.414] | 2.533 [53,8] |
| Troponina elevadab | 1.689 [68,2] | 2.235 [47,4] |
| Tratamiento y atención en urgencias | ||
| Oxígeno | 3.235 (69,1) | 27 (0,6) |
| Ventilación no invasiva | 278 (5,9) | 28 (0,6) |
| Ventilación mecánica | 52 (1,1) | 27 (0,6) |
| Morfina | 274 (5,8) | 27 (0,6) |
| Diurético i.v. | 3.919 (83,7) | 27 (0,6) |
| Nitroglicerina i.v. | 453 (9,7) | 27 (0,6) |
| Tratamiento inotrópico o vasopresor | 61 (1,3) | 28 (0,6) |
| Hospitalización | 3.554 (75,5) | 2 (0,0) |
IAMCEST: infarto de miocardio con elevación del segmento ST; i.v.: intravenoso; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Destino final de los pacientes diagnosticados de insuficiencia cardiaca aguda en urgencias según la categoría de riesgo asignada por la escala MEESSI
| Riesgo bajo | Riesgo intermedio | Riesgo alto | Riesgo muy alto | Total | |
|---|---|---|---|---|---|
| Medicina interna | 390 (23,3) | 739 (36,6) | 217 (40,9) | 228 (47,3) | 1.574 (33,5) |
| Cardiología | 336 (20,1) | 310 (15,4) | 75 (14,2) | 43 (8,9) | 764 (16,2) |
| Unidad de corta estancia | 170 (10,2) | 244 (12,1) | 61 (11,5) | 55 (11,4) | 530 (11,3) |
| Geriátrico | 41 (2,5) | 123 (6,1) | 45 (8,5) | 55 (11,4) | 264 (5,6) |
| Unidad de cuidados intensivos/coronarios | 11 (0,7) | 24 (1,2) | 11 (2,1) | 15 (3,1) | 61 (1,3) |
| Otros | 94 (5,6) | 156 (7,7) | 55 (10,4) | 49 (10,2) | 354 (7,5) |
| No ingresados | 630 (37,7) | 423 (21,0) | 66 (12,5) | 37 (7,7) | 1.156 (24,6) |
| Total | 1.672 | 2.019 | 530 | 482 | 4.703 |
Valores ausentes (sin conocimiento de dónde fueron ingresados los pacientes), 8 (0,17%).
Los valores expresan n (%).
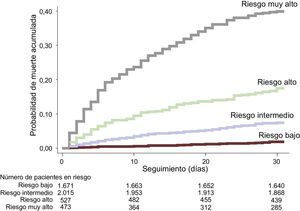
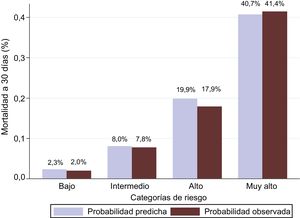
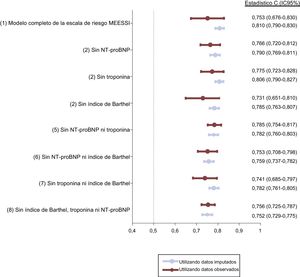
En esta cohorte de validación, 486 pacientes (10,3%) fallecieron en los 30 días tras el ingreso en el SUH. La escala MEESSI predijo la mortalidad a 30 días utilizando 13 variables (modelo completo) con una discriminación excelente (estadístico C=0,810; intervalo de confianza del 95% [IC95%], 0,790-0,830; p <0,001). La distribución de pacientes en las categorías clínicas de riesgo definidas por la escala MEESSI fue la siguiente: 1.673 (35,5%) se clasificaron como de bajo riesgo; 2.023 (42,9%), en riesgo intermedio; 530 (11,3%), en riesgo alto, y 485 (10,3%), en riesgo muy alto. El fuerte gradiente en la mortalidad a 30 días se mantuvo coherente en todas las categorías de riesgo, con una mortalidad acumulada a los 30 días del 2,0, el 7,8, el 17,9 y el 41,4% respectivamente (figura 1). La bondad de ajuste del modelo fue excelente (figura 2). Los otros 7 modelos de la escala MEESSI, que pueden aplicarse para predecir la mortalidad a 30 días en ausencia de índice de Barthel, NT-proBNP y/o troponina, mostraron un estadístico C entre 0,752 y 0,806. El análisis de sensibilidad utilizando únicamente a los pacientes con datos completos (es decir, sin utilizar valores imputados de las variables sin datos disponibles) produjo valores parecidos para los 8 modelos, con un estadístico C que oscilaba entre 0,731 y 0,785 (figura 3). Además, el porcentaje de pacientes que volvían a acudir a urgencias en los 30 días posteriores fue mayor con un aumento de la categoría de riesgo (el 18,5, el 23,5, el 23,7 y el 27,0% respectivamente; p=0,01), y se observó la misma relación respecto a la rehospitalización a 30 días (el 11,0, el 17,5, el 19,7 y el 22,5%; p <0,001).
Curvas de Kaplan-Meier que muestran la mortalidad acumulada a 30 días de los 4 grupos de riesgo clínico determinados por la escala MEESSI. Las categorías de riesgo bajo, intermedio, alto y muy alto corresponden a grupos definidos por los límites hallados en el estudio de derivación original que incluía los quintiles inferiores primero y segundo, los quintiles tercero y cuarto, el decil noveno y el decil superior de mortalidad a 30 días respectivamente.
Evaluación de la bondad de ajuste de la escala MEESSI en los nuevos pacientes incluidos en el presente estudio tras comparar las mortalidades a 30 días observadas y predichas. La prueba de Hosmer-Lemeshow (p=0,745) indica que la mortalidad a 30 días estimada por la escala MEESSI no se desvía de manera significativa de los datos observados.
Descripción del área bajo la curva de características operativas del receptor para el modelo completo MEESSI-ICA y para cada modelo reducido utilizando datos imputados y reales. Los cálculos para el grupo en que se «utilizaron datos imputados» se llevaron a cabo con todos los 4.711 pacientes en todos los modelos, e incluyeron valores reales y también valores imputados para los datos ausentes. Los cálculos del grupo en que «se utilizaron datos observados» se llevaron a cabo únicamente con los pacientes con datos completos de todas las variables relevantes: 602 pacientes en el modelo 1 (modelo completo de la escala MEESSI); 1.215 en el modelo 2; 953 en el modelo 3; 662 en el modelo 4; 2.216 en el modelo 5; 1.394 en el modelo 6; 1.048 en el modelo 7 y 2.669 en el modelo 8. IC95%: intervalo de confianza del 95%; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral.
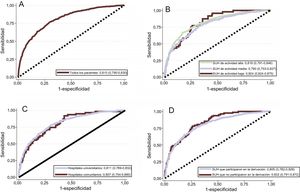
La figura 4 muestra el análisis por subgrupos de la capacidad discriminatoria de la escala MEESSI por tipo de hospital, volumen de actividad del SUH y participación previa en la derivación de la escala. Se obtuvieron estadísticos C muy parecidos, sin diferencias significativas entre los subgrupos. Sorprendentemente, la capacidad discriminatoria del modelo fue muy alta (estadístico C=0,832; IC95%, 0,791-0,872) en la muestra de pacientes reclutados en los SUH que no participaron en la derivación de la escala de riesgo MEESSI.
Curvas de características operativas del receptor para la escala MEESSI aplicadas a toda la cohorte (A), y para los subgrupos de pacientes procedentes de hospitales universitarios y comunitarios (B), SUH con niveles de actividad alto, medio y bajo (C), y de los SUH que participaron y que no participaron en la derivación original de la escala MEESSI (D). Las curvas de características operativas del receptor se obtuvieron con el modelo completo MEESSI e incluyeron a todos los pacientes (aquellos con todos los datos reales completos y aquellos en los que había sido necesaria cierta imputación porque faltaban datos). SUH: servicios de urgencias hospitalarios.
Se ha validado externamente la escala de riesgo MEESSI en una nueva cohorte de pacientes con ICA procedentes de 30 SUH españoles. Los resultados demuestran que la escala MEESSI tiene una gran capacidad discriminatoria, lo cual coincide en los diversos análisis de subgrupos, incluidos los 10 SUH que no se habían involucrado con anterioridad en el proceso de derivación. La escala MEESSI clasifica a los pacientes en 4 categorías clínicas de riesgo. En particular, se clasificó al 35,7% de los pacientes en la categoría de bajo riesgo (mortalidad acumulada a 30 días del 2,0%) y al 10,1% en la categoría de riesgo muy alto (mortalidad acumulada a 30 días del 41,4%, más de 20 veces superior a la de los pacientes de bajo riesgo). Esta estratificación inequívoca del riesgo basada en la predicción de la mortalidad a 30 días puede ayudar a los médicos de urgencias a tomar decisiones clínicas con respecto a la predisposición del paciente con ICA según cálculos objetivos del riesgo.
La escala de riesgo MEESSI mostró una capacidad discriminatoria considerablemente alta en las 3 cohortes de pacientes españoles (estadístico C de 0,836 y 0,828 en las cohortes originales de derivación y validación, y de 0,810 en el estudio de validación actual). Por lo que se sabe, hasta la fecha solo se han elaborado 3 escalas de riesgo derivadas de pacientes de los SUH para predecir la mortalidad: una de Estados Unidos (la STRATIFY [mejora de la estratificación del riesgo de insuficiencia cardiaca en un SUH]5) y 2 de Canadá (la Escala OHFRS [Ottawa Heart Failure Risk Scale]3 y la Escala EHMRG [Emergency Heart Failure Mortality Risk Grade]4). No obstante, su capacidad discriminatoria era inferior a la observada con la escala de riesgo MEESSI (estadístico C=0,68 para la STRATIFY; C=0,77 para la OHFRS; C=0,807 y C=0,804 para la las cohortes de derivación y validación de la EHMRG). Además, puesto que las puntuaciones de riesgo funcionan con las poblaciones a las que se aplican, las diferencias en características del sistema sanitario y en la organización local podrían influir en su desempeño. Esto es particularmente cierto para la ICA en la que los planes de transición, la consulta externa, los ambulatorios sin cita previa, los centros de ICA y otras vías dedicadas específicamente a la enfermedad desempeñan un papel importante en el tratamiento del paciente y pueden influir en sus resultados12-14. Al probar el desempeño de la escala EHMRG en 2 cohortes españolas distintas, formadas por 1.553 y 2.137 pacientes con ICA que acudieron a urgencias, el estadístico C disminuyó desde el valor original (0,807 y 0,804) a 0,74115 y 0,7506 respectivamente. Teniendo en cuenta que se incluyó a todos los pacientes consecutivos con ICA y solo se excluyó a aquellos con infarto de miocardio por elevación del segmento ST e ICA concomitante, la escala MEESSI posiblemente pueda aplicarse a la gran mayoría de pacientes con ICA diagnosticados en los SUH. Esto también diferencia esta escala de riesgo de las demás escalas disponibles, ya que algunas se crearon excluyendo a un número considerable de subgrupos de pacientes (es decir, la EHMRG excluyó a los pacientes de paliativos y la OHFRS reclutó a una muestra no consecutiva con múltiples criterios de exclusión). En consecuencia, los resultados indican que la escala MEESSI no solo funciona bien en los SUH españoles, sino que también satisface una necesidad clínica no cubierta.
La notable precisión de la escala MEESSI para identificar a pacientes de bajo riesgo es potencialmente relevante. Se observó que los pacientes con ICA dados de alta en los SUH españoles y que, por lo tanto, no fueron hospitalizados se hallaban expuestos a un riesgo considerablemente mayor de presentar resultados adversos, lo que a corto plazo equivale a un riesgo especialmente elevado. En realidad, los cocientes de riesgos instantáneos para los pacientes dados de alta de los SUH, comparados con los pacientes dados de alta del hospital tras ajustar por paciente y características del centro, fueron de 2,07 (IC95%, 1,19-3,60), por lo que respecta al hecho de volver a acudir a urgencias durante los 7 días posteriores al alta, y de 3,07 (IC95%, 1,92-4,92) en lo que respecta al riesgo de rehospitalización a 7 días16. Se han comunicado resultados parecidos en Canadá17,18 y Estados Unidos19. Esto pone en evidencia que hay margen de mejora en lo que respecta a la toma de decisiones en urgencias y que la definición y la implementación de estrategias efectivas para mejorar la selección de pacientes para el alta directa de un SUH pueden mejorar los resultados. En un documento reciente de consenso, los expertos propusieron que en los SUH donde fuera posible ampliar la observación (normalmente hasta 24 h), como en muchos SUH españoles, la tasa de altas directas desde urgencias debería ser superior al 40%, mientras que convendría mantener la de pacientes que vuelven a urgencias en 7 días por debajo del 10%, la mortalidad a 30 días <2% y una tasa combinada de nuevas visitas al SUH y rehospitalización a 30 días <20% para este grupo de pacientes tratados sin hospitalización20. La escala MEESSI estratificó a casi el 40% de todos los pacientes en el grupo de bajo riesgo, y la mortalidad a 30 días fue de aproximadamente el 2% en este grupo. Además, estos datos indican que la escala MEESSI también podría estratificar el riesgo de volver al SUH o rehospitalización por ICA, aunque esta capacidad potencial tendrá que comprobarse en posteriores estudios. Estas cifras indican que debería ser factible alcanzar los objetivos de las recomendaciones de los expertos mencionadas anteriormente, y que la escala MEESSI podría servir para conseguir dichos objetivos. Sin embargo, puesto que gran parte de los pacientes de bajo riesgo (62,3%) fueron hospitalizados, no se sabe si los buenos resultados alcanzados en estos pacientes de bajo riesgo habrían sido los mismos si se les hubiera dado de alta directamente desde el SUH sin hospitalizarlos.
La detección de pacientes con ICA en una situación de muy alto riesgo también puede ayudar a los médicos a identificar mejor a este subgrupo de pacientes con alta probabilidad de fallecer en los días posteriores a su paso por el SUH. El hecho de no identificar de inmediato a estos pacientes y la demora en brindarles cuidados intensivos se relaciona con peores resultados21,22. En este contexto, la escala MEESSI también podría servir para mejorar los resultados en este subgrupo de pacientes, si bien en este contexto pueden aplicarse otras escalas de riesgo creadas en el ámbito de los SUH, tales como la recientemente publicada EAHFE-3D23,24, que podría ser incluso más satisfactoria en este grupo de pacientes tan enfermos. Sin embargo, la detección precoz de esta situación no lleva necesariamente al ingreso de los pacientes en la unidad de cuidados intensivos, ya que los cuidados paliativos, más que los intensivos, quizá sean la estrategia más apropiada para algunos pacientes en quienes la ICA es la etapa final de la miocardiopatía crónica avanzada25,26. De hecho, los datos ponen de relieve que la mayoría de los pacientes asignados a la categoría de riesgo muy alto no ingresaron en unidades de cardiología y cuidados intensivos/coronarios, lo que indica que se asignó a cuidados paliativos a una gran proporción de estos pacientes.
LimitacionesEste estudio tiene algunas limitaciones. En primer lugar, al igual que en cualquier estudio llevado a cabo en un solo país, convendría ser prudentes a la hora de extrapolar estos hallazgos a otros países. Además, los SUH no se seleccionaron de manera aleatoria, sino que formaban parte del Registro EAHFE, lo que incluye a investigadores locales con un especial interés en la ICA. No obstante, el desempeño de la escala MEESSI en pacientes de urgencias cuya participación en el Registro EAHFE era reciente y que, por lo tanto, no habían estado implicados en la creación de la escala MEESSI fue muy bueno. Se cree que podrían haberse obtenido resultados parecidos si se hubieran aplicado a otros SUH27, por lo menos en España. En segundo lugar, algunas variables, como el índice de Barthel, la clase funcional de la New York Heart Association y la asociación con el síndrome coronario agudo o el bajo gasto cardiaco se basan parcialmente en la interpretación subjetiva y la adjudicación puede variar entre los distintos observadores. En tercer lugar, la escala MEESSI solo evalúa el riesgo de mortalidad a 30 días. Aunque podría argumentarse que otros resultados relevantes como, por ejemplo, volver a urgencias o la necesidad de rehospitalización podrían hacer más realista o significativa dicha estimación, la relevancia de incluir algunos de estos resultados para estimar el riesgo de ICA sigue siendo tema de debate. Además, no se diferenciaron las causas de la muerte; por lo tanto, se desconoce la contribución real de las causas cardiovasculares a los eventos mortales. Cuarto, tratándose de un estudio observacional real, algunos predictores importantes tenían gran número de valores ausentes. No obstante, esta cuestión se ha tratado utilizando la técnica de la imputación múltiple y presentando 7 modelos adicionales que permiten estimar el riesgo en ausencia de información sobre el índice de Barthel, el NT-proBNP o la troponina. Sin embargo, estas medidas pueden obtenerse prospectivamente en la mayor parte de casos, a excepción quizá del NT-proBNP, y en consecuencia la mayoría de las veces debería ser factible calcular el modelo completo de MEESSI. Quinto, las variables relacionadas con la atención prehospitalaria de los equipos de urgencias no se tuvieron en cuenta, y cada vez está más claro que la asistencia prehospitalaria puede influir en los resultados28,29. Por último, la precisión en el cálculo del riesgo de la escala MEESSI podría cambiar en un futuro si fuera posible disponer de tratamientos que modificaran el pronóstico de la insuficiencia cardiaca. Por ejemplo, los inhibidores del receptor de la angiotensina y de la neprilisina actualmente disponibles no se incluyeron en la creación y la validación de la escala MEESSI.
CONCLUSIONESLa escala MEESSI es una herramienta de utilidad clínica para estratificar el riesgo agudo de los pacientes con ICA de todos los SUH españoles y, a la larga, de todo el mundo. Se creó en una cohorte multicéntrica de gran tamaño, que incluía prácticamente todo tipo de pacientes con ICA. Se ha validado externamente e internamente, muestra un buen desempeño utilizando únicamente variables fácilmente disponibles en el ámbito de los SUH. Además, el acceso online a una calculadora de riesgo fácil de usar que funciona incluso en ausencia de algunas variables6 lo hace muy práctico. Cabe esperar que la generalización de un cálculo preciso del riesgo de los pacientes con ICA que reciben cuidados de médicos de urgencias en un SUH sirva de ayuda para mejorar la toma de decisiones clínicas y, a su vez, influya positivamente en los resultados a corto plazo en un síndrome cuyo pronóstico se ha mantenido en gran parte inamovible a lo largo de varias décadas.
FINANCIACIÓNEste estudio fue financiado parcialmente por subvenciones del Instituto de Salud Carlos III y del Ministerio de Sanidad de España y FEDER (PI15/01019 y PI15/00773) y la Fundació La Marató de TV3 (2015/2510). El grupo de investigaciones «Urgencias: procesos y patologías» del IDIBAPS recibe financiación económica del gobierno catalán para grupos de investigación consolidados (GRC 2009/1385 y 2014/0313). Xavier Rosselló ha recibido financiación del programa de becas SEC-CNIC CARDIOJOVEN.
CONFLICTO DE INTERESESEl Grupo de investigación ICA-SEMES ha recibido financiación ilimitada de Orion Pharma y Novartis. El presente estudio fue diseñado, realizado, analizado y escrito exclusivamente por los autores con independencia de estos laboratorios farmacéuticos. H. Bueno comunica subvenciones y retribuciones personales de AstraZeneca, Daiichi Sankyo, Eli Lilly, Bayer y Sanofi durante la realización del estudio, y retribuciones personales de Novartis, BMS-Pfizer y Servier ajenas al trabajo presentado.
- –
La toma de decisiones (dar el alta u hospitalizar) sobre los pacientes con ICA atendidos en los SUH sigue llevándose a cabo sin estratificación del riesgo.
- –
Solo se han creado unas pocas escalas basadas en pacientes con diagnóstico de ICA; todas de Estados Unidos y Canadá, y actualmente no se utiliza ninguna.
- –
Los resultados del presente estudio validan el desempeño de la escala de riesgo MEESSI en una nueva cohorte de pacientes españoles y en varios subgrupos de hospitales y SUH, y también evalúan la precisión de esta escala a la hora de estratificar a los pacientes con ICA en función del riesgo.
- –
La escala MEESSI muestra que los médicos disponen de 13 ítems para calcular el riesgo individual de muerte a 30 días de los pacientes con ICA que pasan por el SUH.
- –
Este instrumento tiene una capacidad de discriminación y validación excelente y su eficacia se validó en una cohorte distinta de la utilizada para crear la escala.
- –
Los médicos pueden considerar la posibilidad de utilizar esta escala para tomar decisiones clínicas.
- –
La escala MEESSI es un instrumento de utilidad clínica para estratificar el riesgo agudo de los pacientes con ICA de todos los SUH españoles y, a la larga, de todo el mundo.
Agradecemos a Alícia Díaz su profesionalidad en el tratamiento de los datos. Por otros investigadores del ICA-SEMES (Grupo de investigación Insuficiencia Cardiaca Aguda de la Sociedad Española de Medicina de Urgencias y Emergencias), se puede consultar el