Entre los pacientes que se someten a una intervención coronaria percutánea (ICP), los que presentan síntomas de síndrome coronario agudo (SCA) corren un mayor riesgo de sufrir eventos trombóticos que aquellos con síntomas de síndrome coronario crónico (SCC). Para atenuar este riesgo, se recomienda aplicar el tratamiento antiagregante plaquetario doble (TAPD) más potente y de mayor duración1. No obstante, esto plantea dudas con respecto a un mayor riesgo de hemorragia, en particular para los pacientes que ya se consideran en alto riesgo hemorrágico (ARH).
Para definir el ARH en los pacientes con SCA sometidos a ICP, la guía de práctica clínica europea recomienda utilizar los criterios del Academic Research Consortium for High Bleeding Risk (ARC-HBR) o una puntuación en la escala PRECISE-DAPT ≥ 252. El ARC-HBR define arbitrariamente el ARH como una tasa de hemorragias de grado Bleeding Academic Research Consortium (BARC) 35 ≥ 4% o de hemorragias intracraneales (HIC) ≥ 1% al cabo de 1 año3. A partir de una revisión de la literatura médica y de consensos de expertos, se clasificaron 20 factores de riesgo hemorrágico en criterios mayores o menores según estos valores de corte y el riesgo de hemorragia asociado. Se define como criterio mayor cualquiera que, por sí solo, se asocie con la frecuencia de los eventos mencionados y como criterio menor, cualquier criterio que, por sí solo, se asocie con una mayor tasa de hemorragias pero con un riesgo BARC 3-5 < 4% al cabo de 1 año. Se consideró que los pacientes con 1 o más criterios mayores o 2 o más criterios menores corrían un ARH. La clasificación en criterios mayores o menores se hizo de acuerdo con los datos de los ensayos y los registros procedentes de poblaciones mixtas de SCC y SCA. Además, los estudios a gran escala previos que validaron el uso de estos criterios lo hicieron mayoritariamente en poblaciones mixtas de SCC y SCA de registros de ICP, con datos del registro Bern PCI en 3 estudios, del registro del Hospital Mount Sinai de Nueva York en 2 estudios y del registro CREDO-Kyoto en 1 (tabla 1)4–9.
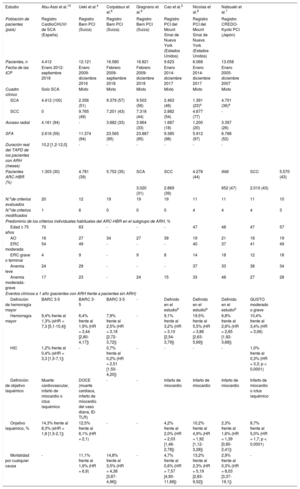
Estudios que validan los criterios de ARC-HBR en registros reales de ICP
| Estudio | Abu-Assi et al.10 | Ueki et al.4 | Corpataux et al.6 | Gragnano et al.9 | Cao et al.5 | Nicolas et al.8 | Natsuaki et al.7 | ||
|---|---|---|---|---|---|---|---|---|---|
| Población de pacientes (país) | Registro CardioCHUVI de SCA (España) | Registro Bern PCI (Suiza) | Registro Bern PCI (Suiza) | Registro Bern PCI (Suiza) | Registro PCI del Mount Sinai de Nueva York (Estados Unidos) | Registro PCI del Mount Sinai de Nueva York (Estados Unidos) | Registro CREDO-Kyoto PCI (Japón) | ||
| Pacientes, n | 4.412 | 12.121 | 16.580 | 16.821 | 9.623 | 6.068 | 13.058 | ||
| Fecha de las ICP | Enero 2012-septiembre 2018 | Enero 2009-diciembre 2016 | Febrero 2009-septiembre 2018 | Febrero 2009-diciembre 2018 | Enero 2014-diciembre 2017 | Enero 2014-diciembre 2017 | Enero 2005-diciembre 2007 | ||
| Cuadro clínico | Solo SCA | Mixto | Mixto | Mixto | Mixto | Mixto | Mixto | ||
| SCA | 4.412 (100) | 2.356 (51) | 9.379 (57) | 9.503 (56) | 2.463 (46) | 1.391 (23)a | 4.701 (36)a | ||
| SCC | 0 | 9.765 (49) | 7.201 (43) | 7.318 (44) | 2.882 (54) | 4.677 (77) | - | ||
| Acceso radial | 4.161 (94) | - | 3.882 (33) | 3.964 (33) | 1.687 (18) | 1.200 (20) | 3.397 (26) | ||
| SFA | 2.616 (59) | 11.374 (94) | 23.565 (95) | 23.887 (95) | 9.385 (98) | 5.912 (97) | 6.788 (52) | ||
| Duración real del TAPD de los pacientes con ARH (meses) | 10,2 [1,2-12,0] | - | - | - | - | - | - | ||
| Pacientes ARC-HBR (%) | 1.303 (30) | 4.781 (39) | 5.752 (35) | SCA | SCC | 4.278 (44) | IAM | SCC | 5.570 (43) |
| 3.020 (31) | 2.869 (39) | 652 (47) | 2.010 (43) | ||||||
| N.ode criterios evaluados | 20 | 12 | 19 | 19 | 19 | 11 | 11 | 11 | 10 |
| N.ode criterios modificados | 1 | 6 | 0 | 0 | 0 | 4 | 4 | 4 | 3 |
| Predominio de los criterios individuales habituales del ARC-HBR en el subgrupo de ARH, % | |||||||||
| Edad ≥ 75 años | 70 | 63 | - | - | - | 47 | 48 | 47 | 57 |
| AO | 16 | 27 | 34 | 27 | 39 | 19 | 21 | 18 | 19 |
| ERC moderada | 54 | 49 | - | - | - | 40 | 37 | 41 | 49 |
| ERC grave o terminal | 4 | 9 | - | 9 | 8 | 14 | 18 | 12 | 18 |
| Anemia leve | 24 | 29 | - | - | - | 37 | 33 | 38 | 34 |
| Anemia moderada-grave | 17 | 23 | - | 24 | 15 | 33 | 48 | 27 | 28 |
| Eventos clínicos a 1 año (pacientes con ARH frente a pacientes sin ARH) | |||||||||
| Definición de hemorragia mayor | BARC 3-5 | BARC 3-5 | BARC 3-5 | - | Definido en el estudiob | Definido en el estudiob | Definido en el estudiob | GUSTO moderado o grave | |
| Hemorragia mayor | 9,4% frente al 1,3% (sHR = 7,3 [5,1-10,4]) | 6,4% frente al 1,9% (HR = 3,44 [2,80-4,17]) | 7,9% frente al 2,5% (HR = 3,18 [2,72-3,72]) | - | 9,1% frente al 3,2% (HR = 3,10 [2,54-3,79]) | 19,5% frente al 5,5% (HR = 3,86 [2,63-5,69]) | 6,8% frente al 2,6% (HR = 2,65 [1,92-3,68]) | 10,4% frente al 3,4% (HR = 3,06) | |
| HIC | 1,2% frente al 0,4% (sHR = 3,3 [1,5-7,1]) | - | 0,7% frente al 0,2% (HR = 2,51 [1,50-4,20]) | - | - | - | - | 1,0% frente al 0,3% (HR = 3,3; p < 0,0001) | |
| Definición de objetivo isquémico | Muerte cardiovascular, infarto de miocardio o ictus isquémico | DOCE (muerte cardiaca, infarto de miocardio del vaso diana, ID-TLR) | - | - | Infarto de miocardio | Infarto de miocardio | Infarto de miocardio | Infarto de miocardio o ictus isquémico | |
| Onjetivo isquémico, % | 14,3% frente al 8,3% (sHR = 1,8 [1,5-2,1]) | 12,5% frente al 6,1% (HR = 2,1) | - | - | 4,2% frente al 2,0% (HR = 2,03 [1,48-2,78]) | 10,2% frente al 4,9% (HR = 1,92 [1,12-3,28]) | 2,3% frente al 1,6% (HR = 1,39 [0,80-2,41]) | 8,7% frente al 5,0% (HR = 1,7; p < 0,0001) | |
| Mortalidad por cualquier causa | - | 11,1% frente al 1,6% (HR = 6,9) | 14,8% frente al 3,5% (HR = 4,38 [3,87-4,96]) | - | 4,7% frente al 0,6% (HR = 7,57 [4,90-11,68]) | 13,2% frente al 2,3% (HR = 5,19 [2,83-9,52]) | 2,9% frente al 0,3% (HR = 8,03 [3,37-19,1]) | - | |
AO: anticoagulación oral; ARC-HBR: Academic Research Consortium for High Bleeding Risk; ARH: alto riesgo hemorrágico; BARC: Bleeding Academic Research Consortium; ERC: enfermedad renal crónica; HR: hazard ratio; IAM: infarto agudo de miocardio; ID-TLR: revascularización de la lesión diana guiada por isquemia; IPC: intervención coronaria percutánea; OR: odds ratio; SCA: síndrome coronario agudo; SCC: síndrome coronario crónico; SFA: stent farmacoactivo; sHR: subhazard ratio; TAPD: tratamiento antiagregante plaquetario doble.
Hemorragia hospitalaria y posterior al alta hasta 1 año después de la ICP. La hemorragia hospitalaria se definió según la definición del Registro CathPCI de datos cardiovasculares como una caída de la hemoglobina ≥ 3g/dl, una caída de la hemoglobina que requiere transfusión de sangre o hemorragia que requiere intervención en el sitio de la hemorragia. La hemorragia posterior al alta se definió como cualquier hemorragia que requiera hospitalización o transfusión de sangre.
Con esta información en mente, en un reciente artículo publicado en Revista Española de Cardiología, Abu-Assi et al.10 analizaron la validez de los criterios del ARC-HBR en una población con SCA sometida a ICP seguida de TAPD (n=4.412) y compararon las definiciones del ARC-HBR y la escala PRECISE-DAPT de ARH con respecto a su capacidad para predecir eventos hemorrágicos a partir de datos retrospectivos del registro CardioCHUVI-ACS. Los investigadores observaron que, en los pacientes con ARH según la definición del ARC comparados con los pacientes sin ARH, las tasas de hemorragias mayores a 1 año eran considerablemente mayores y que según aumenta el número de criterios en los pacientes con ARH según el ARC aumentan las tasas de hemorragias. Estas observaciones corroboran los resultados de los estudios de validación previos en las poblaciones mixtas de SCC y SCA4,5,7. Además, las tasas de hemorragias BARC 3-5 y HIC a 1 año satisficieron los valores de corte propuestos por el ARC-HBR. Por otro lado, las tasas de hemorragias asociadas con todos los criterios excepto 4 satisficieron el valor de corte predefinido por el ARC-HBR (una tasa de hemorragias BARC 3-5 ≥ 4% a 1 año para un criterio mayor solo o una tasa de hemorragias aumentada < 4% para un criterio menor solo). El predominio de los 4 criterios que no lo satisficieron fue muy bajo (entre el 0,2 y el 1,8% de la población del ARC-HBR), lo que impidió su evaluación exhaustiva. Por último, comparada con la puntuación de la escala PRECISE-DAPT, la clasificación según la definición del ARC-HBR resultó en una prevalencia notablemente inferior de pacientes en ARH (el 30 frente al 40%) y una predicción más exacta de las hemorragias BARC 3-5 a 1 año, lo que llevó a los autores a concluir que el ARC es un sistema de clasificación más exacto del ARH que la puntuación de la escala PRECISE-DAPT.
Se debe felicitar a los autores por el que, según nuestros conocimientos, es el primer estudio a gran escala que valida el uso de los criterios del ARC-HBR en una población con SCA que incluye el espectro completo de los síntomas del SCA. Los puntos fuertes importantes de este análisis son el empleo de la tasa de hemorragias BARC 3-5 como definición de hemorragia mayor según la definición del ARC-HBR y el análisis de las tasas de HIC, además de la hemorragia mayor y la adjudicación retrospectiva (más que la omisión o modificación) de los criterios no disponibles en la base de datos utilizada. Se evaluaron los 20 criterios, con modificación de solo uno (toma crónica de fármacos antiinflamatorios no esteroideos o esteroides). Además, la alta frecuencia del acceso radial (más del 90% de las intervenciones comparado con solo una tercera parte de las intervenciones en el registro Bern PCI y una quinta en el registro del Mount Sinai) aumenta la validez externa para la práctica contemporánea. Por otro lado, la generalización de los resultados está algo limitada por la naturaleza unicéntrica del estudio y porque en el grupo de ARH se implantaron stents farmacoactivos (SFA) solo al 48% de los pacientes. Incluso entre los pacientes sin ARH, solo el 64% recibió un SFA. Esta práctica no concuerda con el actual protocolo asistencial europeo, que desde 2018 recomienda el SFA como el de elección para todo paciente al que se practique una ICP1. Aunque se puede explicar en parte por el hecho de que las ICP tuvieron lugar entre enero de 2012 y septiembre de 2018, en los estudios de validación de los registros Bern PCI y Mount Sinai PCI se informaba del uso de SFA en al menos el 95% de los pacientes con datos de edad similar, lo que indicaría que esta práctica es un amplio reflejo de los protocolos específicos de la institución en aquel momento.
Es notable que el predominio de pacientes con ARH según la definición del ARC en esta población fue claramente inferior (30%) al de los estudios previos de poblaciones mixtas de SCC y SCA (un 35-39% en el registro Bern PCI, un 44% en el registro del Mount Sinai y un 43% en el registro CREDO-Kyoto)4–7. Hay dos posibles explicaciones. Primero, puede que haya menor predominio de pacientes en ARH según el ARC entre los que presentan síntomas de SCA que en aquellos con SCC. Segundo, el uso de criterios modificados del ARC-HBR en algunos estudios previos puede haber sobrestimado el predominio de los pacientes en ARH. Esta explicación se basa en los resultados del registro Bern PCI, en el cual el predominio observado de pacientes con ARH según el ARC fue del 31% de los sujetos con SCA comparado con el 39% de aquellos con SCC, principalmente porque los primeros eran más jóvenes y tomaban menos anticoagulantes orales9. No obstante, se mostró lo contrario en un estudio del Mount Sinai, que informó de una prevalencia del 47% de los pacientes que sufrieron infarto agudo de miocardio frente al 43% de los que sufrieron SCC8. La exclusión de pacientes con angina inestable y la modificación de algunos criterios ARC-HBR en el estudio del Mount Sinai podría ayudar a explicar esta tendencia inversa. Esto último probablemente también explique la mayor prevalencia de pacientes con ARH en general. Solo se adjudicaron 11 de los 20 criterios, 4 de los cuales se modificaron en el estudio del Mount Sinai frente a los 19 criterios sin modificar del estudio de Abu-Assi et al. y del estudio Bern. La sustitución de los criterios propuestos por otros modificados menos específicos («antecedentes de cualquier tipo de hemorragia gastrointestinal» en lugar de «hemorragia no intracraneal espontánea que requiere hospitalización o transfusión entre 6 y 12 meses antes de la ICP») resulta inevitablemente en una clasificación errónea de una mayor proporción de pacientes con ARH.
En consonancia con otros estudios de validación, los criterios más frecuentes del ARC-HBR en el estudio de Abu-Assi et al. fueron la edad, la enfermedad renal crónica, la anemia y los anticoagulante orales, aunque hubo un mayor predominio de pacientes ancianos y menor frecuencia de anemia en el estudio de Abu-Assi et al.10. Es notable que los anticoagulantes orales solos se relacionaron con una tasa de hemorragias BARC 3-5 del 5,4% a 1 año frente a solo el 2,5% del registro Bern PCI4. Los anticoagulantes orales se combinaron con TAPD (tratamiento triple) durante un periodo medio de 1,9 meses en el estudio de Abu-Assi et al.10, mientras que no se ofrece información sobre la duración del TAPD o su cumplimiento en el último registro, lo cual complica la comparación. También merece la pena destacar que la edad ≥ 75 años se relacionó por sí sola con una tasa de hemorragias BARC 3-5 de solo el 0,7% en el estudio de Abu-Assi et al.10. Aunque la tasa esperada de hemorragias con un criterio menor es < 4%, parece que es inferior a lo esperado, en particular en el contexto de una tasa de hemorragias BARC 3-5 del 1,3% en otros pacientes sin ARH (con 1 criterio menor o ninguno). El motivo no está claro.
Aunque se esperan mayores tasas absolutas de hemorragias en los pacientes con SCA que en aquellos con SCC, por el tratamiento antitrombótico más agresivo8, cabe destacar que el aumento relativo de la tasa de hemorragias entre los pacientes con ARH y sin ARH fue más pronunciado en el estudio de Abu-Assi et al.10 que en los estudios en poblaciones mixtas. Se observó un aumento de las hemorragias BARC 3-5 de 7 veces, comparado con un aumento de aproximadamente el triple de la hemorragias mayores en estudios previos, independientemente de la definición de hemorragia utilizada11. En un estudio del Mount Sinai, se observaron resultados concordantes, aunque la diferencia no fue tan marcada: la hazard ratio de eventos hemorrágicos en los pacientes con ARH frente a sin ARH fue de 3,86 con SCA y 2,65 con SCC8. En cambio, en el estudio de Abu-Assi et al., el número de eventos isquémicos, prácticamente el doble, en los pacientes con ARH frente a sin ARH coincide con estudios previos con poblaciones mixtas de SCA y SCC11, aunque en los estudios se han utilizado definiciones distintas para los resultados isquémicos.
Si se tienen en cuenta todos los estudios de validación, frente a los pacientes con SCC, parece que la proporción de pacientes con SCA y ARH sería menor, pero cuando estos pacientes sangran, la tasa de hemorragias es exageradamente más alta en los pacientes sin ARH que lo que se observa en el SCC. No está claro si esto se debe en parte a algún proceso inflamatorio sistémico intrínseco en el momento del evento agudo o simplemente a factores extrínsecos, como las diferencias en la intervención y los tratamientos antitrombóticos. Por ejemplo, en el registro Bern PCI, en los pacientes con síntomas de SCA, frente a SCC, fue mayor la frecuencia del acceso femoral, la asistencia hemodinámica invasiva y la ICP gradual, así como el tratamiento con antiagregantes plaquetarios más potentes y durante más tiempo en la intervención y el mantenimiento9. Además, por razones que no están claras, en el estudio de Abu-Assi et al.10, la frecuencia del acceso femoral fue considerablemente mayor en aquellos con ARH que sin ARH, un resultado que también se observó en los registros Bern, Mount Sinai y CREDO-Kyoto6–8.
Una cosa es cierta: estos factores extrínsecos (o iatrogénicos) pueden modificarse. Las estrategias para evitar hemorragias, como elegir por defecto el acceso radial, el ajuste de la dosis de los anticoagulantes durante la intervención y la prescripción liberal de inhibidores de la bomba de protones, deben ser objeto de especial atención en los pacientes con SCA. Además, aunque el SCA es un contexto de alto riesgo trombótico, hay que sopesar tanto este riesgo como el hemorrágico12. En este sentido, la guía europea recomienda individualizar el TAPD para los pacientes con SCA en función del balance de estos riesgos, con TAPD menos potente y de menor duración si las dudas relativas al riesgo hemorrágico superan a las relativas al riesgo trombótico2. No obstante, el paso crucial en todo esto es ser capaz de identificar a los pacientes adecuados. El estudio de Abu-Assi et al.10 da la seguridad de que puede hacerse con confianza utilizando los criterios ARC-HBR en los pacientes con SCA.
FINANCIACIÓNR. Colleran ha recibido una beca de investigación para la institución por parte de Women As One. No se recurrió a financiación externa para el comentario editorial.
CONFLICTO DE INTERESESR. Colleran ha recibido honorarios de conferenciante de Medtronic. P. Urban es director médico de CERC (Massy, Francia) y asesor de MedAlliance (Nyon, Suiza) y Biosensors (Morges, Suiza).