Se han desarrollado puntuaciones multiparamétricas para una mejor estratificación del riesgo en el síndrome de Brugada (SBr). Nuestro objetivo es validar 3 abordajes multiparamétricos (las escalas Delise, Sieira y Shanghai BrS) en una cohorte de pacientes con síndrome de Brugada y estudio electrofisiológico (EEF).
MétodosPacientes diagnosticados de SBr y con un EEF previo entre 1998-2019 en 23 hospitales. Se utilizaron análisis mediante estadístico C y modelos de regresión de riesgos proporcionales de Cox.
ResultadosSe incluyó en total a 831 pacientes con una media de edad de 42,8±13,1 años; 623 (75%) eran varones; 386 (46,5%) tenían patrón electrocardiográfico (ECG) tipo 1; 677 (81,5%) estaban asintomáticos y 319 (38,4%) tenían un desfibrilador automático implantable. Durante un seguimiento de 10,2±4,7 años, 47 (5,7%) sufrieron un evento cardiovascular. En la cohorte total, un ECG tipo 1 y síncope fueron predictivos de eventos arrítmicos. Todas las puntuaciones de riesgo se asociaron significativamente con los eventos. Las capacidades discriminatorias de las 3 escalas fueron discretas (particularmente al aplicarlas a pacientes asintomáticos). La evaluación de las puntuaciones de Delise y Sieira con diferente número de extraestímulos (1 o 2 frente a 3) no mejoró sustancialmente el índice c de predicción de eventos.
ConclusionesEn el SBr, los factores de riesgo clásicos como el ECG y el síncope previo predicen eventos arrítmicos. El número de extraestímulos necesarios para inducir arritmias ventriculares influye en las capacidades predictivas del EEF. Las escalas que combinan factores de riesgo clínico con EEF ayudan a identificar las poblaciones con más riesgo, aunque sus capacidades predictivas siguen siendo discretas tanto en población general con SBr como en pacientes asintomáticos.
Palabras clave
Se ha demostrado que diversas variables clínicas predicen un peor resultado en los pacientes con síndrome de Brugada (SBr)1–5. Los ejemplos destacados son el síncope o la parada cardiaca previos y un patrón espontáneo de tipo 1 en el electrocardiograma (ECG)3. Se ha indicado la realización de un estudio electrofisiológico (EEF) como factor válido para predecir muerte súbita cardiaca (MSC). En concreto, se cree que el número de extraestímulos que inducen las arritmias ventriculares (AV) son un indicador pronóstico apropiado6. Lamentablemente, hoy en día no hay consenso sobre la importancia del EEF a la hora de predecir resultados ni acuerdo alguno sobre el valor pronóstico de los antecedentes familiares de MSC. Así pues, los distintos factores carecen de la especificidad suficiente para predecir resultados y orientar el tratamiento, como la necesidad de un desfibrilador automático implantable (DAI).
Para solventar la escasa utilidad de cada uno de estos factores, varios autores han recomendado utilizar enfoques combinados que incluyan parámetros clínicos, electrocardiográficos y, a veces, electrofisiológicos7–10. En 2010, Delise et al.7 informaron de la utilidad de una escala que incluye parámetros tanto clínicos como del EEF de los pacientes con SBr y sin parada cardiaca previa. Asimismo, el grupo de Pedro Brugada8 recomendó una escala clínica, de elevada eficacia pronóstica, que incorporaba un patrón de ECG, antecedentes familiares de MSC tempranos, EEF inducible, cuadro clínico de síncope o MSC recuperada y disfunción del nódulo sinusal. En 2018, el sistema de puntuación diagnóstica propuesto, denominado escala Shanghai para SBr, basada en los informes publicados disponibles y en los coeficientes ponderados derivados de algunos conjuntos de datos —como un patrón de ECG de tipo 1 espontáneo, fiebre o un ECG de tipo 1 inducido por fármacos, los antecedentes de arritmia o síncope arrítmico, los antecedentes familiares y los resultados de una prueba genética— puso de relieve su valor diagnóstico y la estratificación del riesgo en los pacientes con SBr9 (tabla 1). No obstante, han validado estos modelos solo Letsas et al.10 en una pequeña serie y más recientemente Probst et al.11. Mayormente, se desconoce su utilidad según el número de extraestímulos que inducen AV. Por último, hay poca información sobre su valor pronóstico en los pacientes asintomáticos.
Variables pronósticas independientes en las 3 escalas de riesgo en estudio
| Escala | Variables | Categorías |
|---|---|---|
| Delise et al.7 | 1. Antecedentes familiares de MSC2. Síncope3. ECG de tipo 1 espontáneo4. EEF positivo | Los sujetos en mayor riesgo son aquellos con un patrón de tipo 1 en el ECG basal y 2 o más de los siguientes factores de riesgo:• Síncope• Antecedentes familiares de MSC• EEF positivo |
| Sieira et al.8 | 1. Síncope (2 puntos)2. MSC recuperada (4 puntos)3. ECG de tipo 1 espontáneo (1 punto)4. Disfunción del nódulo sinusal (3 puntos)5. Antecedentes familiares de MSC tempranos en familiares de primer grado (1 punto)6. AV inducibles (2 puntos) | Una puntuación >2 muestra una probabilidad del evento considerablemente mayor |
| Escala Shanghai para SBr9 | I. ECG (12 derivaciones/ambulatorio)• ECG de tipo 1 espontáneo en las derivaciones indicadas o superiores (3,5 puntos)• ECG de tipo 1 inducido por fiebre en las derivaciones indicadas o superiores (3 puntos)• Patrón del ECG de tipo 2 o 3 que se transforma con la exposición a fármacos (2 puntos) | • Riesgo moderado: 3,5• Riesgo elevado: 4 a 5• Riesgo más alto ≥ 5,5 |
| II. Anamnesis | ||
| • Parada cardiaca de causa desconocida o FV documentada/TV polimórfica (3 puntos)• Respiraciones agónicas nocturnas (2 puntos)• Sospecha de síncope arrítmico (2 puntos)• Síncope de mecanismo poco claro/etiología poco clara (1 punto)• Aleteo auricular/fibrilación en menores de 30 años sin etiología alternativa (0,5 puntos) | ||
| III. Antecedentes familiares | ||
| • Familiar de primer o segundo grado con SBr definitivo (2 puntos)• Sospecha de MSC (fiebre, nocturna, fármacos que agravan el síndrome de Brugada) en un familiar de primer o segundo grado (1 punto)• MSC de origen desconocido en un familiar de primer o segundo grado menor de 45 años con autopsia negativa (0,5 puntos) | ||
| IV. Resultado de las pruebas genéticas | ||
| • Probable mutación patógena en un gen susceptible al SBr (0,5 puntos) |
AV: arritmia ventricular; ECG: electrocardiograma; EEF: estudio electrofisiológico; FV: fibrilación ventricular; MSC: muerte súbita cardiaca; SBr: síndrome de Brugada; TV: taquicardia ventricular.
El objetivo de este estudio es validar estas escalas multiparamétricas en una amplia cohorte de pacientes con SBr y EEF, y para ello se determinó su capacidad diagnóstica por medio del número de extraestímulos necesarios para inducir AV, así como la presencia de síntomas previos. Un objetivo secundario es analizar las variables independientes de un EEF positivo.
MÉTODOSInclusión en el estudioEl presente es un registro retrospectivo de pacientes con diagnóstico de SBr y EEF previo realizado entre 1998 y noviembre de 2020 en 23 hospitales especializados españoles y 1 portugués. El registro se llevó a cabo según la Declaración de Helsinki y lo aprobó el comité de ética de cada centro. Los centros participantes incluyeron a pacientes consecutivos con SBr y EEF. Se diagnosticó SBr después de un episodio de MSC recuperada, durante la evaluación de un síncope, en pacientes asintomáticos con un patrón de ECG indicativo durante la exploración habitual o como consecuencia del cribado familiar posterior al diagnóstico de SBr en un miembro de la familia.
Se definió el síncope como la pérdida de conciencia según el consenso de la literatura médica actual12–15. Para el propósito de este estudio, se intentó diferenciar entre causas vasovagales y arrítmicas, y solo se incluyeron los episodios de síncope de origen cardiovascular. Se incluyó a los pacientes que cumplían los mencionados criterios de cribado y presentaban un patrón de Brugada de tipo 1 en el ECG basal en al menos una ocasión o tras la provocación con un fármaco antiarrítmico de clase I (dependiendo de su disponibilidad en los hospitales participantes, se utilizaron tanto ajmalina como flecainida/procainamida). El patrón de tipo 1 en el ECG se definió como una elevación prominente del segmento ST que mostraba una amplitud de onda J o una elevación del segmento ST ≥ 0,2mV en el punto máximo seguido de una onda T negativa14.
El objetivo primario incluyó MSC o tratamiento con desfibrilador de alto voltaje (es decir, descargas) para la taquicardia ventricular polimórfica o la fibrilación ventricular (FV), tal como se determinó mediante las consultas de datos del desfibrilador durante el seguimiento. Solo se clasificaron las descargas del desfibrilador para la taquicardia ventricular polimórfica o la fibrilación; las AV finalizadas con marcapasos antitaquicardia no se clasificaron como objetivo primario alcanzado.
Protocolo del seguimientoCuando los pacientes no presentaban síntomas ni recibían tratamiento con algún dispositivo, solo se les visitaba cada 6 a 12 meses para una revisión clínica y consulta de dispositivo, según el protocolo del centro de salud local. La programación del DAI se dejó a cargo del electrofisiólogo remitente. No obstante, tras las recomendaciones de 2006, se aconsejó la programación de una única zona de FV por encima de los 210-220 lpm. Se contactó por teléfono con los pacientes que no tenían seguimiento en el centro de procedencia.
Estudio electrofisiológicoFue constante la estimulación ventricular programada desde el ápex del ventrículo derecho (VD) y, en algunos centros, también desde el tracto de salida del ventrículo derecho. La estimulación incluyó de 2 a 3 longitudes del ciclo de estimulación (600, 500 y 430ms) con hasta 3 extraestímulos. Los extraestímulos se anticiparon en reducciones de 10ms hasta un intervalo más corto de acoplamiento de 200ms. Se determinó como resultado positivo del EEF la inducción de una AV sostenida (> 30 s) o una que requiriera descarga. Se atribuyó un resultado negativo al EEF cuando no se indujo AV o esta fue corta y finalizó por sí sola sin necesidad de descarga.
Análisis estadísticoLos análisis estadísticos se hicieron con la versión 21 del software SPSS (SPSS Inc., Estados Unidos) y la versión 3.6 del paquete estadístico R (R Foundation for Statistical Computing, Austria)16. Las variables continuas informan media±desviación estándar y las variables categóricas, frecuencias y porcentajes. Se compararon las características iniciales entre los grupos con la prueba de la χ2 para las variables categóricas y las pruebas de la t de Student o de la U de Mann-Whitney para comparar los rangos de las variables continuas. Se utilizó el estadístico C para evaluar la capacidad de discriminación del modelo (concordancia).
Se representaron curvas de incidencia acumulada para evaluar la supervivencia de los pacientes según el riesgo de los eventos competitivos. El tiempo 0 corresponde al momento del EEF. Un riesgo competitivo es un evento cuya ocurrencia impide la ocurrencia de otro evento en estudio o básicamente altera la probabilidad de que este otro evento se produzca.
Se utilizaron los modelos de regresión de riesgos competitivos de Fine y Gray para predecir el riesgo total de un individuo (incidencia) de sufrir el evento. Los riesgos se cuantificaron como tasas de riesgos de subdistribución (TRS) de Fine-Gray, con intervalos de confianza del 95% (IC95%). La categoría de referencia en cada una de las 4 escalas se correspondió con la de la puntuación más baja (0 para la escala Delise7, <2 para la escala Sieira8 y ≤ 3 puntos para la escala Shanghai para SBr)9. Para cada valor de corte de las escalas y del EEF, se estimaron el valor diagnóstico de un resultado positivo (VDP) y el valor diagnóstico de un resultado negativo (VDN) dependientes del tiempo mediante la ponderación de la probabilidad inversa de la censura estadística, teniendo en cuenta los riesgos competitivos.
RESULTADOSCaracterísticas clínicas e indicación de implante de desfibrilador automático implantableCaracterísticas de los pacientesSe dispuso de un total de 831 pacientes para el análisis. En la tabla 2 se resumen las características basales de los pacientes en la base de datos final. El seguimiento medio fue de 10,18±4,77 años.
Características demográficas de la población en estudio
| Población total (N=831) | |
|---|---|
| Edad al diagnóstico (años) | 42,8±13,1 |
| Varones/mujeres | 561 (77)/208 (25) |
| Tipo 1 espontáneo | 386 (46,5) |
| Tipo 1 inducido por fármacos | 541 (65,1) |
| Ajmalina/flecainida | 156 (18,8)/398 (47,9) |
| Tipo 1 inducido por fiebre | 60 (3,6) |
| Antecedentes familiares de MSC | 282 (33,9) |
| Asintomáticos | 677 (81,5) |
| Síncope | 127 (15,3) |
| Antecedentes de MSC | 28 (3,4) |
| Fibrilación auricular | 42 (5,1) |
| Genética positiva | 126 (15,2) (n=390) |
| EEF positivo (3 extraestímulos) | 272 (32,7) |
| EEF positivo (2 extraestímulos) | 111 (13,4) |
| Inducido por fármacos y EEF positivo | 99 (11,9) |
| Implante de DAI | 319 (38,4) |
| Puntuación media de la Delise | 1,3±1 |
| Puntuación media de la Sieira | 5,6±1,6 |
| Puntuación media de la Shanghai para SBr | 3,8±1,3 |
| Puntuación Sieira | |
| ≤ 2 | 577 (69,4) |
| 3-5 | 238 (28,6) |
| 6-8 | 12 (1,4) |
| Puntuación Delise | |
| 1 | 305 (36,7) |
| 2 | 222 (26,7) |
| 3 | 88 (10,6) |
| 4 | 9 (1,1) |
| Puntuación Shanghai | |
| ≤ 3 | 103 (12,4) |
| 3,5 | 90 (10,8) |
| 4-5 | 104 (12,5) |
| ≥ 5,5 | 59 (7,1) |
DAI: desfibrilador automático implantable; EEF: estudio electrofisiológico; MSC: muerte súbita cardiaca; SBr: síndrome de Brugada.
Los valores expresan n (%) o media ± desviación estándar.
Se indujeron arritmias ventriculares (taquicardia ventricular/FV) mediante estimulación ventricular programada a 272 pacientes (32,7%). Concretamente, se indujeron AV con 1 o 2 extraestímulos a 111 pacientes (13,4%). Se careció de información sobre el número de extraestímulos de 4 pacientes (0,48%).
El EEF se realizó desde el ápex del VD en 523 pacientes (62,9%) y desde el tracto de salida del VD en 245 (29,5%). No se pudo recuperar este dato de63 pacientes. La tasa de episodios varió entre el protocolo del sitio 1 (ápex del VD) y el del sitio 2 (tracto de salida del VD) (el 7,5 frente al 2,4%; p=0,043). No obstante, en el análisis univariable de regresión de Cox no se observó relación estadística del tiempo transcurrido hasta el evento con la aparición de AV.
En el análisis multivariable, la edad en el momento del diagnóstico (odds ratio [OR] = 1,02; IC95%, 1,01-1,04) y el patrón de tipo 1 en el ECG (OR = 2,14; IC95%, 1,38-3,33) y los antecedentes familiares de MSC o los episodios de síncope previos fueron predictores de un EEF positivo (1, 2 o 3 extraestímulos), y se observó relación inversa en el sexo femenino (OR = 0,41; IC95%, 0,27-0,62) (tabla 3). Cuando se consideró que el EEF era positivo al inducir AV con 1 o 2 extraestímulos, los episodios de síncope previos no fueron predictores de EEF positivo (tabla 3).
Análisis de regresión logística para predecir el riesgo de un estudio electrofisiológico positivo con 3 y con 1 o 2 extraestímulos
| EEF positivo (3 extraestímulos) | EEF positivo (1-2 extraestímulos) | |||||||
|---|---|---|---|---|---|---|---|---|
| Univariable, OR (IC95%) | p | Multivariable, OR (IC95%) | p | Univariable, OR (IC95%) | p | Multivariable, OR (IC95%) | p | |
| ABC | 0,79 | 0,82 | ||||||
| Intersección | 0,02 (0-0,08) | <0,0001 | 0,0009 (0-0,01) | <0,0001 | ||||
| Edad al diagnóstico | 1,02 (1,01-1,03) | 0,0003 | 1,05 (1,02-1,08) | 0,004 | 1,03 (1,01-1,04) | 0,0013 | 1,09 (1,05-1,14) | <0,0001 |
| Mujeres frente a varones | 0,39 (0,26-0,56) | <0,0001 | 0,23 (0,08-0,58) | 0,003 | 0,39 (0,21-0,68) | 0,002 | 0,02 (0,05-0,63) | 0,012 |
| Tipo 1 espontáneo | 2,91 (2,16-3,94) | <0,0001 | 3,74 (1,87-7,79) | 0,0003 | 3,19 (2,08-4,97) | <0,0001 | 4,18 (1,71-11,15) | 0,0025 |
| Tipo 1 inducido por fármacos | 0,4 (0,3-0,55) | <0,0001 | 0,38 (0,25-0,57) | <0,0001 | ||||
| Tipo 1 inducido por fiebre | 1,84 (0,87-3,84) | 0,1 | 2,03 (0,79-4,62) | 0,11 | ||||
| Antecedentes familiares de MSC | 1,18 (0,87-1,59) | 0,3 | 2,64 (1,3-5,45) | 0,008 | 1,18 (0,77-1,77) | 0,44 | 2,72 (1,14-6,62) | 0,024 |
| Síncope | 1,49 (1,01-2,2) | 0,04 | 2,64 (1,19-5,86) | 0,016 | 1,38 (0,81-2,29) | 0,22 | 1,81 (0,67-4,71) | 0,23 |
| Muerte súbita cardiaca | 1,57 (0,71-3,34) | 0,25 | 1,8 (0,65-4,29) | 0,21 | ||||
| Resultados del genotipo, positivo | 0,76 (0,41-1,37) | 0,36 | 0,9 (0,43-1,87) | 0,78 | 0,78 (0,36-1,62) | 0,51 | 0,94 (0,36-2,36) | 0,9 |
| Fibrilación auricular | 1,58 (0,83-2,95) | 0,15 | 1,11 (0,41-2,53) | 0,82 | ||||
| p, Hosmer-Lemeshow | 0,92* | 0,437* | ||||||
ABC: área bajo la curva; EEF: estudio electrofisiológico positivo; IC95%, intervalo de confianza del 95%; MSC: muerte súbita cardiaca; OR: odds ratio.
En la tabla 4 se muestra el número de pacientes en cada categoría. Durante el seguimiento, 47 pacientes (5,7%) sufrieron MSC o descargas de alto voltaje del desfibrilador (39 recibieron una intervención del DAI apropiada y 8 sufrieron taquicardia ventricular sostenida, 2 de ellos rescatados satisfactoriamente y 6 fallecidos) (figura 1). Catorce pacientes fallecieron por choque no relacionado con MSC/DAI.
Número de pacientes en cada categoría del presente estudio y número de eventos en cada categoría
| Escala | Pacientes en cada categoría | Eventos en cada categoría | Pacientes asintomáticos en cada categoría | Eventos en cada categoría (pacientes asintomáticos) |
|---|---|---|---|---|
| Delise et al.7 | 0=187 (23) | 0=2 (4) | 0=184 (27) | 0=2 (10) |
| 1=305 (37) | 4=9 (1) | 1=272 (40) | 1=4 (19) | |
| 2=222 (27) | 2=19 (40) | 2=176 (26) | 2=12 (57) | |
| 3=88 (11) | 3=9 (19) | 3=45 (7) | 3=3 (14) | |
| 4=9 (1) | 4=3 (6) | 4=0 | 4=0 | |
| Sieira et al.8 | ≤ 2=577 (69) | ≤ 2=12 (26) | ≤ 2=530 (78) | ≤ 2=10 (48) |
| 3-5=238 (29) | 3-5=30 (64) | 3-5=145 (21) | 3-5=11 (52) | |
| 6-8=12 (1) | 6-8=5 (11) | 6-8=0 | 6-8=0 | |
| Shanghai para SBr9 | ≤ 3=103 (12) | ≤ 3=2 (4) | ≤ 3=103 (15) | ≤ 3=2 (10) |
| 3,5=90 (11) | 3,5=6 (13) | 3,5=90 (13) | 3,5=6 (29) | |
| 4-5=104 (13) | 4-5=7 (15) | 4-5=78 (12) | 4-5=4 (19) | |
| ≥ 5,5=59 (7) | ≥ 5,5=14 (30) | ≥ 5,5=14 (2) | ≥ 5,5=0 |
SBr: síndrome de Brugada.
Los valores expresan n (%).
Representación esquemática de la población del estudio con las características basales y la tasa de eventos más apropiadas durante el periodo de seguimiento. CVP: complejo ventricular prematuro; DAI: desfibrilador automático implantable; ECG: electrocardiograma; EEF: estudio electrofisiológico; MSC: muerte súbita cardiaca; ND: no disponible; RDC: riesgo determinado por la causa.
El tiempo medio hasta la ocurrencia de eventos cardiacos tras el EEF fue 5,21±4,23 [intervalo intercuartílico, 1,3-6,8] años y la media de edad al evento maligno, 51,06±15,47 años. Entre los pacientes que sufrieron un evento, 34 (72,3%) presentaron un ECG con patrón de tipo 1, 21 (44,7%) previamente estaban asintomáticos, 21 (44,7%) tenían antecedentes familiares de MSC (en 4 casos, el familiar tenía menos de 35 años), 27 (57,4%) tenían un EEF positivo (15 positivos [31,9%] con 2 extraestímulos) y 10 (21,3%), antecedentes de MSC. En la tabla 4 también se muestra el número de episodios en la población total y los que estaban asintomáticos según su puntuación de riesgo basal.
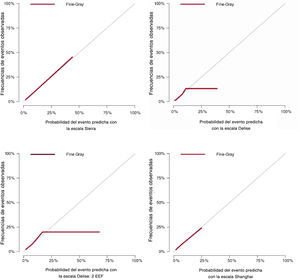
Se informó del VDP y del VDN de las 3 escalas, ajustadas por los riesgos competitivos (). Como muestra la gráfica, las curvas del VDP y el VDN cuantifican los valores diagnósticos de las escalas evaluadas, determinadas en una escala continua con un resultado del tiempo de fallo censurado.
Tiempo hasta el episodio, análisis de regresión multivariable y estadístico CCuando se llevaron a cabo los análisis de regresión de los riesgos competitivos y el tiempo hasta el episodio en toda la cohorte, se relacionó con los episodios de arritmia presentar un patrón de tipo 1 en el ECG y un EEF positivo con 1 o 2 extraestímulos y haber sufrido ya un síncope (tabla 2). En los pacientes asintomáticos, un patrón de tipo 1 en el ECG y un EEF positivo con 1 o 2 extraestímulos se relacionaron con los episodios de arritmia.
Aumento gradual del riesgo de muerteTodas las puntuaciones de riesgo mostraron una tendencia hacia un aumento del riesgo de eventos que se correspondía con la banda alta de las puntuaciones de las 3 escalas en estudio (figura 2, tabla 4). La capacidad de discriminación y la calibración de las 3 escalas se representan en la tabla 4 y la figura 3. Los estadísticos C observados en la figura 2 proceden de los modelos de Fine-Gray para el total de la población y los pacientes asintomáticos. La evaluación de los modelos que incorporan el EEF (escalas Delise y Sieira) con el número de extraestímulos (1 o 2 frente a 3) no modificó de manera significativa los límites del IC95% ni cambió sustancialmente el estadístico C de predicción de eventos.
El objetivo del presente estudio es evaluar qué papel desempeñaban las 3 escalas de riesgo multiparamétricas en pacientes con SBr sometidos a un EEF. Las principales observaciones son: a) conforme a los datos existentes, los factores de riesgo clásicos como el patrón del ECG y el síncope previo pronosticaron los futuros eventos de arritmia; b) el número de extraestímulos necesarios para inducir AV (1 o 2 frente a 3) tiene un impacto significativo en la capacidad pronóstica del EEF, y c) las escalas que combinan factores de riesgo clínico con el EEF contribuyen a identificar a las poblaciones en mayor riesgo, aunque su capacidad pronóstica siga siendo moderada para la población general y los pacientes asintomáticos.
Factores de riesgo independientesHasta la fecha, el factor con el mayor valor diagnóstico sigue siendo el patrón del ECG basal, a menudo útil como base para la toma de decisiones12,13. No obstante, es importante resaltar que un tercio de los pacientes que sufrieron episodios no tenían un ECG con patrón de tipo 1, lo que destaca la naturaleza dinámica del SBr. Además del ECG, tener antecedentes de eventos arrítmicos se considera un presagio de recurrencia12–14,17. En la muestra del estudio, el síncope previo también constituyó un firme factor pronóstico de futuros episodios. Por otro lado, la importancia de los antecedentes familiares de MSC a la hora de pronosticar futuros eventos arrítmicos sigue siendo controvertida7,12,17–20. En el estudio de Delise et al.7, los antecedentes familiares de MSC no se relacionaron de manera independiente con un riesgo aumentado de sufrir arritmia. Cabe destacar que en la caracterización de los antecedentes familiares se observaron ligeras diferencias según la escala («MSC temprana en los familiares de primer grado» en la escala Sieiras; «antes de los 40 años» en la escala Delise y «antecedentes familiares en los parientes de primer y segundo grado», con distinta importancia según el diagnóstico definitivo de SBr [2 puntos], sospecha de MSC [1 punto] relacionada con el SBr o MSC no explicada antes de los 45 años5 en la escala Shanghai para SBr). En un estudio reciente se estableció una puntuación pronóstica genética basada en la presencia de la mutación SCN5A y el polimorfismo en otros genes asociados con riesgo de arritmia20. Queda por ver si la incorporación de los antecedentes familiares y los predictores genéticos permitiría identificar mejor a aquellos con mucho riesgo genético de MSC. En nuestro estudio, ni la presencia de antecedentes familiares ni una mutación genética perceptible (realizada en más de 300 pacientes) fueron predictores fiables de posteriores episodios. La utilidad del EEF se ha tratado en varios documentos de consenso y múltiples metanálisis apropiados. Lamentablemente, sigue habiendo pruebas contradictorias relacionadas con su valor diagnóstico y aún se mantiene como una indicación IIb21,22. Sin embargo, en los últimos años ha ganado importancia con la publicación de metanálisis5. Curiosamente, según datos previos y de este estudio, la inducción con menos extraestímulos se relacionó con mayor riesgo. Sin embargo, como ya observaron Sroubek et al.4, un EEF negativo no presagia un riesgo bajo de AV, en particular en pacientes con características clínicas de alto riesgo. Los datos de este estudio son aún más desconcertantes. Se hizo el seguimiento de hasta 20 pacientes con un EEF negativo (32 si se consideraba que el EEF era positivo cuando se inducían AV con 1-2 extraestímulos) y que sufrieron eventos cardiacos a largo plazo. También es reseñable que su VDN y su VDP dependan del periodo de seguimiento (). Aunque esta observación no se ha analizado nunca, en nuestra opinión, su capacidad diagnóstica, al parecer, depende del tiempo y podría discutirse si debería revaluarse el EEF a intervalos determinados.
Factores de riesgo combinadosPara solventar la escasa utilidad de cada uno de los factores mencionados, varios autores han aconsejado utilizar enfoques combinados. Esto se hace en algunas recomendaciones; por ejemplo, la Sociedad Japonesa de Cardiología ha recomendado el implante de DAI para la prevención primaria en pacientes con SBr en función del número de factores de riesgo (síncope, EEF positivo y antecedentes familiares de MSC)23. Una posible ventaja del enfoque multiparamétrico radica en la especificidad mejorada de los factores de riesgo combinados frente a sus componentes por separado. Una ventaja fundamental de la estratificación de riesgos combinados es que la incidencia de eventos arrítmicos en los pacientes sin ningún factor de riesgo es lo bastante baja para evitar con fundamento un tratamiento específico3. En sus estudios multicéntricos (con 111 personas y con el EEF de 59), Letsas et al.10 evaluaron la capacidad pronóstica de estas puntuaciones de riesgo. El análisis de Kaplan-Meier mostró que los sujetos con 4 o más factores de riesgo (ECG, síncope, antecedentes familiares, EEF, QRS fragmentado y QRS prolongado en la derivación V2) corrían mayor riesgo de eventos arrítmicos. El patrón del ECG, la presencia de síncope y un EEF positivo (aunque la escala Shanghai para SBr no evalúe qué papel desempeña el EEF) son factores de riesgo comunes a los 3 modelos evaluados. Curiosamente, parece que la presencia de antecedentes familiares de MSC —aunque sin significación estadística como variable aislada al menos en la escala Delise— sirve para calibrar el modelo final y, aunque no fue el caso en la cohorte de este estudio, podría ser de utilidad en los casos dudosos. Más recientemente, Probst et al.11 han evaluado la precisión de las escalas Shanghai para SBr y Siera. Se estimó la capacidad predictiva mediante una área bajo la curva de 0,73 (IC95%, 0,67-0,79) y 0,71 (IC95%, 0,61-0,81). Cabe destacar, y de acuerdo con los resultados de este estudio, que las puntuaciones de riesgo no permitieron estratificar el riesgo de eventos arrítmicos de los pacientes con riesgo intermedio.
En la cohorte de este estudio, con las 3 escalas y 1 EEF positivo con 1-2 estímulos o con 3, se observaron un VDP bajo y un VDN medio alto (teniendo en cuenta los riesgos competitivos). No obstante, el VDN mostró una fuerte dependencia temporal, que era alta (de hasta el 100% al inicio del seguimiento, cuando no se registraron episodios) y con un descenso pronunciado a largo plazo (). El ensayo FINGER informó que los pacientes sin síntomas ni un ECG con patrón de tipo 1 espontáneo mostraron un riesgo muy bajo de MSC independientemente de que pudiera inducirse FV durante el EEF11. En la muestra de este estudio, aunque el número de eventos sufridos por los pacientes con pocos factores de riesgo fue bajo (tabla 2), no fue insignificante. Se produjeron 2 eventos en los pacientes con 0 factores de riesgo en las escalas Delise7 y Shanghai9 para SBr, y sufrieron eventos 12 pacientes con menos de 2 puntos en la escala Sieira8. Es probable que la inclusión de un número considerablemente mayor de pacientes asintomáticos en este estudio comparado con esas series (1547, 7410, 2698 y 2719 frente a los 627 de este estudio) habría atenuado el valor pronóstico de las puntuaciones. La adición de fibrilación auricular o la disfunción del nódulo sinusal en los modelos (tal como proponen las escalas Shanghai9 y Sieria8) puede haber mejorado su capacidad pronóstica, aunque esta no resultó en un cambio significativo en esta muestra, muy probablemente por el reducido número de pacientes con estos diagnósticos. En realidad, parece que se trata de un diagnóstico poco frecuente entre los pacientes con SBr, no solo en la serie de este estudio. En la serie de Sieira, solo a 2 de los 269 pacientes asintomáticos se les hizo este diagnóstico8.
En resumen, se cree que estos datos insisten en la necesidad urgente de mejorar los instrumentos de clasificación para los pacientes con poco riesgo respecto a los actuales factores de riesgo convencionales. Hasta que se disponga de tales herramientas, en particular para el subgrupo de pacientes con SBr asintomáticos y en particular aquellos con un patrón de tipo 1 espontáneo en el ECG, la indicación es utilizar escalas que incorporen el ECG y el EEF. No obstante, como ya se ha mencionado, debido a la falta de especificidad del EEF, esto puede llevar a sobretratar a los pacientes con poco riesgo. Probablemente el tratamiento de estos pacientes debería individualizarse y complementarse con otros marcadores recomendados, tales como unos complejos QRS fragmentados, la repolarización precoz, las técnicas de señal promediada, una onda T microscópica alternante3 o un periodo refractario ventricular < 200ms13, junto con factores clínicos tales como la fibrilación auricular y la disfunción del nódulo sinusal8,9. En cambio, un EEF negativo no debería vincularse con poco riesgo de AV, y estos pacientes también deberían someterse a evaluación periódica. Además, aunque se hipotetizó que el ajuste de estas puntuaciones de riesgo por la incorporación del número de extraestímulos necesarios para inducir AV podría mejorar su capacidad pronóstica, este no fue el caso (tabla 5) y la inducción de AV con 1 o 2 extraestímulos (comparado con 3) no mejoró la eficacia pronóstica determinada mediante el índice de concordancia. Sin embargo, dado al valor positivo del EEF con 1 o 2 extraestímulos desde un único punto del ventrículo derecho comparado con los 3 extraestímulos del modelo de este estudio (junto con la edad en el momento del diagnóstico y el patrón de tipo 1 en el ECG), podría fomentarse este protocolo en lugar del tradicional con 3 extrasístoles en 2 sitios del ventrículo derecho.
Coeficientes e índices C de modelos que predicen eventos en la población general y en pacientes asintomáticos según el número de extraestímulos que indujeron las arritmias ventriculares (1 o 2 frente a 3). Ajustados por el riesgo competitivo de una persona de fallecer sin sufrir el evento de interés
| IAF de eventos | ||||
|---|---|---|---|---|
| Estadístico C | SHR | IC95% | p | |
| Modelo en la población general | ||||
| Sieira | 0,81 | 1,78 | 1,53-2,07 | <0,0001 |
| Sieira con 1-2 EEF | 0,80 | 1,83 | 1,56-2,13 | <0,0001 |
| Escala Delise* | 0,77 | 2,40 | 1,75-3,28 | <0,0001 |
| Delise con 1-2 EEF* | 0,76 | 2,71 | 1,91-3,85 | <0,0001 |
| Escala Shanghai | 0,80 | 1,75 | 1,38-2,22 | <0,0001 |
| Modelo en personas asintomáticas | ||||
| Sieira | 0,69 | 1,70 | 1,28-2,27 | 0,0001-0,001 |
| Sieira con 1-2 EEF | 0,66 | 1,79 | 1,32-2,44 | 0,0001-0,001 |
| Escala Delise | 0,72 | 2,09 | 1,36-3,21 | 0,0001-0,001 |
| Delise con 1-2 EEF | 0,69 | 2,31 | 1,42-3,76 | 0,0001-0,001 |
| Escala Shanghai | 0,64 | 1,15 | 0,78-1,69 | |
EEF: estudio electrofisiológico; IAF: incidencia acumulada del modelo de Fine-Gray; IC95%: intervalo de confianza del 95%; SHR: tasa de riesgos de subdistribución (exponenciales).
Los pacientes con síndrome de Brugada y una puntuación entre 3 y 5 o entre 6 y 8 en la escala Sieira o los sujetos con mayor riesgo según la escala Delise (patrón de tipo 1 en el ECG y por lo menos 2 de los siguientes factores de riesgo: síncope, antecedentes familiares de MSC o un EEF positivo) (véase tabla 1), pero cuyo EEF se consideró positivo cuando las arritmias ventriculares inducibles se provocaban con 1 o 2 extraestímulos (si las arritmias ventriculares se indujeron con 3 extraestímulos, el EEF se clasificó como negativo).
Aunque se tuvo en cuenta el perfil clínico de los episodios sincopales para descartar a los pacientes con síncope no cardiogénico, es plausible que se hayan incluido algunos episodios sincopales vasovagales que podrían haber influido en los resultados del estudio. Este estudio utilizó un registro nacional, que puede estar sujeto al sesgo de remisión y a las características regionales, que varían entre las poblaciones. Sin embargo, se cree que es un buen indicador de la práctica y los resultados en todo el mundo. Además, la cohorte solo incluyó a los pacientes con SBr sometidos a un EEF. La remisión a EEF se dejó a manos de los médicos antes que a las indicaciones estándar y puede que variase entre los distintos centros. Así pues, no se pudo extrapolar de manera uniforme los resultados del estudio a la población general con SBr. Los eventos arrítmicos se clasificaron según MSC y consulta del DAI. No obstante, puesto que las taquiarritmias ventriculares pueden finalizar de manera espontánea, una descarga apropiada del DAI no es sinónimo de MSC. Además, no todas las MSC pueden atribuirse al SBr. Este matiz podría haber llevado a sobrestimar el número de episodios.
Una limitación importante de este estudio es que no pudieron calcularse las puntuaciones de riesgo de toda la población del estudio por falta de información. En particular esto fue así para la escala de Shanghai (que solo se calculó en 415 de los 831 sujetos). Este estudio no pretendía comparar las escalas entre sí, sino expresar su capacidad pronóstica en los pacientes con SBr. Se llevó a cabo un análisis de sensibilidad eliminando todas las filas con valores ausentes en la escala de Shanghai, sin cambios en la interpretación de los modelos multivariables o la predicción de episodios para la cohorte. No obstante, en los pacientes asintomáticos, la pérdida de potencia debida a la eliminación de los datos ausentes hizo que la escala de Delise no fuera pronóstica y produjo ausencia de convergencia en la puntuación de Shanghai.
En una enfermedad con un riesgo de arritmias letales durante toda la vida, este estudio, aunque comparativamente más largo que la vasta mayoría de las series, podría no tener suficiente potencia para excluir o confirmar definitivamente el valor diagnóstico de cualquiera de los parámetros mencionados. Además, la tasa de eventos cardiacos pudo ser demasiado baja para que se pueda extraer conclusiones firmes; se requieren más estudios con un mayor número de pacientes para confirmar las conclusiones de este estudio.
Por último, solo las escalas Shanghai para el SBr y Sieira parecen estar bien calibradas, mientras que la escala Delise demostró poca calibración. Los resultados de este estudio se deben considerar teniendo en cuenta esta limitación.
CONCLUSIONESEn los pacientes con SBr, los factores de riesgo clásicos como el patrón del ECG y el síncope previo pronostican futuros eventos arrítmicos. El número de extraestímulos necesarios para inducir las AV (1–2 frente a 3) influye de manera sustancial en la capacidad pronóstica del EEF. Las escalas que combinan factores de riesgo clínicos con el EEF contribuyen a identificar a las poblaciones en mayor riesgo, aunque su capacidad pronóstica sigue siendo moderada en la población general con SBr y los pacientes asintomáticos.
FINANCIACIÓNM. Rodríguez-Mañero tiene una beca de la «Fundación Mutua Madrileña» para el estudio del síndrome de Brugada. E. Arbelo y J. Brugada han recibido el apoyo para este estudio del Instituto de Salud Carlos III (FIS PI16/01203) cofinanciado por FEDER/FSE, “Investing in Your Future” y Fundació La Marató de TV3 (Projecte 245/U/2020).
CONTRIBUCIÓN DE LOS AUTORESM. Rodríguez-Mañero y A. Baluja concibieron el estudio. Ambos autores han contribuido por igual en la redacción de este artículo. Todos los autores participaron en la elaboración de hipótesis, supervisaron los datos de esta investigación, discutieron los resultados y contribuyeron al artículo final.
CONFLICTO DE INTERESESM.Á. Arias es editor asociado de Rev Esp Cardiol. Se ha seguido el procedimiento editorial de la Revista para asegurar el tratamiento imparcial del artículo. Los demás autores afirman no tener ningún conflicto de intereses.
- –
En el síndrome de Brugada, los distintos factores de riesgo son poco concretos para predecir resultados y orientar el tratamiento.
- –
Para solventar la utilidad limitada de cada uno de estos factores, se ha recomendado utilizar escalas combinadas que incluyan parámetros clínicos, electrocardiográficos y electrofisiológicos.
- –
Estos modelos solo se han validado en series pequeñas. Es importante señalar que se desconoce su utilidad según el número de extraestímulos que inducen AV.
- –
El objetivo es validar 3 escalas multiparamétricas en una cohorte de pacientes con síndrome de Brugada y estudio electrofisiológico.
- –
Todas las puntuaciones de riesgo se relacionan de manera significativa con los eventos. La capacidad discriminatoria de las 3 escalas es moderada (en particular cuando se evalúan en pacientes asintomáticos). La evaluación de las escalas con distintas cantidades de extraestímulos (1-2 frente a 3) no mejoró de manera sustancial el estadístico C de predicción de episodios.
- –
Estos datos resaltan la necesidad urgente de unos instrumentos de clasificación mejores que los actuales factores de riesgo convencionales para los pacientes con poco riesgo.