Algunos estudios indican que los parámetros de strain por speckle-tracking pueden ser una alternativa no invasiva a la biopsia endomiocárdica para excluir el rechazo celular agudo (RCA) moderado o grave (≥ 2R) tras el trasplante cardiaco (TxC). En una cohorte inicial, unos puntos de corte del 15,5% para el strain longitudinal global del ventrículo izquierdo (SLGVI) y el 17% para el strain de pared libre del ventrículo derecho mostraron un valor predictivo negativo del 100% para excluir RCA ≥ 2R. Nuestro objetivo es analizar la utilidad del strain y validar estos puntos de corte en una cohorte multicéntrica prospectiva externa.
MétodosEstudio multicéntrico y prospectivo que incluyó a pacientes con seguimiento el primer año tras el TC. Se compararon los resultados de biopsias electivas con ecocardiogramas realizados el mismo día.
ResultadosSe incluyó a 99 pacientes y 501 pares de biopsias-ecocardiogramas. El RCA ≥ 2R en las biopsias fue del 7,4%. El SLGVI y el strain longitudinal de pared libre del ventrículo derecho fueron menores durante los RCA ≥ 2R en el análisis univariante. En el análisis multivariante, el SLGVI se asoció de manera independiente con el RCA ≥ 2R. Los puntos de corte originales mostraron un valor predictivo negativo del 94,3% el RCA ≥ 2R.
ConclusionesEste estudio mantiene un alto valor predictivo negativo para excluir RCA ≥ 2R tras el TxC y el SLGVI se asoció de manera independiente con el RCA ≥ 2R. El strain y, principalmente, el SLGVI pueden ser de utilidad en el diagnóstico y el tratamiento no invasivo del RCA.
Palabras clave
Los avances en la inmunosupresión han llevado a una disminución de la incidencia del rechazo celular agudo (RCA) tras el trasplante cardiaco (TxC) ortotópico1. Sin embargo, el RCA continúa siendo un importante motivo de preocupación, puesto que su aparición se relaciona con la pérdida del injerto y una reducción de la supervivencia a largo plazo2. La vigilancia activa del RCA, por lo tanto, es imprescindible después de un TxC. Esto tiene especial importancia, dado que la técnica de referencia para la detección del RCA es la biopsia endomiocárdica (BEM), que es un método invasivo no exento de complicaciones3,4. La ecocardiografía es una técnica ampliamente disponible y se han realizado muchos estudios en los que se ha evaluado su uso para el diagnóstico del RCA. Los parámetros clásicos han mostrado resultados poco uniformes, y no hay ningún parámetro que haya permitido por sí solo diagnosticar correctamente el RCA5–10.
Más recientemente, el strain (deformación) del miocardio ha surgido como una herramienta prometedora gracias a su mayor sensibilidad en la detección de la disfunción miocárdica en muchas situaciones clínicas11,12. Varios estudios han descrito una relación significativa entre el RCA y la ecocardiografía bidimensional con speckle-tracking (STE)13–15. En 2015 se publicó un estudio sobre la utilidad del strain longitudinal global del ventrículo izquierdo (SLGVI) y el strain longitudinal de la pared libre del ventrículo derecho (SLVD) para descartar el RCA en una cohorte de un solo centro16. Los puntos de corte del 15,5 y el 17% (valores absolutos) para el SLGVI y el SLVD de la pared libre proporcionaron altas sensibilidad y especificidad para descartar RCA y alcanzaron también un valor predictivo negativo (VPN) del 100% combinando ambas variables.
Esta evidencia se basa en estudios unicéntricos, con criterios de inclusión diferentes, y se han propuesto valores de corte distintos para el diagnóstico del RCA. Además, no todos los estudios han descrito resultados positivos17,18. Nuestro objetivo es realizar una validación externa de la utilidad de la STE y de los valores de corte originales propuestos para descartar con seguridad un RCA ≥ 2R. Nuestra hipótesis era que una medición más sensible del SLGVI y el SLVD de la pared libre podría ser una herramienta útil y reproducible en el tratamiento no invasivo del RCA.
MÉTODOSEste estudio multicéntrico se llevó a cabo en 7 centros de TxC de España. Se incluyó prospectivamente en el estudio a los pacientes consecutivos ingresados para un TxC desde diciembre de 2015 hasta diciembre de 2016, y se les dio seguimiento durante el primer año siguiente al TxC. Se evaluaron muestras emparejadas de BEM y exploraciones ecográficas realizadas en las 24 h tras la BEM y siempre antes del tratamiento del RCA en los casos que necesitaron este tratamiento.
Se realizaron las BEM a los 15 días y a los 1, 2, 3, 6 y 12 meses del TxC (). Se incluyeron también las BEM de control realizadas después de un RCA moderado o grave. Las BEM fueron interpretadas por anatomopatólogos locales y se estableció un grado de afección según las recomendaciones de 2005 de la International Society of Heart and Lung Transplantation para el diagnóstico de RCA19. Estos resultados se consideran el patrón de referencia y la necesidad de tratamiento en los pacientes estables (generalmente aceptada en los casos con un RCA ≥ 2R) se dejó al criterio de los clínicos locales. Todas las BEM se examinaron sistemáticamente en la búsqueda de posibles signos histológicos de rechazo mediado por anticuerpos. Las técnicas inmunopatológicas y la evaluación de la presencia de anticuerpos contra antígenos leucocitarios humanos circulantes característicos de este tipo de rechazo se llevaron a cabo según los protocolos locales de cada centro. Ecocardiografistas locales de cada centro, con enmascaramiento de los resultados de la BEM, realizaron y analizaron las exploraciones ecocardiográficas. Los criterios de exclusión principales fueron el fallo primario derecho o izquierdo grave del órgano trasplantado según la guía de la International Society for Heart and Lung Transplantation20 y la ausencia de una ventana ecocardiográfica adecuada para evaluar los parámetros de STE. Nuestro estudio se llevó a cabo cumpliendo lo establecido en la Declaración de Helsinki y fue aprobado por todos los comités de ética de investigación locales. Se obtuvo el consentimiento informado por escrito de todos los participantes en el estudio.
Se enviaron los datos relativos a los parámetros demográficos y las características clínicas y de BEM, que se introdujeron en una base de datos. Cada centro mantuvo su propio protocolo de inmunosupresión y de seguimiento tras el TxC, con la inclusión de visitas no programadas en caso necesario. Cada centro siguió su propio protocolo de vigilancia angiográfica de la aparición de enfermedad vascular del injerto (EVI) tras el TxC.
Ecocardiografía bidimensionalTamaño de las cámaras y evaluación clásica de la función cardiacaTodos los estudios se realizaron con un equipo de ecocardiografía (IE33, Phillips Medical Systems, Países Bajos). Se tomaron imágenes de cine empleando la imagen armónica en las proyecciones estándares apical y paraesternal. Se determinaron los grosores del tabique interventricular y de la pared posterior, así como los diámetros telesistólico y telediastólico a partir de imágenes en modo M o bidimensional en la proyección paraesternal de eje largo. Se calcularon las dimensiones del ventrículo izquierdo (VI) y el ventrículo derecho (VD), la fracción de eyección del VI con el método de Simpson, el desplazamiento sistólico en el plano del anillo tricuspídeo y el cambio de área fraccional del VD siguiendo las recomendaciones de la American Society of Echocardiography21. Se utilizó Doppler pulsado para la medición de la onda E, la onda A (y el cálculo de la relación E/A), el tiempo de deceleración de la onda E (TDE) y el tiempo de relajación isovolumétrica. El Doppler tisular se obtuvo con el volumen de muestra en el anillo medial y lateral del VI para calcular la E’ medial y la E’ lateral respectivamente y luego se estimaron los cocientes E/E’ medial y E/E’ lateral. Se utilizó también el Doppler tisular para calcular la velocidad pico sistólica tricuspídea (S’).
Parámetros derivados del speckle-trackingAntes del inicio del estudio, se llevó a cabo una reunión de los ecocardiografistas de los diferentes hospitales con el objetivo de estandarizar los criterios para el análisis offline de la STE. Todos los ecocardiografistas seleccionados para este estudio tenían experiencia previa en el análisis de STE en su práctica clínica cotidiana. Los ecocardiogramas se realizaron y se analizaron en cada hospital y se enviaron luego a un segundo ecocardiografista del hospital organizador del estudio, que supervisó el tracking y recogió los datos. Cuando el segundo ecocardiografista consideraba que el tracking de la deformación era inadecuado, los ecocardiografistas locales realizaron nuevos intentos de obtener un tracking apropiado. En los casos infrecuentes en los que, a pesar de varios intentos de los ecocardiografistas locales, el ecocardiografista central consideró inadecuado el tracking, se excluyeron las proyecciones correspondientes y no se incluyeron en el análisis.
Se registraron digitalmente los datos de 3 ciclos cardiacos consecutivos para un posterior análisis offline mediante un programa informático comercial (QLab versión 10.2, 10.3 y 10.5) y se optimizó la frecuencia de fotogramas para cada proyección (entre 55 y 90 fps). Se determinó el pico sistólico de strain longitudinal por STE en los planos apicales de 4 y 2 cámaras según el modelo de 12 segmentos del VI (el mismo modelo que se utilizó en la cohorte original)16. Se calculó la media de ambos valores para determinar SLGVI. El SLGVD se obtuvo de un modelo de 6 segmentos, y el SLVD de la pared libre se determinó con el promedio de los 3 segmentos laterales. Se seleccionaron 3 regiones de interés en cada proyección y se generaron automáticamente los valores de strain, que se expresan en cifras absolutas en aras de una mayor claridad. Los segmentos en los que no se obtuvo un tracking adecuado se ajustaron manualmente hasta obtener un tracking correcto fotograma a fotograma. Se excluyeron las proyecciones con más de 2 segmentos con visualización endocárdica o tracking inadecuados.
Análisis estadísticoSe evaluó la normalidad de la distribución de los datos con métodos gráficos y con el método de Kolmogorov-Smirnov. Las variables continuas se expresan como media±desviación estándar o mediana [intervalo intercuartílico] para las variables con una distribución no normal, y los datos cualitativos se expresan mediante frecuencias y porcentajes. Con el fin de analizar la capacidad para excluir RCA, los estudios se dividieron en 2 grupos en función de que se diera un RCA ≥ 2R. Se utilizó la prueba de la χ2 y la prueba de t de Student para la comparación de las variables cualitativas y cuantitativas respectivamente. Para las variables de distribución no normal, se utilizó la prueba de la U de Mann-Whitney. Se consideró que un valor de p <0,05 indicaba significación estadística. Los factores predictivos de un RCA ≥ 2R, seleccionados en función de un valor de p <0,05 se introdujeron en un análisis multivariante. Para dicho análisis se utilizó una regresión logística binaria con un enfoque escalonado anterógrado. Se calcularon las curvas ROC para el SLGVI y el SLVD de la pared libre. La reproducibilidad interobservadores se evaluó con el coeficiente de correlación intraclase y con gráficos de Bland-Altman. Todos los análisis se llevaron a cabo con el programa SPSS versión 20 (SPSS Inc.; Estados Unidos). Los gráficos de Bland-Altman se realizaron con el programa R (R Core Team, 2019)22.
RESULTADOSEntre diciembre de 2015 y diciembre de 2016, se incluyó en el estudio a un total de 99 pacientes (). Se excluyó a 5 pacientes a causa de una ventana ecocardiográfica deficiente. En principio se incluyeron 516 pares de BEM y ecocardiografías, pero se excluyeron 15 pares (2,9%) a causa de un material insuficiente en la BEM que impedía su comparación con las ecocardiografías. Finalmente se analizaron 501 BEM y sus correspondientes evaluaciones ecocardiográficas. El número medio de BEM por paciente fue 4 (intervalo, 1-10). Las características basales de los pacientes se muestran en la tabla 1.
Características de los pacientes (n=99)
| Pacientes, n | 99 |
| Varones | 78 (79) |
| Edad del donante (años) | 51 [41-57] |
| Edad del receptor (años) | 58 [48-64] |
| Hipertensión | 45 (45) |
| Tiempo medio de isquemia (min) | 218±66 |
| Media del tiempo de circulación extracorpórea (min) | 119±29 |
| Diabetes mellitus | 29 (29) |
| Hipercolesterolemia | 44 (44) |
| Razones del TxC | |
| Miocardiopatía isquémica | 31 (31) |
| Miocardiopatía dilatada idiopática | 30 (30) |
| Shock tras IAM | 7 (7) |
| Valvulopatía | 7 (7) |
| Otras | 24 (24) |
| Cateterismo cardiaco derecho antes de un TxC (n=80) | |
| Presión arterial pulmonar sistólica (mmHg) | 42,5±15,8 |
| Media de presión arterial pulmonar (mmHg) | 27,3±10,2 |
| Presión capilar pulmonar enclavada (mmHg) | 19,7±8,5 |
| Gradiente de presión transpulmonar (mmHg) | 8,5±4,2 |
| Resistencia vascular pulmonar (UW) | 1,4±2,9 |
IAM: infarto agudo de miocardio; TxC: trasplante cardiaco ortotópico.
Salvo otra indicación, los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
En la tabla 2 se presenta el grado de RCA observado durante el seguimiento en las 501 BEM. Las BEM se dividieron en 2 grupos según hubiera o no un RCA ≥ 2R. Se halló RCA ≥ 2R en 37 muestras (7,4%) y correspondía a 26 pacientes, de los que 9 habían tenido más de un episodio de RCA ≥ 2R. Se observaron signos inmunopatológicos de rechazo mediado por anticuerpos en 3 exámenes (pAMR1-I), sin que hubiera ningún otro signo o síntoma de rechazo. Ninguno se consideró significativo ni tuvo un RCA ≥ 2R simultaneamente. Hubo 1 muerte debida a un RCA resistente en el momento de la tercera BEM. Las demás muertes durante el seguimiento se debieron a 2 casos de sepsis, 1 muerte súbita cardiaca (en un paciente sin coronariografía previa) y 1 caso de fallo multiorgánico (sin exploraciones ecocardiográficas con análisis de STE debido a un curso clínico indolente).
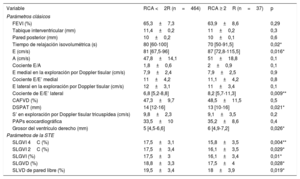
En la tabla 3 se muestran los parámetros de ecocardiografía convencional y de STE relacionados con la presencia de un RCA ≥ 2R en el análisis univariante. La fracción de eyección del VI no mostró diferencias significativas entre estos 2 grupos, como tampoco en el grosor en la pared posterior o septal del VI. El tiempo de relajación isovolumétrica fue significativamente inferior en los pacientes con un RCA ≥ 2R. Además, los valores de E y del cociente E/E’ lateral fueron notablemente superiores. La presencia de un derrame pericárdico significativo (moderado o grave) fue más frecuente en los exámenes en que se halló un RCA ≥ 2R (el 8,3 frente al 24,3%; p = 0,008).
Parámetros de ecocardiografía convencional, basada en Doppler y STE, y su relación con la presencia de un RCA ≥ 2R en el análisis univariante (los resultados de la STE se presentan en valores absolutos)
| Variable | RCA <2R (n=464) | RCA ≥ 2R (n=37) | p |
|---|---|---|---|
| Parámetros clásicos | |||
| FEVI (%) | 65,3±7,3 | 63,9±8,6 | 0,29 |
| Tabique interventricular (mm) | 11,4±0,2 | 11±0,2 | 0,3 |
| Pared posterior (mm) | 10±0,2 | 10±0,1 | 0,6 |
| Tiempo de relajación isovolumétrica (s) | 80 [60-100] | 70 [50-91,5] | 0,02* |
| E (cm/s) | 81 [67,5-96] | 87 [72,8-115,5] | 0,016* |
| A (cm/s) | 47,8±14,1 | 51±18,8 | 0,1 |
| Cociente E/A | 1,8±0,6 | 2±0,9 | 0,1 |
| E medial en la exploración por Doppler tisular (cm/s) | 7,9±2,4 | 7,9±2,5 | 0,9 |
| Cociente E/E’ medial | 11±4,2 | 11,1±4,2 | 0,8 |
| E lateral en la exploración por Doppler tisular (cm/s) | 12±3,1 | 11±3,4 | 0,1 |
| Cociente de E/E’ lateral | 6,8 [5,2-8,8] | 8,2 [5,7-11,3] | 0,009** |
| CAFVD (%) | 47,3±9,7 | 48,5±11,5 | 0,5 |
| DSPAT (mm) | 14 [12-16] | 13 [10-16] | 0,021* |
| S’ en exploración por Doppler tisular tricuspídea (cm/s) | 9,8±2,3 | 9,1±3,5 | 0,2 |
| PAPs ecocardiográfica | 33,5±10 | 35,2±8,6 | 0,4 |
| Grosor del ventrículo derecho (mm) | 5 [4,5-6,6] | 6 [4,9-7,2] | 0,026* |
| Parámetros de la STE | |||
| SLGVI 4C (%) | 17,5±3,1 | 15,8±3,5 | 0,004** |
| SLGVI 2C (%) | 17,5±3,4 | 16,1±3,5 | 0,029* |
| SLGVI (%) | 17,5±3 | 16,1±3,4 | 0,01* |
| SLGVD (%) | 18,8±3,3 | 17,5±4 | 0,028* |
| SLVD de pared libre (%) | 19,5±3,4 | 18±3,9 | 0,019* |
CAFVD: cambio de área fraccional del ventrículo derecho; DSPAT: desplazamiento sistólico del plano del anillo tricuspídeo; FEVI: fracción de eyección del ventrículo izquierdo; PAPs: presión arterial pulmonar sistólica; RCA: rechazo celular agudo; SLGVD: strain longitudinal global del ventrículo derecho; SLGVI 2C: strain longitudinal del ventrículo izquierdo en proyección bicameral; SLGVI 4C: strain longitudinal del ventrículo izquierdo en proyección tetracameral; SLGVI: strain longitudinal global del ventrículo izquierdo; SLVD: strain longitudinal del ventrículo derecho; STE: ecocardiografía con speckle tracking.
Los valores expresan media±desviación estándar o mediana [intervalo intercuartílico].
El SLGVI y el SLGVD mostraron una reducción significativa en los pacientes con RCA ≥ 2R en el análisis univariante (figura 1). El SLGVI fue del 17,5%±3% en los pacientes con RCA <2R y del 16,1%±3,4% en aquellos con RCA ≥ 2R (p=0,01). Se observaron diferencias similares entre los 2 grupos en cuanto al SLVD de la pared libre (el 19,5%±3,4% con RCA <2R frente al 18%±3,9% con RCA ≥ 2R; p=0,019).
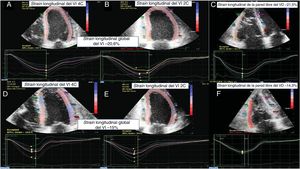
Imágenes de STE de un paciente. A-C: BEM clasificada como de grado 0R. D-F: un episodio de RCA ≥ 2R. De izquierda a derecha: strain longitudinal del VI tetracameral, strain longitudinal del VI bicameral y strain longitudinal de la pared libre del VD. BEM: biopsia endomiocárdica; RCA: rechazo celular agudo; STE: ecocardiografía speckle-tracking bidimensional; VD: ventrículo derecho; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
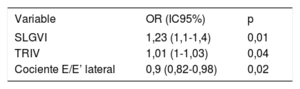
En el análisis multivariante, el tiempo de relajación isovolumétrica, el cociente E/E’ lateral y el SLGVI continuaron mostrando una relación independiente con la ausencia de RCA ≥ 2R (tabla 4). El SLGVI fue el mejor parámetro para descartar un RCA ≥ 2R.
Parámetros ecocardiográficos relacionados con la ausencia de RCA ≥ 2R en el análisis multivariante
| Variable | OR (IC95%) | p |
|---|---|---|
| SLGVI | 1,23 (1,1-1,4) | 0,01 |
| TRIV | 1,01 (1-1,03) | 0,04 |
| Cociente E/E’ lateral | 0,9 (0,82-0,98) | 0,02 |
IC95%: intervalo de confianza del 95%; OR: odds ratio; RCA: rechazo celular agudo; SLGVI: strain longitudinal global del ventrículo izquierdo; TRIV: tiempo de relajación isovolumétrica.
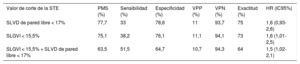
El área bajo la curva de características operativas del receptor fue 0,67 para el SLGVI y de 0,60 para el SLVD de la pared libre. Se aplicaron a nuestra cohorte los valores de corte originales del SLGVI y del SLVD de la pared libre (valores absolutos del 15,5 y el 17% respectivamente), así como las variables cualitativas correspondientes a los pacientes con un SLGVI> 15,5% y un SLVD de la pared libre> 17% (SLGVI> 15,5% + SLVD de la pared libre> 17%). En la tabla 5 se muestran los resultados del rendimiento de la prueba con cada valor por lo que respecta a excluir RCA ≥ 2R. El VPN fue del 93,7% para el strain de la pared libre del VD, del 94,1% para el SLGVI y del 94,3% para el SLGVI + SLVD de la pared libre.
Valores de corte originales del SLGVI y el SLVD de la pared libre relacionados con el diagnóstico de RCA ≥ 2R y sus valores de prevalencia, sensibilidad, especificidad, predictivo positivo, predictivo negativo, hazard ratio y exactitud
| Valor de corte de la STE | PMS (%) | Sensibilidad (%) | Especificidad (%) | VPP (%) | VPN (%) | Exactitud (%) | HR (IC95%) |
|---|---|---|---|---|---|---|---|
| SLVD de pared libre < 17% | 77,7 | 33 | 78,6 | 11 | 93,7 | 75 | 1,6 (0,93-2,6) |
| SLGVI < 15,5% | 75,1 | 38,2 | 76,1 | 11,1 | 94,1 | 73 | 1,6 (1,01-2,5) |
| SLGVI < 15,5% + SLVD de pared libre < 17% | 63,5 | 51,5 | 64,7 | 10,7 | 94,3 | 64 | 1,5 (1,02-2,1) |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; PMS: prevalencia de las medidas en la muestra; RCA: rechazo celular agudo; SLGVI: strain longitudinal global del ventrículo izquierdo; SLVD: strain longitudinal del ventrículo derecho; STE: ecocardiografía con speckle-tracking; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Valores de hazard ratio para el análisis univariante de predicción del RCA ≥ 2R.
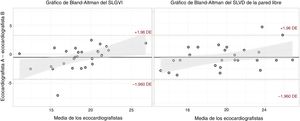
Del total de 501 BEM y ecocardiogramas incluidos inicialmente, en 20 casos no fue posible un análisis de STE por razones técnicas (4%). De las 481 exploraciones restantes, no se pudo analizar el SLGVI del 2,3% y el SLVD de la pared libre del 6,6% a causa de una visualización endocárdica deficiente a pesar del ajuste manual. Se evaluó la reproducibilidad interobservadores en 28 exámenes que incluían ecocardiografías de todos los centros. El coeficiente de correlación intraclase general para el SLGVI fue de 0,86 (intervalo de confianza del 95% [IC95%], 0,72-0,93) y para el SLVD de la pared libre fue de 0,93 (IC95%, 0,86-0,97). Los gráficos de Bland-Altman se muestran en la figura 2.
Análisis de Bland-Altman de la variabilidad interobservadores. Análisis de Bland-Altman del strain longitudinal global del ventrículo izquierdo (izquierda) y del strain longitudinal de la pared libre del ventrículo derecho (derecha). SLGVI: strain longitudinal global del ventrículo izquierdo; SLVD: strain longitudinal del ventrículo derecho.
La enfermedad vascular del injerto (EVI) se clasificó angiográficamente según la clasificación de la ISHLT (EVI0-3)23. Dos pacientes presentaron una EVI grave (EVI3). En el primero de ellos hubo una angiografía inicial sin estenosis significativas, y varios meses después del TxC sufrió un infarto agudo de miocardio. Tan solo se incluyeron los ecocardiogramas anteriores al infarto. En el segundo paciente no hubo episodios de RCA ≥ 2R durante el seguimiento, como tampoco en el único paciente con una EVI moderada (EVI2). No se dispuso de información de 26 pacientes (26,2%) sobre el estado de la coronariografía 1 año después del TxC. En la mayor parte de los casos, esto se debió a los protocolos locales de supervisión angiográfica de EVI que realizaban la primera coronariografía de control más de 1 año después del TxC (tiempo de seguimiento del estudio).
DISCUSIÓNEl objetivo de este estudio multicéntrico es validar la utilidad de los parámetros de la STE para descartar el RCA en pacientes asintomáticos durante el primer año tras un TxC. Este es el primer estudio multicéntrico en el que se ha evaluado la utilidad de la STE en el RCA tras el TxC. Se evaluó también la utilidad del análisis del strain del VD, que hasta la fecha se ha descrito muy poco en este contexto.
Nuestro estudio confirma la reducción de los parámetros de la STE del VI y el VD durante el RCA ≥ 2R. Además, en el análisis multivariante, el SLGVI mostró asociación independiente con el RCA ≥ 2R. Por último, este estudio halla un fuerte VPN cuando se combinan el SLGVI y el SLVD de la pared libre, que por lo tanto podría ser una herramienta útil para el tratamiento no invasivo del RCA y la optimización de las pautas de tratamiento inmunosupresor.
Los parámetros de la STE se han propuesto anteriormente en varios estudios como instrumento para el diagnóstico no invasivo del RCA, pero continúa habiendo debate al respecto13–18. Estos estudios previos son unicéntricos y se han utilizado criterios de inclusión y poblaciones heterogéneos. Además, no todos han mostrado una reducción significativa del SLGVI o algún otro parámetro de strain en contextos de RCA17,18. A este respecto, la mayor parte de los estudios describen la utilidad del SLGVI más tarde tras el TxC, y la evidencia existente para respaldar su uso durante el primer año siguiente al TxC es menor13,16,18. Ambardekar et al.18 no pudieron mostrar ningún cambio en el análisis de la STE durante los episodios de rechazo asintomáticos (cualquier grado de RCA). En nuestro estudio solo se tuvo en cuenta un RCA ≥ 2R, ya que uno leve asintomático (RCA=1R) no suele ser objeto de tratamiento, y ello puede explicar en parte la diferencia observada en nuestros resultados.
Son importantes puntos fuertes de este estudio su carácter multicéntrico y su diseño concebido para una amplia aplicabilidad a pacientes con un TxC y para que refleje la práctica clínica real en los centros de TxC. Esto conlleva, naturalmente, una mayor variabilidad y unos resultados menos favorables que en la cohorte original. De hecho, los valores de STE mostraron un mayor solapamiento entre los 2 grupos (RCA <2R frente a ≥ 2R) y hubo una ligera disminución del VPN (el 94,3% en la presente cohorte frente al 100% en la cohorte original para la variable SLGVI> 15,5% + SLVD de la pared libre> 17%)16.
Tras el análisis multivariante, el SLVD de la pared libre dejó de mostrar una asociación significativa con la aparición de un RCA ≥ 2R. Estos resultados podrían estar influidos por varios factores. En primer lugar, la obtención y el análisis de las proyecciones del VD es más difícil que para las proyecciones apicales del VI; por consiguiente, pueden ser menos fiables que el SLGVI en la práctica clínica cotidiana. Esto se confirma por el hecho de que hubiera más segmentos ventriculares derechos no analizables (6,6%), en comparación con el SLGVI (2,3%). Además, la presencia de hipertensión pulmonar en pacientes con insuficiencia cardiaca avanzada está relacionada con la insuficiencia del VD después del TxC. Además, en una fase temprana tras muchas intervenciones de cirugía cardiaca (no exclusivamente en el caso del TxC) se produce un cambio natural del patrón de contractilidad y la geometría del VD, con una pérdida relativa del acortamiento longitudinal24. Todos estos hechos contribuyen a la función del VD después de un TxC, incluso en ausencia de RCA.
La variabilidad y la reproducibilidad de la STE continúan siendo un importante motivo de preocupación no solo entre los diferentes proveedores, sino también en lo que respecta a las actualizaciones del software para la valoración del strain25–28. El optimismo es general en cuanto a que esta limitación se reducirá con los avances tecnológicos12,29–31. Actualmente se recomienda realizar ecocardiografías seriadas con los mismos proveedor y software, si bien las actualizaciones parecen inevitables y los estudios realizados con una tecnología antigua tienen escasos valor y utilidad. La cohorte original se analizó con el programa de Phillips QLab 7. La cohorte de este estudio multicéntrico se evaluó con su actualización, QLab 10, y ello puede explicar en parte la pérdida de capacidad para descartar el RCA en esta cohorte con nuestros valores de corte originales.
La BEM se ha considerado el patrón de referencia para el diagnóstico del RCA y se acepta de manera generalizada que un RCA ≥ 2R debe ser objeto de tratamiento. Sin embargo, la capacidad de la BEM de ser un verdadero patrón de referencia es cuestionable y la consideración de un RCA ≥ 2R no debiera ser el único criterio para establecer un determinado régimen inmunosupresor32,33. Es importante resaltar la variabilidad interobservadores de la BEM, que claramente han mostrado los investigadores de los estudios CARGO y CARGO II34–37. Esta variabilidad entre los anatomopatólogos es superior en las muestras con algún grado de rechazo, de modo que la BEM resulta más objetiva para descartar el RCA que para diagnosticarlo. Esto contrasta con la inseguridad de haber tomado muestras de tejido lesionado por RCA en la BEM y que se produzca un error de muestreo, dada la naturaleza parcheada del RCA. Así pues, cabe la posibilidad de que se evaluen las BEM erróneamente como ausencia de RCA y, por lo tanto, no se aplique tratamento.
La determinación del perfil de expresión génica en sangre periférica ha resultado útil para descartar el RCA ≥ 2R en pacientes con bajo riesgo, y una estrategia basada en esta técnica resulta segura en el seguimiento de esta complicación y sus consecuencias tras el TxC33,36,37. Hoy es el método más comúnmente utilizado en el tratamiento no invasivo del RCA después de un TxC. Sin embargo, no se ha evaluado la utilidad de determinar el perfil precozmente (< 2 meses) después de un TxC o un RCA reciente33,37. En el estudio CARGO II, se mantuvo un VPN excelente (el 98,1% para un valor de corte de 34), que aumentó a un 100% al modificar el punto de corte y reducir simultáneamente el valor predictivo positivo a un 2%. De igual modo, en este estudio se obtuvo un VPN del 94,3% para el SLGVI + SLVD de la pared libre (con un valor predictivo positivo del 10,7%). La prevalencia de un RCA ≥ 2R en el estudio CARGO II fue de tan solo un 3,2% (frente a un 7,4% en nuestra serie), lo cual contribuye a explicar el elevado VPN y el escaso valor predictivo positivo, que es una hallazgo frecuente en los estudios de tratamiento no invasivo para descartar el RCA. La presencia de ADN libre procedente del donante en la sangre periférica del receptor (donor-derived cell-free DNA) permite también un diagnóstico no invasivo del RCA38–40. Sin embargo, los métodos iniciales requerían el genotipo tanto del receptor como del donante, y ello limitaba su aplicabilidad38,39,41. Hay nuevas técnicas que parecen prometedoras en este campo, pero serán necesarios nuevos estudios para validarlas40,42.
En comparación con estas alternativas, la ecocardiografía proporciona información acerca de otros parámetros básicos, además de la presencia de RCA, que tienen consecuencias en el pronóstico y el tratamiento (como la función del injerto) y pueden verse afectados por otras complicaciones derivadas del TxC. Además, estos métodos, al igual que otras técnicas de diagnóstico por la imagen como la resonancia magnética, no son tan accesibles ni están tan disponibles como la ecocardiografía. Creemos que los parámetros de la STE (en especial el SLGVI, según nuestros resultados) pueden ser una herramienta útil como parte del diagnóstico y el tratamiento no invasivos del RCA. Pueden ser de especial utilidad en pacientes asintomáticos sin ningún otro signo o síntoma de rechazo y con valores absolutos de STE más altos (en los que se prevé un mayor VPN). A estos pacientes se los puede considerar en bajo riesgo y se podría plantear un tratamiento no invasivo del RCA con un seguimiento estrecho, en especial en los centros de TxC en que las BEM se realizan tempranamente o en pacientes con complicaciones o dificultades para la BEM. Además, cuando se utiliza en la práctica clínica cotidiana, la variación que se produce con el tiempo puede ser también de interés. Un descenso brusco en los parámetros de strain en cuanto a los valores absolutos (con un VPN inferior) en comparación con las exploraciones ecocardiográficas previas también podría ser útil a los clínicos como parte del tratamiento de los pacientes con un TxC. Así pues, se recomienda su medición en la práctica clínica cotidiana para mejorar la evaluación de esos pacientes. En cualquier caso, el estudio no pretende reemplazar la BEM, sino enriquecer las posibilidades del tratamiento no invasivo del RCA.
LimitacionesEste estudio tiene varias limitaciones. En primer lugar, la baja prevalencia del RCA ≥ 2R observada en nuestro estudio puede haber sobrestimado el VPN. Debe tenerse en cuenta también la necesidad de una estandarización continua de la técnica de STE, de manera que la necesaria ausencia de cambios de proveedor o de software sería una limitación, como puede haber ocurrido en nuestro estudio. Asimismo, no se utilizó un laboratorio central para el análisis de las biopsias ni para las mediciones de parámetros ecocardiográficos, si bien todos los datos fueron supervisados por un segundo ecocardiografista. A pesar de que nuestros resultados reflejan una mayor variabilidad, nuestro objetivo es evaluar la efectividad de STE en la práctica clínica real. Por último, no hubo un protocolo común para la determinación de rechazo mediado por anticuerpos o de EVI en los diversos centros, y ello puede haber modificado ligeramente los resultados.
CONCLUSIONESNuestros resultados muestran un VPN sólido para descartar RCA ≥ 2R cuando se combinan el SLGVI y el SLVD de la pared libre, lo cual proporciona una herramienta útil en el tratamiento no invasivo de esta complicación. Además, el SLGVI se asoció de manera independiente con la presencia de RCA ≥ 2R. Se propone el uso sistemático de los parámetros de STE tras el TxC, sobre todo en pacientes con bajo riesgo y clínicamente estables con unos valores absolutos de STE más altos, para quienes puede ser de utilidad para disminuir la carga de BEM repetidas. Serán necesarios nuevos estudios con un tamaño muestral más amplio para confirmar estos resultados.
- –
El uso de parámetros de strain se ha propuesto en estudios unicéntricos como posible alternativa no invasiva a la BEM en el diagnóstico del RCA.
- –
En la cohorte original, los valores de corte del 15,5% del SLGVI y del 17% del SLVD de la pared libre mostraron un VPN del 100% para descartar el RCA.
- –
Este es el primer estudio multicéntrico en el que se analiza la utilidad de los parámetros de la STE en el RCA.
- –
Los pacientes con un RCA ≥ 2R mostraron una reducción del SLGVI y del SLVD de la pared libre en el análisis univariante.
- –
El SLGVI continuó siendo un factor independiente predictivo de RCA ≥ 2R en el análisis multivariante y fue el mejor parámetro relacionado con un RCA ≥ 2R.
- –
Un SLGVI> 17% y un SLVD de la pared libre> 15,5% mostraron un VPN del 94,3% para descartar el RCA ≥ 2R.
- –
Los parámetros de la STE pueden usarse como parte del tratamiento no invasivo del RCA.
Este estudio contó con financiación mediante una subvención de investigación del Grupo de Trabajo sobre Insuficiencia Cardiaca y Trasplante Cardiaco de la Sociedad Española de Cardiología.
CONFLICTO DE INTERESESC.-H. Li declara haber recibido pagos por conferencias de Philips, sin relación con el trabajo presentado. Los demás autores no declaran ningún conflicto de intereses.
Los autores dan las gracias a Fina Casals, Zulaika Grille, Paula Blanco y todas las unidades de trasplante cardiaco y de diagnóstico por la imagen cardiaco que colaboraron en este proyecto.