La insuficiencia pulmonar es una complicación frecuente en pacientes con tetralogía de Fallot o estenosis pulmonar congénita reparada. Se han correlacionado variables electrocardiográficas con parámetros de función del ventrículo derecho. Proponemos analizar el valor diagnóstico de la anchura y la fragmentación del electrocardiograma en la identificación de pacientes con disfunción y/o dilatación del ventrículo derecho.
MétodosSeleccionamos a 107 pacientes consecutivos diagnosticados de insuficiencia pulmonar grave tras reparación de estenosis pulmonar o tetralogía de Fallot. Se les realizó electrocardiograma, ecocardiograma y resonancia magnética. Cada electrocardiograma se analizó manualmente midiendo la duración del QRS. Definimos fragmentación del QRS como la presencia de ondas de bajo voltaje en la porción terminal del QRS en al menos dos derivaciones contiguas.
ResultadosSe obtuvo una correlación negativa y significativa entre anchura del QRS y función del ventrículo derecho, así como una correlación positiva con el volumen de este. De la curva ROC se obtuvo el punto de corte en 140ms de anchura del QRS, que mostró buena sensibilidad para el diagnóstico de dilatación (> 80%) y disfunción (> 95%) del ventrículo derecho. En los modelos de regresión logística, QRSd>140ms se mostró como el único predictor independiente de dilatación y disfunción del ventrículo derecho.
ConclusionesEl electrocardiograma es una herramienta rápida, disponible y reproducible. La anchura del QRS permite predecir de manera independiente la presencia de dilatación y disfunción del ventrículo derecho. Este es el primer estudio que propone un punto de corte en la anchura del QRS para el cribado de afección del ventrículo derecho.
Palabras clave
La insuficiencia pulmonar (IP) es una complicación frecuente en los pacientes con tetralogía de Fallot (TF) o estenosis pulmonar congénita intervenidas durante la infancia. En la TF, se ha demostrado que la cirugía correctora mejora los síntomas y aumenta la supervivencia1,2. En la estenosis pulmonar la obstrucción puede localizarse valvular, subvalvular (infundibular) o supravalvular. La estenosis valvular se puede tratar mediante valvuloplastia percutánea, mientras que la supravalvular y la subvalvular generalmente requieren cirugía convencional y su pronóstico es menos benigno3.
La IP grave que suele aparecer tras la intervención conlleva una dilatación y la progresiva disfunción del ventrículo derecho (VD), lo que incrementa el riesgo de arritmias y empeora el pronóstico de estos pacientes. El tratamiento es quirúrgico, mediante el recambio valvular pulmonar por prótesis u homoinjerto. Cuando la sustitución valvular pulmonar se realiza en el momento adecuado, suele acompañarse de reducción del volumen del VD y, en ocasiones, de una mejoría de la fracción de eyección del VD (FEVD). Sin embargo, cuando se indica de manera tardía, la recuperación del VD es incompleta4. Los criterios actuales para indicar sustitución valvular pulmonar no están claramente definidos, y se basan principalmente en la aparición de eventos clínicos y/o dilatación excesiva del VD5. La selección del momento adecuado de la cirugía, por lo tanto, es un desafío para el clínico, pues, además de las variables clínicas, se debe considerar los datos derivados de pruebas de imagen.
La técnica de referencia para la estimación de la FEVD y los volúmenes del VD es la cardiorresonancia magnética (CRM). Sin embargo, la CRM es una técnica con un coste elevado, no disponible en todos los centros y de uso controvertido con pacientes portadores de dispositivos de estimulación cardiaca o desfibriladores, en particular estos, tanto por el riesgo de interferencias como por el robo de señal que inducen6. En este contexto, los métodos diagnósticos no invasivos complementarios, como el electrocardiograma (ECG), cobran especial importancia como posibles marcadores indirectos de la progresión de la cardiopatía.
El ECG de superficie es una prueba diagnóstica sencilla, asequible y poco invasiva; diferentes variables electrocardiográficas se han correlacionado con parámetros de función del VD y con la aparición de eventos cardiovasculares7,8. En la TF se ha estudiado la relación de la fragmentación y la anchura del QRS con parámetros clínicos e incluso con la aparición de arritmias9.
El objetivo de este estudio es analizar el valor diagnóstico de los parámetros derivados del ECG para identificar a los pacientes con disfunción y/o dilatación del VD secundaria a IP grave.
MÉTODOSPoblación del estudioSeleccionamos retrospectivamente a 107 pacientes diagnosticados de IP grave y seguidos en la unidad de cardiopatías congénitas del adulto de nuestro centro. Todos ellos estaban diagnosticados de TF o estenosis pulmonar y se sometieron a reparación quirúrgica en la infancia, con aparición de una IP significativa como secuela. Definimos IP grave según los criterios previamente establecidos en la literatura10.
Las variables recogidas incluyeron datos demográficos y clínicos. Se realizó ECG de superficie, ecocardiograma transtorácico y CRM como parte de su evaluación clínica rutinaria. El intervalo entre el ECG y la CRM no superó los 15 días en ningún caso. Se excluyó a los pacientes con una o más de las siguientes condiciones: a) uso de medicación con efecto en la duración del QRS; b) ritmo estimulado por MP; c) problemas para la interpretación de los datos de la CRM por el área de robo de señal debida a la presencia de desfibrilador implantable (DAI), y d) presencia de atresia tricuspídea y/o hipoplasia del VD.
Evaluación electrocardiográficaSe realizó un ECG de doce derivaciones en reposo a todos los pacientes como parte de su seguimiento habitual mediante un sistema de adquisición y almacenamiento digital (banda de filtro, 0,16-100Hz; 25mm/s; 10mm/mV; PageWriter TC70 cardiograph, Philips Medical Systems; Eindhoven, Países Bajos). Para realizar las mediciones, se aumentó el tamaño y se empleó un software específico de medición (CardioCaliper 3.3, Iconico®) con una resolución de 1ms en el eje horizontal y 0,01mV en el eje vertical.
Cada ECG se analizó manualmente midiendo la duración de un complejo QRS (QRSd) en cada una de las derivaciones precordiales y obteniendo su media aritmética. La duración del QRS se definió como la distancia entre la primera deflexión y el punto de confluencia del vector final con la línea isoeléctrica. Se seleccionaron los complejos cuya duración se pudiera evaluar correctamente gracias a la correcta visualización de la línea isoeléctrica. Se excluyeron de la medición los latidos anticipados auriculares y ventriculares. Para el análisis estadístico, definimos QRS largo aquel > 120ms.
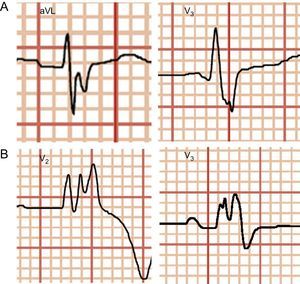
Se analizó la fragmentación del QRS (QRSf), definida como la presencia de muescas u ondas de bajo voltaje (R’) en la porción terminal del QRS o en el inicio del segmento ST en al menos dos derivaciones contiguas (figura 1A). En pacientes con QRS largo (> 120ms), incluso con morfología de bloqueo de rama, se definió la fragmentación del QRS como la presencia de más de 2 R’ en la onda R o en el nadir de la onda S en al menos dos derivaciones contiguas (figura 1B).
Todos los ECG fueron analizados por cardiólogos clínicos que desconocían el resultado de la CRM. Se seleccionó aleatoriamente a 10 pacientes para repetir de manera enmascarada el análisis del QRS por el mismo operador y por un segundo operador para establecer la variabilidad interobservador e intraobservador.
Cardiorresonancia magnéticaTodas las CRM se realizaron en un equipo de 1,5 T Magnetom versión Syngo MR 2004V® (Siemens Medical Solutions; Elangen, Alemania) y las interpretó una cardióloga experta en imagen cardiaca. Se empleó un protocolo en el que se obtuvieron secuencias de cine (True FISP), secuencias morfológicas (TSE T1 y TSE T2) y secuencias de viabilidad (Turbo FLASH). Los datos de volúmenes y fracción de eyección de ambos ventrículos se analizaron mediante el software QMASS MR 6.1.5® (Medis; Leiden, Países Bajos). La CRM se utilizó como método de referencia para el cálculo de la FEVD (por el método de Simpson) y los volúmenes ventriculares sistólicos y diastólicos. Siguiendo las recomendaciones actuales, definimos disfunción del VD como la presencia de una FEVD<45%11. Definimos dilatación clínicamente relevante del VD como la presencia de un volumen telediastólico indexado del VD (VTDVDi) > 150ml/m2.
Análisis estadísticoSe obtuvieron estadísticos descriptivos de frecuencia de las variables continuas estudiadas (media ± desviación típica) y las variables categóricas (porcentaje ± desviación típica). Para determinar la variabilidad interobservador e intraobservador, se empleó el coeficiente de correlación intraclase para variables continuas y el índice kappa para las variables categóricas. Se realizaron estudios de correlación lineal simple con determinación del coeficiente de correlación de Pearson entre las variables continuas. Las comparaciones entre las medias se analizaron con la prueba de la t de Student. A partir de la curva ROC (receiver operating characteristics), se estimaron los puntos de corte óptimos de cada parámetro para el diagnóstico de disfunción y dilatación del VD, con sus correspondientes sensibilidad, especificidad y valores predictivos positivo y negativo. Se realizaron modelos de regresión logística para determinar los factores predictores de dilatación o disfunción del VD.
El análisis estadístico se realizó con el programa IBM SPSS Statistics 18® (SPSS Inc.; Chicago, Estados Unidos). Se consideraron estadísticamente significativos valores de p<0,05.
RESULTADOSPoblación de estudioDe los 114 pacientes con IP grave seguidos en nuestra consulta de cardiopatías congénitas del adulto, finalmente se incluyó en el análisis a 107. De estos 107 pacientes, se excluyó del estudio a 7 por las siguientes razones: a 3 por otra anomalía congénita asociada, a 1 por ritmo ventricular estimulado y a 3 por ser portadores de un DAI, ya que el artefacto que este causa impide la interpretación de las imágenes de la CRM.
Las características de la población de estudio se muestran en la tabla 1. El 49,5% de los pacientes eran mujeres, con una media de edad de 32 años. Respecto a la enfermedad de base, 80 pacientes (74,7%) presentaron TF y 27 (25,23%), estenosis subpulmonar. La técnica quirúrgica empleada en 91 pacientes (85%) fue la cirugía de ampliación del tracto de salida del VD mediante un parche transanular, mientras que en 45 (42,1%) se practicó valvulotomía de la válvula pulmonar. Del total de pacientes, 89 (83,17%) se encontraban en clase funcional I de la New York Heart Association (NYHA), 15 (14%) en NYHA II, 2 (1,86%) en NYHA III y 1 (0,83%) en NYHA IV. En lo referente al tratamiento farmacológico, 5 pacientes (4,7%) estaban en tratamiento con inhibidor de la enzima de conversión de la angiotensina o antagonista del receptor de la angiotensina II, 9 (8,4%) con bloqueadores beta y 15 (14,9%) con diuréticos de asa (furosemida).
Características de la muestra (n=107)
| Mujeres | 53 (49,5) |
| Edad (años) | 32±13 |
| Clase funcional de la NYHA | |
| I | 89 (83,17) |
| II | 15 (14) |
| III | 2 (1,86) |
| IV | 1 (0,93) |
| Cardiopatía congénita | |
| Tetralogía de Fallot | 80 (74,76) |
| Estenosis subpulmonar | 27 (25,23) |
| Tipo de intervención inicial | |
| Valvulotomía | 45 (42,1) |
| Parche transanular | 91 (85) |
| Tratamiento | |
| Diuréticos | 15 (14,9) |
| Bloqueadores beta | 9 (8,4) |
| IECA/ARA–II | 5 (4,7) |
ARA–II: antagonistas del receptor de la angiotensina II; IECA: inhibidor de la enzima de conversión de la angiotensina; NYHA: New York Heart Association.
Los datos expresan n (%) o media±desviación estándar.
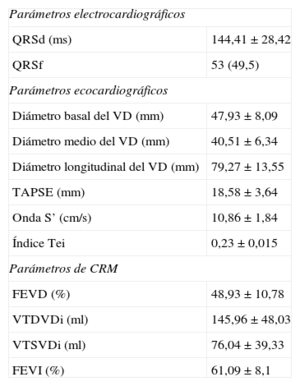
A todos los pacientes se les realizó un ecocardiograma durante los 15 días posteriores a la CRM. Los datos ecocardiográficos y los obtenidos de la CRM se recogen en la tabla 2. Un total de 33 pacientes (30,8%) presentaban disfunción del VD según los criterios de CRM (FEVD<45%, que fue la técnica de referencia empleada en nuestro estudio). El desplazamiento sistólico del anillo tricúspide (TAPSE) medio fue de 18,58±3,64mm; la onda S’, 10,86±1,84cm/s, y el índice Tei, 0,23±0,015. La FEVD estimada por CRM fue del 48,93%±10,78%. Respecto a los volúmenes del VD calculados mediante la CRM, 49 pacientes (45,8%) presentaron un VTDVDi>150ml (punto de corte seleccionado como dilatación significativa del VD).
Datos ecocardiográficos y de la cardiorresonancia magnética
| Parámetros electrocardiográficos | |
| QRSd (ms) | 144,41±28,42 |
| QRSf | 53 (49,5) |
| Parámetros ecocardiográficos | |
| Diámetro basal del VD (mm) | 47,93±8,09 |
| Diámetro medio del VD (mm) | 40,51±6,34 |
| Diámetro longitudinal del VD (mm) | 79,27±13,55 |
| TAPSE (mm) | 18,58±3,64 |
| Onda S’ (cm/s) | 10,86±1,84 |
| Índice Tei | 0,23±0,015 |
| Parámetros de CRM | |
| FEVD (%) | 48,93±10,78 |
| VTDVDi (ml) | 145,96±48,03 |
| VTSVDi (ml) | 76,04±39,33 |
| FEVI (%) | 61,09±8,1 |
CRM: cardiorresonancia magnética; FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; QRSd: duración del QRS; QRSf: presencia de fragmentación; VD: ventrículo derecho; VTDVDi: volumen telediastólico del ventrículo derecho indexado; VTSVDi: volumen telesistólico del ventrículo derecho indexado.
Los datos expresan n (%) o media ± desviación estándar.
En primer lugar, se realizó un estudio de la reproducibilidad de los datos electrocardiográficos analizando las variabilidades interobservador e intraobservador. El coeficiente de correlación intraclase para la correlación intraobservador fue 0,984 para la estimación de QRSd y 0,986 para la correlación interobservador para el cálculo de QRSd. Todos ellos se corresponden con excelentes correlaciones interobservador e intraobservador. Hubo excelente reproducibilidad para la detección de fragmentación del QRS (κ=1), tanto interobservador como intraobservador.
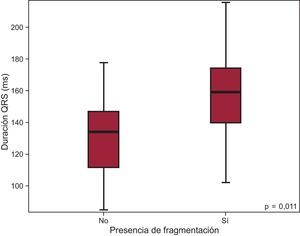
La duración del QRS en los pacientes de la muestra osciló entre 84,67 y 215,67ms, con una media de 144,41±28,42ms; 79 pacientes (73,8%) presentaron QRS largo (> 120ms). Respecto a la conducción intraventricular, 79 pacientes (73,8%) mostraron bloqueo completo de rama derecha del haz de His. En 53 pacientes (49,5%) se detectó fragmentación del QRS. La mayoría de los pacientes con fragmentación presentaron asimismo QRS largo (48 pacientes; 90,56%), con diferencias estadísticamente significativas en la duración del QRS entre pacientes con fragmentación y sin ella (QRSd, 156,83 frente a 131,5ms; p<0,001) (figura 2).
Al analizar los datos electrocardiográficos en función de la técnica quirúrgica realizada, se observó que en los pacientes intervenidos con la técnica del parche transanular el QRS era significativamente más ancho (QRSd, 147,67 frente a 126,48ms; p=0,008) (figura 3). Sin embargo, en lo que respecta a la presencia de fragmentación, no hubo diferencias significativas entre pacientes con y sin parche transanular.
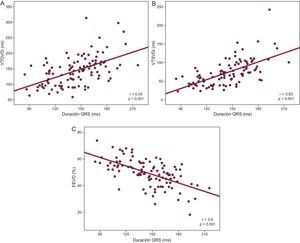
Estudio de la correlación entre parámetros electrocardiográficos y datos de imagenEn primer lugar se estudió si había correlación entre la anchura del complejo QRS y los parámetros de volumen y función del VD estimados por CRM (figuras 4A–C). La correlación de Pearson mostró una correlación negativa y significativa entre QRSd y FEVD (r=–0,6; p<0,001) y una correlación positiva y significativa entre QRSd y VTSVDi (r=0,63; p<0,001) y entre QRSd y VTDVDi (r=0,55; p<0,001), lo que evidencia que a mayor QRSd, menor FEVD y mayores volúmenes del VD.
Estudio de la correlación entre la anchura del QRS y los parámetros de volumen y función del ventrículo derecho estimados mediante cardiorresonancia magnética. FEVD: fracción de eyección del ventrículo derecho; VTDVDi: volumen telediastólico del ventrículo derecho indexado; VTSVDi: volumen telesistólico del ventrículo derecho indexado.
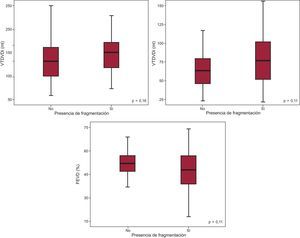
En el estudio de la fragmentación no se apreciaron diferencias estadísticamente significativas en lo que respecta a VTDVDi (137,68 frente a 150,49ml; p=0,16), VTSVDi (67,79 frente a 79,36ml; p=0,11) y FEVD (el 51,12 frente al 47,88%; p=0,11) entre los grupos con y sin fragmentación. No obstante, se apreció una tendencia a VD más dilatado y con peor función sistólica en los pacientes con fragmentación en el ECG (figura 5).
Estudio de las características morfológicas y funcionales del ventrículo derecho en función de la presencia de fragmentación. FEVD: fracción de eyección del ventrículo derecho; VTDVDi: volumen telediastólico del ventrículo derecho indexado; VTSVDi: volumen telesistólico del ventrículo derecho indexado.
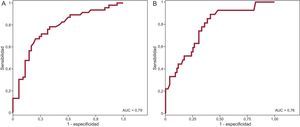
Se elaboró una curva ROC (figura 6A) para determinar el poder de discriminación del parámetro QRSd para detectar disfunción del VD. El área bajo la curva obtenida para QRSd fue 0,79. El punto de corte de QRSd>140ms mostró una sensibilidad del 89% (intervalo de confianza del 95% [IC95%], 72%-96%) y una especificidad del 56% (IC95%, 45%-66%) para predecir disfunción del VD, con un valor predictivo negativo del 94% (IC95%, 81%-98%). Se estudió la curva ROC obtenida con QRSd para detectar dilatación del VD (> 150ml/m2); se halló para QRS>140ms una sensibilidad de 76% (IC95%, 63%-85%) y una especificidad del 65% (IC95%, 52%-77%), con un valor predictivo negativo del 72% (IC95%, 58%-83%). El área bajo la curva para la detección de dilatación del VD fue 0,76 (figura 6B).
Con los datos derivados de la curva ROC, se estableció como punto de corte óptimo de QRSd para detectar dilatación y disfunción del VD una anchura > 140ms, con lo que se creó una variable binaria en función de QRSd mayor o menor que 140ms. Empleamos esta nueva variable y los datos previos existentes (edad, sexo, edad en el momento de la corrección quirúrgica, tiempo de evolución tras la corrección, fístula paliativa previa, uso de parche transanular en la cirugía y presencia de fragmentación) para la elaboración de sendos modelos de regresión logística para predecir la presencia de dilatación y disfunción del VD. La presencia de un QRSd > 140ms (hazard ratio [HR]=6,69; IC95%, 2,69-16,71; p<0,001) y el sexo masculino (HR=0,34; IC95%, 0,14-0,84; p=0,019) se mostraron como los únicos predictores independientes de dilatación del VD. Ambas variables se mostraron también como predictores independientes de disfunción del VD: QRSd>140ms, HR=10,69 (IC95%, 2,91-39,37; p<0,001); sexo masculino, HR=0,32 (IC95%, 0,12-0,895; p=0,031).
DISCUSIÓNEl ECG de superficie es una técnica esencial en la cardiología clínica; se trata de una herramienta incruenta, de bajo coste y disponible en la práctica totalidad de los centros sanitarios, que tiene enorme valor clínico para el diagnóstico de una gran variedad de trastornos cardiacos12 y aporta asimismo información pronóstica13.
Nuestro trabajo plantea el estudio del valor de la anchura y la fragmentación del QRS para el diagnóstico de dilatación y disfunción del VD. Estudiamos de forma selectiva a pacientes con IP significativa tras la reparación quirúrgica de una TF o estenosis pulmonar congénita.
Se ha demostrado la capacidad predictiva de eventos de la duración del complejo QRS y la presencia de fragmentación, así como su buena correlación con parámetros clínicos y de imagen en pacientes con cardiopatías tanto adquiridas14,15 como congénitas16,17. La relación entre la duración del complejo QRS y el volumen del VD se ha estudiado previamente; Gatzoulis et al18 demostraron que la presencia de QRS>180ms se correlaciona con un VD más dilatado y es capaz de predecir la aparición de arritmias ventriculares en pacientes con TF reparada. Según Gatzoulis et al, la despolarización anómala que se produce en el VD dilatado condiciona el ensanchamiento del QRS, siguiendo una hipótesis de interacción mecanoeléctrica; estudios posteriores han confirmado dicha hipótesis estudiando la dinámica del VD mediante ecocardiografía tridimensional19 y CRM20. En una reciente revisión, Bassareo y Mercuro9 apuntan que la duración del QRS es uno de los más robustos predictores de arritmias ventriculares en pacientes con TF reparada, y hacen hincapié en su medición. Plantean como limitación las elevadas variabilidades en la medición del QRS tanto interobservador como intraobservador.
Sung et al21 propusieron que ciertos patrones electrocardiográficos y el QRS largo de los pacientes con comunicación interauricular tipo ostium secundum se relaciona con la dilatación del VD, más que con un trastorno intrínseco del sistema de conducción intraventricular. Recientemente, Ladouceur et al22 han estudiado el papel del QRS en pacientes con IP significativa en el seno de una cardiopatía congénita. En este estudio se concluyó que ciertos parámetros ecocardiográficos y electrocardiográficos (la anchura del QRS) facilitan la identificación de los pacientes que requieren un seguimiento más estrecho mediante CRM.
La fragmentación del QRS se ha establecido como un marcador de afección miocárdica, que puede ser una alteración cardiaca primaria (como la hipertrofia ventricular izquierda12, los síndromes coronarios agudos14 o la DAVD15) o secundaria, en el contexto de enfermedad sistémica (como amiloidosis15, artritis reumatoide16 o sarcoidosis pulmonar17).
En el ámbito de las cardiopatías congénitas del adulto, hay varias publicaciones recientes sobre la fragmentación; Assenza et al17 han descrito en un reciente trabajo que la presencia de fragmentación predijo un mayor volumen «atrializado» del VD en una cohorte de pacientes con anomalía de Ebstein; Shanmugam et al23 han estudiado la fragmentación en pacientes con TF reparada; se asoció con un VD disfuncionante y la existencia de aneurisma del tracto de salida del VD (en particular la fragmentación en derivaciones anteriores).
Nuestro estudio ha analizado a pacientes diagnosticados de IP significativa secundaria a una reparación quirúrgica de TF o estenosis pulmonar congénita. El estudio de los parámetros derivados del QRS muestra, a diferencia del trabajo de Bassareo y Mercuro9, elevada reproducibilidad de las mediciones electrocardiográficas tanto interobservador como intraobservador. De manera similar a lo expuesto en la literatura previa, la anchura del QRS muestra buena correlación con los datos de función y volumen del VD estimados mediante CRM, y es un predictor independiente de la presencia de dilatación y disfunción del VD. Asimismo, la curva ROC muestra una buena área bajo la curva para la detección de dilatación y de disfunción del VD.
Como punto novedoso de este trabajo, se seleccionó, a partir de los datos obtenidos de las curvas ROC, un punto de corte óptimo para cribar la presencia de dilatación y disfunción del VD. Así, la anchura del QRS>140ms muestra una sensibilidad>90% para la detección de disfunción del VD y > 80% para la detección de dilatación del VD.
La presencia de fragmentación del QRS en nuestra muestra es menos frecuente que en estudios previos (aproximadamente un 50% de los pacientes, frente a casi el 80% en otras series publicadas); además, no mostró relación estadísticamente significativa con la dilatación y la disfunción del VD, a diferencia de lo referido en la literatura23. Una posible explicación a este hecho estriba en las diferencias en las poblaciones de estudio, ya que los pacientes incluidos en el trabajo de Shanmugam et al23, en el que se registró mayor prevalencia de fragmentación, tenían VD más dilatados y con peor función sistólica. Probablemente esté por definir el papel de la fragmentación del QRS en pacientes con un VD de menor volumen, aunque a tenor de nuestros resultados es posible que aporte poco en las fases iniciales de la dilatación y la disfunción ventriculares. Es precisamente en estas fases precoces cuando el cribado de disfunción del VD adquiere especial importancia.
Al realizar el análisis de regresión, se obtuvo como predictor independiente de afección del VD la presencia de un QRS > 140ms; el hecho de que la fragmentación no lo fuera probablemente esté en relación con la marcada colinealidad existente entre ambas variables.
LimitacionesLa principal limitación es el pequeño tamaño muestral (107 pacientes), que limita la generalización de las conclusiones obtenidas, asumiendo la dificultad de realizar estudios con tamaño muestral elevado sobre enfermedades de baja prevalencia. Se trata, además, de un estudio basado en datos retrospectivos, con lo que hay más riesgo de incurrir en sesgos.
Consideramos que se requieren nuevos estudios de mayor escala para confirmar el valor del diámetro del QRS para el cribado de dilatación y/o disfunción del VD.
Sería deseable estudiar el valor diagnóstico de la fragmentación en pacientes con un volumen del VD moderadamente aumentado, ya que los datos existentes en la literatura provienen de estudios realizados en pacientes con una marcada dilatación del VD.
CONCLUSIONESSe trata del primer estudio que propone un punto de corte de QRSd para el cribado de afección del VD. El QRSd es capaz de predecir de manera independiente la presencia de dilatación y disfunción del VD. La baja variabilidad de las mediciones electrocardiográficas hacen de esta una herramienta útil, rápida, disponible y reproducible.
CONFLICTO DE INTERESESNinguno.