Los pacientes con síndrome de QT largo (SQTL) tienen una adaptación anormal del QT a los cambios bruscos de la frecuencia cardiaca producidos con la bipedestación. Este trabajo estudia la utilidad del test de bipedestación en una cohorte de pacientes con SQTL y evalúa si el fenómeno de «mala adaptación» del QT se normaliza con el tratamiento con bloqueadores beta.
MétodosSe realizó un electrocardiograma basal y otro inmediatamente tras la bipedestación a 36 pacientes con SQTL (6 [17%] con QTL1, 20 [56%] con QTL2, 3 [8%] con QTL7 y 7 [19%] con genotipo no identificado) y 41 controles. Se midió el intervalo QT corregido (QTc) basal (QTcdecúbito) y tras la bipedestación (QTcbipedestación) y el incremento del QTc (ΔQTc = QTcbipedestación – QTcdecúbito). Se repitió el test en 26 de los pacientes bajo tratamiento con bloqueadores beta.
ResultadosEl QTcbipedestación y el ΔQTc fueron mayores en el grupo de SQTL que en el grupo control (QTcbipedestación, 528 ± 46 frente a 420 ± 15 ms; p < 0,0001; ΔQTc, 78 ± 40 frente a 8 ± 13 ms; p < 0,0001). No hubo diferencias significativas entre los pacientes con QTL1 y QTL2. Los pacientes con SQTL presentaron patrones típicos del segmento ST-onda T tras la bipedestación. Las curvas receiver operating characteristic del QTcbipedestación y ΔQTc mostraron un incremento significativo del valor diagnóstico comparadas con la del QTcdecúbito (área bajo la curva de ambos, 0,99 frente a 0,85; p < 0,001). El tratamiento con bloqueadores beta atenuó la respuesta a la bipedestación de los pacientes con SQTL (en tratamiento, QTcbipedestación, 440 ± 32 ms [p < 0,0001] y ΔQTc, 14 ± 16 ms [p < 0,0001]).
ConclusionesLa evaluación del intervalo QTc tras la bipedestación proporciona un alto rendimiento diagnóstico y podría ser de gran utilidad en la monitorización del tratamiento con bloqueadores beta en los pacientes con SQTL.
Palabras clave
Aunque el síndrome de QT largo (SQTL) es una canalopatía con un tratamiento altamente eficaz, su diagnóstico sigue siendo un verdadero reto para los clínicos por diversos motivos: en primer lugar, hay un considerable solapamiento en la distribución de valores del intervalo QT entre las personas sanas y los pacientes con un SQTL confirmado por genética1,2; en segundo lugar, los episodios arrítmicos son infrecuentes y suelen producirse en contextos sin monitorización; en tercer lugar, el resultado negativo del estudio genético no permite descartar de manera inequívoca el diagnóstico de SQTL, y en ocasiones es difícil diferenciar mutaciones patógenas de variantes raras inocuas3.
Los pacientes en los que se sospecha un SQTL son a menudo objeto de exploraciones diagnósticas adicionales, como prueba de esfuerzo, registro Holter de 24 h y test de provocación con adrenalina4. La herramienta ideal para el diagnóstico de esta enfermedad de riesgo vital debe ser sencilla de aplicar e interpretar, a fin de iniciar el tratamiento inmediatamente y sin retrasos diagnósticos. Recientemente se ha descrito5,6 que los pacientes con síndrome de QT largo presentan un acortamiento del intervalo QT insuficiente para la taquicardia provocada por la bipedestación, debido a que tienen una respuesta anormal al aumento de la frecuencia cardiaca (FC) y a los cambios súbitos en el tono del sistema nervioso autónomo que se producen con la bipedestación. En consecuencia, la estimulación betaadrenérgica no consigue producir un incremento en la corriente repolarizante neta de los pacientes con SQTL y un defecto en las corrientes sensibles a la estimulación simpática (IKs, IKr e IK1)7-9.
Los objetivos de este estudio son: a) confirmar en nuestra cohorte de pacientes con SQTL y sujetos de control los resultados previos del test de bipedestación; b) describir los cambios en los patrones del segmento ST-onda T que podrían ser útiles para identificar los diferentes genotipos, y c) determinar si el tratamiento con bloqueadores beta (BB) de los pacientes con SQTL mejora el acortamiento del intervalo QT corregido (QTc) que se produce con la bipedestación brusca.
MÉTODOSPoblación del estudioSe incluyó consecutivamente en el estudio a 36 pacientes con SQTL de nuevo diagnóstico evaluados en el Hospital Universitario Virgen de la Arrixaca de Murcia (España) o en el Hospital Universitario y Politécnico La Fe de Valencia (España). El diagnóstico del SQTL se basó en la presencia de una puntuación en la escala de Schwartz10 ≥ 4 o una mutación patógena en los genes del SQTL.
Se identificó una mutación causal en 29 pacientes (80,5%). Los otros 7 presentaban sordera congénita (n = 2), síncope (n = 4), QTc en el cuarto minuto de la recuperación de la prueba de esfuerzo ≥ 480 ms (n = 5), ondas T melladas (n = 5) y muerte súbita cardiaca inexplicada de familiares de primer grado antes de los 30 años (n = 2).
Constituyeron el grupo de control 41 familiares asintomáticos de pacientes con SQTL genotipificado que no eran portadores de la mutación familiar. Se excluyó del grupo de control a los individuos con alteraciones basales del electrocardiograma (ECG). El protocolo se aplicó antes del inicio del tratamiento con BB a todos los pacientes con SQTL y después de la dosis óptima de BB a 26 pacientes. El estudio fue aprobado por los comités éticos de investigación de ambos centros participantes y se llevó a cabo de acuerdo con la Declaración de Helsinki. Todos los pacientes dieron su consentimiento informado por escrito antes del estudio.
Protocolo y medicionesSe realizó un ECG estándar de 12 derivaciones a una velocidad del papel de 25 mm/s, con una ganancia de 10 mm/mV. Se utilizó el test de bipedestación descrito previamente por Viskin et al.5. Se obtuvo un ECG basal tras un periodo de reposo de 10 min en decúbito supino; durante el registro continuo del ECG, se les indicó que se levantaran con rapidez. Se simplificó el «protocolo de Viskin» realizando únicamente determinaciones del QTc: a) antes de la bipedestación (QTcdecúbito), y b) inmediatamente después de la desaparición de los artefactos causados por la bipedestación (QTcbipedestación). Se excluyeron los ECG registrados más de 10 s después de la bipedestación. Se calculó el incremento del QTc respecto al valor basal (ΔQTc) restando el valor de QTcdecúbito del valor de QTcbipedestación. Los intervalos QT se midieron manualmente desde el inicio del complejo QRS hasta el final de la onda T, y este se definió como el punto de intersección de la línea tangente de la pendiente descendente máxima de la onda T con la línea isoeléctrica. El intervalo QT se midió en las derivaciones II y V5 y se corrigió por la FC con las fórmulas de Bazett y Fridericia. Un investigador ciego a la información genética y clínica realizó las mediciones del intervalo QT. Las mediciones del ECG se repitieron 3 veces, y se utilizó el valor medio para el análisis estadístico.
En el protocolo descrito por Viskin et al.5, el registro electrocardiográfico se realizaba en los 30 s siguientes a la bipedestación y se calculaba el intervalo QTc en 3 momentos: FC máxima, intervalo QT máximo y en el instante de máximo acercamiento entre el final de la onda T y el inicio de la siguiente onda P. En el presente estudio se propone un nuevo protocolo para medir el intervalo QTc. Este método utiliza una sola medición, es más fácil de aplicar y más rápido y está al alcance de cualquier profesional, además de que resuelve la dificultad fuera del laboratorio de electrofisiología de medir con exactitud la prolongación máxima del QT y el intervalo RR más corto.
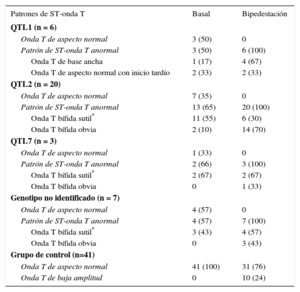
Los ECG obtenidos en decúbito y en bipedestación de los pacientes con SQTL se clasificaron según presentaran una repolarización de morfología normal o patrones segmento ST-onda T típicos. Se utilizaron las morfologías de ST-T descritas por Zhang et al.11, que diferenciaban 2 patrones de repolarización típicos del SQTL de tipo 1 (QTL1) —a) onda T de base ancha, y b) onda T de aspecto normal e inicio tardío— y 2 subtipos de ondas T bífidas en el SQTL de tipo 2 (QTL2): a) onda T bífida sutil, y b) onda T bífida obvia. A los pacientes con un SQTL de tipo 7 (QTL7) y los pacientes de genotipo no identificado se los clasificó también según estas morfologías.
Análisis estadísticoEl análisis estadístico se llevó a cabo mediante la versión 15.0 del programa informático SPSS (SPSS Inc.; Chicago, Estados Unidos). Se comprobó la distribución normal de las variables continuas mediante el test de Kolmogorov-Smirnov, las variables que mostraron distribución normal se expresan como media ± desviación estándar. Las variables cualitativas se expresan como valor absoluto y porcentaje. Para la comparación entre grupos, se emplearon el test de la t de Student bilateral, el test de la χ2 o la prueba exacta de Fisher. Se generaron las curvas de características operativas del receptor para determinar el área bajo la curva y calcular la especificidad para una sensibilidad predefinida del 90% del QTcdecúbito, el QTcbipedestación y el ΔQTc para identificar a los pacientes con SQTL. Se utilizó el método de DeLong para comparar las curvas de características operativas del receptor de los diferentes parámetros medidos. Las comparaciones de los intervalos QTc de antes y después del tratamiento con BB se realizaron mediante la prueba de Wilcoxon. Se consideraron estadísticamente significativos todos los valores de p < 0,05.
RESULTADOSCaracterísticas clínicas y electrocardiográficas basalesDe entre los pacientes con SQTL, 6 (17%) tenían QTL1; 20 (56%), QTL2; 3 (8%), QTL7, y 7 (19%) no tenían genotipo identificado. Tal como se preveía, los intervalos QT y QTc fueron significativamente más largos en los pacientes con SQTL que en el grupo de control. No hubo diferencias en edad, distribución por sexo, FC en reposo y FC en bipedestación entre el grupo de SQTL y el de control (tabla 1).
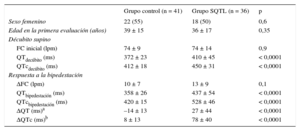
Características basales y respuesta a la bipedestación de los pacientes con síndrome de QT largo y los sujetos de control
| Grupo control (n = 41) | Grupo SQTL (n = 36) | p | |
|---|---|---|---|
| Sexo femenino | 22 (55) | 18 (50) | 0,6 |
| Edad en la primera evaluación (años) | 39 ± 15 | 36 ± 17 | 0,35 |
| Décubito supino | |||
| FC inicial (lpm) | 74 ± 9 | 74 ± 14 | 0,9 |
| QTdecúbito (ms) | 372 ± 23 | 410 ± 45 | < 0,0001 |
| QTcdecúbito (ms) | 412 ± 18 | 450 ± 31 | < 0,0001 |
| Respuesta a la bipedestación | |||
| ΔFC (lpm) | 10 ± 7 | 13 ± 9 | 0,1 |
| QTbipedestación (ms) | 358 ± 26 | 437 ± 54 | < 0,0001 |
| QTcbipedestación (ms) | 420 ± 15 | 528 ± 46 | < 0,0001 |
| ΔQT (ms)a | –14 ± 13 | 27 ± 44 | < 0,0001 |
| ΔQTc (ms)b | 8 ± 13 | 78 ± 40 | < 0,0001 |
Δ: aumento; FC: frecuencia cardiaca; QTc: intervalo QT corregido (fórmula de Bazett); SQTL: síndrome de QT largo.
Los valores expresan n (%) o media ± desviación estándar.
No se observaron diferencias en el incremento de la FC producido con la bipedestación entre los 2 grupos. El intervalo QTc aumentó ligeramente en el grupo de control tras el cambio postural (QTcdecúbito frente a QTcbipedestación, 412 ± 18 frente a 420 ± 15 ms; p < 0,0001), debido a que se produjo un acortamiento del intervalo QT más lento que el del intervalo RR durante la taquicardia inducida por la bipedestación. Sin embargo, la respuesta del intervalo QT a la bipedestación fue notablemente diferente en el grupo con SQTL. Así pues, en el grupo de pacientes con SQTL se produjo un incremento significativo de los intervalos QT y QTc inmediatamente tras la bipedestación (QTdecúbito frente a QTbipedestación, 410 ± 45 frente a 437 ± 54 ms; p = 0,001; QTcdecúbito frente a QTcbipedestación, 450 ± 31 frente a 528 ± 46 ms; p < 0,0001), y este cambio fue significativamente diferente del observado en el grupo de control (ΔQT en el grupo de SQTL frente al grupo de control, 27 ± 44 frente a –14 ± 13 ms; p < 0,0001; ΔQTc en el grupo de SQTL frente al grupo de control, 78 ± 40 frente a 8 ± 13 ms; p < 0,0001) (tabla 1). La diferencia del QTc entre ambos grupos continuó siendo estadísticamente significativa al utilizar la fórmula de Fridericia y tanto para la derivación V5 como para la II.
No se observaron diferencias significativas en el incremento del intervalo QTc entre los varones y las mujeres con SQTL (ΔQTc en las mujeres frente a los varones, 85 ± 43 frente a 71 ± 37 ms; p = 0,3).
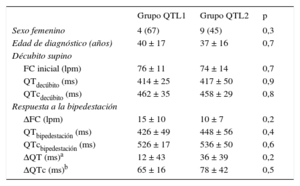
Los pacientes con QTL1 y QTL2 mostraron características basales similares, incluidos los valores de los intervalos QT y QTc (tabla 2). Se observó una tendencia a una mayor prolongación del intervalo QTc con la bipedestación en los pacientes con QTL2, pero esta diferencia no alcanzó significación estadística.
Comparación de los grupos de síndrome de QT largo tipo 1 y de síndrome de QT largo tipo 2
| Grupo QTL1 | Grupo QTL2 | p | |
|---|---|---|---|
| Sexo femenino | 4 (67) | 9 (45) | 0,3 |
| Edad de diagnóstico (años) | 40 ± 17 | 37 ± 16 | 0,7 |
| Décubito supino | |||
| FC inicial (lpm) | 76 ± 11 | 74 ± 14 | 0,7 |
| QTdecúbito (ms) | 414 ± 25 | 417 ± 50 | 0,9 |
| QTcdecúbito (ms) | 462 ± 35 | 458 ± 29 | 0,8 |
| Respuesta a la bipedestación | |||
| ΔFC (lpm) | 15 ± 10 | 10 ± 7 | 0,2 |
| QTbipedestación (ms) | 426 ± 49 | 448 ± 56 | 0,4 |
| QTcbipedestación (ms) | 526 ± 17 | 536 ± 50 | 0,6 |
| ΔQT (ms)a | 12 ± 43 | 36 ± 39 | 0,2 |
| ΔQTc (ms)b | 65 ± 16 | 78 ± 42 | 0,5 |
Δ: aumento; FC: frecuencia cardiaca; QTc: intervalo QT corregido (fórmula de Bazett); QTL1: síndrome de QT largo de tipo 1; QTL2: síndrome de QT largo de tipo 2.
Los valores espresan n (%) o media ± desviación estándar.
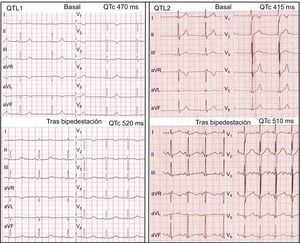
Las características morfológicas del segmento ST-onda T basales e inmediatamente después de la bipedestación se muestran en la tabla 3. Tres de los pacientes con QTL1 (50%) presentaron ondas T de aspecto normal en decúbito. Sin embargo, tras la bipedestación todos los pacientes con QTL1 mostraron un patrón de onda T anormal (4 [67%] con ondas T de base ancha y 2 [33%] con ondas T de aspecto normal e inicio tardío) (figura 1). En el grupo de pacientes con QTL2, 7 (35%) presentaban repolarización normal y en todos los pacientes aparecieron ondas T bífidas en respuesta a la bipedestación brusca (14 [70%], ondas T bífidas marcadas y 6 [30%], ondas T bífidas sutiles] (figura 1). Además, ninguno de los pacientes con QTL7 o con un SQTL con genotipo negativo presentó ondas T normales inmediatamente tras la bipedestación. En contraposición, la mayoría de los individuos del grupo de control mantuvieron inalterada la morfología normal de las ondas T con la bipedestación, y solo en 10 individuos de este grupo (24%) se produjo una disminución de la amplitud de la onda T sin cambios asociados en la morfología.
Patrones morfológicos de ST-onda T en decúbito supino y tras la bipedestación
| Patrones de ST-onda T | Basal | Bipedestación |
|---|---|---|
| QTL1 (n = 6) | ||
| Onda T de aspecto normal | 3 (50) | 0 |
| Patrón de ST-onda T anormal | 3 (50) | 6 (100) |
| Onda T de base ancha | 1 (17) | 4 (67) |
| Onda T de aspecto normal con inicio tardío | 2 (33) | 2 (33) |
| QTL2 (n = 20) | ||
| Onda T de aspecto normal | 7 (35) | 0 |
| Patrón de ST-onda T anormal | 13 (65) | 20 (100) |
| Onda T bífida sutil* | 11 (55) | 6 (30) |
| Onda T bífida obvia | 2 (10) | 14 (70) |
| QTL7 (n = 3) | ||
| Onda T de aspecto normal | 1 (33) | 0 |
| Patrón de ST-onda T anormal | 2 (66) | 3 (100) |
| Onda T bífida sutil* | 2 (67) | 2 (67) |
| Onda T bífida obvia | 0 | 1 (33) |
| Genotipo no identificado (n = 7) | ||
| Onda T de aspecto normal | 4 (57) | 0 |
| Patrón de ST-onda T anormal | 4 (57) | 7 (100) |
| Onda T bífida sutil* | 3 (43) | 4 (57) |
| Onda T bífida obvia | 0 | 3 (43) |
| Grupo de control (n=41) | ||
| Onda T de aspecto normal | 41 (100) | 31 (76) |
| Onda T de baja amplitud | 0 | 10 (24) |
QTL1: síndrome de QT largo de tipo 1; QTL2: síndrome de QT largo de tipo 2; QTL7: síndrome de QT largo de tipo 7.
Los valores expresan n (%).
Izquierda: test de bipedestación de un paciente con QTL1; en la situación basal, la FC es de 50 lpm; el intervalo QT, 515 ms y el intervalo QTc, 470 ms; tras la bipedestación, la FC es de 75 lpm; el intervalo QT, 465 ms y el intervalo QTc, 520 ms; se observa un patrón de onda T de aspecto normal e inicio tardío después de la bipedestación. Derecha: test de bipedestación de un paciente con QTL2; en la situación basal, la FC es de 60 lpm; el intervalo QT, 415 ms y el intervalo QTc, 415 ms, y se observan ondas T bífidas sutiles en las derivaciones V2-V3; después de la bipedestación, la FC es de 106 lpm; el intervalo QT, 384 ms y el intervalo QTc, 510 ms, y hay ondas T bífidas obvias en todas las derivaciones. FC: frecuencia cardiaca; QTc: intervalo QT corregido; QTL1: síndrome de QT largo tipo 1; QTL2: síndrome de QT largo tipo 2.
Se analizó el efecto del tratamiento con BB en la respuesta del intervalo QT a la bipedestación brusca en un subgrupo de pacientes (tabla 4). Como es lógico, el aumento de la FC con la bipedestación fue significativamente inferior con el tratamiento con BB. Se observó una reducción significativa del intervalo QTcbipedestación y del ΔQTc durante el tratamiento con BB, y se alcanzaron valores similares a los del grupo de control (figura 2). Por otra parte, esta «normalización» de la respuesta del intervalo QT a la bipedestación se observó en los subgrupos de QTL1, QTL2 y QTL con genotipo no identificado. Dos pacientes con QTL7 recibieron tratamiento con BB y presentaron también una disminución del intervalo QT tras la bipedestación. Se obtuvieron resultados similares al emplear la fórmula de Fridericia.
Efecto del tratamiento con bloqueadores beta en la respuesta de intervalo QT a la bipedestación de los pacientes con síndrome de QT largo
| Antes del tratamiento | Después del tratamiento | p | |
|---|---|---|---|
| Cohorte completa (n = 26) | |||
| ΔFC (lpm) | 12 ± 8 | 8 ± 4 | < 0,0001 |
| QTcdecúbito (ms) | 457 ± 28 | 426 ± 35 | < 0,0001 |
| QTcbipedestación (ms) | 538 ± 48 | 440 ± 32 | < 0,0001 |
| ΔQTc (ms)* | 81 ± 42 | 14 ± 16 | < 0,0001 |
| QTL1 (n = 4) | |||
| ΔFC (lpm) | 11 ± 5 | 8 ± 3 | < 0,0001 |
| QTcdecúbito (ms) | 477 ± 34 | 453 ± 16 | < 0,0001 |
| QTcbipedestación (ms) | 546 ± 32 | 455 ± 24 | < 0,0001 |
| ΔQTc (ms)* | 70 ± 18 | 2 ± 11 | 0,03 |
| QTL2 (n = 14) | |||
| ΔFC (lpm) | 10 ± 8 | 6 ± 4 | < 0,0001 |
| QTcdecúbito (ms) | 468 ± 16 | 441 ± 26 | < 0,0001 |
| QTcbipedestación (ms) | 552 ± 47 | 454 ± 26 | < 0,0001 |
| ΔQTc (ms)* | 70 ± 48 | 14 ± 17 | < 0,0001 |
| QTL con genotipo negativo (n = 6) | |||
| ΔFC (lpm) | 19 ± 11 | 12 ± 2 | < 0,0001 |
| QTcdecúbito (ms) | 420 ± 15 | 381 ± 18 | < 0,0001 |
| QTcbipedestación (ms) | 507 ± 54 | 405 ± 21 | < 0,0001 |
| ΔQTc (ms)* | 87 ± 49 | 24 ± 13 | 0,002 |
Δ: aumento; FC: frecuencia cardiaca; QTc: intervalo QT corregido (fórmula de Bazett); QTL1: síndrome de QT largo de tipo 1; QTL2: síndrome de QT largo de tipo 2.
Los valores espresan n (%).
Gráficos de cajas de las mediciones del intervalo QT de los pacientes con SQTL y los controles. La caja central corresponde a los valores de los percentiles 25 y 75; la línea del centro, a la mediana, y la línea vertical se extiende del valor mínimo al máximo, excluyendo los valores extremos (que se presentan en forma de puntos aislados). BB: bloqueadores beta; QTc: intervalo QT corregido; SQTL: síndrome de QT largo.
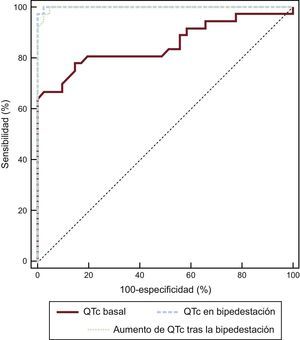
Las curvas de características operativas del receptor del intervalo QTcbipedestación y del ΔQTc mostraron un valor diagnóstico superior a la del intervalo QTcdecúbito (figura 3, tabla 5). Se observó que, para una sensibilidad predeterminada del 90%, la especificidad aumentaba del 58% para el intervalo QTcdecúbito al 100% tanto para el intervalo QTcbipedestación como para el ΔQTc. Las comparaciones de las curvas pusieron de manifiesto que tanto el intervalo QTcbipedestación como el ΔQTc eran significativamente mejores que el intervalo QTcdecúbito para el diagnóstico de los pacientes con SQTL (p = 0,001 y p = 0,002 respectivamente).
Análisis de las variables de las curvas de características operativas del receptor
| AUC | IC95% | p | Sensibilidad del 90% | Especificidad, % | |
|---|---|---|---|---|---|
| QTcdecúbito | 0,85 | 0,76-0,95 | < 0,001 | 415 | 58 |
| QTcbipedestación | 0,99 | 0,99-1,00 | < 0,001 | 475 | 100 |
| ΔQTc* | 0,99 | 0,99-1,00 | < 0,001 | 46 | 100 |
Δ: incremento; AUC: área bajo la curva; IC95%: intervalo de confianza del 95%; QTc: intervalo QT corregido (fórmula de Bazett).
En respuesta a una aceleración súbita de la FC, el intervalo QT se acorta más lentamente que el intervalo RR12. En consecuencia, tras cambios bruscos de la frecuencia de estimulación en pacientes con bloqueo auriculoventricular completo, se necesitan aproximadamente 2 min de acortamiento progresivo del intervalo QT hasta que se alcanza un nuevo estado de equilibrio; la duración de este intervalo es independiente de la magnitud del cambio de frecuencia y de la FC basal13,14. Otro estudio demostró que, cuando se reduce súbitamente la longitud de ciclo de estimulación, la duración del primer potencial de acción se acorta bruscamente, y se requieren varios minutos de adaptación hasta lograr el nuevo estado de equilibrio15. Según estas observaciones y teniendo en consideración que: a) la estimulación simpática relacionada con la bipedestación influye en el intervalo QT de manera independiente de la FC15; b) el cambio brusco de la FC es más importante que la FC máxima alcanzada, y c) pasa un tiempo relativamente largo hasta que se alcanza la adaptación del intervalo QT a su estado estable, se intentó corroborar los datos previos descritos por Viskin et al.5 realizando un único registro de ECG en bipedestación inmediatamente después de la desaparición de los artefactos causados por el movimiento. En el estudio de Viskin et al.5, el incremento máximo de la FC se produjo en los primeros 15 s de bipedestación, mientras que el ECG en nuestro protocolo se registró antes de los 10 s. Así pues, es probable que en algunos pacientes el ECG se realizó antes de que se alcanzara la FC máxima, lo cual subraya la importancia de la estimulación simpática y el cambio brusco de la FC mencionados anteriormente.
En el grupo de control del presente estudio, la prolongación del intervalo QTc en respuesta a la bipedestación fue inferior a la descrita en estudios previos6,7. Sin embargo, la rapidez con que el intervalo QT se adapta a los cambios de la FC es muy individual12. En cambio, los pacientes con SQTL mostraron un defecto marcado en la adaptación del intervalo QT a los cambios de la FC en comparación con los individuos del grupo de control. Los tests de provocación con infusión de catecolaminas, la prueba de esfuerzo y la respuesta a la bipedestación brusca pueden poner de manifiesto esta mala adaptación, y todos estos métodos resultan útiles para desenmascarar las formas ocultas de esta enfermedad que puede resultar mortal15. En condiciones normales, se prevé que la estimulación betaadrenérgica aumente la corriente neta repolarizante de salida, de modo que el incremento del componente lento activado por Ca2+ de la corriente de potasio rectificadora tardía (IKs) es mayor que el de la corriente de entrada, la corriente de intercambio de Na+/Ca2+ (INa-Ca), lo que da lugar a un acortamiento de la duración del potencial de acción y del intervalo QT. En el QTL1, un defecto de la IKs podría explicar que la estimulación betaadrenérgica no acortara la duración del potencial de acción ni, por lo tanto, el intervalo QT, y causaara una prolongación persistente y paradójica del QT en presencia de la estimulación simpática7. De los pacientes con QTL2, se ha descrito que la estimulación betaadrenérgica prolonga al inicio la duración del potencial de acción y el intervalo QT y después los acorta, probablemente por un aumento inicial de la corriente INa-Ca asociado a un defecto concomitante en el componente de activación rápida del canal de potasio rectificador tardío (IKr), que después se sigue de la estimulación de la corriente IKs16. Así pues, el intervalo QT medido inmediatamente después de la bipedestación sería equivalente a la fase inicial del test de adrenalina del protocolo de Shimizu, en la que tanto los pacientes con QTL1 como con QTL2 podrían mostrar una respuesta anormal del intervalo QT4. Estudios previos han descrito que los pacientes con QTL2 presentan en respuesta a la bipedestación una prolongación del intervalo QT mayor que aquellos con QTL15,6. Aunque las diferencias entre los subtipos de SQTL fueron menos marcadas en la presente cohorte, se observa también esta tendencia, que concuerda con la alta frecuencia de arritmias relacionadas con la aceleración súbita de la FC en los pacientes con QTL217. En este contexto, resulta adecuado plantear la hipótesis de que la activación rápida de la IKr en comparación con la IKs podría explicar la tendencia a una mayor prolongación del intervalo QT en los pacientes con QTL2. La IKs no está completamente activada inmediatamente después del cambio brusco de la FC en los individuos sanos, por lo que un defecto en este canal puede no ser del todo evidente en los pacientes con QTL1. Sin embargo, se observa en el presente trabajo que el grado de activación de la IKs inmediatamente después de la bipedestación bastaría para valorar una adaptación insuficiente del intervalo QT en el QTL1.
La corriente de potasio rectificadora de entrada (IK1), que es la causa del QTL7, también es sensible a la estimulación simpática18. El QTL7 (síndrome de Andersen-Tawil), un trastorno clínico raro en el que se combinan parálisis periódica sensible al potasio, intervalo QT largo y rasgos dismórficos, se ha relacionado con defectos en KCNJ2, el gen que codifica la IK1. El defecto de la corriente IK1 produce una prolongación homogénea de la duración del potencial de acción de los 3 tipos celulares del ventrículo (células epicárdicas, endocárdicas y M), por lo que prolonga el intervalo QT sin aumentar la dispersión transmural de la repolarización9. En presencia de una inhibición de la IK1, el isoproterenol produce un acortamiento de la duración del potencial de acción de las 3 capas celulares que empieza a ser significativa tras 3 min de infusión9, de tal manera que los pacientes con QTL7 podrían presentar una prolongación del intervalo QT con la bipedestación. Sin embargo, son necesarios estudios en poblaciones más amplias para establecer con más exactitud cuál es la respuesta de los pacientes con QTL7 a la bipedestación.
En los pacientes con SQTL es frecuente la presencia de patrones de segmento ST-onda T característicos que pueden ser útiles al cardiólogo para identificar el genotipo. Moss et al.19 y Dausse et al.20 fueron los primeros en describir una asociación de patrones específicos de la onda T con el QTL1 y el QTL2. Posteriormente, Zhang et al.11 analizaron a 284 portadores de mutaciones en genes de SQTL con objeto de determinar qué patrones de ST-onda T eran más frecuentes en cada subtipo de SQTL. La explicación fisiopatológica de este fenómeno reside en la diferente prolongación de la duración del potencial de acción en las células epicárdicas, endocárdicas y M en cada tipo de SQTL. En el presente estudio, se observó que las anomalías del ST-onda T se hacían más marcadas con la bipedestación en los pacientes que presentaban alteraciones morfológicas basales y que los pacientes con una morfología normal de la onda T basal sufrían anomalías con la bipedestación. En consecuencia, todos los pacientes con SQTL, incluidos aquellos con genotipo no identificado, tuvieron algún grado de alteración de la morfología de la onda T en respuesta a la bipedestación. En cambio, aunque el 25% de los controles mostraron ondas T de baja amplitud con la bipedestación, ninguno tuvo las anomalías típicas de ST-onda T descritas en los pacientes con SQTL.
En este trabajo se observó un aumento del intervalo QTc tras la bipedestación ligeramente inferior al observado en estudios previos, sobre todo en el grupo de control5,6. Esta diferencia podría explicarse por diferencias en los métodos de estudio, como el empleo de un solo ECG, que no siempre corresponde al intervalo QT durante el máximo QT stretching (momento en el que el final de la onda T se encuentra más próximo de la siguiente onda P). Así, en la presente cohorte, un punto de corte de 475 ms para el intervalo QTcbipedestación y de 46 ms para el ΔQTc mostró una especificidad del 100% y gran sensibilidad. La mayor especificidad en comparación con el estudio de Viskin et al.5 probablemente se deba al menor incremento del intervalo QTc observado en el grupo de control.
Como ya se ha indicado, la activación del sistema nervioso simpático en el SQTL causa prolongación del intervalo QT, dispersión transmural de la repolarización y arritmias ventriculares. Linker et al.21 describieron que, en los pacientes con SQTL que presentan una adaptación anormal del intervalo QTc, se produce una normalización de la dinámica del intervalo QT después del bloqueo betaadrenérgico. Estudios posteriores demostraron que el bloqueo betaadrenérgico reduce ligeramente el valor medio del intervalo QTc en pacientes con SQTL, pero produce una marcada supresión del incremento del intervalo QTc causado por la bipedestación, probablemente al reducir la dispersión espacial de la repolarización ventricular22-24. Concretamente, Walker et al.24 describieron en un grupo de 11 pacientes con QTL2 que, en la prueba de esfuerzo, el efecto del cambio postural en el intervalo QTc se atenúa. En este estudio, se respalda la hipótesis de que la adaptación del intervalo QTc a los cambios bruscos de la FC prácticamente se normaliza en los pacientes con SQTL en tratamiento con BB y se demuestra por primera vez que este efecto es uniforme en los diferentes tipos de SQTL que afectan a canales sensibles a la estimulación simpática (IKs, IKr e IK1). El efecto de los BB en el SQTL es secundario a diversos mecanismos, como la modulación directa de los canales de potasio, la inhibición de las posdespolarizaciones precoces, la reducción de la aceleración de la FC y los cambios bruscos de la FC, y la supresión de la prolongación del potencial de acción mediada por catecolaminas, especialmente en la capa de células M, que reduce la duración del potencial de acción24,25. Además, el bloqueo betaadrenérgico evita el efecto de la adrenalina en la morfología de la onda T25. En este contexto, se observó que la bipedestación brusca produce cambios en la morfología del ST-onda T similares a los documentados en otras pruebas de provocación y que estos cambios se normalizan con el tratamiento con BB.
Debido a que algunos pacientes no toleran dosis máximas de BB por sus efectos adversos, se desconoce si la dosis prescrita es segura para la prevención de eventos arrítmicos. Aunque el tratamiento con BB puede reducir ligeramente el intervalo QTc de los pacientes con SQTL en reposo22-24, resulta difícil determinar su dosis efectiva, en especial para los pacientes asintomáticos o con intervalo QT normal. Una prolongación significativa del intervalo QTc con la bipedestación refleja un aumento de la dispersión de la repolarización que podría incrementar el riesgo de arritmias. En este sentido, una respuesta no patológica a la bipedestación durante el tratamiento con BB podría asociarse con una mayor estabilidad eléctrica y, por lo tanto, indicar que la dosis administrada sería apropiada. En cambio, sería razonable aumentar la dosis de BB a los pacientes con una prolongación patológica del intervalo QTc con la bipedestación. Sin embargo, son necesarios estudios más amplios para determinar la relación entre la respuesta al test de bipedestación y los eventos arrítmicos en el seguimiento.
Limitaciones del estudioEntre las limitaciones del estudio, están el relativamente bajo número de pacientes evaluados y el significativo porcentaje de pacientes con SQTL con genotipo no identificado. Otra potencial limitación es que un único investigador realizara todas las mediciones del intervalo QT.
Aunque el QTL3 se asocia con defectos de los canales del sodio cardiacos, se requieren nuevos estudios para establecer la respuesta a la bipedestación en este tipo de SQTL. Por último, son fundamentales estudios de seguimiento a largo plazo para determinar si los pacientes tratados con BB y con una adaptación normal del QTc a la bipedestación brusca sufren menos eventos arrítmicos.
CONCLUSIONESEn los pacientes con SQTL se produce una adaptación anormal del QTc al cambio brusco de la FC causado por la bipedestación. Tanto el QTc después de la bipedestación como el ΔQTc mostraron altas sensibilidad y especificidad para la identificación de los pacientes con SQTL. Los patrones característicos de ST-onda T observados tras la bipedestación podrían ser útiles en la identificación del genotipo de los pacientes con SQTL. Finalmente, el bloqueo betaadrenérgico suprimió el incremento anormal del intervalo QTc tras la bipedestación que se observaba en los pacientes con SQTL previamente al tratamiento.
AGRADECIMIENTOSEste estudio ha sido financiado en parte por una subvención nacional del FIS (PI11/02459) y por la Red de Investigación Cardiovascular (RIC, RD12/0042/0049,29) del Instituto de Salud Carlos III-Unión Europea, Fondo Europeo de Desarrollo Regional, «Una manera de hacer Europa».
Los investigadores forman parte de la Red de Investigación Cardiovascular (RIC RD12/0042/0049) y del Instituto Murciano de Investigación Biosanitaria (IMIB), ambas del Instituto de Salud Carlos III. J.R. Gimeno Blanes forma parte del grupo clínico CIBERER (GCV14/ER/1).
CONFLICTO DE INTERESESNinguno.
- –
El diagnóstico del SQTL continúa siendo un verdadero reto clínico. Aunque las pruebas genéticas pueden confirmar el diagnóstico, requieren tiempo y que no se logre identificar una mutación no descarta la presencia de un SQTL. Además, los pacientes con SQTL con frecuencia tienen un QTc limíte o ligeramente prolongado que no se considera diagnóstico.
- –
Los pacientes con un SQTL congénito tienen una adaptación anormal del intervalo QT a la taquicardia brusca inducida por la bipedestación.
- –
Este estudio pone de manifiesto que el test de bipedestación podría ser útil en el diagnóstico de los pacientes con SQTL debido a alteración en las corrientes repolarizantes sensibles a la estimulación simpática (IKs, IKr e IK1).
- –
Tanto el intervalo QTcbipedestación como el ΔQTc muestran altas sensibilidad y especificidad para la identificación de pacientes con SQTL.
- –
Los patrones morfológicos de ST-onda T típicos se observan con frecuencia tras la bipedestación en los pacientes con SQTL, lo que puede aportar información útil para el diagnóstico y la identificación del genotipo de estos pacientes.
- –
Se describe que el bloqueo betaadrenérgico suprime la respuesta anormal del intervalo QTc a la bipedestación en diferentes tipos de SQTL que afectan a canales sensibles a la estimulación simpática.