Se ha demostrado el valor pronóstico de varios índices de resonancia magnética cardiaca a medio plazo tras un infarto agudo de miocardio con elevación del segmento ST. La extensión de la necrosis transmural permite una predicción simple y exacta de viabilidad miocárdica. Sin embargo, se desconoce su valor pronóstico a largo plazo más allá de una completa evaluación clínica y por resonancia. Nuestra hipótesis es que la evaluación semicuantitativa de la extensión de la necrosis transmural es el mejor índice de resonancia para predecir el pronóstico a largo plazo tras un infarto con elevación del segmento ST.
MétodosSe realizó un estudio cuantitativo con resonancia a 206 pacientes consecutivos tras un infarto con elevación del segmento ST. También se evaluó semicuantitativamente (número de segmentos alterados, modelo de 17 segmentos) edema, contractilidad basal y tras dobutamina, perfusión de primer paso, obstrucción microvascular y extensión de la necrosis transmural.
ResultadosDurante el seguimiento (mediana, 51 meses), 29 pacientes sufrieron un primer evento cardiaco adverso (8 muertes cardiacas, 11 infartos y 10 reingresos por insuficiencia cardiaca). Estos eventos se asociaron con mayor alteración de los índices de resonancia. Tras un ajuste multivariable, la extensión de la necrosis transmural fue el único índice de resonancia con asociación independiente con los eventos cardiacos adversos (razón de riesgos=1,34 [1,19-1,51] por cada segmento con necrosis transmural > 50%; p<0,001).
ConclusionesUn sencillo análisis semicuantitativo de la extensión de la necrosis transmural es el índice de resonancia cardiaca más potente para predecir el pronóstico a largo plazo tras un infarto agudo de miocardio con elevación del segmento ST.
Palabras clave
La resonancia magnética cardiaca (RMC) permite un análisis simultáneo de diversos índices cardiacos y ha pasado a ser la actual técnica no invasiva de referencia para la evaluación de las consecuencias estructurales del infarto agudo de miocardio con elevación del segmento ST (IAMCEST)1–4. Más allá de su valor diagnóstico bien demostrado, la firme validación de la utilidad pronóstica de esta técnica es un paso imprescindible antes de poder recomendar su uso generalizado en la práctica clínica habitual5.
Hasta el momento, hay varios índices de la RMC que han mostrado ya valor pronóstico a corto y medio plazo6–15. Sin embargo, son necesarias algunas precauciones al interpretar estos estudios. En primer lugar, todos se han limitado a un seguimiento de corto o medio plazo. En segundo lugar, la mayoría de los estudios se centraron en índices que consumen mucho tiempo, de gran interés en el campo de la investigación pero difíciles de aplicar en laboratorios de RMC atareados. En tercer lugar, no se ha introducido todavía un ajuste por los factores pronósticos del riesgo tradicionales ni por la amplia gama de índices cuantitativos y semicuantitativos de la RMC actualmente disponibles. Por último, la tendencia a resaltar la utilidad predictiva de índices individuales ha llevado a la existencia de multitud de parámetros de la RMC de los que se ha apuntado que predicen de manera independiente la evolución clínica del paciente inmediatamente después de un IAMCEST. Esto último podría inducir cierta confusión y desalentar a los clínicos a la hora de trasladar los resultados derivados de los registros a la práctica clínica.
Kim et al16 fueron los primeros en mostrar que la extensión de la necrosis transmural (ENT) es el índice de RMC que muestra una relación más intensa con la recuperación sistólica en los pacientes con isquemia crónica. Nosotros confirmamos, poco después del IAMCEST, que la ENT es el parámetro de RMC que se asocia de manera más potente no sólo con la recuperación sistólica, sino también con el pronóstico a medio plazo1,10,15. El paralelismo entre la captación tardía de gadolinio en la RMC y la extensión de miocardio necrótico es un fundamento fisiopatológico sólido que subyace a estas observaciones.
Nuestra hipótesis fue que una valoración semicuantitativa sencilla de la ENT, basada en el número de segmentos que muestran necrosis transmural, es el índice de RMC mejor y más apropiado para predecir los resultados a muy largo plazo tras un IAMCEST, incluso tras un ajuste detallado por variables clínicas, electrocardiográficas, bioquímicas y de RMC cuantitativas y semicuantitativas.
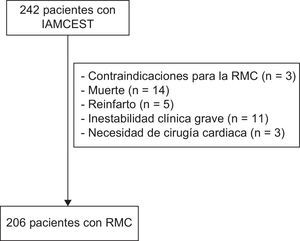
MATERIAL Y MÉTODOSGrupo de estudioEntre enero de 2004 y diciembre de 2006, se incluyó prospectivamente en el estudio a 242 pacientes consecutivos ingresados con un primer IAMCEST en un hospital universitario de nivel terciario. Los criterios de exclusión fueron: contraindicaciones para la RMC (n=3), muerte (n=14), reinfarto (n=5), inestabilidad clínica grave (n=11) y necesidad de cirugía cardiaca (n=3) durante el ingreso. En consecuencia, formaron el grupo de estudio 206 pacientes sin complicaciones graves durante el ingreso (fig. 1).
El comité de ética local autorizó el protocolo de investigación. Se obtuvo el consentimiento informado por escrito de todos los participantes.
Tratamiento de reperfusiónLa estrategia de reperfusión y el tratamiento médico se dejaron a criterio de los cardiólogos encargados de los pacientes.
Se llevó a cabo angioplastia primaria a 51 (25%) pacientes. Se utilizó una estrategia farmacológica-invasiva con 122 pacientes (59%): se administraban fármacos trombolíticos y, si se cumplían los criterios de reperfusión (100 pacientes), en caso necesario se realizaban cateterismo electivo y angioplastia en las primeras 24h. Se llevó a cabo angioplastia de rescate a 22 pacientes por reperfusión ineficaz después del tratamiento trombolítico.
Un total de 34 pacientes (17%) no recibieron tratamiento con ninguna estrategia de reperfusión en las primeras 12h, debido a su presentación tardía. A todos ellos se les realizó en caso necesario cateterismo electivo y angioplastia, en las primeras 24h (tabla 1).
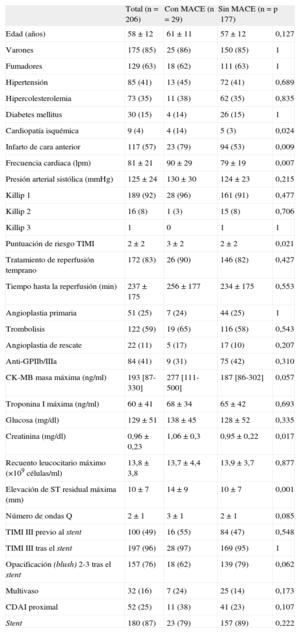
Características clínicas, electrocardiográficas, bioquímicas y angiográficas del conjunto del grupo de estudio y de los pacientes con y sin eventos adversos cardiovasculares mayores
| Total (n=206) | Con MACE (n=29) | Sin MACE (n=177) | p | |
| Edad (años) | 58±12 | 61±11 | 57±12 | 0,127 |
| Varones | 175 (85) | 25 (86) | 150 (85) | 1 |
| Fumadores | 129 (63) | 18 (62) | 111 (63) | 1 |
| Hipertensión | 85 (41) | 13 (45) | 72 (41) | 0,689 |
| Hipercolesterolemia | 73 (35) | 11 (38) | 62 (35) | 0,835 |
| Diabetes mellitus | 30 (15) | 4 (14) | 26 (15) | 1 |
| Cardiopatía isquémica | 9 (4) | 4 (14) | 5 (3) | 0,024 |
| Infarto de cara anterior | 117 (57) | 23 (79) | 94 (53) | 0,009 |
| Frecuencia cardiaca (lpm) | 81±21 | 90±29 | 79±19 | 0,007 |
| Presión arterial sistólica (mmHg) | 125±24 | 130±30 | 124±23 | 0,215 |
| Killip 1 | 189 (92) | 28 (96) | 161 (91) | 0,477 |
| Killip 2 | 16 (8) | 1 (3) | 15 (8) | 0,706 |
| Killip 3 | 1 | 0 | 1 | 1 |
| Puntuación de riesgo TIMI | 2±2 | 3±2 | 2±2 | 0,021 |
| Tratamiento de reperfusión temprano | 172 (83) | 26 (90) | 146 (82) | 0,427 |
| Tiempo hasta la reperfusión (min) | 237±175 | 256±177 | 234±175 | 0,553 |
| Angioplastia primaria | 51 (25) | 7 (24) | 44 (25) | 1 |
| Trombolisis | 122 (59) | 19 (65) | 116 (58) | 0,543 |
| Angioplastia de rescate | 22 (11) | 5 (17) | 17 (10) | 0,207 |
| Anti-GPIIb/IIIa | 84 (41) | 9 (31) | 75 (42) | 0,310 |
| CK-MB masa máxima (ng/ml) | 193 [87-330] | 277 [111-500] | 187 [86-302] | 0,057 |
| Troponina I máxima (ng/ml) | 60±41 | 68±34 | 65±42 | 0,693 |
| Glucosa (mg/dl) | 129±51 | 138±45 | 128±52 | 0,335 |
| Creatinina (mg/dl) | 0,96±0,23 | 1,06±0,3 | 0,95±0,22 | 0,017 |
| Recuento leucocitario máximo (×109 células/ml) | 13,8±3,8 | 13,7±4,4 | 13,9±3,7 | 0,877 |
| Elevación de ST residual máxima (mm) | 10±7 | 14±9 | 10±7 | 0,001 |
| Número de ondas Q | 2±1 | 3±1 | 2±1 | 0,085 |
| TIMI III previo al stent | 100 (49) | 16 (55) | 84 (47) | 0,548 |
| TIMI III tras el stent | 197 (96) | 28 (97) | 169 (95) | 1 |
| Opacificación (blush) 2-3 tras el stent | 157 (76) | 18 (62) | 139 (79) | 0,062 |
| Multivaso | 32 (16) | 7 (24) | 25 (14) | 0,173 |
| CDAI proximal | 52 (25) | 11 (38) | 41 (23) | 0,107 |
| Stent | 180 (87) | 23 (79) | 157 (89) | 0,222 |
CDAI: arteria coronaria descendente anterior izquierda; CK-MB: fracción MB de la creatincinasa; GPIIb/IIIa: glucoproteína IIb/IIIa; MACE: eventos adversos cardiovasculares mayores; TIMI: Thrombolysis In Myocardial Infarction.
Los datos expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Un observador experimentado que no conocía los resultados de la RMC determinó offline el grado TIMI (Thrombolysis In Myocardial Infarction) del flujo y el grado de opacificación (blush) miocárdica, usando el programa informático Integris HM3000 (Philips; Best, Países Bajos). Se consideró normales el flujo de grado TIMI 3 y el blush miocárdico de grado 2–317.
Características clínicas, bioquímicas y electrocardiográficasSe registraron las características basales. Se calculó la puntuación de riesgo TIMI para el IAMCEST de todos los pacientes, como variable sustitutiva indirecta del riesgo clínico basal18. Se determinó el valor máximo de troponina I, el recuento leucocitario máximo y las concentraciones de glucosa y creatinina al ingreso. Se determinó el número de ondas Q y la elevación del segmento ST residual máxima (determinada mediante la suma de la elevación del segmento ST tras la reperfusión en las derivaciones V1–V6, I y aVL para el infarto de cara anterior y en las derivaciones II, III, aVF, V5 y V6 para el infarto no localizado en cara anterior).
Resonancia magnética cardiacaA los 7±2 días del IAMCEST, se realizó una RMC (escáner de 1,5 T, Sonata Magnetom, Siemens; Erlangen, Alemania) aplicando el protocolo de nuestro laboratorio2,10,15,19,20, tal como se describe en el material adicional.
Un evaluador experimentado, que no conocía ningún dato del paciente, analizó las exploraciones de RMC offline con un programa informático específicamente adaptado para ello (QMASS MR 6.1.5, Medis; Leiden, Países Bajos). Se determinaron los índices de RMC cuantitativamente (tal como se define más adelante) y semicuantitativamente (utilizando el número de segmentos alterados en el modelo de 17 segmentos)21. Los valores de corte utilizados para considerar que las anomalías eran extensas se establecieron en función de las curvas de características operativas del receptor para la predicción de los eventos adversos cardiovasculares mayores (MACE).
EdemaSe determinó cuantitativamente, mediante definición manual, el porcentaje de la masa del ventrículo izquierdo (VI) que mostraba edema, manifestado por un área miocárdica con una intensidad de señal > 2 desviaciones estándar por encima de la señal del miocardio distal sin infarto en las secuencias con ponderación T2. En la evaluación semicuantitativa, se determinó el número de segmentos con edema. Se consideró que había edema extenso si se detectaba en más de seis segmentos.
Anomalías del movimiento de la paredSe determinaron cuantitativamente los índices de volumen telediastólico y telesistólico (ml/m2), la masa indexada del VI (g/m2) y la fracción de eyección del VI (FEVI, %). Se definió la disfunción sistólica según los valores de corte establecidos para la FEVI según el sexo, la superficie corporal y la edad22. En la evaluación semicuantitativa, se registró el número de segmentos con anomalías del movimiento de la pared (AMP): hipocinesia, acinesia o discinesia. La AMP se consideró extensa si se daba en más de seis segmentos.
Anomalías del movimiento de la pared-dobutaminaSe determinó cuantitativamente la FEVI durante una infusión de dobutamina en dosis bajas (FEVI-dobutamina, %). En la evaluación semicuantitativa, se determinó el número de segmentos con AMP durante la infusión de dobutamina en dosis bajas. La AMP-dobutamina se consideró extensa si se daba en más de seis segmentos.
Perfusión de primer paso anormalEste índice se definió cualitativamente como un miocardio que mostraba hipocaptación de contraste al final del periodo de adquisición en las imágenes de perfusión de primer paso. Se evaluó semicuantitativamente el número de segmentos con perfusión de primer paso anormal. Se consideró que había perfusión de primer paso anormal extensa si se detectaba en más de dos segmentos.
Obstrucción microvascularSe determinó cuantitativamente el porcentaje de masa del VI que mostraba obstrucción microvascular, definida como la falta de captación de contraste rodeada por un tejido que mostraba captación tardía del gadolinio. En la evaluación semicuantitativa, se consideró el número de segmentos con obstrucción microvascular. Se consideró que había obstrucción microvascular extensa si se detectaba en más de cuatro segmentos.
Extensión de la necrosis transmuralSe consideró que había necrosis transmural cuando más del 50% del grosor de la pared miocárdica mostraba captación tardía de gadolinio (definida como una intensidad de señal > 2 desviaciones estándar por encima de la señal del miocardio distal no infartado). Se determinó cuantitativamente el tamaño del infarto mediante definición manual, como porcentaje de la masa del VI que mostraba captación tardía de gadolinio y el índice de miocardio salvado como porcentaje de la masa del VI con edema que no mostraba captación tardía de gadolinio. En la evaluación semicuantitativa, se valoró la ENT como el número de segmentos con necrosis transmural en el modelo de 17 segmentos. Se consideró que había necrosis transmural si se detectaba en más de seis segmentos.
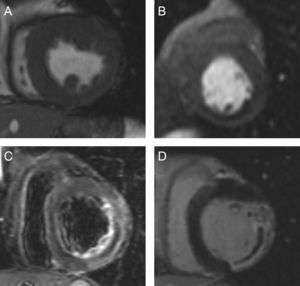
En la figura 2 se muestran los diversos índices de RMC cuantitativos y semicuantitativos determinados. Se había analizado previamente la variabilidad intraobservador de nuestro laboratorio, que resulta < 5% para todos los índices15.
Índices cuantitativos y semicuantitativos evaluados en el presente estudio. A: Imágenes de cine: volúmenes telediastólico y telesistólico indexados (ml/m2); masa del ventrículo izquierdo (g/m2); fracción de eyección del ventrículo izquierdo (%); fracción de eyección del ventrículo izquierdo-dobutamina (%); grosor de la pared (mm); anomalías del movimiento de la pared (segmentos); anomalías del movimiento de la pared-dobutamina (segmentos). B: Perfusión de primer paso: perfusión de primer paso anormal (segmentos). C: Imágenes con ponderación en T2: edema (% de masa del ventrículo izquierdo); edema (segmentos). D: Imágenes con captación de contraste tardía: tamaño del infarto (%); obstrucción microvascular (% de masa del ventrículo izquierdo); necrosis transmural (segmentos); obstrucción microvascular (segmentos); índice de miocardio salvado (%).
El objetivo de valoración final fueron los MACE, definidos como muerte cardiaca, ingreso por infarto de miocardio no mortal o ingreso por insuficiencia cardiaca, lo que se produjera antes. La muerte cardiaca se definió como muerte por infarto agudo de miocardio, insuficiencia cardiaca congestiva, arritmias o parada cardiaca súbita inesperada. El infarto de miocardio23 y la insuficiencia cardiaca24 se definieron según criterios de definición actuales.
Realizaron el seguimiento dos cardiólogos y dos enfermeras especializadas, con al menos una de las tres fuentes de información siguientes: a) clínica ambulatoria; b) entrevista telefónica con el paciente o su familia, o c) examen de la historia clínica hospitalaria del paciente. Se exigió el consenso de los dos cardiólogos para la adjudicación final de un evento.
Análisis estadísticoSe utilizó la prueba de Kolmogorov-Smirnov para evaluar la distribución normal de los datos continuos. Las variables de distribución normal se expresaron en forma de media±desviación estándar y se compararon con la prueba de la t de Student para datos no apareados. Las variables sin distribución normal se expresaron en forma de mediana [intervalo intercuartílico] y se compararon con la prueba de la U de Mann-Whitney. Las variables dicotómicas se expresaron en forma de porcentajes y se compararon con la prueba de la χ2 o la exacta de Fisher, según fuera apropiado. Se estimaron las distribuciones de supervivencia para el tiempo hasta el evento mediante el método de Kaplan-Meier y log rank test.
La asociación de las variables con los MACE se evaluó con modelos multivariables de regresión de riesgos proporcionales de Cox. Los modelos multivariables para predecir los MACE se ajustaron por las variables identificadas mediante la comparación de los pacientes que sufrieron MACE durante el seguimiento con los pacientes que no; las variables con p<0,2 en los análisis univariables se incluyeron en los modelos de regresión como cofactores. Se calcularon las razones de riesgos (HR) con los correspondientes intervalos de confianza del 95% (IC95%).
Con objeto de evaluar el valor pronóstico adicional de los índices de RMC respecto a la estratificación del riesgo tradicional, determinamos el estadístico C y la −2 log probabilidad de un modelo multivariado que incluía las variables clínicas, electrocardiográficas, bioquímicas y angiográficas, junto con la FEVI calculada mediante la RMC (que, en general, está disponible en todos los pacientes con IAMCEST mediante el uso de ecocardiografía). Determinamos entonces el estadístico C y la probabilidad –2 log del modelo multivariable final, que incluía también todos los índices de RMC. Exploramos, asimismo, el efecto pronóstico de la ENT, basándonos en el análisis de cuartiles. Se evaluó el riesgo de MACE en todo el espectro continuo de valores del número de segmentos con necrosis transmural en un contexto polinómico fraccional multivariable (4 grados de libertad).
Un valor bilateral de p<0,05 se consideró indicativo de una diferencia estadísticamente significativa. Se utilizó el programa informático SPSS versión 13.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos) y el programa STATA 11.1 (StataCorp. 2009. Stata Statistical Software: Release 11. College Station, Texas: StataCorp LP, Estados Unidos).
RESULTADOSDurante una mediana de seguimiento de 51 meses (intervalo, 40-74), se detectaron 39 MACE en 29 pacientes, incluidas 12 muertes cardiacas, 15 infartos de miocardio no mortales y 12 reingresos por insuficiencia cardiaca. El primer evento en los 29 pacientes que sufrieron un MACE fue la muerte en 8 pacientes, el infarto de miocardio no mortal en 11 y el reingreso por insuficiencia cardiaca en 10.
Los pacientes con MACE presentaron una tasa superior de miocardiopatía isquémica previa, frecuencia cardiaca más elevada al ingreso, infarto de miocardio de cara anterior, peor perfil de riesgo clínico derivado de la puntuación de riesgo TIMI, mayor elevación residual del segmento ST y valores de creatinina más altos. En la tabla 1 se presentan las variables clínicas, electrocardiográficas, bioquímicas y de cateterismo cardiaco del conjunto del grupo de estudio y de los pacientes con y sin MACE.
Eventos adversos cardiovasculares mayores y datos de resonancia magnética cardiaca. Análisis univariableEn la tabla 2 se presentan las características de RMC del conjunto del grupo en estudio y de los pacientes con o sin MACE.
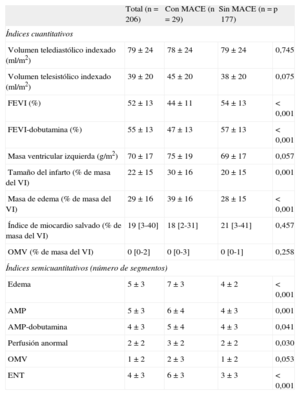
Características de la resonancia magnética cardiaca en el grupo total del estudio y los pacientes con y sin eventos adversos cardiovasculares mayores
| Total (n = 206) | Con MACE (n=29) | Sin MACE (n=177) | p | |
| Índices cuantitativos | ||||
| Volumen telediastólico indexado (ml/m2) | 79±24 | 78±24 | 79±24 | 0,745 |
| Volumen telesistólico indexado (ml/m2) | 39±20 | 45±20 | 38±20 | 0,075 |
| FEVI (%) | 52±13 | 44±11 | 54±13 | < 0,001 |
| FEVI-dobutamina (%) | 55±13 | 47±13 | 57±13 | < 0,001 |
| Masa ventricular izquierda (g/m2) | 70±17 | 75±19 | 69±17 | 0,057 |
| Tamaño del infarto (% de masa del VI) | 22±15 | 30±16 | 20±15 | 0,001 |
| Masa de edema (% de masa del VI) | 29±16 | 39±16 | 28±15 | < 0,001 |
| Índice de miocardio salvado (% de masa del VI) | 19 [3-40] | 18 [2-31] | 21 [3-41] | 0,457 |
| OMV (% de masa del VI) | 0 [0-2] | 0 [0-3] | 0 [0-1] | 0,258 |
| Índices semicuantitativos (número de segmentos) | ||||
| Edema | 5±3 | 7±3 | 4±2 | < 0,001 |
| AMP | 5±3 | 6±4 | 4±3 | 0,001 |
| AMP-dobutamina | 4±3 | 5±4 | 4±3 | 0,041 |
| Perfusión anormal | 2±2 | 3±2 | 2±2 | 0,030 |
| OMV | 1±2 | 2±3 | 1±2 | 0,053 |
| ENT | 4±3 | 6±3 | 3±3 | < 0,001 |
AMP: anomalías de movimiento de la pared; ENT: extensión de la necrosis transmural; FEVI: fracción de eyección del ventrículo izquierdo; MACE: eventos adversos cardiovasculares mayores; OMV: obstrucción microvascular; VI: ventrículo izquierdo.
Los datos expresan media±desviación estándar o mediana [intervalo intercuartílico].
Por lo que respecta a los índices de RMC cuantitativos, los pacientes con MACE mostraron mayor depresión de la FEVI, menor FEVI-dobutamina, mayor tamaño del infarto, mayor porcentaje de masa del VI con edema y tendencia a valores del índice de volumen telesistólico superiores y mayor masa del VI (tabla 2).
En cuanto a los índices de RMC semicuantitativos, los pacientes con MACE presentaron mayor extensión (número de segmentos) de los seis índices de RMC evaluados: edema, AMP, AMP-dobutamina, perfusión de primer paso anormal, obstrucción microvascular y necrosis transmural (tabla 2).
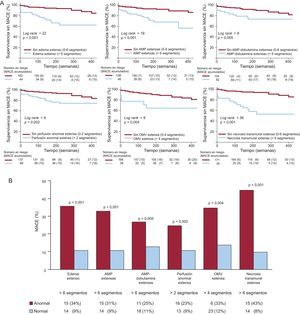
Se detectaron anomalías extensas en los índices semicuantitativos de la siguiente forma: edema en 44 pacientes (21%), AMP en 48 (23%), AMP-dobutamina en 44 (21%), perfusión de primer paso anormal en 69 (33%), obstrucción microvascular en 18 (9%) y ENT en 35 (17%). La presencia de anomalías extensas en todos los índices de RMC evaluados mostró una relación significativa con mayor probabilidad de MACE durante el seguimiento (p<0,01 para todas las comparaciones) (fig. 3).
A: curvas de Kaplan-Meier de los pacientes con y sin anomalías importantes de los índices semicuantitativos evaluados. B: tasas de eventos adversos cardiovasculares mayores de los pacientes con y sin anomalías importantes de los índices semicuantitativos evaluados. AMP: anomalías del movimiento de la pared; MACE: eventos adversos cardiovasculares mayores; OMV: obstrucción microvascular.
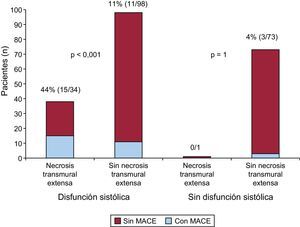
La tasa de MACE fue del 20% en los pacientes con disfunción sistólica y del 4% en los pacientes sin disfunción sistólica (p=0,001). De los pacientes con disfunción sistólica, aquellos con ENT presentaron una tasa de MACE superior a la de los pacientes sin ENT (el 44 frente al 11%; p<0,001). Por el contrario, entre los pacientes sin disfunción sistólica, la tasa de MACE no fue diferente en los subgrupos de pacientes con y sin ENT (0 frente al 4%; p=1). Esto se ilustra también en la figura 4.
Número de pacientes con y sin eventos adversos cardiovasculares mayores según la presencia de disfunción sistólica y necrosis transmural extensa. En los pacientes sin disfunción sistólica, a diferencia del grupo de pacientes con disfunción sistólica, los eventos adversos cardiovasculares mayores fueron muy poco frecuentes y no estuvieron relacionados con la presencia de una necrosis transmural extensa. La disfunción sistólica se definió según el valor de corte establecido para edad, sexo y superficie corporal. MACE: eventos adversos cardiovasculares mayores.
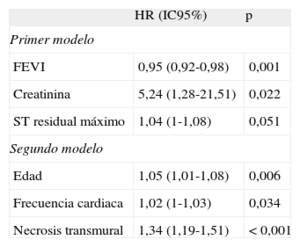
Las variables para las que se indica un valor de p<0,2 en la tabla 1, junto con la FEVI derivada de la RMC, se evaluaron en un primer análisis multivariable, incluyendo datos empleados convencionalmente en una estratificación del riesgo tras IAMCEST a largo plazo. Con este enfoque, las variables asociadas de manera independiente a los MACE fueron: FEVI, concentración de creatinina y elevación residual máxima del segmento ST (tabla 3). El estadístico C del modelo resultante fue 0,75 [0,66-0,85].
Análisis multivariable
| HR (IC95%) | p | |
| Primer modelo | ||
| FEVI | 0,95 (0,92-0,98) | 0,001 |
| Creatinina | 5,24 (1,28-21,51) | 0,022 |
| ST residual máximo | 1,04 (1-1,08) | 0,051 |
| Segundo modelo | ||
| Edad | 1,05 (1,01-1,08) | 0,006 |
| Frecuencia cardiaca | 1,02 (1-1,03) | 0,034 |
| Necrosis transmural | 1,34 (1,19-1,51) | < 0,001 |
FEVI: fracción de eyección del ventrículo izquierdo; HR: razón de riesgos; IC95%: intervalo de confianza del 95%.
El primer modelo incluyó los parámetros edad, infarto de miocardio de cara anterior, frecuencia cardiaca, puntuación de riesgo Thrombolysis in Myocardial Infarction, creatinina, masa máxima de la fracción MB de la creatincinasa, elevación residual máxima del segmento ST, número de ondas Q, opacificación (blush) 2-3 tras stent, afección de la arteria descendente anterior izquierda proximal y FEVI. El estadístico C del modelo resultante fue 0,75 [0,66-0,85]. El segundo modelo incluyó las mismas variables que el primero y todos los índices de resonancia magnética cardiaca determinados. El estadístico C del modelo final fue 0,83 [0,75-0,91]. El estadístico de probabilidad –2 log fue significativamente inferior en el segundo modelo (258,3 frente a 268; p < 0,005).
En un segundo análisis multivariable exhaustivo, incluimos todas las variables evaluadas en el primer modelo, así como los parámetros de la RMC que mostraban un valor de p<0,2. Junto con la edad más avanzada y la mayor frecuencia cardiaca al ingreso, la evaluación semicuantitativa de la ENT fue el único índice de RMC asociado de manera independiente a los MACE (HR=1,34; IC95%, 1,19-1,51; p<0,001) (tabla 3). El estadístico C del modelo final fue de 0,83 [0,75–0,91]. El estadístico de probabilidad –2 log fue significativamente inferior en el segundo modelo (258,3 frente a 268; p<0,005), lo cual indica que la ENT aportaba información pronóstica adicional a muy largo plazo, más allá de la proporcionada por las variables pronósticas tradicionales.
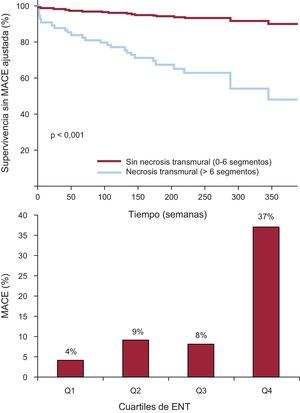
Así, la evaluación semicuantitativa de la ENT resultó ser la variable asociada de manera más potente a los MACE tras IAMCEST a muy largo plazo. Las curvas de supervivencia ajustadas mostraron diferencias notables desde las primeras semanas del seguimiento al comparar a pacientes con y sin ENT (fig. 5). Se observó un aumento constante de la tasa de MACE al clasificar la ENT en cuartiles (número de segmentos con necrosis transmural > 50%) (fig. 5).
A: supervivencia sin eventos adversos cardiovasculares mayores ajustada en pacientes con y sin necrosis transmural extensa. B: tasa de eventos adversos cardiovasculares mayores según los cuartiles de extensión de la necrosis transmural: Q1, < 3 segmentos; Q2, 3 segmentos; Q3, 4–5 segmentos, y Q4, > 6 segmentos. ENT: extensión de la necrosis transmural; MACE: eventos adversos cardiovasculares mayores.
Al analizar el riesgo de MACE a lo largo del espectro continuo del número de segmentos con necrosis transmural, observamos que el riesgo atribuible a la ENT mostraba un gradiente lineal (figura del material adicional).
DISCUSIÓNEl principal resultado del presente estudio es que un índice sencillo, intuitivo y de determinación poco laboriosa, basado en una evaluación semicuantitativa de la ENT, predice de manera independiente la evolución clínica a muy largo plazo de los pacientes con IAMCEST, incluso tras un ajuste detallado respecto a la amplia gama de factores pronósticos clínicos, electrocardiográficos, bioquímicos y angiográficos, así como respecto a diversos índices de RMC cuantitativos y semicuantitativos.
El seguimiento (mediana, > 4 años) es, con mucho, el más largo que se haya descrito. Realizamos una evaluación detallada de la RMC que incluyó una amplia gama de índices cuantitativos laboriosos, junto con algunos parámetros semicuantitativos sencillos e intuitivos basados en el número de segmentos que muestran anomalías; es de destacar que incluimos en nuestro análisis la respuesta a dosis bajas de dobutamina, que es un predictor sólido de la recuperación sistólica en los pacientes con IAMCEST que no se ha tenido en cuenta en la mayoría de los estudios previos. Se aplicó también un ajuste respecto a las variables clínicas basales y derivadas de la puntuación TIMI y respecto a las variables electrocardiográficas, bioquímicas y angiográficas.
Estudios previosIndudablemente, la función sistólica es un factor predictivo importante de la evolución clínica después del infarto. Tal como indican los conocimientos existentes al respecto, los pacientes con disfunción sistólica de nuestro estudio presentaron una tasa de MACE más alta. En los pacientes revascularizados, la FEVI puede presentar cambios muy importantes en los meses siguientes a un IAMCEST, lo que puede tener una notable influencia en la evolución clínica del paciente. Así pues, el fundamento del uso de técnicas de imagen adicionales, como la RMC, no está sólo en la identificación de índices que permitan predecir de manera fiable la recuperación sistólica, sino también en examinar detalladamente el valor pronóstico de esos índices.
Paralelamente a lo que indican estudios recientemente publicados, nuestros datos confirman que, por separado, todos los índices cuantitativos y semicuantitativos de la RMC evaluados aportan información pronóstica después de un IAMCEST.
La presencia de un edema miocárdico aporta información sobre unas características únicas respecto a la extensión del área en riesgo durante la oclusión coronaria. Recientemente se ha incorporado este aspecto al conjunto de parámetros que utilizamos, y su evaluación solamente puede realizarse mediante una RMC19,20. Los datos sobre el valor pronóstico del edema en los pacientes con IAMCEST son escasos. Al comparar el área en riesgo con el tamaño final del infarto, Eitel et al11 han descrito que un valor superior del índice de miocardio salvado se asocia a mejor pronóstico de los pacientes con IAMCEST. En nuestro estudio, una mayor extensión del edema se asoció a peor pronóstico, pero no fue así en cambio en el caso del índice de miocardio salvado. Lo que puede subyacer al bajo valor predictivo de este índice es que algunos pacientes presenten un área en riesgo enorme y, a pesar del alto índice de miocardio salvado, el infarto resultante pueda continuar siendo grande.
La utilidad de AMP-dobutamina para predecir la recuperación sistólica y el pronóstico se abordó de manera bien fundamentada con la ecocardiografía de estrés. Aunque la excelente resolución espacial de la RMC permite realizar una evaluación exacta de la reserva contráctil, la prolongación de las exploraciones, junto con la necesidad de fármacos inotrópicos en un entorno insuficientemente monitorizado, comporta algunos inconvenientes. Aunque en el análisis univariable un menor grado de reserva contráctil predijo una mayor tasa de MACE, las dificultades citadas, junto con el hecho de que la ENT supere la información predictiva de la AMP-dobutamina, indican claramente limitar el uso de este método a casos seleccionados.
La RMC permite estudiar la perfusión microvascular1,2,6,7,10,12,25, ya sea empleando perfusión de primer paso o secuencias de captación de contraste de gadolinio tardía. Wu et al6, en un grupo pequeño de 44 pacientes, mostraron el valor pronóstico de un paso intermedio de 1-2min tras la infusión del contraste. De Waha et al12 señalaron que la obstrucción microvascular (basada en técnicas de imagen con captación tardía de contraste de gadolinio) es un factor pronóstico independiente después del IAMCEST. Hombach et al7 obtuvieron resultados similares en un grupo heterogéneo en el que había pacientes con IAMCEST e infarto agudo de miocardio sin elevación del segmento ST. En los análisis univariables, nuestros resultados confirman la asociación entre la perfusión microvascular anormal y la tasa más alta de MACE, pero este índice no se asocia de manera independiente al pronóstico en un análisis multivariable, de modo similar a lo indicado por otros estudios11,14. Esto podría explicarse en parte por el hecho de que algunos casos con obstrucción microvascular presentan un área de infarto pequeña, con escasa trascendencia pronóstica (p. ej., en el caso de reperfusión tardía de una rama marginal). Además, esto pone de relieve la potencia predictiva del enfoque sencillo utilizado en este estudio para cuantificar la ENT, que considera simultáneamente la extensión y la transmuralidad del área infartada.
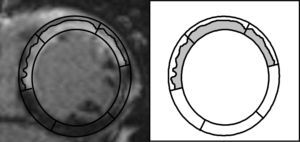
Implicaciones del presente estudioEn una perspectiva a muy largo plazo y tras un ajuste detallado —no sólo para los factores pronósticos tradicionales, sino también para la amplia gama de índices de RMC actualmente utilizados—, hemos confirmado que una evaluación semicuantitativa de la ENT es el parámetro de RMC que se asocia de manera más intensa al pronóstico de los pacientes con IAMCEST. Desde un punto de vista fisiopatológico, esta observación podría deberse probablemente a que este índice engloba información relevante sobre: a) transmuralidad (todos los segmentos incluidos en este índice muestran > 50% de necrosis transmural), y b) extensión de la necrosis (un mayor número de segmentos alterados indica obviamente un infarto transmural más extenso) (fig. 6).
Desde un punto de vista práctico, estos resultados aportan ventajas claras. La evaluación semicuantitativa de la ENT se puede interpretar de manera rápida y exacta por observadores experimentados. Aun después de un ajuste por diversas variables de la RMC de evaluación laboriosa, este índice sencillo resultó ser el factor pronóstico de RMC más fiable. Así pues teniendo en cuenta: a) la fuerte asociación fisiopatológica con la extensión de la necrosis miocárdica; b) la utilidad claramente demostrada en la predicción de la recuperación sistólica tardía; c) el valor pronóstico a muy largo plazo, y finalmente d) su simplicidad, la ENT puede llegar a ser un elemento clave en la evaluación mediante RMC de los pacientes tras un IAMCEST. Así pues, en esta situación, lo más sencillo es lo mejor. El valor de corte de la ENT > 6 segmentos indica que alrededor del 30% de la masa del VI parece constituir el mejor valor de corte para la predicción de los MACE. Nosotros hemos descrito anteriormente que un valor de corte similar (> 5 segmentos) predijo mejor los resultados clínicos en un seguimiento a medio plazo10.
Sin embargo, en una época de restricciones presupuestarias, la RMC puede no estar disponible para todos los pacientes. Nuestros resultados indican que, para los fines del pronóstico a muy largo plazo, la FEVI es un instrumento sencillo que permite identificar a los pacientes que pueden obtener mayor beneficio de una RMC poco después de sufrir un IAMCEST. Mientras que, en general, los pacientes revascularizados con una FEVI preservada tienen un pronóstico a muy largo plazo excelente (tasa de MACE del 4% en nuestra serie), los resultados clínicos en los pacientes con depresión de la FEVI son diversos. Según lo indicado por nuestros resultados, estos constituyen el subgrupo de pacientes en que una RMC obtenida poco después del IAMCEST puede establecer de manera más eficiente el pronóstico sobre los resultados clínicos a muy largo plazo: en los pacientes con FEVI deprimida, la tasa de MACE fue 4 veces superior (el 44 frente al 11%) en los casos de ENT amplia.
Limitaciones del estudioAunque este estudio constituye la serie más amplia de pacientes con seguimiento a largo plazo, el escaso número de eventos explica las pequeñas variaciones del mejor valor de corte de los parámetros de RMC para la predicción de los eventos en comparación con nuestros datos previos, en los que se analizó el seguimiento a corto y medio plazo10. Esto explica también por qué, además de la potente significación pronóstica de la ENT, los factores independientes predictivos de MACE varían en función de las variables incluidas en el análisis multivariable. El uso casi universal de la revascularización percutánea previa al alta, junto con la exclusión de los casos que sufren eventos clínicos en el hospital o que presentan inestabilidad hemodinámica grave, puede explicar esta baja tasa de MACE. Las futuras oportunidades terapéuticas derivadas de nuestros resultados requerirán nuevos estudios y el uso de grupos de estudio más amplios.
CONCLUSIONESUn análisis semicuantitativo sencillo y poco laborioso de la ENT es el índice de RMC que se asocia de manera más intensa con los resultados clínicos a muy largo plazo tras un primer episodio de IAMCEST, incluso después de introducir un ajuste para una amplia gama de parámetros clínicos, electrocardiográficos, bioquímicos, angiográficos y de RMC cuantitativos y semicuantitativos. Los pacientes con depresión de la FEVI constituyen un subgrupo de casos que, por lo que respecta a la determinación del pronóstico, obtienen el máximo beneficio del análisis de este parámetro.
FINANCIACIÓNEste estudio se financió con subvenciones de FIS PI11/02323, Microcluster Protección Cardiovascular VLC-Campus of Excellence, Fundació Gent per Gent, Ayuda para Grupos Emergentes INCLIVA.
CONFLICTO DE INTERESESNinguno.