Diferentes estudios han demostrado el valor diagnóstico y pronóstico de la resonancia magnética cardiaca (RMC) de estrés en pacientes con cardiopatía isquémica. No obstante, la evidencia en ancianos es escasa, en parte por las limitaciones de las técnicas diagnósticas disponibles para esta población. El objetivo de este estudio es evaluar la utilidad de la RMC de estrés en pacientes ancianos.
MétodosSe estudió de manera prospectiva a los pacientes remitidos a una RMC de estrés para descartar isquemia miocárdica. Se consideró paciente anciano a los mayores de 70 años. El estudio de RMC de estrés se realizó conforme a los protocolos internacionales. La gravedad de la hipoperfusión se clasificó en función de los segmentos afectados: ligera (1-2 segmentos), moderada (3-4 segmentos) o grave (> 4 segmentos). Se analizó la aparición de eventos mayores durante el seguimiento (muerte, síndrome coronario agudo o revascularización). La supervivencia se analizó con el método de Kaplan-Meier y un modelo de regresión multivariante de Cox.
ResultadosDe la cohorte inicial de 333 pacientes, 110 eran mayores de 70 años. En el 40,9% de estos, la RMC de estrés fue positiva para isquemia. La mediana de seguimiento fue de 26 [18-37] meses. En los pacientes ancianos se registraron 35 eventos: 15 fallecimientos, 10 síndromes coronarios agudos y 10 revascularizaciones. Los pacientes con isquemia moderada o grave tenían mayor riesgo de eventos ajustado por edad, sexo y riesgo cardiovascular (HR=3,53; IC95%, 1,41-8,79; p=0,01).
ConclusionesLa presencia de hipoperfusión moderada o grave detectada mediante RMC de estrés predice de manera significativa la aparición de eventos en mayores de 70 años, sin que aparezcan efectos adversos relevantes.
Palabras clave
La incidencia y la mortalidad de la cardiopatía isquémica (CI) aumentan con la edad1,2. Una de las razones del aumento de la mortalidad es que, en los ancianos, el diagnóstico es más complejo debido a la forma de presentación atípica de la CI en esta población (p. ej., fatiga, mareo, dolor torácico atípico)3,4. Además, no hay escalas de riesgo cardiovascular validadas de manera específica, y en muchos casos las técnicas disponibles son más difíciles de realizar e interpretar en los ancianos5,6. Sin embargo, un diagnóstico correcto permite aplicar un tratamiento adecuado, como la revascularización coronaria, que puede mejorar el pronóstico7–9.
Las guías de práctica clínica han establecido las indicaciones actuales para el correcto estudio diagnóstico de la CI. Se basan en la probabilidad pretest de que el paciente contraiga la enfermedad, que se calcula en función de parámetros como el sexo, el electrocardiograma en reposo, las características del dolor torácico y la capacidad de ejercicio10,11. Algunos de estos parámetros tienen limitaciones sustanciales en los pacientes ancianos. Así pues, es preciso evaluar individualmente la utilidad y la seguridad de cada una de las técnicas disponibles.
La cardiorresonancia magnética o resonancia magnética cardiaca (RMC) de estrés tiene demostrada su utilidad en el diagnóstico de la isquemia miocárdica12,13. Además, esta técnica permite reclasificar la probabilidad pretest de CI y predice también los eventos cardiovasculares14,15. Sin embargo, la media de edad de las personas incluidas en los estudios es de alrededor de 55 a 60 años, y los pacientes mayores de 70 están generalmente infrarrepresentados16.
El objetivo de este estudio es evaluar la capacidad de la RMC de estrés de predecir los eventos cardiovasculares en los pacientes mayores de 70 años. Además, se evaluó también la seguridad de esta prueba diagnóstica en los ancianos y la capacidad de la RMC de estrés de reclasificar su probabilidad pretest, dada la ausencia de escalas de riesgo validadas.
MÉTODOSPoblación de pacientesSe estudió prospectivamente a todas las personas a las que se realizó una RMC de estrés en nuestro centro entre 2009 y 2013. La decisión de remitir a los pacientes a esta prueba específica y no a otras se basó en el criterio clínico del cardiólogo que los remitía y la guía de práctica clínica vigente17. Se excluyó a los pacientes con contraindicaciones para la resonancia magnética, como claustrofobia, marcapasos o desfibrilador automático implantable y enfermedad renal crónica (filtrado glomerular estimado ≤ 30ml/min/1,73 m2). Se indicó a los participantes que evitaran el consumo de alimentos y bebidas con contenido de cafeína en las 24 h previas a la exploración de RMC. El estudio fue aprobado por el comité de ética de investigación de nuestro centro (referencia 096/2010) y todos los pacientes firmaron un documento de consentimiento informado.
En la consulta ambulatoria de cardiología se registraron los datos clínicos, como factores de riesgo cardiovascular, índice de masa corporal, antecedentes de tabaquismo, dislipemia, diabetes mellitus, antecedentes familiares de CI y enfermedad cardiovascular previa; parámetros clínicos como frecuencia cardiaca, presión arterial y frecuencia cardiaca basal, y valores analíticos, como colesterol unido a lipoproteínas de baja densidad, colesterol unido a lipoproteínas de alta densidad, glucemia basal, glucohemoglobina y tasa de filtrado glomerular estimada. Se utilizó la HeartScore correspondiente a una población de riesgo bajo (España) para estimar el riesgo cardiovascular de cada paciente. Se consideró paciente con muy alto riesgo a la población diabética y los pacientes con una CI conocida. El cálculo del riesgo cardiovascular de los mayores de 70 años se realizó extrapolando la HeartScore, según indica la guía de práctica clínica18.
Protocolo de la resonancia magnética cardiaca de estrésRealizaron las exploraciones de RMC de estrés un cardiólogo y un radiólogo con un aparato de 1,5 T (MAGNETOM Symphony y MAGNETOM Aera, Siemens Healthcare GmbH; Erlangen, Alemania), según lo establecido en las recomendaciones de 2008 de la Society for Cardiovascular Magnetic Resonance19. Se administró una dosis total de 0,2 mmol/kg de gadobutrol (Gadovist, Bayer Schering Pharma AG; Berlín-Wedding, Alemania) a una velocidad de 4 ml/s, tras una hiperemia máxima inducida mediante dosis crecientes de adenosina intravenosa (140, 180 y 210μg/kg/min) durante 4-6 min con objeto de alcanzar una respuesta apropiada: un aumento de la frecuencia cardiaca de como mínimo 10 lpm o una disminución de la presión arterial sistólica de como mínimo 10 mmHg20.
El análisis de las imágenes de RMC se realizó visualmente y se clasificó como positiva para isquemia si se detectaban defectos de perfusión reversibles. El grado de hipoperfusión se clasificó como leve (1-2 segmentos afectados), moderado (3-4 segmentos) o grave (más de 4 segmentos). Para los fines del análisis, se consideraron conjuntamente los defectos de perfusión moderados y los graves. En los segmentos con un realce tardío de gadolinio de tipo isquémico, la presencia de isquemia se definió por la observación de un defecto de perfusión reversible mayor que la extensión de la cicatriz.
Seguimiento de los pacientesEl seguimiento se programó cada 3 a 6 meses en la consulta ambulatoria o telefónicamente, según el criterio del cardiólogo y la preferencia del paciente, hasta el final del periodo de seguimiento o hasta la primera aparición de uno de los siguientes eventos: muerte por cualquier causa, síndrome coronario agudo (SCA) o necesidad de revascularización. Dado que el objetivo era establecer el valor diagnóstico y pronóstico de la RMC de estrés, se consideró un patrón de referencia combinado que incluía la coronariografía guiada por el resultado de la prueba o la aparición de eventos. La indicación y el momento de realización de la coronariografía dependían del criterio del cardiólogo y la preferencia del paciente.
Análisis estadísticoLas variables cuantitativas se presentan como media ± desviación estándar o la mediana [intervalo intercuartílico] para los datos no paramétricos, y las variables cualitativas se expresan en número y porcentaje. Las variables cuantitativas continuas se compararon con la prueba de la t de Student o con la de la suma de rangos de Wilcoxon para los datos no paramétricos. Las variables discretas se compararon con la prueba de la X2 y la prueba exacta de Fisher. Se estableció un nivel de significación de 0,05 (bilateral) para todas las pruebas estadísticas.
La distribución de la supervivencia relativa al tiempo transcurrido hasta un evento se evaluó con el método de Kaplan-Meier, analizando la existencia y el grado de isquemia (leve frente a moderada/grave). Para la comparación de las curvas de supervivencia, se utilizó el log-rank test. Se desarrolló un modelo de regresión de riesgos proporcionales de Cox para calcular los valores ajustados de la hazard ratio (HR) y para determinar el efecto de diversas variables en la función de supervivencia. Se llevó a cabo un análisis univariante para seleccionar las variables que tener en cuenta en el análisis multivariante. Las variables con un resultado de p < 0,01 en el análisis univariante se seleccionaron para el análisis multivariante. En el análisis multivariante, se consideró estadísticamente significativo un valor de p < 0,05. El análisis estadístico se realizó con el programa Stata 13.1 (Stata Corp.; College Station, Texas, Estados Unidos) y el programa SPSS 21.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
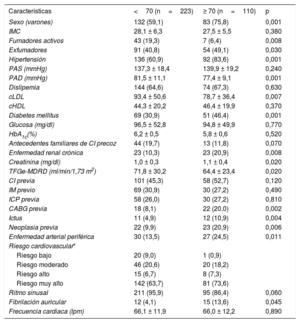
RESULTADOSPacientesDe la cohorte inicial de 333 pacientes a los que se realizó una RMC de estrés (el 76,3% varones; media de edad, 64,6±10,6 años), 223 (66,7%) tenían menos de 70 años y 110 (33%), 70 años o más. En la tabla 1 se muestran las características de cada grupo en la situación inicial. Los pacientes de edad ≥ 70 años eran predominantemente varones y tenían una mayor prevalencia de tabaquismo, hipertensión, diabetes, enfermedad renal crónica, neoplasia previa, enfermedad arterial periférica, ictus y fibrilación auricular, por lo que su puntuación HeartScore de riesgo cardiovascular era más alta. No hubo diferencias estadísticamente significativas en los porcentajes de enfermedad coronaria previa, infarto de miocardio previo u otros parámetros clínicos, si bien el colesterol unido a lipoproteínas de baja densidad y el porcentaje de fumadores activos fueron menores en la población anciana.
Características clínicas basales de la cohorte de pacientes evaluada en este estudio
| Características | <70 (n=223) | ≥ 70 (n=110) | p |
|---|---|---|---|
| Sexo (varones) | 132 (59,1) | 83 (75,8) | 0,001 |
| IMC | 28,1 ± 6,3 | 27,5 ± 5,5 | 0,380 |
| Fumadores activos | 43 (19,3) | 7 (6,4) | 0,008 |
| Exfumadores | 91 (40,8) | 54 (49,1) | 0,030 |
| Hipertensión | 136 (60,9) | 92 (83,6) | 0,001 |
| PAS (mmHg) | 137,3 ± 18,4 | 139,9 ± 19,2 | 0,240 |
| PAD (mmHg) | 81,5 ± 11,1 | 77,4 ± 9,1 | 0,001 |
| Dislipemia | 144 (64,6) | 74 (67,3) | 0,630 |
| cLDL | 93,4 ± 50,6 | 78,7 ± 36,4 | 0,007 |
| cHDL | 44,3 ± 20,2 | 46,4 ± 19,9 | 0,370 |
| Diabetes mellitus | 69 (30,9) | 51 (46,4) | 0,001 |
| Glucosa (mg/dl) | 96,5 ± 52,8 | 94,8 ± 49,9 | 0,770 |
| HbA1c(%) | 6,2 ± 0,5 | 5,8 ± 0,6 | 0,520 |
| Antecedentes familiares de CI precoz | 44 (19,7) | 13 (11,8) | 0,070 |
| Enfermedad renal crónica | 23 (10,3) | 23 (20,9) | 0,008 |
| Creatinina (mg/dl) | 1,0 ± 0,3 | 1,1 ± 0,4 | 0,020 |
| TFGe-MDRD (ml/min/1,73 m2) | 71,8 ± 30,2 | 64,4 ± 23,4 | 0,020 |
| CI previa | 101 (45,3) | 58 (52,7) | 0,120 |
| IM previo | 69 (30,9) | 30 (27,2) | 0,490 |
| ICP previa | 58 (26,0) | 30 (27,2) | 0,810 |
| CABG previa | 18 (8,1) | 22 (20,0) | 0,002 |
| Ictus | 11 (4,9) | 12 (10,9) | 0,004 |
| Neoplasia previa | 22 (9,9) | 23 (20,9) | 0,006 |
| Enfermedad arterial periférica | 30 (13,5) | 27 (24,5) | 0,011 |
| Riesgo cardiovascular* | |||
| Riesgo bajo | 20 (9,0) | 1 (0,9) | |
| Riesgo moderado | 46 (20,6) | 20 (18,2) | |
| Riesgo alto | 15 (6,7) | 8 (7,3) | |
| Riesgo muy alto | 142 (63,7) | 81 (73,6) | |
| Ritmo sinusal | 211 (95,9) | 95 (86,4) | 0,060 |
| Fibrilación auricular | 12 (4,1) | 15 (13,6) | 0,045 |
| Frecuencia cardiaca (lpm) | 66,1 ± 11,9 | 66,0 ± 12,2 | 0,890 |
CABG: cirugía de derivación aortocoronaria; cHDL: colesterol unido a lipoproteínas de alta densidad; CI: cardiopatía isquémica; cLDL: colesterol unido a lipoproteínas de baja densidad; HbA1c: glucohemoglobina; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IMC: índice de masa corporal; MDRD: Modification of Diet in Renal Disease; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimada.
Los valores expresan n (%) o media ± desviación estándar.
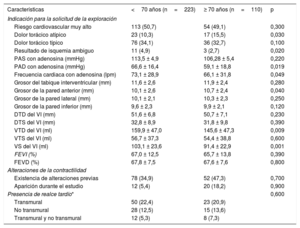
Las indicaciones más frecuentes para la RMC fueron la sospecha de enfermedad coronaria en pacientes de riesgo cardiovascular muy alto o con un dolor torácico típico (tabla 2). La dosis de adenosina fue similar en ambos grupos (163,2±28,8 y 160,5±27,2μg/kg/min en los pacientes de edad ≥ 70 años y < 70 años respectivamente; p=0,39). No hubo ninguna complicación mayor. Se produjeron una complicación menor en el grupo de más de 70 años (bloqueo auriculoventricular transitorio) y 3 complicaciones menores en menores de 70 años (bloqueo auriculoventricular transitorio en 2 casos y episodio de dolor torácico que no requirió nitroglicerina en 1).
Indicaciones clínicas para la resonancia magnética cardiaca de estrés y resultados de la exploración
| Características | <70 años (n=223) | ≥ 70 años (n=110) | p |
|---|---|---|---|
| Indicación para la solicitud de la exploración | |||
| Riesgo cardiovascular muy alto | 113 (50,7) | 54 (49,1) | 0,300 |
| Dolor torácico atípico | 23 (10,3) | 17 (15,5) | 0,030 |
| Dolor torácico típico | 76 (34,1) | 36 (32,7) | 0,100 |
| Resultado de isquemia ambiguo | 11 (4,9) | 3 (2,7) | 0,020 |
| PAS con adenosina (mmHg) | 113,5 ± 4,9 | 106,28 ± 5,4 | 0,220 |
| PAD con adenosina (mmHg) | 66,6 ± 16,4 | 59,1 ± 18,8 | 0,019 |
| Frecuencia cardiaca con adenosina (lpm) | 73,1 ± 28,9 | 66,1 ± 31,8 | 0,049 |
| Grosor del tabique interventricular (mm) | 11,6 ± 2,6 | 11,9 ± 2,4 | 0,280 |
| Grosor de la pared anterior (mm) | 10,1 ± 2,6 | 10,7 ± 2,4 | 0,040 |
| Grosor de la pared lateral (mm) | 10,1 ± 2,1 | 10,3 ± 2,3 | 0,250 |
| Grosor de la pared inferior (mm) | 9,6 ± 2,3 | 9,9 ± 2,1 | 0,120 |
| DTD del VI (mm) | 51,6 ± 6,8 | 50,7 ± 7,1 | 0,230 |
| DTS del VI (mm) | 32,8 ± 8,9 | 31,8 ± 9,8 | 0,390 |
| VTD del VI (ml) | 159,9 ± 47,0 | 145,6 ± 47,3 | 0,009 |
| VTS del VI (ml) | 56,7 ± 37,3 | 54,4 ± 38,8 | 0,600 |
| VS del VI (ml) | 103,1 ± 23,6 | 91,4 ± 22,9 | 0,001 |
| FEVI (%) | 67,0 ± 12,5 | 65,7 ± 13,8 | 0,390 |
| FEVD (%) | 67,8 ± 7,5 | 67,6 ± 7,6 | 0,800 |
| Alteraciones de la contractilidad | |||
| Existencia de alteraciones previas | 78 (34,9) | 52 (47,3) | 0,700 |
| Aparición durante el estudio | 12 (5,4) | 20 (18,2) | 0,900 |
| Presencia de realce tardío* | 0,600 | ||
| Transmural | 50 (22,4) | 23 (20,9) | |
| No transmural | 28 (12,5) | 15 (13,6) | |
| Transmural y no transmural | 12 (5,3) | 8 (7,3) | |
DTD: diámetro telediastólico; DTS: diámetro telesistólico; FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; PAD: presión arterial diastólica; PAS: presión arterial sistólica; VI: ventrículo izquierdo; VS: volumen sistólico; VTD: volumen telediastólico; VTS: volumen telesistólico.
Los valores expresan n (%) o media ± desviación estándar.
La RMC de estrés en pacientes de menos de 70 años fue negativa para isquemia en 159 (71,3%) y positiva en 64 (28,7%). El defecto de perfusión fue leve en 28 individuos (43,7%) y moderado/grave en 36 pacientes (56,3%). En los de edad ≥ 70 años, el resultado fue negativo en 65 casos (59,1%) y positivo en 45 (40,9%), con defectos de perfusión de carácter leve en 17 (37,8%) y moderado/grave en 28 (62,2%). No hubo diferencias significativas en los porcentajes de presencia de realce tardío de gadolinio ni en la aparición de alteraciones de la contractilidad durante la exploración. El resultado positivo en la RMC de estrés era más probable con el incremento de la edad (odds ratio = 1,04; intervalo de confianza del 95% [IC95%], 1,02-1,07; p=0,03).
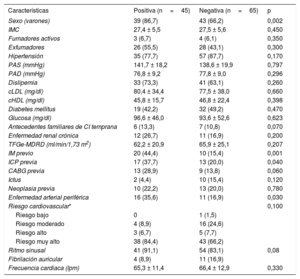
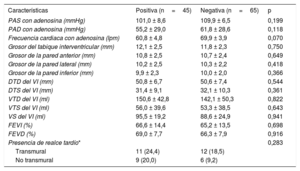
En los pacientes de más de 70 años, los que tenían un resultado positivo eran con mayor frecuencia varones con antecedentes de IM y enfermedad arterial periférica. No hubo diferencias estadísticamente significativas en el resto de las características basales (tabla 3). Además, no hubo diferencias en los parámetros de la RMC, ni siquiera en cuanto a la presencia de realce tardío de gadolinio, según el resultado de la prueba (tabla 4).
Características clínicas basales de los pacientes de edad ≥ 70 años según el resultado de la resonancia magnética cardiaca (positiva/negativa)
| Características | Positiva (n=45) | Negativa (n=65) | p |
|---|---|---|---|
| Sexo (varones) | 39 (86,7) | 43 (66,2) | 0,002 |
| IMC | 27,4 ± 5,5 | 27,5 ± 5,6 | 0,450 |
| Fumadores activos | 3 (6,7) | 4 (6,1) | 0,350 |
| Exfumadores | 26 (55,5) | 28 (43,1) | 0,300 |
| Hipertensión | 35 (77,7) | 57 (87,7) | 0,170 |
| PAS (mmHg) | 141,7 ± 18,2 | 138,6 ± 19,9 | 0,797 |
| PAD (mmHg) | 76,8 ± 9,2 | 77,8 ± 9,0 | 0,296 |
| Dislipemia | 33 (73,3) | 41 (63,1) | 0,260 |
| cLDL (mg/dl) | 80,4 ± 34,4 | 77,5 ± 38,0 | 0,660 |
| cHDL (mg/dl) | 45,8 ± 15,7 | 46,8 ± 22,4 | 0,398 |
| Diabetes mellitus | 19 (42,2) | 32 (49,2) | 0,470 |
| Glucosa (mg/dl) | 96,6 ± 46,0 | 93,6 ± 52,6 | 0,623 |
| Antecedentes familiares de CI temprana | 6 (13,3) | 7 (10,8) | 0,070 |
| Enfermedad renal crónica | 12 (26,7) | 11 (16,9) | 0,200 |
| TFGe-MDRD (ml/min/1,73 m2) | 62,2 ± 20,9 | 65,9 ± 25,1 | 0,207 |
| IM previo | 20 (44,4) | 10 (15,4) | 0,001 |
| ICP previa | 17 (37,7) | 13 (20,0) | 0,040 |
| CABG previa | 13 (28,9) | 9 (13,8) | 0,060 |
| Ictus | 2 (4,4) | 10 (15,4) | 0,120 |
| Neoplasia previa | 10 (22,2) | 13 (20,0) | 0,780 |
| Enfermedad arterial periférica | 16 (35,6) | 11 (16,9) | 0,030 |
| Riesgo cardiovascular* | 0,100 | ||
| Riesgo bajo | 0 | 1 (1,5) | |
| Riesgo moderado | 4 (8,9) | 16 (24,6) | |
| Riesgo alto | 3 (6,7) | 5 (7,7) | |
| Riesgo muy alto | 38 (84,4) | 43 (66,2) | |
| Ritmo sinusal | 41 (91,1) | 54 (83,1) | 0,08 |
| Fibrilación auricular | 4 (8,9) | 11 (16,9) | |
| Frecuencia cardiaca (lpm) | 65,3 ± 11,4 | 66,4 ± 12,9 | 0,330 |
CABG: cirugía de derivación aortocoronaria; cHDL: colesterol unido a lipoproteínas de alta densidad; CI: cardiopatía isquémica; cLDL: colesterol unido a lipoproteínas de baja densidad; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IMC: índice de masa corporal; MDRD: Modification of Diet in Renal Disease; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimada.
Los valores expresan n (%) o media ± desviación estándar.
Resultados de la resonancia magnética cardiaca en pacientes de edad ≥ 70 años según el resultado de la exploración (positiva/negativa)
| Características | Positiva (n=45) | Negativa (n=65) | p |
|---|---|---|---|
| PAS con adenosina (mmHg) | 101,0 ± 8,6 | 109,9 ± 6,5 | 0,199 |
| PAD con adenosina (mmHg) | 55,2 ± 29,0 | 61,8 ± 28,6 | 0,118 |
| Frecuencia cardiaca con adenosina (lpm) | 60,8 ± 4,8 | 69,9 ± 3,9 | 0,070 |
| Grosor del tabique interventricular (mm) | 12,1 ± 2,5 | 11,8 ± 2,3 | 0,750 |
| Grosor de la pared anterior (mm) | 10,8 ± 2,5 | 10,7 ± 2,4 | 0,649 |
| Grosor de la pared lateral (mm) | 10,2 ± 2,5 | 10,3 ± 2,2 | 0,418 |
| Grosor de la pared inferior (mm) | 9,9 ± 2,3 | 10,0 ± 2,0 | 0,366 |
| DTD del VI (mm) | 50,8 ± 6,7 | 50,6 ± 7,4 | 0,544 |
| DTS del VI (mm) | 31,4 ± 9,1 | 32,1 ± 10,3 | 0,361 |
| VTD del VI (ml) | 150,6 ± 42,8 | 142,1 ± 50,3 | 0,822 |
| VTS del VI (ml) | 56,0 ± 39,6 | 53,3 ± 38,5 | 0,643 |
| VS del VI (ml) | 95,5 ± 19,2 | 88,6 ± 24,9 | 0,941 |
| FEVI (%) | 66,6 ± 14,4 | 65,2 ± 13,5 | 0,698 |
| FEVD (%) | 69,0 ± 7,7 | 66,3 ± 7,9 | 0,916 |
| Presencia de realce tardío* | 0,283 | ||
| Transmural | 11 (24,4) | 12 (18,5) | |
| No transmural | 9 (20,0) | 6 (9,2) |
DTD: diámetro telediastólico; DTS: diámetro telesistólico; FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; PAD: presión arterial diastólica; PAS: presión arterial sistólica; VI: ventrículo izquierdo; VS: volumen sistólico; VTD: volumen telediastólico; VTS: volumen telesistólico.
Los valores expresan n (%) o media ± desviación estándar.
Todos los pacientes completaron el seguimiento. Tras una mediana de seguimiento de 26 [18-37] meses, se registraron 70 eventos, 35 en cada grupo. En los pacientes de edad ≥ 70 años hubo 15 muertes (4 en el grupo con RMC positiva), 10 SCA (8 en el grupo de RMC positiva) y 10 revascularizaciones (7 en el grupo de RMC positiva). En los de menos de 70 años, se registraron 7 muertes, 12 SCA y 16 revascularizaciones. La probabilidad de que se produjeran eventos fue más alta en los pacientes ancianos que en los de menos edad (odds ratio = 1,05; IC95%, 1,02-1,08; p=0,04).
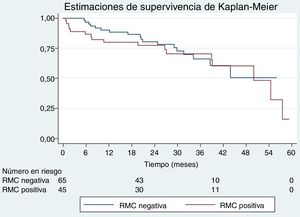
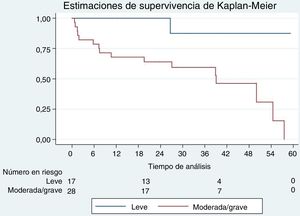
En el análisis de la supervivencia de los pacientes de más de 70 años, no hubo diferencias significativas en función del resultado de la RMC de estrés (positiva frente a negativa, curvas de supervivencia de Kaplan-Meier, log-rank test, p=0,69). Se observaron diferencias significativas en función del grado de positividad (hipoperfusión) de la RMC de estrés (positiva leve frente a positiva moderada/grave; curvas de supervivencia de Kaplan-Meier, log-rank test, p=0,003) (figura 1 y figura 2). En los pacientes con una exploración de RMC de estrés positiva, los que presentaban un grado de isquemia moderado o grave tuvieron un mayor riesgo de sufrir un evento, tras ajustar por edad (mayor o menor de 70 años), el sexo y el riesgo cardiovascular (HR = 3,53; IC95%, 1,41-8,79; p = 0,01). Así pues, una RMC de estrés positiva con un defecto de hipoperfusión moderado o grave predecía la aparición de eventos en el periodo de seguimiento en los pacientes de más de 70 años.
Por último, en los pacientes con un resultado positivo en la RMC de estrés, se confirmó que el grado de isquemia es un factor independiente predictivo de eventos (HR = 2,81; IC95% 1,11-7,11; p = 0,03), con independencia de los antecedentes de IM, el realce tardío de gadolinio, la edad, el riesgo cardiovascular y el sexo.
DISCUSIÓNEl principal resultado de nuestro estudio es que los pacientes ancianos con un grado de isquemia moderado o grave en la RMC de estrés tienen un mayor riesgo de sufrir un evento cardiovascular durante el seguimiento. Según nuestro conocimiento, este es el primer estudio en el que se evalúa el valor pronóstico de la RMC de estrés en pacientes ancianos en la práctica clínica habitual.
En nuestra cohorte, los pacientes ancianos mostraron una alta prevalencia de factores de riesgo cardiovascular tanto clásicos (como hipertensión y diabetes mellitus) como no clásicos (enfermedad renal crónica o neoplasia previa). Sin embargo, el cálculo del riesgo cardiovascular indicado por la guía de práctica clínica21 puede no ser preciso en los ancianos. Por ejemplo, en nuestra cohorte, el 73,6% de los pacientes habrían sido clasificados como en riesgo cardiovascular muy alto y, por consiguiente, podrían requerir exploraciones invasivas. No obstante, en los ancianos el empleo de estas exploraciones diagnósticas comporta una alta tasa de complicaciones y efectos adversos9,22,23. En esta situación, el uso sistemático de exploraciones no invasivas permitiría reclasificar y seleccionar a los pacientes que pueden obtener un mayor beneficio con tratamientos que mejoran la calidad de vida y el pronóstico9.
La sospecha de CI en el anciano se complica también por la presencia de síntomas atípicos y por las características clínicas de esta población de pacientes (como fragilidad, incapacidad de realizar ejercicio o alteraciones electrocardiográficas en la situación inicial), que pueden interferir en el cálculo de la probabilidad pretest de la enfermedad e influir en la indicación de diferentes pruebas diagnósticas. Por ejemplo, en el ensayo CLARIFY, la mayoría de los pacientes ancianos con enfermedad coronaria estaban asintomáticos debido a la reducción de la actividad física3. En nuestra muestra, la indicación clínica para la RMC de estrés fue el dolor torácico atípico en un 15,5% de los pacientes ancianos, mientras que en los individuos de menos de 70 años el porcentaje de casos en los que se solicitó la RMC por esta indicación clínica fue ligeramente superior (el 10,3 frente al 15,5%).
Hay pocos estudios sobre el uso de técnicas diagnósticas no invasivas en la población anciana, y en la práctica clínica se acepta que su exactitud es similar a la que tienen en la población general. Jeger et al.5 observaron la utilidad de la ecocardiografía de estrés de ejercicio o de estrés farmacológico en pacientes de más de 75 años, y Gurunathan et al.24 subrayaron el valor pronóstico de la ecocardiografía de estrés en los octogenarios. En el caso de la RMC, Barbier et al.25 demostraron que la detección de un infarto previo predice la aparición de eventos cardiovasculares en las personas de más de 70 años.
Sin embargo, algunos estudios han puesto de manifiesto que el grado de isquemia es uno de los parámetros más importantes por lo que respecta al pronóstico. Rösner et al.26 han demostrado recientemente que, en una población tratada anteriormente con revascularización, era necesaria la presencia de 3 segmentos isquémicos positivos en una prueba de estrés para orientar la toma de decisiones. En otro estudio, Vincenti et al.27 llegaron a la conclusión de que la presencia de 1,5 o más segmentos isquémicos en la RMC era el factor predictivo de eventos cardiovasculares más potente. Así, en nuestro estudio en pacientes de más de 70 años, la presencia de una isquemia inducible, con 3 segmentos afectados o más, aumentó la probabilidad de aparición de un evento en 3,5 veces, con independencia del nivel de riesgo cardiovascular y del sexo. Estas razones pueden explicar el resultado no significativo observado en la supervivencia al considerar los resultados generales de la exploración de RMC de estrés y las diferencias significativas observadas cuando se tuvo en cuenta el grado de isquemia (leve frente a moderada/grave). Además, la importancia del grado de isquemia es independiente de otros parámetros, como la presencia de realce tardío de gadolinio.
Al igual que en otros estudios de RMC realizados en la población general, nuestros resultados pueden ser útiles para reclasificar la probabilidad pretest en los pacientes ancianos28. Así, el uso de la RMC de estrés puede reducir el número de exploraciones invasivas innecesarias y puede ser útil para guiar una posible revascularización de los territorios isquémicos en esta población concreta. En nuestro estudio, la RMC de estrés identificó a los pacientes que requerían una coronariografía invasiva, puesto que la mayor parte de las revascularizaciones y los SCA se dieron en pacientes con una RMC de estrés positiva. Las diferencias observadas en la mortalidad pueden explicarse porque las personas de más de 70 años con una RMC negativa pueden fallecer por otras razones relacionadas con la edad, aparte de los eventos cardiovasculares.
Además, se ha demostrado que la RMC de estrés es una exploración segura. De manera similar a lo observado en los registros a gran escala, como el EuroCMR29, no se registraron efectos adversos importantes, lo cual respalda la seguridad de la RMC en los ancianos. Esta observación sitúa a la RMC de estrés como exploración de gran exactitud para el estudio de la CI en esta población de pacientes. Además, nuestro estudio ha mostrado también que, en los individuos de más de 70 años, un protocolo de RMC de estrés que incluye una perfusión de adenosina y un examen de la viabilidad tras la inyección de gadolinio, es el método más potente existente para predecir los eventos30.
Este estudio tiene ciertas limitaciones. En primer lugar, el límite de edad para definir la población geriátrica puede ser muy diverso, en especial cuando no se tienen en cuenta criterios de fragilidad. En este estudio, el umbral de edad para determinar la población geriátrica se estableció en ≥ 70 años, aunque clásicamente se ha definido como 65 años31. En segundo lugar, en este estudio el objetivo evaluado es la mortalidad por cualquier causa y no la muerte de causa cardiovascular, ya que no fue posible definir con exactitud la causa de la muerte en todos los casos. En tercer lugar, se trata de un estudio de la práctica clínica real y no de un ensayo aleatorizado y a doble ciego, por lo que la realización de una coronariografía guiada por el resultado de la RMC fue más frecuente en los pacientes con una isquemia moderada o grave. Por último, el porcentaje de mujeres fue bajo, aunque similar al de otros estudios.
CONCLUSIONESSegún lo indicado por nuestros resultados, la presencia de defectos de perfusión moderados o graves en la RMC de estrés predice con fuerza la aparición de eventos en los pacientes de más de 70 años. Así pues, la isquemia moderada o grave permite detectar a una población con riesgo cardiovascular muy alto. Además, la RMC de estrés es una exploración segura que permite una estratificación del riesgo, lo cual tiene consecuencias para el manejo clínico de esta población específica.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
La RMC de estrés es una técnica bien establecida para la detección de la isquemia miocárdica, que desempeña un papel importante en el pronóstico y la predicción de los eventos cardiovasculares. Entre sus ventajas se encuentran las siguientes: a) su seguridad, puesto que no requiere radiación ionizante, y b) la isquemia y la viabilidad pueden evaluarse en la misma exploración. Sin embargo, hay poca experiencia de su uso en poblaciones específicas como los pacientes ancianos.
- –
Hasta donde se sabe, este es el primer estudio en el que se evalúa el valor pronóstico de la resonancia magnética cardiaca de estrés con el empleo de adenosina en pacientes ancianos, una población específica en la que a veces resulta difícil descartar la isquemia y establecer el pronóstico.
- –
Este es uno de los pocos estudios publicados que tienen en cuenta el grado de isquemia detectado en la resonancia magnética cardiaca, y no solo su presencia.