La insuficiencia aórtica (IAo) es una valvulopatía muy prevalente en nuestro medio. La intervención quirúrgica está indicada ante el deterioro clínico o el empeoramiento de mediciones en ecocardiografía bidimensional (2D)1. Los pacientes con IAo pueden permanecen asintomáticos durante décadas, por lo que detectar precozmente la progresión subclínica podría mejorar los resultados1. Los parámetros de deformación miocárdica en 3 dimensiones (3D) son un intrumento prometedor que aporta información adicional a la fracción de eyección del ventrículo izquierdo (FEVI) integrando la geometría ventricular desde una sola ventana apical, pero aún se desconoce su utilidad en la IAo.
Desde marzo 2013 a julio 2014 se llevó a cabo un estudio observacional unicéntrico prospectivo de una cohorte consecutiva de pacientes con IAo al menos moderada (≥ III/IV) con FEVI>55%. Los pacientes se encontraban asintomáticos y no presentaban criterios clásicos de intervención quirúrgica. El estudio fue aprobado por el comité ético de nuestro centro.
Se realizó una ecocardiografía 2D y una valoración del strain ventricular 3D y se determinaron strain global longitudinal (SGL), strain global circunferencial (SGC), strain global radial (SGR) y área de strain global (ASG) mediante Vivid E9 Scanner (General Electric Vingmed Ultrasound, Noruega), el software EchoPAC (4DAutoLVQ-EchoPAC BT12, General Electric Vingmed Ultrasound). Un mismo operador realizó el análisis sin poder comparar la reproducibilidad intraobservador e interobservadores. El objetivo principal fue el combinado de muerte de causa cardiovascular, hospitalización por insuficiencia cardiaca (IC) o la aparición en el seguimiento de disfunción ventricular con FEVI<50% o síntomas atribuibles a la lesión valvular como deterioro de la clase funcional de la New York Heart Association (NYHA), síncope o angina recogidos en la historia clínica.
Se incluyó a 31 pacientes (media de edad, 61±18 años; el 74,2% varones), el 61,3% con válvula tricúspide y 16 (51,6%) con IAo de grado IV. Hasta julio de 2019, se indicó cirugía cardiaca a 12 pacientes (38,7%), todos ellos con IAo de grado IV. La indicación se realizó por empeoramiento clínico en 7 de ellos (4 por IC, 3 por empeoramiento de la clase NYHA), 2 por deterioro de la función ventricular y 3 por causa combinada clínica y ecocardiográfica (FEVI +NYHA). Todas las hospitalizaciones por IC cumplían criterios de cirugía. Ningún paciente falleció por causa cardiovascular.
Se repitió el estudio en asintomáticos y sin cirugía, a los 6 meses en 17 de ellos y al año en 10. No se observaron diferencias significativas en ninguno de los parámetros de strain 3D en las comparaciones del ecocardiograma basal con los de los 6 o 12 meses.
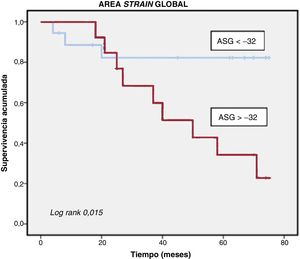
La tabla 1 muestra la comparación según la presencia del objetivo combinado. Respecto al strain 3D, el único parámetro que se asoció con el evento combinado fue el ASG. Tras estudiar el rendimiento diagnóstico mediante la curva ROC, el punto de corte óptimo fue un ASG>–32, con sensibilidad del 75% y especificidad del 73,7%, área bajo la curva =0,76 (p =0,05) y estadístico C =0,64.
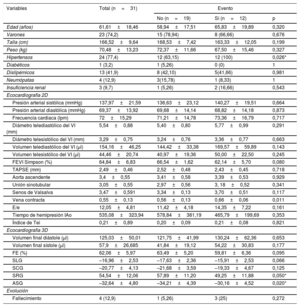
Datos basales y comparados según la incidencia del evento combinado
| Variables | Total (n=31) | Evento | ||
|---|---|---|---|---|
| No (n=19) | Sí (n=12) | p | ||
| Edad (años) | 61,61±18,46 | 58,94±17,51 | 65,83±19,89 | 0,320 |
| Varones | 23 (74,2) | 15 (78,94) | 8 (66,66) | 0,676 |
| Talla (cm) | 166,52±9,64 | 168,53±7,42 | 163,33±12,05 | 0,199 |
| Peso (kg) | 70,48±13,23 | 72,37±11,66 | 67,50±15,46 | 0,327 |
| Hipertensos | 24 (77,4) | 12 (63,15) | 12 (100) | 0,026* |
| Diabéticos | 1 (3,2) | 1 (5,26) | 0 (0) | 1 |
| Dislipémicos | 13 (41,9) | 8 (42,10) | 5(41,66) | 0,981 |
| Neumópatas | 4 (12,9) | 3(15,78) | 1 (8,33) | 1 |
| Insuficiencia renal | 3 (9,7) | 1 (5,26) | 2 (16,66) | 0,543 |
| Ecocardiografía 2D | ||||
| Presión arterial sistólica (mmHg) | 137,97±21,59 | 136,63±23,12 | 140,27±19,51 | 0,664 |
| Presión arterial diastólica (mmHg) | 69,37±13,92 | 69,68±14,14 | 68,82±14,18 | 0,873 |
| Frecuencia cardiaca (lpm) | 72±15,29 | 71,21±14,78 | 73,36±16,79 | 0,717 |
| Diámetro telediastólico del VI (mm) | 5,54±0,88 | 5,40±0,80 | 5,77±0,99 | 0,291 |
| Diámetro telesistólico del VI (mm) | 3,29±0,75 | 3,24±0,76 | 3,36±0,77 | 0,663 |
| Volumen telediastólico del VI (μl) | 154,16±46,25 | 144,42±33,38 | 169,57±59,89 | 0,143 |
| Volumen telesistólico del VI (μl) | 44,46±20,74 | 40,97±19,36 | 50,00±22,50 | 0,245 |
| FEVI Simpson (%) | 64,84±6,83 | 66,54±1,62 | 62,14±5,70 | 0,080 |
| TAPSE (mm) | 2,49±0,46 | 2,52±0,48 | 2,43±0,45 | 0,718 |
| Aorta ascendente | 3,4±0,55 | 3,41±0,58 | 3,39±0,53 | 0,929 |
| Unión sinotubular | 3,05±0,55 | 2,97±0,56 | 3, 18±0,52 | 0,341 |
| Senos de Valsalva | 3,47±0,591 | 3,34±0,13 | 3,70±0,51 | 0,117 |
| Vena contracta | 0,55±0,13 | 0,56±0,13 | 0,66±0,06 | 0,011 |
| E/e | 12,05±4,81 | 11,42±4,18 | 14,35±7,22 | 0,161 |
| Tiempo de hemipresión IAo | 535,08±323,94 | 578,84±381,19 | 465,79±199,69 | 0,353 |
| Índice de Tei | 0,21±0,89 | 0,20±0,09 | 0,21±0,08 | 0,821 |
| Ecocardiografía 3D | ||||
| Volumen final diástole (μl) | 125,03±50,01 | 121,75±41,99 | 130,24±62,36 | 0,653 |
| Volumen final sístole (μl) | 57,9±26,685 | 41,84±19,12 | 54,22±30,83 | 0,177 |
| FE (%) | 62,06±5,97 | 63,49±5,20 | 59,81±6,36 | 0,095 |
| SLG | –16,96±2,53 | –17,63±2,36 | –15,91±2,53 | 0,066 |
| SCG | –20,77±4,13 | –21,68±3,59 | –19,33±4,67 | 0,125 |
| SRG | 54,54±12,06 | 57,89±11,20 | 49,25±11,88 | 0,050* |
| ASG | –32,64±4,80 | –34,21±4,39 | –30,16±4,52 | 0,020* |
| Evolución | ||||
| Fallecimiento | 4 (12,9) | 1 (5,26) | 3 (25) | 0,272 |
ASG: area de strain global; FEVI: fracción de eyección del VI; IAo: insuficiencia aórtica; SCG: strain circunferencial global; SLG: strain longitudinal global; SRD: strain radial global; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; VI: ventrículo izquierdo.
Los valores expresan n (%) o media±desviación estándar.
Los únicos predictores significativos de eventos en el análisis univariado fueron la vena contracta y el ASG>–32. Ambos se introdujeron en un modelo multivariado de riesgos proporcionales de Cox por pasos hacia atrás sin diferencias significativas.
Las curvas de Kaplan-Meier mostraron diferencias en la supervivencia libre de eventos según el ASG>–32 (figura 1). Un mayor número de IAo de grado IV (basal, el 51,6%; final, el 64,5%) incluidos podría explicar una mayor probabilidad de aparición de eventos en comparación con la literatura.
Curva de Kaplan-Meier de supervivencia según el ASG. Un ASG>–32 ocasiona una supervivencia libre de eventos significativamente menor de los pacientes con insuficiencia aórtica de grado>III asintomáticos y FEVI>55%. ASG: área de strain global; FEVI: fracción de eyección del ventrículo izquierdo.
En nuestro estudio, el ASG en IAo identifica a pacientes con mayor riesgo de cirugía, adelantándose al deterioro de la FEVI, lo que podría permitir mejorar el pronóstico. Hasta donde sabemos, nuestro trabajo es el primero en valorar un parámetro de mecánica ventricular 3D, el ASG, como factor predictivo independiente en pacientes con IAo asintomáticos sin criterios quirúrgicos.
Dos características que podrían justificar que el ASG aportase más información que los estudios realizados con strain 2D son la adquisición desde un mismo plano ecocardiográfico evaluando el mismo ciclo cardiaco y la obtención de este parámetro solo reproducible mediante tecnología 3D2–4. El ASG determina el cambio del área subendocárdica obtenida gracias a la información del acortamiento longitudinal y circunferencial medido simultáneamente, lo cual aporta mayor potencia predictiva individual que cada uno por separado, incluso con un menor número de pacientes.
Se ha demostrado el valor pronóstico del ASG en otros contextos clínicos, si bien los intervalos de referencia varían en función de los diferentes equipos ecocardiográficos y autores3,4. En pacientes con insuficiencia mitral grave asintomática y FEVI conservada, un ASG>–41,6% predijo peores eventos (hazard ratio =4,41; p =0,004)5.
En conclusión, el ASG es el parámetro de función ventricular que mejor predice el objetivo combinado, incluso mejor que el que se emplea habitualmente, la FEVI. Su determinación no varía durante el seguimiento de pacientes que siguen asintomáticos y sin criterios de cirugía.
.
Agradecemos al Dr. Pedro Caravaca Pérez por su revisión exhaustiva del manuscrito y sus aportaciones.