La fibrosis hepática precede a la cirrosis y a la insuficiencia hepática. Las formas subclínicas de fibrosis hepática podrían aumentar el riesgo de eventos cardiovasculares. El objetivo fue describir el valor pronóstico del índice FIB-4 en pacientes con síndrome coronario agudo (SCA) sobre la mortalidad hospitalaria y el pronóstico posterior.
MétodosEstudio retrospectivo de pacientes con SCA en un centro. Los objetivos de análisis fueron la mortalidad en la fase hospitalaria y tras el alta, así como la insuficiencia cardiaca y el sangrado mayor (SM), que se evaluaron tomando como evento competitivo la mortalidad por todas las causas y se presentan los sub-hazard ratios (sHR). Los eventos recurrentes se evaluaron mediante la razón de tasas de incidencia (IRR).
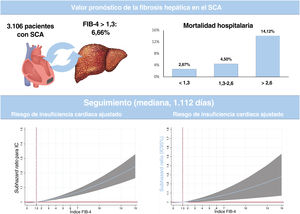
ResultadosSe incluyeron a 3.106 pacientes y el 6,66% tenía un índice FIB-4 ≥ 1,3. El análisis multivariado verificó mayor riesgo de mortalidad intrahospitalaria asociado al índice FIB-4 (OR = 1,24; p=0,016) y los pacientes con valores> 2,67 presentaron el doble de riesgo (OR = 2,35; p=0,038). Tras el alta (mediana de seguimiento 1.112 días) el índice FIB-4 no tuvo valor pronóstico de mortalidad pero valores ≥ 1,3 se asociaron a mayor riesgo del primer reingreso (Shr = 1,61; p=0,04) o recurrente (IRR =1,70; p=0,001) de IC. El índice FIB-4 ≥ 1,30 se asoció con mayor riesgo de SM (sHR = 1,62; p=0,030).
ConclusionesLa evaluación de la fibrosis hepática por el índice FIB-4 identifica a los pacientes con SCA con mayor riesgo de mortalidad intrahospitalaria pero también con mayor riesgo de IC y SM tras el alta.
Palabras clave
Las anomalías de la función hepática son frecuentes en los pacientes con enfermedad coronaria debido a la alta prevalencia de la obesidad, la diabetes y la insuficiencia cardiaca1,2. Se sabe que la enfermedad de hígado graso no alcohólico (EHGNA) y la fibrosis hepática preceden a la cirrosis y la disfunción hepática1,2.
El índice FIB-4 (índice de fibrosis basado en 4 factores) es un instrumento validado para la evaluación de la fibrosis hepática3,4 y su exactitud diagnóstica para la predicción de la fibrosis avanzada en pacientes con una EHGNA, confirmada mediante biopsia, es similar a la de la resonancia magnética5. La cirrosis hepática con hipertensión portal es uno de los criterios mayores para definir a los pacientes con un riesgo hemorrágico alto6, pero las anomalías hepáticas leves o moderadas también podrían aumentar el riesgo de sangrado mayor (SM)4 e incluso, en mayor medida, el de insuficiencia cardiaca7,8, eventos cardiovasculares mayores (MACE) o muerte9. Aunque una parte del riesgo de complicaciones cardiovasculares derivadas de la fibrosis hepática o la EHGNA es atribuible a estas comorbilidades, el diagnóstico de la EHGNA se asocia con un riesgo superior al que comporta la suma de los factores de riesgo relacionados con su incidencia4.
Partiendo de estas premisas, se investigó el valor pronóstico de la fibrosis hepática evaluada mediante el índice FIB-4 en una cohorte de pacientes ingresados por un síndrome coronario agudo (SCA).
MÉTODOSSe llevó a cabo un estudio retrospectivo de todos los pacientes consecutivos ingresados por un SCA en el Servicio de Cardiología del Hospital de San Juan (Alicante, España) entre 2009 y 2019. Ingresaron en total 3.174 pacientes y, tras la exclusión de 8 pacientes seropositivos para el virus de la inmunodeficiencia humana y 29 con una hepatitis conocida, el total de pacientes analizados fue de 3.106. El SCA se definió por la presencia de síntomas clínicos de dolor torácico típicos y alteraciones electrocardiográficas indicativas de una isquemia o lesión miocárdica y/o una elevación de los marcadores séricos de la lesión miocárdica10. El grado de fibrosis hepática se estimó con el índice FIB-41, que es un algoritmo basado en el recuento de plaquetas, la edad, la alanina transaminasa (ALT) y la aspartato transaminasa (AST): edad (años) × AST (U/l) / (recuento de plaquetas [103/μl] × ALT [U/l]). Según las recomendaciones del sistema de puntuación de la Non-alcoholic Steatohepatitis Clinical Research Network, se clasificó a los pacientes en los grupos de puntuación de 1,30, 1,30-2,67 o > 2,671,9,11.
También se clasificó a los pacientes en los grupos de infarto agudo de miocardio con elevación del segmento ST (IAMCEST) y síndrome coronario agudo sin elevación del segmento ST (SCASEST) según las observaciones electrocardiográficas. Personal médico especialmente formado para ello registró los factores de riesgo, los antecedentes patológicos, los tratamientos, las exploraciones complementarias y el diagnóstico principal al alta de todos los pacientes. Los protocolos de diagnóstico y tratamiento del centro para el SCA incluyen análisis de una muestra de sangre en el servicio de urgencias y de la primera muestra en ayunas tras el ingreso en el hospital. Suele disponerse del valor de AST de la primera muestra de sangre en los análisis del servicio de urgencias y del de ALT en las primeras 24 h. Se registró la primera determinación de cada paciente.
DefinicionesAplicando la definición de 2019 del AcademicResearch Consortium for High Bleeding Risk (ARC-HBR)6, se clasificó a los pacientes según el consenso ARC-HBR si cumplían como mínimo 1 criterio mayor o 2 criterios menores. El filtrado glomerular se calculó mediante la ecuación Modification of Diet on Renal Disease12. Las comorbilidades se evaluaron con el índice de Charlson adaptado para los pacientes con enfermedad cardiovascular13, y se consideró que aquellos con una puntuación > 4 tenían una carga de morbilidad elevada. Se determinó prospectivamente la completitud de la revascularización, determinada después de la intervención de revascularización, con base en la revascularización «anatómica equivalente» pretendida antes de la revascularización según la numeración de segmentos de los vasos de diámetro > 1,5mm14.
Objetivos y seguimientoLos objetivos principales fueron la mortalidad por cualquier causa y la mortalidad de causa cardiovascular, la primera hospitalización por insuficiencia cardiaca (IC) y el SM; los objetivos secundarios fueron la incidencia acumulada de IC y SM posteriores. El diagnóstico de la IC se codificó según los informes médicos firmados por el personal médico del centro, y se basó principalmente en los criterios diagnósticos de las guías de práctica clínica15. Los eventos de SM se recogieron según la escala de hemorragia Thrombolysis and Myocardial Infaction (TIMI) para los SM no relacionados con un bypass arterial coronario y los que se correspondían con las definiciones 3 o 5 del Bleeding Academic Research Consortium16. El protocolo del estudio fue aprobado por el comité de ética del hospital que realizaba la coordinación y se obtuvo el consentimiento informado de todos los pacientes.
Para el seguimiento de los pacientes después del alta, se siguió un protocolo claramente establecido con llamadas telefónicas y examen de las historias clínicas electrónicas y las bases de datos de los centros. La supervivencia de los pacientes se determinó mediante llamadas telefónicas cuando no se dispuso de la historia clínica. El estudio se llevó a cabo siguiendo las recomendaciones de Strengthening the Reporting of Observational Studies in Epidemiology (STROBE).
Análisis estadísticosLas variables cuantitativas se presentan en forma de media±DE, y las diferencias se evaluaron con la prueba de la t de Student y la prueba de la χ2. Las variables cualitativas se presentan en forma de porcentajes y las diferencias se analizaron mediante ANOVA. Tal como se preveía, la edad, el filtrado glomerular, la puntuación GRACE, la puntuación PRECISE-DAPT y el índice FIB-4 mostraron una colinealidad en sus resultados y se modelizaron como variables cualitativas; no obstante, ninguna de ellas presentó un resultado positivo en los análisis multivariantes. Las variables asociadas con la mortalidad hospitalaria se evaluaron mediante regresión logística binaria. La calibración del modelo se evaluó con la prueba de Hosmer-Lemeshow y la exactitud diagnóstica, con el área bajo la curva de la probabilidad del diagnóstico; la franja de calibración indica la evaluación global17, que permite señalar los intervalos de riesgo para representar gráficamente dónde hay una desviación significativa respecto a la calibración ideal y el sentido de la desviación.
Los análisis de la supervivencia se realizaron con modelos de regresión de Cox tras la verificación del supuesto de riesgos proporcionales mediante la prueba de residuos de Schoenfeld. Antes de introducirlos en los modelos de regresión, los valores de la puntuación FIB-4 se expandieron con polinomios fraccionales, al objeto de no asumir la linealidad del efecto.
Las estimaciones del riesgo de IC o SM tras el alta podrían verse afectadas por el hecho de que el paciente hubiera sobrevivido o no. En consecuencia, las técnicas habituales de análisis de tiempo hasta el evento habrían producido unos resultados sesgados o no interpretables debido a los riesgos en competencia, y la estimación de Kaplan-Meier habría sobrestimado la incidencia de la IC. Para evitar estos efectos, se aplicó el modelo introducido por Fine y Gray18 para analizar los eventos competidores. Las incidencias de IC y SM se presentan mediante gráficos de función de incidencia acumulados y los resultados del análisis multivariante se presentan como valores de subhazard ratio (sHR) y los correspondientes intervalos de confianza del 95% (IC95%). Se utilizó el estadístico C de Harrel para evaluar la discriminación del modelo. La calibración se evaluó con la prueba de Gronnesby y Borgan. Se clasificó a los pacientes perdidos para el seguimiento como no disponibles, al igual que aquellos de los que faltaba alguna de las variables principales para los análisis, aunque estos fueron menos del 5%. Para la evaluación de la reclasificación del riesgo real de SM del FIB-4, tomando como patrón de referencia la puntuación PRECISE-DAPT, se evaluaron la tasa de reclasificación, la mejora de reclasificación neta y la mejora de discriminación integrada19. Para este cálculo, no se aceptaron los datos censurados para el análisis.
Se evaluaron las hospitalizaciones recurrentes determinando la razón de tasas de incidencia (IRR). Dado que un aumento de las hospitalizaciones por IC se asocia con un aumento del posterior riesgo de muerte, se ha propuesto que cualquier análisis de los ingresos hospitalarios recurrentes debe tener en cuenta también la muerte como evento terminal. Así pues, se calcularon los coeficientes derivados de este método teniendo en cuenta la correlación positiva entre el parámetro de valoración recurrente y la muerte como evento terminal, relacionando las 2 ecuaciones simultáneas (número de rehospitalizaciones y muerte) con la fragilidad común, utilizando el procedimiento bivcnto de STATA20. En consecuencia, dentro del mismo modelo se obtuvieron las estimaciones del riesgo de ambos parámetros de valoración. La selección de las covariables se llevó a cabo con base en el conocimiento médico previo. Las covariables incluidas en el modelo predictivo final de los objetivos del estudio fueron edad, sexo, diabetes, revascularización, IC previa, fracción de eyección del ventrículo izquierdo (FEVI), hemoglobina, fibrilación auricular y tratamientos médicos al alta.
El umbral de la significación estadística se estableció en p <0,05. Todos los análisis se realizaron con el programa STATA 14.3 (StataCorp, 2009, Stata Statistical Software: versión 14, StataCorp LP, Estados Unidos).
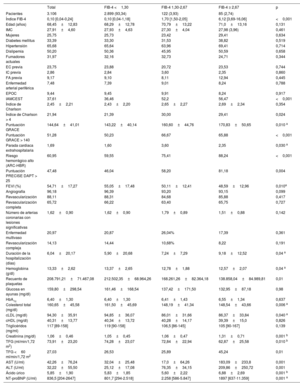
RESULTADOSEn la tabla 1 se muestran las características clínicas de la cohorte. En los 3.106 pacientes, la mediana del índice FIB-4 fue de 0,10 (0,04-0,24) y el 6,66% tenía un FIB-4 ≥ 1,30. Tiene interés señalar que no se observaron diferencias significativas en la mayor parte de las manifestaciones clínicas, pero los pacientes con FIB-4 > 2,67 ingresaron con mayor frecuencia por un IAMCEST, sufrieron más paradas cardiacas extrahospitalarias y mostraron una puntuación GRACE más alta. No se observaron diferencias en las lesiones coronarias ni en las revascularizaciones. En cambio, sí hubo diferencias significativas en las determinaciones bioquímicas (tabla 1). Los pacientes con FIB-4 <1,30 presentaron valores más altos de hemoglobina, colesterol total y colesterol unido a lipoproteínas de baja densidad, pero fueron los que tuvieron una concentración más baja de NT-proBNP. Los pacientes con FIB-4 > 2,67 fueron los de menor filtrado glomerular y mayor uricemia. Se observó una tendencia significativa (p=0,0021) a valores de FIB-4 superiores en los pacientes con una clase de Killip más alta, pero el FIB-4 solo fue significativamente superior en los pacientes en Killip IV respecto a la Killip I (1,80 [6,03] frente a 0,56 [5,79]; p=0,031). De los 1.633 pacientes clasificados como en riesgo hemorrágico no alto, 67 (4,1%) presentaban un índice FIB-4 > 1,30.
Características clínicas de la cohorte en función del índice FIB-4
| Total | FIB-4 <1,30 | FIB-4 1,30-2,67 | FIB-4 ≥ 2,67 | p | |
|---|---|---|---|---|---|
| Pacientes | 3.106 | 2.899 (93,34) | 122 (3,93) | 85 (2,74) | |
| Índice FIB-4 | 0,10 [0,04-0,24] | 0,10 [0,04-1,18] | 1,70 [1,50-2,05] | 6,12 [3,69-16,06] | <0,001 |
| Edad (años) | 68,45±12,83 | 68,29±12,78 | 70,79±13,22 | 71,0±13,16 | 0,131 |
| IMC | 27,91±4,60 | 27,93±4,63 | 27,30±4,04 | 27,98 (3,96) | 0,461 |
| Mujeres | 25,75 | 25,73 | 23,42 | 29,41 | 0,634 |
| Diabetes mellitus | 33,39 | 33,30 | 31,53 | 38,82 | 0,519 |
| Hipertensión | 65,68 | 65,64 | 63,96 | 69,41 | 0,714 |
| Dislipemia | 50,20 | 50,36 | 45,95 | 50,59 | 0,658 |
| Fumadores actuales | 31,97 | 32,16 | 32,73 | 24,71 | 0,344 |
| EC previa | 23,75 | 23,88 | 20,72 | 23,53 | 0,744 |
| IC previa | 2,86 | 2,84 | 3,60 | 2,35 | 0,860 |
| FA previa | 9,17 | 9,10 | 8,11 | 12,94 | 0,445 |
| Enfermedad arterial periférica | 7,48 | 7,39 | 9,01 | 8,24 | 0,788 |
| EPOC | 9,44 | 9,45 | 9,91 | 8,24 | 0,917 |
| IAMCEST | 37,61 | 36,46 | 52,2 | 56,47 | <0,001 |
| Índice de Charlson | 2,45±2,21 | 2,43±2,20 | 2,65±2,27 | 2,69±2,34 | 0,354 |
| Índice de Charlson > 4 | 21,94 | 21,39 | 30,00 | 29,41 | 0,024 |
| Puntuación GRACE | 144,64±41,01 | 143,22±40,14 | 160,60±44,76 | 170,83±50,65 | 0,010 a |
| Puntuación GRACE > 140 | 51,28 | 50,23 | 66,67 | 65,88 | <0,001 |
| Parada cardiaca extrahospitalaria | 1,69 | 1,60 | 3,60 | 2,35 | 0,030 a |
| Riesgo hemorrágico alto (ARC-HBR) | 60,95 | 59,55 | 75,41 | 88,24 | <0,001 |
| Puntuación PRECISE DAPT > 25 | 47,48 | 46,04 | 58,20 | 81,18 | 0,004 |
| FEVI (%) | 54,71±17,27 | 55,05±17,48 | 50,11±12,41 | 48,59±12,96 | 0,010a |
| Angiografía | 96,18 | 96,39 | 93,20 | 93,15 | 0,099 |
| Revascularización | 88,11 | 88,31 | 84,68 | 85,88 | 0,417 |
| Revascularización completa | 65,72 | 66,22 | 63,40 | 65,75 | 0,727 |
| Número de arterias coronarias con lesiones significativas | 1,62±0,90 | 1,62±0,90 | 1,79±0,89 | 1,51±0,88 | 0,142 |
| Enfermedad multivaso | 20,97 | 20,87 | 26,04% | 17,39 | 0,361 |
| Revascularización compleja | 14,13 | 14,44 | 10,68% | 8,22 | 0,191 |
| Duración de la hospitalización (días) | 6,04±20,17 | 5,90±20,68 | 7,24±7,29 | 9,18±12,52 | 0,04 a |
| Hemoglobina (g/dl) | 13,33±2,62 | 13,37±2,65 | 12,78±1,88 | 12,57±2,07 | 0,04 a |
| Recuento de plaquetas | 208.791,21±71.467,08 | 212.502,35±68.964,26 | 168.261,26±82.364,18 | 138.858,04±84.989,81 | 0,01 |
| Glucosa en ayunas (mg/dl) | 159,80±298,54 | 161,46±168,54 | 137,42±171,50 | 132,95±87,18 | 0,98 |
| HbA1c | 6,40±1,30 | 6,40±1,30 | 6,41±1,43 | 6,55±1,34 | 0,637 |
| Colesterol total (mg/dl) | 160,65±45,58 | 161,50±45,69 | 148,19±41,34 | 148,54±43,66 | 0,006 a |
| cLDL (mg/dl) | 94,30±35,91 | 94,85±36,07 | 86,01±31,66 | 86,37±33,84 | 0,040 a |
| cHDL (mg/dl) | 40,31±13,77 | 40,34±13,72 | 40,28±14,17 | 39,39±15,0 | 0,826 |
| Triglicéridos (mg/ml) | 117 [89-158] | 119 [90-158] | 106,5 [86-145] | 105 [90-167] | 0,139 |
| Creatinina (mg/dl) | 1,06±0,46 | 1,05±0,45 | 1,06±0,47 | 1,31±0,71 | 0,001 b |
| TFG (ml/min/1,72 m2) | 73,91±23,20 | 74,28±23,07 | 72,84±22,94 | 62,87±25,58 | 0,010 b |
| TFG <60 ml/min/1,72 m2 | 27,03 | 26,53 | 25,89 | 45,24 | 0,01 |
| AST (U/ml) | 42,26±76,24 | 32,04±25,48 | 17,0±64,26 | 183,09±233,8 | 0,001 |
| ALT (U/ml) | 32,22±55,50 | 25,12±17,08 | 76,35±34,15 | 209,86±250,72 | 0,001 |
| Ácido úrico | 5,85±1,90 | 5,83±1,85 | 5,60±2,22 | 6,88±2,69 | 0,001 b |
| NT-proBNP (U/ml) | 836,5 [204-2647] | 801,7 [294-2.518] | 2.258 [586-5.847] | 1897 [637-11.359] | 0,001 a |
ALT: alanina transaminasa; AST: aspartato transaminasa; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto agudo de miocardio con elevación del segmento ST.TFG: tasa de filtrado glomerular.
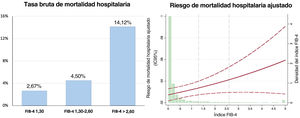
En los pacientes con FIB-4 <1,30, la duración de la hospitalización fue más corta y la FEVI al alta fue más alta. La tasa de mortalidad hospitalaria fue del 3,06% (92 pacientes). Tal como se muestra en la figura 1, la tasa bruta de mortalidad hospitalaria fue mayor en cada categoría del índice FIB-4. El análisis multivariante ajustado por edad, sexo, diabetes, enfermedad coronaria previa, hemoglobina, revascularización y puntuación GRACE mostró una asociación significativa de la mortalidad hospitalaria con el índice FIB-4 y el riesgo de mortalidad hospitalaria (odds ratio [OR] = 1,24; IC95%, 1,04-1,47; p=0,016). Al analizarlos por categorías, se observó que los pacientes con > 2,67 tenían un riesgo de mortalidad hospitalaria 2 veces superior (OR = 2,35; IC95%, 1,045-5,278; p=0,038), pero no se apreció un aumento significativo en los pacientes clasificados en la franja de 1,30-2,67 (OR = 0,93; IC95%, 0,33-2,64; p=0,891). El modelo estaba bien calibrado (p=0,97) y tenía una buena capacidad de discriminación ().
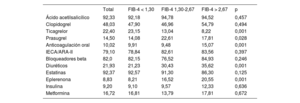
Resultados posteriores al altaEn la tabla 2 se presentan los tratamientos médicos al alta recomendados. Los pacientes con FIB-4 > 2,67 fueron tratados con menos frecuencia con ticagrelor o prasugrel, pero recibieron con mayor frecuencia anticoagulación, eplerenona y diuréticos. Se dispuso del seguimiento posterior al alta del 96% de la cohorte, con una mediana de seguimiento de 1.112 [intervalo intercuartílico, 633-1.796] días. Durante ese periodo, fallecieron 464 pacientes (15,8%) y 308 (10,52%) muertes fueron atribuibles a causas cardiovasculares. Los pacientes clasificados con FIB-4 > 1,30 presentaron unas tasas brutas de mortalidad más altas (); sin embargo, tras aplicar un ajuste por edad, sexo, diabetes, revascularización, FEVI, puntuación GRACE y tratamientos médicos, el índice FIB-4 no mostró ningún valor pronóstico.
Tratamiento médico al alta en función del índice FIB-4
| Total | FIB-4 < 1,30 | FIB-4 1,30-2,67 | FIB-4 > 2,67 | p | |
|---|---|---|---|---|---|
| Ácido acetilsalicílico | 92,33 | 92,18 | 94,78 | 94,52 | 0,457 |
| Clopidogrel | 48,03 | 47,90 | 46,96 | 54,79 | 0,494 |
| Ticagrelor | 22,40 | 23,15 | 13,04 | 8,22 | 0,001 |
| Prasugrel | 14,50 | 14,08 | 22,61 | 17,81 | 0,028 |
| Anticoagulación oral | 10,02 | 9,91 | 9,48 | 15,07 | 0,001 |
| IECA/ARA-II | 79,10 | 78,84 | 82,61 | 83,56 | 0,397 |
| Bloqueadores beta | 82,0 | 82,15 | 76,52 | 84,93 | 0,246 |
| Diuréticos | 21,93 | 21,23 | 30,43 | 35,62 | 0,001 |
| Estatinas | 92,37 | 92,57 | 91,30 | 86,30 | 0,125 |
| Eplerenona | 8,83 | 8,21 | 16,52 | 20,55 | 0,001 |
| Insulina | 9,20 | 9,10 | 9,57 | 12,33 | 0,636 |
| Metformina | 16,72 | 16,81 | 13,79 | 17,81 | 0,672 |
ARA-II: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina.
Los valores expresan porcentajes.
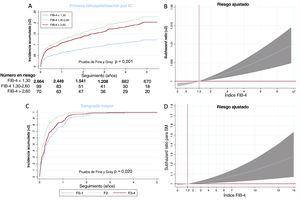
Un total de 328 pacientes (10,41%) tuvieron al menos 1 reingreso hospitalario por IC y 179 (5,28%), al menos 2. Tal como se muestra en la figura 2A, los pacientes con FIB-4 <1,30 tuvieron un riesgo de reingreso por IC significativamente inferior, y tras el por edad, sexo, diabetes, revascularización, IC previa, FEVI, hemoglobina, fibrilación auricular, filtrado glomerular, concentración de NT-proBNP y tratamiento médico, se apreció un riesgo continuo en función del índice FIB-4 (figura 2B). Los pacientes con FIB-4 > 1,30 mostraron mayor riesgo de primer reingreso por IC (sHR = 1,61; IC95%, 1,02-2,44; p =0,04).
Tiempo hasta el primer reingreso hospitalario por insuficiencia cardiaca (IC) según el FIB-4 por categorías (A) o como variable continua (B). Incidencia sin ajustar de primeros eventos de sangrado mayor según el índice FIB-4 por categorías (C) y subdistribución ajustada de valores de hazard ratio (sHR) del índice FIB-4 como variable continua (D).
La mayor tasa de rehospitalizaciones por IC recurrentes fue la observada en los pacientes con FIB-4 > 2,67 (10,33/100 pacientes), seguidos de aquellos con FIB-4 de 1,30-2,67 (4,87/100 pacientes). Las diferencias persistieron tras el ajuste por edad, sexo, diabetes, revascularización, IC previa, hemoglobina, fibrilación auricular y tratamiento médico. Un índice FIB-4 > 2,67 mostraba una asociación independiente con un mayor riesgo de reingresos por IC recurrentes (IRR = 1,70; IC95%, 1,25-2,30; p =0,001).
Sangrado mayorLa incidencia de SM después del alta fue del 6,19% (195 pacientes). Como se muestra en la figura 2C, los pacientes con un índice FIB-4 > 1,30 presentaron una tasa bruta de SM significativamente superior. Tras ajustar por edad, sexo, diabetes, revascularización, IC previa, hemoglobina, fibrilación auricular y tratamiento médico, se observó un riesgo continuo en función del índice FIB-4 (figura 3B). Un índice FIB-4 ≥ 1,30 mostró una asociación independiente con mayor riesgo de SM (sHR = 1,62; IC95%, 0,105-2,88; p=0,030). En los pacientes riesgo hemorrágico no alto, la reclasificación con el índice FIB-4 fue del 13,27%, la mejora de reclasificación neta fue de 0,058 (0,091-1,105) y la mejora de discriminación integrada fue de 0,02 (0,001-0,060).
Evaluación del índice FIB-4 durante la hospitalización por síndrome coronario agudo, comparación antes-despuésSe dispuso de valores de AST, ALT y recuento de plaquetas previos al ingreso por SCA en el 63% de los pacientes. La mediana de tiempo transcurrido hasta el análisis de sangre previo fue de 315,5 [193-522] días antes del ingreso. Los resultados hospitalarios de AST, en comparación con los valores previos disponibles, fueron un 35,7% superiores (42 frente a 27 U/l; p =0,001) y los valores de ALT, un 28,1% superiores (23,2 frente a 32,2 U/l; p =0,001); no se observaron diferencias en el recuento de plaquetas (). Se repitieron todos los análisis utilizando los valores de AST y de ALT de los análisis de muestras de sangre obtenidas antes del ingreso por SCA y no se observaron asociaciones significativas con ninguno de los parámetros de valoración. Se dispuso de valores de transaminasas posteriores al alta en un 75% de la cohorte y se observó una disminución de tan solo un 8% en la AST y la ALT; no hubo ningún cambio en el recuento de plaquetas.
DISCUSIÓNEste análisis de una cohorte de pacientes consecutivos hospitalizados por un SCA pone de manifiesto la repercusión de la fibrosis hepática en la mortalidad hospitalaria y en la IC y el SM después del alta (figura 3). Los resultados resaltan el valor predictivo de la fibrosis hepática para 2 de las complicaciones más importantes en los pacientes dados de alta después de un SCA. Dado que las manifestaciones clínicas y los resultados son similares a lo indicado en estudios previos21–24, creemos que nuestros datos podrían ser representativos y trasladables a la práctica clínica.
Pensamos que nuestros resultados podrían tener consecuencias clínicas para el tratamiento, como la selección de los pacientes que podrían ser candidatos a pautas abreviadas de doble antiagregación plaquetaria o un seguimiento más estrecho, así como para la selección de los pacientes a los que se debería recomendar una ecografía hepática para un estudio diagnóstico más detallado.
El rendimiento diagnóstico del índice FIB-4 podría no estar cuestionado durante una hospitalización por un SCA. Las transaminasas pueden aumentar en los pacientes con un shock cardiogénico o una respuesta inflamatoria elevada2 y esto podría haber llevado a sobrestimar la prevalencia de la fibrosis hepática. Las concentraciones de transaminasas durante un ingreso por SCA fueron significativamente superiores a los valores previos, pero las cifras posteriores al alta fueron también más altas, aunque ligeramente inferiores a las obtenidas al ingreso. Se ha demostrado que el rendimiento diagnóstico del índice FIB-4 es de una gran exactitud en diferentes formas de hepatopatía grasa asociada a una disfunción metabólica4,25. Creemos que estos resultados son solamente generadores de hipótesis y que podrían reflejar la repercusión del SCA en la función hepática.
La EHGNA, a la que precede la fibrosis hepática, será la principal causa de insuficiencia hepática y trasplante hepático en 202526. La determinación del índice FIB-4 es muy accesible, aporta una de las puntuaciones más precisas25 y muestra una buena correlación con las técnicas de imagen que constituyen el patrón de referencia22. No obstante, su repercusión en el pronóstico de los pacientes con una enfermedad cardiovascular, en especial los que presentan un SCA, no se había demostrado hasta ahora. El seguimiento prospectivo de 4 años de 1.773 pacientes adultos de la NASH Clinical Research Network reveló que un índice FIB-4 > 2,67 implica mayor riesgo de mortalidad por cualquier causa, incluso cuando no hay descompensación hepática9. En cambio, la EHGNA no se asoció con un mayor riesgo de infarto de miocardio o ictus en una cohorte amplia de participantes sin enfermedad cardiovascular27. Nuestros resultados muestran una asociación lineal e independiente entre el índice FIB-4 y el riesgo de mortalidad hospitalaria, y los pacientes con valores > 2,67 presentaron una tasa de mortalidad 2 veces superior. Aunque estudios previos han señalado que el examen de detección sistemática de la EHGNA en las personas con diabetes podría no tener una relación de coste-efectividad favorable28, nuestros datos aportan una evidencia concluyente respecto a la repercusión de la EHGNA en la mortalidad por SCA. No obstante, en todas las guías de práctica clínica sobre la prevención primaria y secundaria de la enfermedad cardiovascular se recomiendan encarecidamente las modificaciones del estilo de vida y la reducción del peso29.
A diferencia de lo ocurrido con el riesgo de mortalidad hospitalaria, se observó ausencia de efecto del índice FIB-4 en la mortalidad a largo plazo. En los participantes con EHGNA hubo un aumento del riesgo de IC incidente, con un riesgo superior de IC con fracción de eyección conservada7. Los resultados de este estudio indican también una relación epidemiológica entre la EHGNA y la IC que va más allá de la asociada con tener factores de riesgo comunes debido a la persistencia de un aumento del riesgo tras el ajuste por factores clínicos y demográficos, como ha resaltado también la declaración de la American Heart Association4. Estos resultados se han verificado también en un metanálisis que puso de manifiesto el mayor riesgo de IC incidente en los pacientes con EHGNA8. Nuestros resultados concuerdan plenamente con estas observaciones y aportan evidencia del riesgo independiente de rehospitalizaciones por IC que el índice FIB-4 implica. Nuestro grupo ha descrito anteriormente que el riesgo de IC es muy superior al riesgo de mortalidad en los pacientes con SCA sin IC o disfunción de ventrículo izquierdo previas30, y este nuevo estudio respalda el papel relevante del FIB-4 en la identificación de los pacientes con un riesgo elevado de incidencia de IC.
La actual definición binaria de los pacientes con riesgo hemorrágico alto del Academic Research Consortium for High Bleeding Risk6 no incluye las anomalías hepáticas de grado leve o moderado y tan solo considera la cirrosis con hipertensión portal como un criterio de riesgo mayor. La mayoría de los factores de la coagulación se sintetizan en el hígado, y una disfunción hepática subclínica podría asociarse con deterioro de estos factores4. Se ha demostrado que esta definición permite identificar con exactitud a los pacientes con mayor riesgo de SM31, y nuestro grupo ha demostrado también que los pacientes con un SCA clasificados como en riesgo hemorrágico alto tienen un riesgo de SM superior al de mortalidad por cualquier causa en los primeros 6-7 años siguientes al SCA32. En este nuevo estudio, la prevalencia de pacientes con un riesgo hemorrágico alto entre los que tenían un FIB-4 > 1,30 fue > 50% y, además, un FIB-4 > 1,30 se asoció de manera independiente con mayor riesgo de SM tras el alta hospitalaria. Estos resultados resaltan que un importante porcentaje de pacientes clasificados como en riesgo hemorrágico no alto según las recomendaciones actuales tenían un índice FIB-4 > 1,30 y que esto se asocia con un riesgo superior de SM. Además, la mejora de reclasificación neta, que corresponde al promedio de la mejora ponderada, y la mejora de discriminación integrada, que corresponde a la mejora del promedio de sensibilidad sin sacrificar el promedio de especificidad, fueron positivas. Por consiguiente, nuestros resultados respaldan la determinación del índice FIB-4, en especial en pacientes con un riesgo hemorrágico no alto.
Estos resultados subrayan la influencia de la fibrosis hepática leve o moderada en el SM. Creemos que los resultados podrían respaldar el mensaje de la importancia clínica y pronóstica que tiene la evaluación de la fibrosis hepática mediante el índice FIB-4 en todos los pacientes con SCA.
LimitacionesNuestro estudio tiene ciertas limitaciones que es preciso abordar. En primer lugar, como en todos los estudios observacionales, hay algunas limitaciones inherentes, como la ausencia de aleatorización, las modificaciones a largo plazo en los tratamientos médicos o las variables no controladas. En segundo lugar, en nuestra base de datos no se registra de manera sistemática el consumo de alcohol, por lo que no se puede descartar el posible efecto del abuso del alcohol en la función hepática. En tercer lugar, el diagnóstico del inicio de una IC también podría ser discutible. Dado que se analizaron solo los reingresos hospitalarios, creemos que se incluyeron casos de IC reales y no casos de disnea o trastornos respiratorios. Por último, dado que el periodo de inclusión fue largo, el empleo de tratamientos concomitantes podría haber cambiado en ese periodo. No obstante, teniendo en cuenta que las características clínicas y la incidencia de eventos a largo plazo son similares a lo observado en estudios previos21–24,31, creemos que las limitaciones mencionadas podrían no haber tenido una repercusión relevante en nuestros resultados.
CONCLUSIONESLa evaluación de la fibrosis hepática mediante el índice FIB-4 identifica a los pacientes con SCA no solo con mayor riesgo de mortalidad hospitalaria, sino también a los que tienen mayor riesgo de IC y SM después del alta. El índice FIB-4 es un parámetro muy accesible y, aunque no es un método establecido para el diagnóstico de la fibrosis hepática, podría usarse para seleccionar a los pacientes a los que aplicar luego métodos de diagnóstico por la imagen.
FINANCIACIÓNEste estudio contó con el apoyo del Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV).
CONTRIBUCIÓN DE LOS AUTORESConceptualización y metodología: A. Cordero; análisis formal y redacción de la primera versión del original: A. Cordero y D. Escribano; investigación: M.A. Quintanilla y J.M. López-Ayala; obtención de los datos: M.D. Masía, D. Cazorla, E. Martínez Rey-Rañal y J. Moreno-Arribas; revisión, corrección y supervisión de la primera versión: P. Zuazola.
CONFLICTO DE INTERESESA. Cordero declara pagos por conferencias de AstraZeneca, AMGEN, Bristol-Myers Squibb, Ferrer, Boehringer Ingelheim, MSD, Daichy Sankio, Novartis, Novo Nordisk y Amarin, y actividades de consultoría de AstraZeneca, Ferrer, AMGEN, Novartis, Lilly, Novo Nordisk y Amarin. Los demás autores no tienen conflictos de intereses.
- –
La fibrosis hepática precede a la cirrosis y la disfunción hepática grave.
- –
En la enfermedad de hígado graso no alcohólico, la fibrosis hepática se asocia con diabetes, obesidad y enfermedad cardiovascular.
- –
La disfunción hepática avanzada es un importante factor de riesgo de sangrado mayor.
- –
La fibrosis hepática puede evaluarse no solo con técnicas de diagnóstico por la imagen, sino también mediante índices clínicos, como el FIB-4.
- –
El 6,5% de los pacientes ingresados por un SCA tienen un índice FIB-4 > 1,3.
- –
Un índice FIB-4 ≥ 1,3 se asoció con mayor riesgo de primera hospitalización y hospitalizaciones por insuficiencia cardiaca recurrentes.
- –
Un índice FIB-4 ≥ 1,3 se asoció a un mayor riesgo de sangrado mayor.