Múltiples ensayos clínicos han demostrado de forma inequívoca que los medicamentos hipocolesterolemiantes disminuyen el riesgo de enfermedad cardiovascular ateroesclerótica de una muy amplia variedad de personas. A pesar de esto, muchas personas tratadas de manera óptima según los estándares actuales presentan eventos isquémicos potencialmente letales. Evidencia experimental y clínica reciente indica que la inflamación persistente en la placa ateroesclerótica es uno de los principales mecanismos subyacentes a este riesgo residual, lo que ha abierto la puerta a la aplicación de fármacos antiinflamatorios para la prevención de la enfermedad cardiovascular. En este artículo se repasa el conocimiento actual sobre la biología de la citocina interleucina 1β, un regulador clave de la respuesta inflamatoria en la placa ateroesclerótica y la diana del primer ensayo clínico que ha demostrado que un fármaco antiinflamatorio puede reducir de forma efectiva el riesgo cardiovascular. Se discuten los importantes retos a los que se enfrentan los inhibidores de la interleucina 1β y otros compuestos antiinflamatorios en su traslación al ámbito clínico y se identifican otras posibles dianas en esta vía de señalización, prometedoras en el contexto cardiovascular.
Palabras clave
Desde que Russell Ross describiera la ateroesclerosis como una enfermedad inflamatoria en 19991,2, han sido miles los estudios de investigación básica que han proporcionado cada vez más pruebas de la clara relación existente entre la inflamación y la enfermedad cardiovascular (ECV) ateroesclerótica. Se acepta de manera generalizada que la exposición a varios factores de riesgo cardiovascular, en particular el colesterol unido a lipoproteínas de baja densidad (cLDL) circulante, induce una disfunción del endotelio que desencadena una respuesta inflamatoria en la pared vascular. Cuando la exposición se vuelve crónica, esta inflamación vascular, incapaz de neutralizar las sustancias perjudiciales, continúa indefinidamente y, en consecuencia, lleva a la formación, el crecimiento y la rotura o erosión final de la placa ateroesclerótica, causa principal de la mayor parte de los eventos cardiovasculares de isquemia. Así pues, si bien la inflamación no es necesariamente uno de los principales desencadenantes de la aterogénesis, es un intermediario fundamental entre los factores de riesgo cardiovascular y la aparición de la ateroesclerosis y sus complicaciones. Aunque siguen sin estar totalmente claras las complejidades de la respuesta inflamatoria en la placa ateroesclerótica, numerosos estudios preclínicos3–5 respaldan la idea de que la inflamación descontrolada es un elemento fundamental de la ateroesclerosis. Además, varios biomarcadores de inflamación sistémica se han asociado con un mayor riesgo de eventos cardiovasculares en humanos6,7. Sin embargo, atacar la inflamación para prevenir la ECV fue algo que muchos investigadores y médicos consideraron tradicionalmente no viable, dada la naturaleza compleja de las respuestas inflamatorias y los notables efectos adversos de los fármacos antiinflamatorios, que dificultan su uso en los trastornos crónicos. En efecto, los fármacos antiinflamatorios no esteroideos, los fármacos de este tipo más habitualmente utilizados, aumentan más que evitan los eventos cardiovasculares8. Esta situación ha empezado a cambiar a causa de los resultados positivos del ensayo Canakinumab Anti-inflammatory Thrombosis Outcome Study (CANTOS), que demostró por primera vez que atacar la inflamación puede ser efectivo para prevenir la ECV9. Esta serie de enfoques de Revista Española de Cardiología tiene por objetivo proporcionar un breve resumen de la situación actual en el desarrollo de fármacos antiinflamatorios para prevenir la ECV. En el presente artículo, se resumen los resultados del ensayo CANTOS y su posible relevancia en el contexto clínico, y se discuten otras posibles dianas relacionadas con la interleucina 1-beta (IL-1β), el mediador proinflamatorio que se inhibió en este ensayo clínico. Un artículo relacionado describe otros enfoques antiinflamatorios, además de la inhibición de la IL-1β, que actualmente se están probando en ensayos clínicos para prevenir la ECV o pueden convertirse en la base de futuros ensayos.
IL-1β: UN ELEMENTO FUNDAMENTAL DE LA INFLAMACIÓN Y LA ATEROGÉNESISLa IL-1β, una de las primeras citocinas reconocidas como tales, es un mediador clave de la comunicación célula a célula dentro del sistema inmunitario y un elemento fundamental de las respuestas inmunitarias locales y sistémicas en la ECV ateroesclerótica10. La IL-1β induce en la pared vascular la expresión local de varias citocinas, quimiocinas y moléculas de adhesión que contribuyen a la selección y la diferenciación de los leucocitos circulantes10. Además, la IL-1β también puede inducir su propia expresión a través de un circuito de retroalimentación positivo que amplifica la respuesta inflamatoria11–15. Hay también indicios de que la IL-1β fomenta un cambio fenotípico proaterogénico en las células vasculares del músculo liso por inducción de la expresión de citocinas proinflamatorias mientras que reduce la expresión de los marcadores del músculo liso16. A nivel sistémico, la IL-1β contribuye a la inflamación induciendo principalmente la producción de la citocina proinflamatoria IL-6, de la que se sabe que tiene acciones endocrinas y provoca una respuesta de fase aguda en el hígado que puede detectarse por la presencia de proteína C reactiva (PCR) en el torrente circulatorio17. Por ello, la PCR, cuantificada mediante un ensayo de alta sensibilidad (PCRas), está ampliamente aceptada como biomarcador fiable y clínicamente relevante de la inflamación sistémica producida por IL-1β/IL-6.
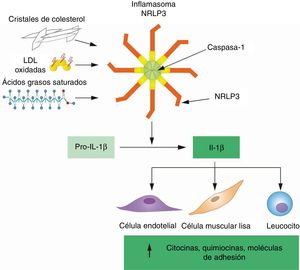
En concordancia con su función principal en la inflamación, la producción de IL-1β y su señalización están sujetas a diversos grados de regulación, lo que se debe tener en cuenta cuando se diseñan estrategias farmacológicas para inhibir esta citocina para la prevención de la ECV. El gen de la IL-1β no se expresa de forma constitutiva y su transcripción solo se induce por la exposición a estímulos proinflamatorios, más habitualmente productos microbianos o, en el contexto de la pared arterial, lípidos y lipoproteínas oxidados que comparten características moleculares con estructuras microbianas y son reconocidos por los mismos receptores de reconocimiento de patrones18,19. Más allá de la transcripción, la IL-1β también se regula después de la traducción, ya que requiere un procesado proteolítico para hacerse biológicamente activa y secretarse al espacio extracelular. La principal enzima proteolítica encargada de esta escisión es la caspasa-1, que se somete a la activación por unos complejos macromoleculares de señalización, conocidos como inflamasomas, que solo se ensamblan en respuesta a estímulos específicos. Los desencadenantes de la activación de los inflamasomas son varios, y entre ellos destacan patógenos microbianos y no microbianos, estructuras cristalinas y productos de la degradación celular que una proteína sensora que hay en el interior del inflamasoma reconoce como indicadores de patógenos o alteraciones de la homeostasis. Entre las diversas proteínas sensoras involucradas en la activación del inflamasoma, la NLRP3 es la más relevante en el contexto de la ECV ateroesclerótica, ya que se activa por varios lípidos aterogénicos, con mayor frecuencia cristales de colesterol, un subproducto de la acumulación de LDL oxidadas en las placas ateroescleróticas (figura 1)20–25. Una vez secretada, varios inhibidores competitivos aún pueden modular la función de la IL-1β, tales como el receptor 2 de la IL-1 (IL-1R2), un receptor señuelo que se une a la IL-1β pero es incapaz de señalizar, o el antagonista del receptor de la IL-1 (IL-1RA), un inhibidor competitivo secretado de la unión de la IL-1β con su receptor de señalización IL-1R126.
Los lípidos aterogénicos activan el inflamasoma NLRP3 para activar la IL–1β por medio de su procesamiento proteolítico. La transcripción del gen IL1B produce pro-IL-1β, una proteína precursora que carece de actividad biológica y se escinde por la caspasa–1 para generar la forma activa de la IL-1β, que se secreta al espacio extracelular. En la placa ateroesclerótica, la actividad de la caspasa–1 y la escisión de la IL–1β dependen principalmente del inflamasoma NLRP3, que se activa al detectar lípidos aterogénicos, con mayor frecuencia cristales de colesterol. Una vez secretada, la IL–1β induce la expresión de varias citocinas, quimiocinas y moléculas de adhesión, fundamentales para la perpetuación de la inflamación en la placa ateroesclerótica. IL-1β: interleucina 1 beta; LDL: lipoproteínas de baja densidad; NLRP3: dominio pirínico de la familia NLR que consta de 3.
Gran cantidad de datos procedentes de estudios en animales han demostrado las acciones proaterogénicas generales del inflamasoma NLRP3, la IL-1β y varios intermediarios de la señalización relacionados con esta citocina22,27–35. Aunque también se han publicado algunos resultados contradictorios36,37, la función directa de la IL-1β en la aterogénesis que la mayoría de estos estudios experimentales indican proporcionó una base sólida para el ensayo clínico CANTOS, que probaba la eficacia de la inhibición de la inflamación producida por la IL-1β en la prevención secundaria de los eventos ateroescleróticos de isquemia en pacientes con alto riesgo.
CANTOS: EL RESULTADO FINAL DE DOS DÉCADAS DE INVESTIGACIONES SOBRE LA INFLAMACIÓN VASCULAR EN LA ATEROESCLEROSISDesde la concepción del ensayo CANTOS, sus resultados eran esperados con gran expectación por la comunidad cardiovascular, ya que se concibió con gran cuidado como un estudio a gran escala de prueba de concepto de la hipótesis inflamatoria de la ECV ateroesclerótica38.
La elección de la IL-1β como objetivo para esta primera prueba clínica sobre la base inflamatoria de la ECV ateroesclerótica no fue al azar. Eran muchas las razones para identificar la IL-1β como candidata ideal entre la gran cantidad de citocinas que se han estudiado en el contexto de la ateroesclerosis experimental39,40. La IL-1β y el inflamasoma NLRP3 se encuentran en gran concentración en las placas ateroescleróticas humanas20,41, y son considerables las pruebas experimentales que indican que esta citocina desempeña un papel importante en la aterogénesis22,27–35. Cabe destacar que la inhibición de la IL-1β no afecta a las concentraciones de colesterol42, al contrario que la inhibición de otras citocinas proinflamatorias como la IL-6, que con frecuencia aumenta el cLDL43,44, lo que pone en duda su potencial como objetivo para prevenir la ECV. La existencia de varios inhibidores de la IL-1β aprobados clínicamente que han mostrado seguridad y eficacia en el tratamiento de las enfermedades reumáticas y autoinmunitarias también respaldaba la elección de la IL-1β como diana. De ellos, para inhibir la IL-1β en el ensayo CANTOS, se eligió el canakinumab, un anticuerpo monoclonal humano que neutraliza la IL-1β45, por su mayor especificidad y su mayor vida media en el torrente circulatorio comparado con otros inhibidores de la IL-1β, lo que permite la inhibición eficaz de la IL-1β con dosis subcutáneas administradas cada 3 meses. Además, en contraste con otros inhibidores de la IL-1β, el canakinumab no inhibe la citocina relacionada IL-1α, que es diferente desde un punto de vista funcional. Esta selectividad es importante, ya que estudios experimentales recientes han demostrado que la inhibición de la IL-1α o la IL-1β puede tener efectos notablemente distintos en el remodelado de la placa ateroesclerótica34. Estas características justificaron la elección del canakinumab en lugar del anakinra, una forma recombinante humana de la IL-1RA, que requiere inyecciones diarias y bloquea tanto la IL-1α como la IL-1β.
La población en estudio del ensayo CANTOS se seleccionó con mucho cuidado, ya que incluye exclusivamente a pacientes que habían tenido un infarto de miocardio (IM) con indicios claros de inflamación persistente, de los que sería de esperar una mejoría considerable tras el tratamiento con fármacos antiinflamatorios. Más concretamente, el CANTOS es un ensayo aleatorizado, a doble ciego y controlado con placebo que incluyo a ∼10.000 pacientes con antecedentes de IM e indicios de inflamación sistémica (PCRas ≥ 2 mg/l), a los que se trató según las guías vigentes (incluido tratamiento con estatinas) y en quienes se constató una concentración basal de cLDL baja (∼80 mg/dl). Se aleatorizó a los participantes en el estudio a recibir placebo o una de 3 dosis distintas (50, 150, 300 mg) de canakinumab, que se administraban cada 3 meses.
Los principales hallazgos positivos del ensayo CANTOS fueron una reducción del riesgo relativo en el objetivo primario —un compuesto de IM no mortal, ictus no mortal y muerte cardiovascular— estadísticamente significativa del 15% entre los pacientes asignados a la dosis intermedia de 150 mg9. La dosis de 300 mg tuvo un efecto protector similar, que no alcanzó significatividad estadística, mientras que la dosis de 50 mg de canakinumab se relacionó con una reducción no significativa del riesgo relativo, del 7%. El tratamiento con canakinumab redujo la inflamación sistémica (concentración de la PCRas) de manera dependiente de la dosis, sin reducir la concentración de cLDL, tal como era de esperar según estudios piloto anteriores42. Los resultados positivos asociados con dosis de canakinumab más altas en el ensayo CANTOS se debieron principalmente a la reducción del IM y la notable disminución en la necesidad de intervenciones de revascularización coronaria (como angioplastia o cirugía de revascularización), sin cambios significativos en el ictus no mortal o la mortalidad cardiovascular. Otros análisis del ensayo CANTOS han confirmado recientemente las ventajas del canakinumab en la prevención de los episodios recurrentes de isquemia en pacientes afectados por diabetes46 y enfermedad renal crónica47. Sin embargo, estas ventajas tienen como contrapartida un efecto adverso importante: un aumento significativo de las infecciones mortales. Esta observación, aunque esperada, destaca los inconvenientes de las estrategias antiinflamatorias en el contexto de las enfermedades crónicas e indica que será necesario realizar un control minucioso de cualquiera de los posibles pacientes tratados con canakinumab o con fármacos antiinflamatorios parecidos.
En conjunto, los resultados positivos del ensayo CANTOS representaban el resultado final de más de 20 años de investigaciones, pero también el primer paso en el camino para aplicar tratamientos antiinflamatorios en la ECV. En consecuencia, este ensayo fue recibido con entusiasmo por los investigadores y los médicos que forman parte de la comunidad cardiovascular48–55. Inevitablemente, ahora hay indicios claros de que tratar la inflamación —por lo menos la inflamación producida por la IL-1β— reduce el riesgo vascular en algunos pacientes con alto riesgo independientemente de que se produzcan cambios en los lípidos circulantes. La inflamación ya no puede considerarse simplemente un epifenómeno, sino más bien una fuerza motriz de la ateroesclerosis y una posible diana para la intervención. Así pues, tras el ensayo CANTOS, quedan las puertas abiertas para comprobar todo un conjunto de dianas inflamatorias. No obstante, sigue sin estar claro si el canakinumab llegará al contexto clínico.
ATACAR LA IL-1β CON CANAKINUMAB: ¿LISTO PARA LA ARENA CLÍNICA?A pesar del éxito del ensayo CANTOS, la aplicación clínica del canakinumab se enfrenta a numerosas dificultades. Aunque significativa, la reducción del riesgo absoluto, incluso en sujetos con inflamación sistémica persistente, puede considerarse moderada: debería tratarse a 156 pacientes con una dosis intermedia de canakinumab durante 1 año para evitar un evento del objetivo primario9. Este beneficio moderado tiene que añadirse al alto coste del canakinumab, que actualmente es de por lo menos 64.000 dólares estadounidenses anuales teniendo en cuenta el régimen de tratamiento del ensayo CANTOS. Un estudio reciente de rentabilidad médica indicaba que sería necesaria una reducción drástica del 98% del coste para que el canakinumab se considerase rentable para prevenir la ECV secundaria56. Aunque actualmente este compuesto se considera un fármaco huérfano y podría esperarse cierta reducción de su precio si fuera aprobado para la prevención de la ECV, es poco probable que esto bastara para convertirlo en un medicamento económicamente viable. Así pues, dado que su beneficio clínico es relativamente moderado y su coste es alto, no está justificado el uso generalizado del canakinumab en pacientes con ECV ateroesclerótica establecida.
El coste-efectividad del canakinumab podría mejorarse si se identificaran subgrupos de pacientes en quienes esta reducción de los eventos clínicos fuera superior a la media. En otras palabras, el canakinumab podría hallar su nicho clínico en el contexto de la medicina personalizada. En este contexto cabe señalar que un análisis secundario del ensayo CANTOS reveló que la magnitud de la inhibición de la inflamación conseguida en cada uno de los participantes fue un determinante principal de la eficacia clínica del canakinumab. Los sujetos con una concentración de PCRas < 2 mg/l después de la dosis inicial mostraron beneficios clínicos considerablemente superiores, con una reducción del riesgo relativo de eventos cardiovasculares adversos del 25%, además de una reducción del 31% de la mortalidad cardiovascular y la mortalidad por cualquier causa57. Se observó un beneficio aún mayor en los sujetos cuya concentración de IL-6 circulante, un marcador más específico de la inflamación producida por la IL-1β58, era inferior a la media del estudio (1,65 ng/l). Estos hallazgos llevaron a los investigadores del ensayo CANTOS a proponer que la concentración de PCRas tras la primera dosis podría ser de utilidad para identificar a los pacientes que obtendrían un mayor beneficio del tratamiento prolongado con canakinumab. No obstante, este enfoque basado en los pacientes «respondedores» tiene algunas limitaciones metodológicas59 y ha sido revisado desfavorablemente por organismos reguladores de fármacos, que han rechazado las solicitudes de ampliar las indicaciones del canakinumab en la prevención secundaria de la ECV basándose en este análisis60.
Otra oportunidad para utilizar el canakinumab como estrategia terapéutica personalizada en la prevención de la ECV es la que ha aparecido junto con el concepto emergente de la hematopoyesis clonal y el descubrimiento de su importancia fisiopatológica en la ECV ateroesclerótica61. Los estudios de secuenciación han revelado que el envejecimiento se acompaña a menudo de la expansión de clones hematopoyéticos portadores de mutaciones adquiridas que proporcionan un beneficio competitivo a la célula mutante. Entre el 10 y el 20% de los sujetos sanos mayores de 60 años presentan esta hematopoyesis clonal producida por una mutación somática, que resulta en una fracción considerable de células inmunitarias portadoras de una mutación que puede afectar a su funcionalidad. Varios estudios de cohortes recientes indican que los portadores de mutaciones relacionadas con la hematopoyesis clonal muestran el doble de riesgo de presentar ECV ateroesclerótica62,63 y los datos experimentales respaldan que en algunos casos esto puede estar relacionado con una exacerbación de la inflamación producida por la IL-1β. Dos estudios independientes descubrieron que la presencia de mutaciones de pérdida de función en TET2, uno de los genes mutados con mayor frecuencia en sujetos que muestran hematopoyesis clonal, acelera la ateroesclerosis al mismo tiempo que causa una producción excesiva de IL-1β63,64. Además, uno de estos estudios mostró que suprimir la producción de IL-1β inhibiendo el inflamasoma NLRP3 confiere una mayor protección contra la ateroesclerosis en ratones portadores de células mutantes del gen TET264. Así pues, los estudios llevados a cabo con ratones indican claramente que el bloqueo de la IL-1β puede ser especialmente eficaz para prevenir la ECV en sujetos portadores de mutaciones somáticas en el gen TET2. A favor de esta posibilidad, un análisis exploratorio de secuenciación de la cohorte del ensayo CANTOS reveló que el canakinumab confiere una reducción del riesgo relativo del 64% en portadores de mutaciones en TET2, lo que representa que se cuadruplique el beneficio respecto al conjunto de la población del ensayo CANTOS65. Y lo más importante, esta magnitud de la reducción del riesgo de ECV en una población específica con alto riesgo de ECV ateroesclerótica podría compensar el elevado coste de este fármaco y justificar su uso como estrategia personalizada de cuidado preventivo en sujetos portadores de mutaciones somáticas en el gen TET2. No obstante, este análisis post hoc tiene que interpretarse con prudencia y se requieren otros estudios clínicos para confirmar la eficacia del canakinumab en sujetos portadores de mutaciones en las células sanguíneas en el gen TET2 o en otros genes relacionados con la hematopoyesis clonal.
INHIBICIÓN DE LA IL-1β MÁS ALLÁ DE LA ECV ATEROESCLERÓTICALa inflamación desempeña un papel fundamental en muchas enfermedades relacionadas con la edad y, en consecuencia, los enfoques antiinflamatorios tienen un valor potencial en múltiples trastornos vinculados a la edad avanzada. En este contexto, la evidencia emergente, tanto clínica como experimental, indica que el bloqueo de la IL-1β puede tener aplicaciones en enfermedades no ateroescleróticas tanto en el ámbito cardiovascular como más allá. De hecho, uno de los hallazgos más fascinantes del ensayo CANTOS fue que el canakinumab llevaba a una reducción drástica de la incidencia de cáncer de pulmón y de la mortalidad por cáncer, con una notable reducción del riesgo relativo del 77% en el caso de los cánceres de pulmón mortales66. Si bien meramente exploratorios y generadores de hipótesis, estos hallazgos del ensayo CANTOS suscitaron nuevos ensayos clínicos para evaluar si el canakinumab puede ser un tratamiento adyuvante efectivo a la hora de tratar determinados tumores con una base inflamatoria conocida, tal como un cáncer de pulmón45,67. En el contexto cardiovascular, los resultados del ensayo CANTOS indican que el canakinumab puede ser efectivo para limitar los episodios agudos de insuficiencia cardiaca68, una posibilidad que también coincide con datos experimentales69,70. Curiosamente, la hematopoyesis clonal se ha asociado con un agravamiento de la insuficiencia cardiaca, tanto en el contexto experimental71 como en el clínico72, lo que respalda el alto valor potencial de seleccionar como diana la IL-1β en sujetos que portan mutaciones somáticas relacionadas con este fenómeno. Las pruebas preclínicas también indican que el bloqueo de la IL-1β puede ser beneficioso en el contexto del remodelado cardiaco adverso posterior al IM agudo69,73–76. Más recientemente, se ha visto que la inhibición de la IL-1β tras la reperfusión mejora el remodelado cardiaco y la función según un modelo de lesión por isquemia/reperfusión llevado a cabo con ratas69. Asimismo, un sustituto murino del canakinumab muestra efectos positivos cuando se administra tras la isquemia/reperfusión en un modelo experimental de ictus agudo77. En conjunto, estos estudios respaldan la posibilidad de nuevos ensayos clínicos que cuenten con una potencia estadística adecuada para evaluar la eficacia de la inhibición de la IL-1β en una variedad de enfermedades cardiovasculares y cerebrovasculares.
MÁS ALLÁ DEL ENSAYO CANTOS: OBJETIVOS ALTERNATIVOS EN LA VÍA DE LA IL-1βTeniendo en cuenta el éxito del tratamiento anti-IL-1β en el ensayo CANTOS y las dificultades a las que se enfrenta su aplicación clínica, es lógico buscar dianas alternativas en esta vía que podrían mostrar ventajas con respecto al canakinumab. Un paso por encima de la IL-1β en esta vía, el inflamasoma NLRP3 merece especial atención como posible objetivo en la ECV ateroesclerótica y otros trastornos inflamatorios78. Se ha observado que inhibiendo la secreción de IL-1β a través del MCC95079, un inhibidor muy selectivo de NLRP3, se atenúa la aparición de ateroesclerosis en ratones hipercolesterolémicos80, en particular en condiciones de hematopoyesis clonal producida por la mutación del gen TET264. El MCC950 también reduce el tamaño del infarto y la disfunción cardiaca tras la isquemia/reperfusión en modelos de IM agudo81 y mejora el remodelado cardiaco y la función en modelos murinos de insuficiencia cardiaca71. Y lo que es más importante, se ha sugerido que los antagonistas de NLRP3 podrían tener menores efectos adversos relacionados con la infección que los inhibidores directos de la IL-1β, ya que bloquean preferentemente la secreción de IL-1β producida por dislipemia, al tiempo que conservan la activación de otros inflamasomas que permiten la producción de IL-1β en respuesta a infecciones82. Aunque esta posibilidad se apoya en algunos datos experimentales83, sigue sin haberse probado clínicamente. Además, el bloqueo del NLRP3 también impediría la liberación de otras moléculas de señalización escindidas por los inflamasomas, tales como la citocina IL-18. Así pues, la inhibición del NLRP3 puede no ser equivalente a la neutralización de la IL-1β en cuanto a inmunodepresión se refiere, y se requieren estudios más exhaustivos para determinar si los antagonistas del NLRP3 tienen realmente alguna ventaja sobre los inhibidores de la IL-1β en la prevención de la ECV.
Otro objetivo de valor potencial es la citocina IL-6, que media algunas de las acciones inmunomoduladoras de la IL-1β17. La IL-1β induce claramente la expresión de la IL-6, y la reducción de la concentración de IL-6 probablemente sea un mecanismo importante de ateroprotección en los pacientes tratados con canakinumab58. No obstante, la IL-1β también ejerce numerosas acciones proaterogénicas importantes independientes de la IL-6, por lo que la inhibición de la IL-6 no debería considerarse equivalente al bloqueo de la IL-1β. En efecto, los inhibidores de la IL-6 se enfrentan a dificultades únicas en el contexto de la ECV a causa de los efectos complejos de esta citocina en el metabolismo. La IL-6 ejerce acciones contradictorias en la homeostasis de la glucosa y la resistencia de la insulina a varios niveles84–86. Además, tal como se ha mencionado anteriormente, la inhibición de la IL-6 con frecuencia lleva a un aumento del cLDL43,44, que arroja dudas sobre su valor potencial en la prevención de la ECV ateroesclerótica. Sin embargo, son continuos los esfuerzos para elaborar estrategias dirigidas a la IL-6 para la ECV. Un ensayo clínico a pequeña escala mostró que el tocilizumab, un anticuerpo monoclonal dirigido contra el receptor de la IL-6, reduce la inflamación y la liberación de troponina después de un IM sin elevación del segmento ST87, lo que indica un menor tamaño del infarto, observación que actualmente el ensayo en curso ASSAIL88 está corroborando.
CONCLUSIONESLa inhibición de la IL-1β con canakinumab ha sido la primera estrategia antiinflamatoria que ha completado de manera satisfactoria la transición de los estudios preclínicos a los estudios clínicos en la ECV ateroesclerótica. Y al hacerlo, ha validado la hipótesis inflamatoria de la aterotrombosis y ha abierto la puerta a la aparición de nuevos enfoques antiinflamatorios ante la ECV ateroesclerótica, tanto en la vía de señalización inflamasoma/IL-1β como más allá. Aunque es poco probable que su uso se generalice para prevenir la ECV, los tratamientos dirigidos contra la IL-1β pueden convertirse en una poderosa herramienta en estrategias de medicina de precisión. Es tentador vislumbrar un futuro en el que datos de secuenciación del ADN, biomarcadores sanguíneos y técnicas de diagnóstico por imagen se utilicen para identificar a los sujetos que pese al tratamiento óptimo de los factores de riesgo tradicionales siguen estando en riesgo de sufrir una ECV y pueden obtener mayores beneficios adicionales de los fármacos antiinflamatorios.
FINANCIACIÓNJ.J. Fuster cuenta con el apoyo del programa Ramón y Cajal del Ministerio de Ciencia, Innovación y Universidades español (RYC-2016-20026). El Centro Nacional de Investigaciones Cardiovasculares (CNIC) está financiado por el Instituto de Salud Carlos III (ISCIII), el Ministerio de Ciencia, Innovación y Universidades y la Fundación Pro CNIC, y es un Centro de Excelencia Severo Ochoa (SEV-2015-0505).
CONFLICTO DE INTERESESV. Viana-Huete no tiene nada que declarar. J.J. Fuster es coinventor de una patente relacionada con el tratamiento de las enfermedades cardiometabólicas asociadas con las mutaciones somáticas en TET2.