El vericiguat, un estimulador oral de la guanilato ciclasa soluble de administración una vez al día, se ha estudiado ampliamente en pacientes con insuficiencia cardiaca y fracción de eyección reducida (IC-FEr). El estudio VICTORIA es un ensayo clínico de fase 3 que comparó frente a placebo el vericiguat añadido al tratamiento recomendado por las guías, en 5.050 pacientes sintomáticos con IC-FEr y una descompensación reciente de la IC (hospitalización por IC en los 6 meses previos o necesidad de diuréticos intravenosos en los 3 meses previos), que representan a una población en alto riesgo y vulnerable no bien caracterizada en otros ensayos clínicos. En ese estudio, el vericiguat redujo significativamente el riesgo de la variable primaria combinada de muerte cardiovascular o primera hospitalización por IC, con un excelente perfil de seguridad. En comparación con otros ensayos clínicos de IC-FEr, como el PARADIGM-HF, DAPA-HF, EMPEROR-REDUCED o GALACTIC-HF, los pacientes incluidos en el VICTORIA eran mayores, estaban más sintomáticos y tenían concentraciones de péptidos natriuréticos más altas. En términos absolutos, en comparación con estos estudios, los resultados del VICTORIA fueron similares o incluso mejores en algunos casos. Por lo tanto, el vericiguat proporciona beneficios adicionales en el abordaje de esta población.
Palabras clave
El vericiguat es un estimulador oral de la guanilato ciclasa soluble, mecanismo por el que se restablece la vía óxido nítrico-guanilato ciclasa soluble-guanosina monofosfato cíclico (GMPc)1-3. El GMPc está alterado en los pacientes con insuficiencia cardiaca (IC), y su normalización se traduce en beneficios clínicos cardiacos, vasculares y renales, entre otros4,5. El vericiguat, que se administra una vez al día, estimula la guanilato ciclasa soluble de manera dependiente de la concentración, esto es, a mayor concentración de vericiguat, mayor estimulación de la enzima3.
La biodisponibilidad absoluta del vericiguat con la comida es elevada (93%), un 19% mayor que en los sujetos en ayunas, por lo que se recomienda la administración concomitante con los alimentos. Tras la ingestión de vericiguat 10 mg, la concentración máxima se alcanza aproximadamente a las 4 h tras una comida con alto contenido en calorías y grasas, y ≤ 2,5 h cuando se administra en ayunas. En estado estacionario, el volumen de distribución es de aproximadamente 44l en voluntarios sanos. La unión a proteínas es elevada (98%), principalmente a la albúmina sérica. En pacientes con IC, la vida media es de 30 h (18-22 h en voluntarios sanos). En voluntarios sanos, aproximadamente el 53% del vericiguat se excreta por la orina y el 45% por las heces. La vía principal de metabolismo es mediante la glucuronida- ción, a través de UGT1A9 y UGT1A1, mientras que el metabolismo mediado por el citocromo P450 es muy pequeño, lo que disminuye el riesgo de interacciones con otros fármacos2,3,6-9.
Aunque la exposición al vericiguat aumenta con el deterioro de la función renal respecto a los sujetos con función renal normal, este incremento no se considera clínicamente significativo, si bien no hay datos suficientes en pacientes con enfermedad renal grave o en hemodiálisis. Del mismo modo, aunque también la exposición al vericiguat aumenta con el deterioro de la función hepática, este incremento no es clínicamente significativo, aunque tampoco hay datos en el caso de daño hepático grave. Igualmente, la farmacocinética de vericiguat no se modifica significativamente por la edad, el sexo, el peso corporal, la raza o los valores basales de péptidos natriuréticos. En consecuencia, no hay que ajustar la dosis en función de ninguna de estas características2,3,6-9.
Se ha estudiado el riesgo de interacciones farmacológicas con diferentes tratamientos para múltiples comorbilidades, incluida la IC, como el ácido acetilsalicílico, la warfarina, el sacubitrilo-valsartán o la nitroglicerina, y el riesgo de interacciones es bajo. Sin embargo, no se recomienda el tratamiento concomitante con inhibidores de la fosfo- diesterasa 5, por el riesgo de hipotensión2,3,10-12.
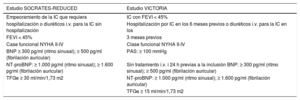
Desarrollo clínico del vericiguat en la insuficiencia cardiaca con fracción de eyección reducidaEl vericiguat se ha estudiado ampliamente en diferentes ensayos clínicos, principalmente los estudios SOCRATES13-15 y VICTORIA16,17. tabla 1).
| Estudio SOCRATES-REDUCED | Estudio VICTORIA |
|---|---|
| Empeoramiento de la IC que requiera | IC con FEVI < 45% |
| hospitalización o diuréticos i.v. para la IC sin hospitalización | Hospitalización por IC en los 6 meses previos o diuréticos i.v. para la IC en los |
| FEVI < 45% | 3 meses previos |
| Case funcional NYHA II-IV | Clase funcional NYHA II-IV |
| BNP ≥ 300 pg/ml (ritmo sinusal); ≥ 500 pg/ml (fibrilación auricular) | PAS: ≥ 100 mmHg |
| NT-proBNP: ≥ 1.000 pg/ml (ritmo sinusal); ≥ 1.600 pg/ml (fibrilación auricular) | Sin tratamiento i.v. i 24 h previas a la inclusión BNP: ≥ 300 pg/ml (ritmo sinusal); ≥ 500 pg/ml (fibrilación auricular) |
| TFGe ≥ 30 ml/min/1,73 m2 | NT-proBNP: ≥ 1.000 pg/ml (ritmo sinusal); ≥ 1.600 pg/ml (fibrilación auricular) |
| TFGe ≥ 15 ml/min/1,73 m2 |
FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; i.v.: intravenosos; NYHA: New York Heart Association; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimada.
El programa SOCRATES consistió en 2 ensayos clínicos de fase II, multicéntricos, aleatorizados, a doble ciego, de grupos paralelos y controlados con placebo: el SOCRATES-REDUCED, para pacientes con insuficiencia cardiaca con fracción de eyección (FE) reducida (ICFEr) (< 45%), y el SOCRATES-PRESERVED, para pacientes con FE ≥ 45%13. El SOCRATES-REDUCED se llevó a cabo con el objetivo de encontrar la dosis óptima de vericiguat. Incluyó a 456 sujetos de Europa, América del Norte y Asia clínicamente estables en las 4 semanas siguientes a un evento de empeoramiento de IC crónica, definido como hospitalización por IC o necesidad de diuréticos intravenosos para la IC pero sin hospitalización, FE < 45%, en clase funcional de la New York Heart Association (NYHA) II-IV, péptidos natriuréticos elevados y una tasa de filtrado glomerular estimada ≥ 30 ml/min/1,73 m2 (tabla 1). Se aleatorizó a los pacientes a placebo o una de las 4 dosis de vericiguat (1,25, 2,5, 5 o 10 mg) durante 12 semanas. La variable primaria del estudio fueron los cambios en la concentración de la fracción aminoterminal del pro- péptido natriurético cerebral (NT-proBNP) a lo largo del estudio. Aunque la diferencia entre el vericiguat (analizado en conjunto) y el grupo de placebo no fue significativa en cuanto al cambio en NT-proBNP (diferencia de medias, -0,122; intervalo de confianza del 90% [IC90%], -0,32 a +0,07; p = 0,15), análisis secundarios indican una relación dosis-respuesta del vericiguat, de modo que a mayor dosis, mayor reducción de NT-proBNP (p < 0,02). El vericiguat se toleró bien. Además, en un análisis secundario, numéricamente se observaron menores tasas de muerte y hospitalizaciones por IC en los grupos de vericiguat 5 mg y 10 mg en comparación con placebo14. En un subanálisis del estudio SOCRATES-REDUCED se objetivaron cambios de la proteína C reactiva ultrasensible a lo largo del estudio del +0,2%, el -19,5%, el -24,3%, el -25,7% y el -31,9% en los grupos de placebo y de vericiguat 1,25, 2,5, 5 y 10 mg respectivamente (vericiguat 10 mg frente a placebo, p = 0,035). Además, hubo una mayor proporción de sujetos en el grupo de vericiguat que alcanzaron cifras ≤ 3,0 mg/l de proteína C reactiva ultrasensible en comparación con el placebo. Con respecto al ácido úrico, estas cifras fueron +5,0%, -1,3%, -1,1%, -3,5% y -5,3% respectivamente (vericiguat 5 mg frente a placebo, p = 0,02; vericiguat 10 mg frente a placebo, p = 0,004). Hubo una mayor proporción de sujetos en el grupo de vericiguat que alcanzaron valores ≤ 7,0 mg/l de ácido úrico15. En consecuencia, los resultados del estudio SOCRATES-REDUCED indicaban un efecto beneficioso del vericiguat en péptidos natriuréticos, estado inflamatorio y eventos clínicos dependiente de la dosis, y este efecto fue máximo con vericiguat 10 mg.
El estudio VICTORIA es un ensayo clínico de fase III aleatorizado, multicéntrico, a doble ciego, de grupos paralelos y controlado con placebo para determinar la eficacia y la seguridad del vericiguat en pacientes con IC-FEr16. Incluyó a un total de 5.050 pacientes con IC y FE < 45%, en NYHA II-IV, con péptidos natriuréticos elevados (péptido natriurético cerebral [BNP], ≥ 300 pg/ml si ritmo sinusal, ≥ 500 pg/ml si en fibrilación auricular; NT-proBNP, ≥ 1.000 pg/ml si en ritmo sinusal, ≥ 1.600 pg/ml si en fibrilación auricular), que hubiesen ingresado por IC en los 6 meses previos a la inclusión en el estudio o hubiesen recibido diuréticos intravenosos para la IC en los 3 meses previos, tuviesen la presión arterial sistólica ≥ 100 mmHg y sin tratamiento endovenoso al menos las 24 h previas a la inclusión (tabla 1). Se alea- torizó a los pacientes a vericiguat 1 vez al día (dosis objetivo, 10 mg) o placebo. La variable primaria del estudio fue la combinación de muerte de causa cardiovascular o primera hospitalización por IC16,17.
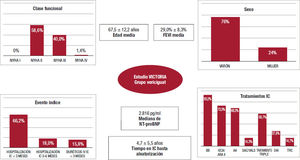
En cuanto a las características basales de los pacientes incluidos, la media de edad fue de aproximadamente 68 años, la mayoría eran varones, en NYHA II-III y la FE media fue del 29%. Con respecto al evento índice, aproximadamente 2 tercios se habían hospitalizado en los 3 meses previos a la inclusión. Con respecto al tratamiento basal de la IC, el 93% de los pacientes tomaban bloqueadores beta; el 73%, inhibidores de la enzima de conversión de la angiotensina/antagonis- tas del receptor de la angiotensina II; el 69%, antagonistas de la aldos- terona; el 14%, sacubitrilo-valsartán y el 59%, tratamiento triple (figura 1)17. En consecuencia, se trata de una población con IC-FEr en tratamiento óptimo, lo que permite establecer el beneficio para este tipo de pacientes del vericiguat añadido al tratamiento médico óptimo recomendado por las guías de práctica clínica18.
Características basales del grupo de vericiguat del estudio VICTORIA. Figura elaborada con datos de Armstrong17. AA: antagonistas de la aldosterona; ARA-II: antagonistas del receptor de la angiotensina II; BB: bloqueadores beta; DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; IV: intravenoso; NYHA: New York Heart Association; SAC/VALS: sacubitrilo-valsartán; TRC: terapia de resincronización cardiaca.
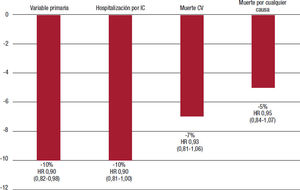
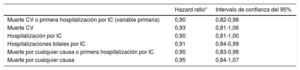
Tras una mediana de seguimiento de 10,8 meses, la variable primaria ocurrió en el 35,5% de los pacientes del grupo de vericiguat y el 38,5% de los del grupo de placebo (hazard ratio [HR] = 0,90; IC95%, 0,82-0,98; p = 0,02). Asimismo, el 27,4 y el 29,6% de los pacientes se hospitalizaron por IC (HR = 0,90; IC95%, 0,81-1,00). Con vericiguat también hubo una reducción significativa de las hospitalizaciones totales por IC. El vericiguat redujo significativamente la variable combinada de muerte por cualquier causa u hospitalización por IC (el 37,9 frente al 40,9%; HR = 0,90; IC95%, 0,83-0,98; p = 0,02). En cambio, no hubo diferencias significativas en la mortalidad cardiovascular (tabla 2). y (figura 2.)17
Resultados principales del estudio VICTORIA
| Hazard ratio* | Intervalo de confianza del 95% | |
|---|---|---|
| Muerte CV o primera hospitalización por IC (variable primaria) | 0,90 | 0,82-0,98 |
| Muerte CV | 0,93 | 0,81-1,06 |
| Hospitalización por IC | 0,90 | 0,81-1,00 |
| Hospitalizaciones totales por IC | 0,91 | 0,84-0,99 |
| Muerte por cualquier causa o primera hospitalización por IC | 0,90 | 0,83-0,98 |
| Muerte por cualquier causa | 0,95 | 0,84-1,07 |
Tabla elaborada con datos de Armstrong17. CV: cardiovascular; IC: insuficiencia cardiaca.
*Vericiguat frente a placebo.
Resultados principales del estudio VICTORIA. Figura elaborada con datos de Armstrong17. Variable primaria: muerte CV o primera hospitalización por IC. CV: cardiovascular; HR: hazard ratio; IC: insuficiencia cardiaca.
Los resultados del vericiguat frente a placebo con respecto a la variable primaria combinada fueron homogéneos entre los diferentes subgrupos de pacientes analizados, incluidos la edad, el sexo, la clase funcional, la función renal basal, la FE basal, el evento índice o la prescripción de sacubitrilo-valsartán (tabla 3)17.
Análisis de subgrupos de la variable primaria (muerte cardiovascular o primera hospitalización por insuficiencia cardiaca) en el estudio VICTORIA
| Hazard ratio* | Intervalo de confianza del 95% | |
|---|---|---|
| General | 0,90 | 0,82-0,98 |
| Edad | ||
| < 65 años | 0,81 | 0,70-0,95 |
| > 65 años | 0,94 | 0,84-1,06 |
| < 75 años | 0,84 | 0,75-0,94 |
| > 75 años | 1,04 | 0,88-1,21 |
| Sexo | ||
| Varón | 0,90 | 0,81-1,00 |
| Mujer | 0,88 | 0,73-1,08 |
| Clase funcional basal | ||
| NYHA I/II | 0,91 | 0,80-1,04 |
| NYHA III/IV | 0,87 | 0,77-0,99 |
| TFGe basal | ||
| ≥ 30 ml/min/1,73 m2 | 1,06 | 0,83-1,34 |
| > 30 a i 60 ml/min/1,73 m2 | 0,84 | 0,73-0,96 |
| > 60 ml/min/1,73 m2 | 0,92 | 0,80-1,07 |
| Fracción de eyección basal | ||
| < 35% | 0,88 | 0,79-0,97 |
| ≥ 35% | 0,96 | 0,81-1,14 |
| < 40% | 0,88 | 0,80-0,97 |
| ≥ 40% | 1,05 | 0,81-1,36 |
| NT-proBNP basal por cuartiles | ||
| Q1 (≤ 1.556 pg/ml) | 0,78 | 0,62-0,99 |
| Q2 (1.556-2.816 pg/ml) | 0,73 | 0,60-0,90 |
| Q3 (2.816-5.314 pg/ml) | 0,82 | 0,69-0,99 |
| Q4 (> 5.314 pg/ml) | 1,16 | 0,99-1,35 |
| Evento índice | ||
| Diuréticos intravenosos < 3 meses | 0,78 | 0,60-1,02 |
| Hospitalización < 3 meses | 0,93 | 0,84-1,04 |
| Hospitalización 3-6 meses | 0,85 | 0,67-1,07 |
| Administración basal de sacubitrilo- valsartán | ||
| Sí | 0,88 | 0,70-1,11 |
| No | 0,90 | 0,81-0,99 |
Tabla elaborada con datos de Armstrong17. NYHA: New York Heart Association; TFGe: tasa de filtrado glomerular estimada.
*Vericiguat frente a placebo.
Recientemente se han publicado diferentes subanálisis del estudio VICTORIA que han ayudado a entender mejor qué pacientes se van a beneficiar más del tratamiento con vericiguat.
Es bien conocido que el periodo tras una hospitalización por IC es especialmente vulnerable a complicaciones como la rehospitalización por IC o la muerte19. En un análisis preespecificado del estudio VICTORIA se analizó el efecto del vericiguat en función del evento índice (hospitalización por IC < 3 meses, hospitalización por IC de 3 a 6 meses y pacientes que requirieron diuréticos intravenosos por IC sin hospitalización). En general, los eventos fueron más frecuentes en los pacientes que se hospitalizaron, sobre todo en el grupo < 3 meses en comparación con el grupo de pacientes que precisaron diuréticos intravenosos sin hospitalizar. El beneficio del vericiguat fue homogéneo entre los 3 subgrupos analizados no solo en la variable primaria, sino también con la mortalidad por cualquier causa y las hospitalizaciones por IC. Sin embargo, hubo una tendencia a un mayor beneficio con vericiguat conforme aumentaba el tiempo desde la hospitalización por IC20.
Por otra parte, se hizo un análisis preespecificado en función de la concentración de NTproBNP en el momento de la aleatorización. La mediana de NT-proBNP al inicio del estudio fue 2.816 [intervalo inter- cuartílico, 1.556-5.314] pg/ml. En este caso sí se observó una interacción significativa entre la eficacia del vericiguat y los valores de péptidos natriuréticos (p = 0,002). Así, el efecto positivo del vericiguat frente a placebo en la variable primaria fue evidente en los pacientes con NT-proBNP ≤ 8.000 pg/ml, que eran el 86% de la población del VICTORIA (HR = 0,85; IC95%, 0,76-0,95), pero más intenso en los pacientes con NT-proBNP ≤ 4.000 pg/ml, que eran el 65% de la población del VICTORIA (HR = 0,77; IC95%, 0,68-0,88). En cambio, este beneficio dejó de ser significativo en los sujetos con NT-proBNP > 8.000 pg/ml (HR = 1,16; IC95%, 0,94-1,41)21. En consecuencia, para los pacientes con péptidos natriuréticos muy aumentados (una pequeña proporción de los pacientes con IC-FEr), será necesario optimizar el tratamiento, incluyendo el tratamiento reductor adecuado para obtener el máximo beneficio del vericiguat.
La hemoglobina y la anemia se relacionan con eventos adversos en pacientes con IC-FEr22. Estudios previos habían observado una asociación entre el riociguat, un estimulador de la guanilato ciclasa soluble, y la anemia y también en modelos animales entre la hemoglobina y la vía de la guanilato ciclasa, si bien el mecanismo resultaba incierto23. Dado que en el estudio VICTORIA hubo más casos de anemia con vericiguat (el 7,6 frente al 5,7%), se estudió específicamente la asociación entre el vericiguat y sus beneficios en función de las concentraciones de hemoglobina, así como la aparición de anemia. En el estudio VICTORIA se definió la anemia como hemoglobina < 13,0 g/dl en varones y < 12,0 g/dl en mujeres. En situación basal, el 35,7% de los pacientes (n = 1.719) tenían anemia. En la semana 16, 1.643 pacientes tenían anemia, de los que 284 fueron nuevos casos para vericiguat y 219 para placebo (p < 0,001). Después de la semana 16 no hubo más reducciones de la hemoglobina a lo largo del estudio. El beneficio del vericiguat fue independiente de los valores de hemoglobina24. Por lo tanto, si bien con el vericiguat hubo un discreto descenso de las concentraciones de hemoglobina hasta la semana 16, esto no se tradujo en una menor eficacia.
En otro subanálisis del estudio VICTORIA se analizó si la eficacia del vericiguat variaba en función del tratamiento de base para la IC (inhibidores del sistema renina-angiotensina, sacubitrilo-valsartán, bloqueadores beta, antagonistas de la aldosterona, tratamiento triple), y se objetivó que el beneficio es independiente de que el paciente estuviera tomando cualquiera de estos tratamientos, solos o en combinación, o de la dosis objetivo alcanzada con cada uno de ellos25. Por lo tanto, el vericiguat se puede añadir en cualquier momento, cualquiera sea el tratamiento de base para la IC, ya que siempre se va a obtener un beneficio adicional.
La insuficiencia renal, el empeoramiento de la función renal y la hiperpotasemia son relativamente frecuentes en el paciente con IC- FEr, en particular aquellos con una disfunción ventricular más grave. Por miedo al riesgo de efectos secundarios, para estos pacientes se emplean menos fármacos con demostrado beneficio clínico, sobre todo los inhibidores del sistema renina-angiotensina-aldosterona, lo que empeora aún más el pronóstico para esta población26-29. El estudio VICTORIA incluyó a pacientes con tasas de filtrado glomerular estimadas de hasta 15 ml/min/1,73 m2. Durante el seguimiento no se observaron diferencias entre ambos grupos de tratamiento en cuanto a variaciones de la función renal. Asimismo, el beneficio del vericiguat no se afectó por la función renal y también fue independiente de que el paciente sufriera un empeoramiento de la función renal30. En consecuencia, el vericiguat supone un valor añadido para esta población en la que son frecuentes la insuficiencia renal o el empeoramiento de la función renal.
La fibrilación auricular es otra comorbilidad frecuente en la IC-FEr, y su presencia se asocia con un peor pronóstico. Por otra parte, tratamientos como los inhibidores del sistema renina-angiotensina-aldos- terona o los bloqueadores beta pueden reducir la incidencia de fibrilación auricular en estos pacientes31,32. En el estudio VICTORIA el 47% de los pacientes tenían antecedentes de fibrilación auricular. Los pacientes con fibrilación auricular tenían un mayor riesgo de muerte cardiovascular que los que no la presentaban. El beneficio del vericiguat tanto en la variable primaria como en sus componentes fue independiente de la presencia de fibrilación auricular. El 6,1% de los pacientes sin fibrilación auricular previa la sufrieron durante el seguimiento, y en esto no influyó el tratamiento con vericiguat33.
Los resultados de los ensayos clínicos son importantes para establecer la eficacia y seguridad de un fármaco en condiciones controladas. Sin embargo, en ocasiones es difícil trasladar los resultados de los ensayos clínicos a la vida real34. Así, los pacientes que sufren un empeoramiento de la IC en la práctica clínica tienen un peor perfil de riesgo y un mayor riesgo de eventos35. Un reciente análisis del registro PINNACLE mostró que los pacientes incluidos en el estudio VICTORIA eran representativos de los pacientes con IC-FEr atendidos en la práctica clínica diaria36.
Los pacientes con IC-FEr que ya han tenido un empeoramiento de la IC consumen gran cantidad de recursos sanitarios, lo que incrementa de manera notable los costes asociados al cuidado médico37,38. Por otra parte, el principal componente del gasto sanitario en el paciente con IC es las hospitalizaciones, por lo que los fármacos que las reduzcan de manera significativa también van a disminuir los costes asociados39. Un reciente análisis realizado en Estados Unidos observó que la adición de vericiguat al tratamiento médico recomendado por las guías se asociaba con menores costes sanitarios, precisamente por su capacidad para reducir las hospitalizaciones por IC40.
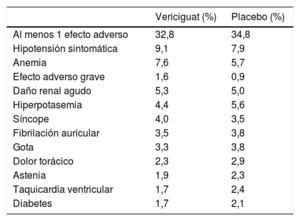
SeguridadEl 89,2% de los pacientes alcanzaron la dosis objetivo de vericiguat de 10 mg. Los principales efectos adversos observados en el estudio VICTORIA se muestran en la tabla 4). En general, los efectos adversos graves fueron numéricamente menos frecuentes con el vericiguat que con placebo (el 32,8 frente al 34,8%). En cuanto a los efectos adversos más relevantes, no hubo diferencias significativas en el riesgo de hipotensión sintomática (el 9,1 frente al 7,9%; p = 0,12) ni en el riesgo de síncope (el 4,0 frente al 3,5%; p = 0,30). Aunque hubo una ligera disminución de la presión arterial sistólica inicial en ambos grupos de tratamiento, posteriormente estas cifras volvieron a los valores basales. Sin embargo, se describieron más casos de anemia con vericiguat (el 7,6 frente al 5,7%), si bien los casos graves fueron poco frecuentes (el 1,6 frente al 0,9%). El cambio de la hemoglobina en las primeras 16 semanas del estudio fue una media de -0,38 ± 1,27 g/dl con el vericiguat y -0,14 ± 1,30 en el grupo de placebo17. En resumen, el vericiguat es un fármaco bien tolerado y con bajo riesgo de efectos secundarios que se puede emplear fácilmente en la práctica clínica.
Efectos adversos cardiovasculares más relevantes del estudio VICTORIA
| Vericiguat (%) | Placebo (%) | |
|---|---|---|
| Al menos 1 efecto adverso | 32,8 | 34,8 |
| Hipotensión sintomática | 9,1 | 7,9 |
| Anemia | 7,6 | 5,7 |
| Efecto adverso grave | 1,6 | 0,9 |
| Daño renal agudo | 5,3 | 5,0 |
| Hiperpotasemia | 4,4 | 5,6 |
| Síncope | 4,0 | 3,5 |
| Fibrilación auricular | 3,5 | 3,8 |
| Gota | 3,3 | 3,8 |
| Dolor torácico | 2,3 | 2,9 |
| Astenia | 1,9 | 2,3 |
| Taquicardia ventricular | 1,7 | 2,4 |
| Diabetes | 1,7 | 2,1 |
Tabla elaborada con datos de Armstrong et al17.
En los últimos años se han publicado importantes ensayos clínicos sobre el tratamiento de pacientes con IC-FEr, entre ellos los estudios PARADIGM-HF (sacubitrilo-valsartán), DAPA-HF (dapagliflozina), EMPEROR-REDUCED (empagliflozina) y GALACTIC-HF (omecamtiv mecarbil)41-44.
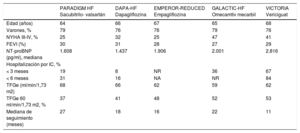
En primer lugar, es importante señalar que no se pueden hacer comparaciones directas entre los distintos ensayos clínicos, ya que hay diferencias relevantes entre ellos en cuanto a criterios de inclusión y tiempo de seguimiento. Así, mientras que el PARADIGM-HF y el GALACTIC-HF incluyeron a pacientes con FE ≤ 35%, los estudios con los inhibidores del SGLT2 incluyeron FE ≤ 40% y el VICTORIA, FE < 45%. En cuanto al filtrado glomerular, el estudio VICTORIA incluyó a pacientes a partir de 15 ml/min/1,73 m2; el EMPEROR-REDUCED y el GALACTIC-HF, de 20 ml/min/1,73 m2, y el PARADIGM-HF y el DAPA-HF, de 30 ml/min/1,73 m2. También los puntos de corte de los péptidos natriuréticos fueron diferentes entre los distintos estudios, mayores en el estudio VICTORIA. Además, en los estudios PARA- DIGM-HF y DAPA-HF no era necesaria una descompensación reciente de IC, y en el EMPEROR-REDUCED los pacientes debían presentar IC crónica ≥ 3 meses. Esto hace que las características clínicas de los pacientes incluidos en los distintos estudios muestren diferencias relevantes (tabla 5). En general, los pacientes del estudio VICTORIA eran los que presentaban un peor perfil de riesgo, con más edad, valores de péptidos natriuréticos más altos y eventos clínicos más recientes17,41-44.
Características basales de los pacientes incluidos en los estudios PARADIGM HF, DAPA-HF, EMPEROR-REDUCED, GALACTIC-HF y VICTORIA
| PARADIGM HF Sacubitrilo- valsartán | DAPA-HF Dapagliflozina | EMPEROR-REDUCED Empagliflozina | GALACTIC-HF Omecamtiv mecarbil | VICTORIA Vericiguat | |
|---|---|---|---|---|---|
| Edad (años) | 64 | 66 | 67 | 65 | 68 |
| Varones, % | 79 | 76 | 76 | 79 | 76 |
| NYHA III-IV, % | 25 | 32 | 25 | 47 | 41 |
| FEVI (%) | 30 | 31 | 28 | 27 | 29 |
| NT-proBNP (pg/ml), mediana | 1.608 | 1.437 | 1.906 | 2.001 | 2.816 |
| Hospitalización por IC, % | |||||
| < 3 meses | 19 | 8 | NR | 36 | 67 |
| < 6 meses | 31 | 16 | NA | NR | 84 |
| TFGe (ml/min/1,73 m2) | 68 | 66 | 62 | 59 | 62 |
| TFGe 60 ml/min/1,73 m2, % | 37 | 41 | 48 | 52 | 53 |
| Mediana de seguimiento (meses) | 27 | 18 | 16 | 22 | 11 |
Tabla elaborada con datos de Armstrong17. McMurray41, Packer42, Teerlink43 y Butler44. FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; NA: no aplicable; NR: no reportado; NYHA: clase funcional de la New York Heart Association; TFGe: tasa de filtrado glomerular estimada.
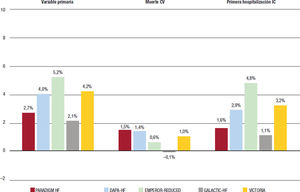
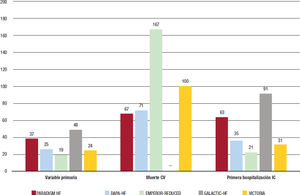
Estas diferencias se hacen más evidentes cuando se analizan los eventos de la variable primaria en el brazo de control de los estudios (13,2, 15,6, 21,0, 26,3, y 37,8 eventos/100 pacientes-año en el PARA- DIGM-HF, DAPA-HF, EMPEROR-REDUCED, GALACTIC-HF y VICTORIA respectivamente)17,41-44. Es decir, las tasas de eventos del brazo de control del estudio VICTORIA pueden llegar a triplicar las de otros estudios, lo que indica que se incluyó a una población con alto riesgo. En este contexto, diferentes perfiles de riesgo, comparar los resultados en términos relativos no parece la mejor opción. En cambio, comparar las diferencias absolutas de riesgo anualizadas podría aportar más información45,46. En las figuras 3 y 4 se muestran la reducción absoluta del riesgo y el número de pacientes que es necesario tratar (NNT) de los diferentes ensayos clínicos. Así, el NNT para la variable primaria, mortalidad cardiovascular y primera hospitalización por IC del vericiguat, en el estudio VICTORIA fueron 24, 100 y 31, respectivamente, valores que están en línea con los de otros ensayos clínicos o incluso son mejores en algunos casos17,41-44. En definitiva, estos datos confirman los beneficios de vericiguat en el tratamiento de pacientes con IC-FEr, en la población con alto riesgo de eventos y más vulnerable.
Reducción absoluta del riesgo en los estudios PARADIGM HF, DAPA-HF, EMPEROR-REDUCED, GALACTIC-HF y VICTORIA. Figura elaborada con datos de Armstrong17. McMurray41, Packer42, Teerlink43 y Butler44. Variable primaria en el DAPA-HF, empeoramiento de la IC (hospitalización no programada/visita urgente que requiera tratamiento intravenoso para la IC) o muerte CV; en los demás, primera hospitalización por IC o muerte CV. CV: cardiovascular; IC: insuficiencia cardiaca.
Número de pacientes que es necesario tratar de los estudios PARADIGM HF, DAPA-HF, EMPEROR-REDUCED, GALACTIC-HF y VICTORIA. Figura elaborada con datos de Armstrong17. McMurray41, Packer42, Teerlink43 y Butler44. Variable primaria en DAPA-HF, empeoramiento de la IC (hospitalización no programada/visita urgente que requiera tratamiento intravenoso para la IC) o muerte CV; en los demás, primera hospitalización por IC o muerte CV. CV: cardiovascular; IC: insuficiencia cardiaca; NNT: número de pacientes que es necesario tratar (los valores se han anualizado ajustando al tiempo de duración de cada ensayo).
El papel del vericiguat en el paciente con IC-FEr se ha analizado principalmente a través de los ensayos clínicos SOCRATES-REDUCED y sobre todo el estudio VICTORIA. El estudio VICTORIA incluyó a un amplio número de pacientes sintomáticos con una descompensación reciente por IC, por lo que representa a una población con alto riesgo y vulnerable que no se había analizado de manera adecuada en estudio previos. El estudio VICTORIA fue positivo y se demostró que el vericiguat añadido al tratamiento médico estándar proporciona beneficios adicionales, sobre todo en cuanto a la reducción de las hospitalizaciones. Los resultados fueron robustos y concordantes entre los diferentes subgrupos de pacientes analizados. Además, el perfil de seguridad del vericiguat es excelente, lo que permite su empleo en la práctica clínica de una manera sencilla.
Contribución de los autoresTodos los autores han contribuido significativamente al trabajo presentado en este artículo, en la concepción, el diseño o la adquisición de información o en el análisis y la interpretación de datos. Todos los autores han participado en la redacción o revisión del manuscrito y aceptan su publicación.
Conflicto de interesesM. Anguita Sánchez ha recibido compensaciones por asesoría y ponencias de Bayer, Daiichi- Sankyo y Pfizer. J. Comín-Colet ha recibido honorarios como ponente de Bayer, no relacionado con el presente artículo. L. Manzano ha recibido compensaciones por asesoría y ponencias de Novartis, Bayer, AstraZeneca and Pfizer. J.L. Zamorano ha recibido honorarios por ponencias de Bayer y Daiichi- Sankyo. J.R. González-Juanatey ha recibido compensaciones por asesoría y ponencias de: Amgen, AstraZeneca, Bayer, Boehringer- Ingelheim, MSD, Daichii-Sankyo, Ferrer International, Novartis, Lilly, Sanofi y Servier.
AgradecimientosContent Ed Net (Madrid) proporcionó asistencia editorial en la redacción de este manuscrito con financiación de Bayer Hispania.