Tras demostrar la eficacia del desfibrilador automático implantable para reducir la mortalidad en ciertos grupos de pacientes, esencialmente con los sistemas monocamerales, se discuten las ventajas y limitaciones de los sistemas bicamerales en diferentes situaciones. Asimismo, se plantean las crecientes indicaciones de los sistemas con terapia de resincronización añadida. Asegurar la eficacia de la desfibrilación de un dispositivo ha sido objeto de diferentes estudios y uno de los pilares durante el implante. Sin embargo, la metodología empleada para su determinación ha sido variable, ha evolucionado y hasta ha llegado a cuestionarse su comprobación. Uno de los elementos importantes que ha de tenerse en cuenta en el momento del implante es la aparición de complicaciones, tanto de forma inmediata como a largo plazo. Se resume y analiza la abundante bibliografía al respecto, recalcándose su incidencia y su posible prevención. Estos aspectos resultan esenciales para reducir la morbilidad relacionada con el implante.
Palabras clave
auriculoventricular.
desfibrilador automático implantable.
fracción de eyección.
fibrilación ventricular.
ventrículo derecho.
ventrículo izquierdo.
No cabe duda de la eficacia del desfibrilador automático implantable (DAI) para abortar la muerte súbita y de su utilidad en diferentes contextos clínicos. Sin embargo, hecha la indicación de un DAI, tenemos que responder a la pregunta de cuál es el sistema que se debe implantar.
Los ensayos clínicos que han demostrado la utilidad del DAI para reducir la mortalidad en grupos seleccionados de pacientes, que han experimentado arritmias ventriculares graves o que están en riesgo de presentarlas, han sido realizados mayoritariamente con dispositivos con una única sonda ventricular, conocidos como sistemas monocamerales1-7. La introducción de sistemas más complejos, que facilitarían la detección y la estimulación bicameral, así como aportar una estimulación más fisiológica, permitían solventar las necesidades de los pacientes candidatos a recibir un DAI y que presentaran indicación de estimulación bicameral. También se planteó su uso ante posibles bradicardias inducidas por fármacos y, de este modo, el DAI bicameral permitiría realizar ajustes terapéuticos sin esa limitación. Sin embargo, con marcadas diferencias según los países y los centros, su empleo ha sido más extenso. Para muchos, las mayores expectativas acerca de la utilidad de los DAI bicamerales estaban generadas no por sus capacidades de estimulación con sincronía auriculoventricular (AV), sino por la información que aportaba la sonda auricular, que permitía diferenciar de forma fiable las taquicardias ventriculares de las de origen supraventricular, esencialmente las auriculares. Los sistemas monocamerales que obtienen sólo la información del ventrículo han incorporado la detección de características que pueden diferenciar ambos tipos de taquicardia, como: a) la regularidad, que tiene como objetivo diferenciar las taquicardias de origen auricular, especialmente la fibrilación, y b) el inicio brusco, para diferenciar la taquicardia sinusal, típicamente de aceleración paulatina. La implementación de estos 2 criterios, en valores ya probados, incrementa la especificidad de la clasificación de las arritmias de manera significativa. La reducción de la sensibilidad que conlleva es inaceptable en este tipo de terapia, lo que se resuelve con un criterio adicional programable, de la duración del episodio, a partir de la cual la terapia se administra independientemente de la clasificación del ritmo, aunque resulte en una nueva reducción de la especificidad8,9. Un tercer criterio de discriminación, llamado de morfología, se ha basado en la alteración de la secuencia de despolarización ventricular durante las arritmias ventriculares comparada con la activación basal, detectable en el electrograma analizado por el dispositivo.
Sin embargo, estos criterios adicionales no son umversalmente empleados en la práctica clínica. El escepticismo acerca de su verdadera utilidad ha llevado a realizar estudios para su valoración, uno de ellos reciente, en pacientes portadores de dispositivos DDD, programados para realizar la detección y la clasificación según criterios de frecuencia únicamente frente a todos los demás (regularidad, comienzo brusco, más ventricular que auricular y protegidos por un criterio limitación de inhibición de terapia en caso de duración del episodio). En este estudio no hubo duda de la superioridad de los criterios adicionales, si bien se comparaban varios criterios juntos frente a la frecuencia sola10.
Aun así, el número de taquicardias detectadas de origen no ventricular y que reciben terapias puede ser elevado11-16. La incidencia puede ser variable y depende de diversos factores, como el tipo de paciente analizado (según la incidencia y el tipo de arritmias auriculares y ventriculares) y las diferentes programaciones y dispositivos empleados (niveles de corte, características de los criterios).
Yendo más allá, la presencia de una sonda auricular, que proporciona información directa de la activación auricular estableciendo la relación AV, debería ser superior para clasificar el origen de las taquicardias. Sin embargo, en algunos estudios aleatorizados, con un número limitado de pacientes, no se consiguió demostrar que los criterios derivados del uso de una sonda auricular fueran superiores a los criterios derivados de una sonda única ventricular1213, aunque un estudio restringido a pacientes con taquicardias ventriculares lentas parecía mostrar la superioridad de la doble cámara en la valoración del número de terapias inadecuadas17.
BicameralMás recientemente, en un estudio prospectivo en el que los pacientes recibían sistemas bicamerales y se aleatorizaban a detección monocameral frente a bicameral, en el que se utilizó una variedad de los criterios comentados, resultó significativamente más precisa la detección bicameral, al emplear los datos recogidos con la sonda auricular18. Por desgracia, no se pudo probar el impacto en la reducción de choques inadecuados por las diferencias de programación entre ambos grupos del estudio, ya que con mayor frecuencia se programó una terapia con estimulación en el grupo de detección monocameral que en el bicameral.
Como detalle relevante de este estudio, importante en la toma de decisiones respecto a la necesidad de discriminar frente a arritmias auriculares, se halla la elevada incidencia de éstas (el 34% a los 6 meses del implante), por lo que sí resulta pertinente la consideración de un sistema bicameral como mejor discriminador de especificidad de detección de arritmias ventriculares. Esta incidencia de arritmias auriculares en las poblaciones no seleccionadas candidatas a DAI es significativa (el 21% en el estudio AVID)1, con una incidencia similar en nuestro medio19,20. Tras el implante se desarrollan arritmias auriculares con frecuencia, incluso en seguimientos cortos, especialmente si se han presentado con anterioridad, pero no de manera exclusiva21,22.
Con lo mencionado hasta el momento podríamos resumir que los DAI bicamerales son superiores a los monocamerales respecto a la discriminación de arritmias auriculares y podrían resultar en una reducción de descargas inadecuadas con una programación correcta. Este efecto sería tanto más relevante cuanto mayor fuera la incidencia de arritmias auriculares. La limitación vendría dada por los efectos negativos inherentes a la implantación de la sonda auricular23.
Por otra parte, añadido a la incidencia variable de arritmias auriculares en los pacientes portadores de DAI, los dispositivos implantados pueden tener un efecto proarrítmico auricular, según indican algunos análisis de grupos de pacientes con dispositivos antibradicardia doble cámara que no tenían bloqueo AV24,25. En este análisis de la importancia de las arritmias auriculares para elegir un tipo de dispositivo concreto hay que considerar que algunos dispositivos de doble cámara (DDED ICD) son capaces de detectar y tratar estas arritmias auriculares con eficacia21,26. Aunque es bien conocido el impacto negativo de las arritmias auriculares sobre el pronóstico de los pacientes con función ventricular deprimida27, el potencial beneficio de estas terapias frente a las arritmias auriculares, incluida la reducción de las arritmias ventriculares inducidas por auriculares28, debe ser contrastado respecto a su impacto clínico. En un estudio reciente, aún no publicado, se incorpora el efecto potencialmente benéfico de estas terapias auriculares cuando se comparan dispositivos de doble cámara con el empleo de todas sus funcionalidades frente a la programación en cámara única19,20, resultando en una mejora significativa de un objetivo compuesto de utilidad clínica.
Según lo comentado hasta ahora, la elección del sistema bicameral frente al monocameral se haría teniendo en cuenta la mejor clasificación de las arritmias detectadas, las limitaciones inherentes al implante de una sonda adicional y las ventajas teóricas del tratamiento de las arritmias auriculares. En este punto, el DAI DDED puede tener ventajas frente al monocameral en pacientes que no lo precisan por indicación antibradicardia espontánea o inducida si el implante de la sonda adicional tiene el mínimo de morbilidad, si es previsible una incidencia significativa de arritmias auriculares con conducción AV conservada que puedan entrar en el intervalo de frecuencias programadas para la detección de arritmias ventriculares, y si el porcentaje de estimulación ventricular, como analizaremos, es previsiblemente bajo.
Una de las limitaciones del sistema bicameral es la estimulación ventricular inherente a la programación DDD frente a la VVI a frecuencias bajas, no sólo por el consumo de batería, sino por el efecto deletéreo generado por la estimulación en el ápex del ventrículo derecho (VD), que distorsiona la sincronía de la activación ventricular. Los datos experimentales y clínicos29-33 señalan que la estimulación ventricular derecha conlleva un efecto negativo sobre la función ventricular, especialmente en los pacientes con deterioro previo, lo que resulta en un empeoramiento por insuficiencia cardiaca y una tendencia hacia una mayor mortalidad. Este efecto negativo parece ser paralelo al porcentaje de estimulación33 y parece reducirse cuando ésta es menor. De hecho, un estudio en que los dispositivos de doble cámara incorporaban un algoritmo especial para minimizar la estimulación ventricular mostró que el objetivo (combinado del número de hospitalizaciones por insuficiencia cardiaca y mortalidad) no era significativamente distinto al compararlo con los dispositivos monocámara, e incluso había una cierta tendencia hacia una menor mortalidad en los bicamerales34. Estos datos se han visto reflejados en otro estudio, desarrollado en nuestro medio, en que la mortalidad del grupo de doble cámara, reduciéndose el porcentaje de estimulación mediante la programación de un intervalo AV largo, era menor que la del monocámara, y ésta a su vez similar a la del doble cámara programado como monocameral, si bien no era objeto de análisis independiente, ya que formaba parte de un parámetro de valoración compuesto20.
TricameralSin discutir las indicaciones de la terapia de resincronización cardiaca, recogidas en las guías clínicas y apoyadas en estudios que las avalan35, es más complicado pronunciarse sobre las indicaciones de DAI en las que nos podemos plantear una terapia de resincronización añadida, no incluidas en estas guías. Por otra parte, trasciende al objetivo de este artículo la discusión de la terapia de resincronización, pero sí se pueden hacer algunas reflexiones acerca de la conveniencia de esta terapia asociada. En este sentido, es indicativo que los pacientes con función ventricular izquierda deprimida con indicación de estimulación por bloqueo AV completo que reciben un sistema biventricular tengan una mejor fracción de eyección y una mejor calidad de vida que los que reciben una sonda en el VD36. Estos datos son concordantes con los obtenidos en pacientes con función del VI deprimida y fibrilación auricular (FA) que precisan ablación AV, en los que la estimulación biventricular parece ser mejor que la de ventrículo derecho37. Por otra parte, no se puede ignorar la tendencia a utilizar criterios ecográficos de asincronía para incorporar pacientes con un complejo QRS no tan ancho o en clase funcional no tan avanzada que se puedan beneficiar de la terapia de resincronización38,39, especialmente si tenemos en cuenta que ya van a recibir un dispositivo implantable. Pero en todos estos casos, aún más que lo comentado para la indicación de la sonda auricular, es crítico el análisis de riesgo/beneficio del implante de la sonda de VI ajustado a cada centro para que la decisión sea realmente individualizada y equilibrada.
Nos podremos plantear la indicación de un sistema de estimulación biventricular en un paciente que no tiene indicación habitual si, con una función ventricular izquierda deprimida, va a precisar un porcentaje significativo de estimulación ventricular. Se puede considerar claramente deletéreo un porcentaje por encima del 40% y razonablemente seguro si está por debajo del 20%, extrapolando datos de algunos análisis33,34.
¿ES NECESARIA LA INDUCCIÓN DE FIBRILACIÓN VENTRICULAR DURANTE EL IMPLANTE?El objetivo de la inducción de fibrilación ventricular (FV) durante el implante es comprobar que el desfibrilador es capaz de detectar correctamente la FV y de interrumpirla con un margen de seguridad determinado. En caso contrario, se realizarán las modificaciones que se consideren pertinentes hasta comprobar el funcionamiento correcto. Desde los inicios de la terapia, la inducción ha sido la norma en la práctica clínica habitual, aunque en la actualidad no se dispone de un protocolo uniforme recomendado.
En los albores de la terapia de desfibrilación se seleccionó un margen de seguridad mínimo de 10 julios, basándose en estudios que indicaban que los sistemas de desfibrilación entonces utilizados (monofásicos y epicárdicos) eran eficaces en general con 15 julios y eran capaces de administrar una energía máxima de 25 julios. Este margen fue comprobado posteriormente en pacientes con desfibrilador implantado40 y validado más adelante por los diversos trabajos que han demostrado la disminución de la mortalidad en pacientes portadores de desfibrilador4,5.
El avance en la tecnología de los sistemas de desfibrilación, con la disponibilidad de electrodos endocárdicos de doble bobina y dispositivos con choques bifásicos y carcasa activa, ha aumentado de forma significativa la eficacia de los choques en la interrupción de la FV41,42. Aporta, además, una mayor duración del generador y la posibilidad de programar múltiples choques en la zona de FV, lo que aumenta la probabilidad de desfibrilación incluso en pacientes con umbrales altos o un margen de seguridad bajo.
La constatación en la práctica clínica de la eficacia de los sistemas actuales ha hecho que aumente la sensación de seguridad y confianza en la terapia, hasta el punto de ponerse en cuestión la necesidad de realizar pruebas de desfibrilación durante el implante43.
La comprobación de la eficacia de la desfibrilación durante el implante se ha llevado cabo de diversas formas. La más habitual es la comprobación de un margen de seguridad mínimo de 10 julios, mediante la inducción de FV y la comprobación de desfibrilación en al menos 2 inducciones consecutivas, basándose en el carácter probabilístico de la desfibrilación44, programando después el dispositivo con choques de máxima energía. Con esta metodología, más del 90% de los pacientes presentan un margen de seguridad adecuado en el implante, requiriendo sin embargo entre el 5-10% de los casos alguna modificación de los parámetros iniciales para poder conseguir dicho margen41,45,46. También se ha utilizado la determinación del umbral de desfibrilación (mínima energía necesaria para desfibrilar), ajustando después en la programación la energía del primer choque47,48. Las ventajas serían el menor gasto de energía del dispositivo y el menor tiempo de carga, lo que disminuiría la probabilidad de síncope en los episodios. Los inconvenientes son la necesidad de múltiples inducciones de FV, con sus posibles efectos deletéreos, así como el consumo de tiempo y batería del dispositivo durante el implante. Algunos trabajos ponen de manifiesto su escasa reproducibilidad, de forma que entre una y otra determinación puede haber diferencias mayores de 10 julios49.
Para evitar estos inconvenientes, algunos autores proponen la utilización del «límite superior de vulnerabilidad», que determina el nivel de energía a partir del cual ya no se induce FV cuando se aplica un choque durante el período vulnerable de la onda T, durante un ritmo cardiaco regular (estimulación ventricular o ritmo sinusal). Tiene una correlación muy estrecha con el umbral de desfibrilación, de forma que si se programa la energía de choque 3-5 julios por encima, la eficacia en la desfibrilación es prácticamente del 100%49,50. Este método permite averiguar el umbral de desfibrilación con un número mucho menor de inducciones de FV y en muchos casos sin ninguna51, y su reproducibilidad es superior a la de la inducción de FV52. Sin embargo, su resultado depende de una metodología adecuada y sigue siendo necesaria la administración de múltiples choques53-55.
FACTORES ASOCIADOS CON UMBRALES ELEVADOS DE DESFIBRILACIÓNDiversos trabajos han tratado de identificar los factores clínicos que se asocian con la presencia de umbrales elevados56-59. El tratamiento con amiodarona es el único factor común, ya que aumenta 3 veces la probabilidad de fallo en el implante. Otros factores que se han asociado son la cardiopatía no isquémica son el mayor grado de dilatación ventricular y la mayor superficie corporal. Sin embargo, en otros trabajos no se encuentran predictores clínicos claros y, por otra parte, la ausencia de estos factores no garantiza que haya un margen de seguridad apropiado.
Las características del dispositivo o su colocación también tienen relación con el umbral de estimulación. Diversos estudios han demostrado que el requerimiento de energía para desfibrilar disminuía con la adición de una bobina o un electrodo proximal, colocado en la unión de la aurícula derecha-vena cava superior (AD-VCS) o en la subclavia izquierda. Se considera que la bobina distal debe estar en su totalidad en el VD para obtener mejores umbrales de desfibrilación y los requerimientos de energía parecen ser menores cuanto más distal está colocado el electrodo dentro del VD60. La programación de la bobina distal (VD) como ánodo disminuye el umbral de desfibrilación de forma significativa61, por lo que se recomienda que las pruebas de desfibrilación se inicien con esta configuración.
La colocación del dispositivo en el lado derecho ofrece una configuración de desfibrilación subóptima que se puede asociar con umbrales de desfibrilación más altos (fig. 1), por lo que en estos casos sería recomendable el empleo de dispositivos de alta energía.
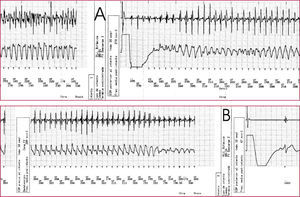
Registro de la inducción de fibrilación ventricular (FV) en un paciente durante el implante de un generador prepectoral derecho, tras la extracción de un dispositivo subpectoral izquierdo por infección. De arriba a abajo, registro del electrograma distal, del electrograma de morfología y del canal de marcas. A. Se induce FV con choque sobre la onda T que es correctamente detectada con la sensibilidad mínima y que no es interrumpida con un primer choque de 31 julios. B. La FV es redetectada correctamente e interrumpida con un segundo choque de alta energía (41 julios).
Una práctica cada vez más habitual es la utilización directa de dispositivos de alta energía en pacientes que pueden presentar umbrales de desfibrilación elevados. Si la desfibrilación es ineficaz a pesar de la posición radiológica correcta, con una posición adecuada de las bobinas de desfibrilación y unos parámetros de estimulación y detección buenos, el primer paso sería realizar cambios de la configuración, como la polaridad del choque o la pendiente de la onda de choque (dispositivos de St. Jude Medical)45,46. La siguiente opción sería la modificación de la posición de la sonda o el implante de un electrodo subcutáneo. Es conveniente realizar el menor número de inducciones posible, ya que la inducción repetida de FV puede ser un factor adicional para la presencia de umbrales altos por isquemia miocárdica, por lo que en estos pacientes se podría considerar suficiente la demostración de una desfibrilación con la máxima energía. Por último, se ha descrito la presencia de umbrales altos de desfibrilación en pacientes con neumotórax, por lo que si ha habido punción subclavia hay que excluir su presencia.
COMPROBACIÓN DE LA CORRECTA DETECCIÓN DE FIBRILACIÓN VENTRICULARUn aspecto importante de la prueba de desfibrilación durante el implante es la comprobación de la detección de FV, para lo que se suele programar la sensibilidad en su grado mínimo, comprobando de esta forma un «margen de seguridad» para la detección. Aunque algunos estudios parecen mostrar una relación entre la presencia de una onda R > 5-7 y la detección correcta de FV62,63, ocasionalmente la FV puede presentar características que dificulten la detección64, lo que hace recomendable su comprobación. Por otra parte, la inducción y su posterior interrupción también constituyen una prueba de la estabilidad de la posición del electrodo.
PRUEBA DE DESFIBRILACIÓN DURANTE EL IMPLANTE DE DISPOSITIVOS DE RESINCRONIZACIÓNLos pacientes a los que se implanta un dispositivo de resincronización constituyen un grupo de consideración especial, ya que en principio tienen más posibilidades de presentar umbrales altos de desfibrilación. En un estudio reciente65 se analizan los resultados de la prueba de desfibrilación durante el implante en más de 500 pacientes y se obtienen resultados muy similares a los de los pacientes en los que no se implanta resincronizador (margen > 10 julios en el 88%). Se identificó que un diámetro diastólico > 64mm y, sobre todo, una duración prolongada del implante (> 257min) se asociaba con un mayor riesgo de no alcanzar un margen de seguridad > 10 julios.
PRUEBA DE DESFIBRILACIÓN DURANTE EL RECAMBIO DEL GENERADORDurante el recambio del generador por cualquier motivo, hay que volver a comprobar la integridad del sistema, prestando especial atención a los datos de deterioro de la sonda. La evolución desde el implante de los parámetros de estimulación/detección nos ayudará a valorar su posible deterioro. También la historia de terapias, valorando la eficacia y la evolución de la impedancia en los choques, nos aportará datos acerca de la integridad de la sonda. Algunos fallos del circuito de alta energía no se ponen de manifiesto con la medida incruenta de la impedancia, por lo que se necesita una descarga de alta energía para detectarla. Si se decide implantar una nueva sonda y se abandona la anterior, es recomendable utilizar sondas de fijación activa y que el lugar de implante sea lo más alejado posible. En este caso es especialmente importante la inducción de FV, ya que la posición de la sonda es más probable que se consiga en posiciones atípicas y, a pesar de una aparente separación, puede haber algún tipo de interferencia entre las sondas que en ocasiones se ponen de manifiesto sólo tras una descarga de alta energía (fig. 2).
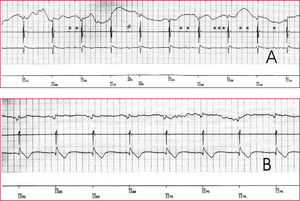
Registros de electrocadiograma (ECG), intracavitarios (electrograma distal y morfología) y canal de marcas durante la colocación de una sonda de fijación activa durante el recambio de un dispositivo, en un paciente que presentaba disfunción de la sonda implantada. A. Se aprecia «ruido» en el electrograma distal (*) producido por el roce entre ambas sondas, que ocasionalmente es detectado por el dispositivo (#). B. Tras colocar la sonda en otro lugar, desaparece el artefacto.
La mayor parte de los riesgos de la prueba de desfibrilación están relacionados con la inducción de FV, aunque los choques sin inducción de FV también pueden ser causa de depresión miocárdica pasajera66. La presencia de FV refractaria se ha encontrado en el 0,5% de pacientes67. En pacientes con enfermedad coronaria, los episodios de FV pueden causar isquemia y necrosis miocárdica68. La complicación más temida es la disociación electromecánica, que ha sido reconocida como una de las causas de muerte súbita en pacientes portadores de desfibrilador69 y que puede suceder durante las pruebas en el implante, incluso durante el primer episodio68, y constituir la causa principal de muerte en el 0,1% de los pacientes.
En pacientes con fibrilación auricular permanente, el choque también puede ocasionar una embolia, por lo que es recomendable realizar una pauta que no suponga una interrupción prolongada de la anticoagulación.
La prueba de inducción está contraindicada en pacientes con ictus reciente, evidencia de trombos intracardiacos o inestabilidad hemodinámica.
En conclusión, en el momento actual no hay datos concluyentes para eliminar la prueba de desfibrilación durante el implante de un desfibrilador70,71. Sin embargo, hay múltiples datos que indican que esta prueba puede ser simplificada, de manera que en la mayoría de los pacientes sería suficiente una única inducción que demostrara una correcta detección y un margen de 5-10 julios42. También sería razonable, a la luz de los datos actuales7, aceptar una configuración que consigue la desfibrilación con la máxima energía, en especial si las inducciones repetidas pueden constituir un problema.
No debería preocupar excesivamente el hecho de no poder realizar una prueba de desfibrilador durante un implante por los motivos antes citados, o por haberse prolongado demasiado el procedimiento, ya que la probabilidad de que el sistema sea eficaz es > 90-95%.
En el implante de dispositivos de resincronización se puede considerar la conveniencia de realizar la prueba de inducción días o semanas después, especialmente si la estabilidad de la sonda de la vena coronaria ofrece alguna duda y/o si el procedimiento ha sido prolongado.
COMPLICACIONES EN EL IMPLANTE: DIAGNÓSTICO Y ACTITUDEl desarrollo tecnológico de sondas endovenosas de desfibrilación y dispositivos cada vez de menor tamaño y peso ha permitido que, en la actualidad, la mayoría de los DAI sean implantados de forma similar a los marcapasos, habitualmente en laboratorios de electrofisiología por electrofisiólogos, con una elevada tasa de éxito, posicionando el generador en una localización subfascial o subcutánea pectoral preferiblemente izquierda, lo que ha supuesto una marcada disminución en la morbimortalidad de la intervención72,73. Así, las complicaciones agudas en la actualidad son superponibles a las del implante de un marcapasos convencional, a las que hay que añadir las propias de la mayor comorbilidad del paciente, las asociadas a una herida de mayor tamaño y con la prueba de desfibrilación.
La emergente terapia de resincronización cardiaca (TRC) en muchas ocasiones precisa el soporte de un DAI, por lo que es necesaria la canalización y estudio del seno coronario, y la progresión de catéteres, guías y sondas a su través, que puede provocar complicaciones específicas, así como aumentar las habituales por incrementar la duración del procedimiento y el número de sondas empleadas.
Cabe destacar que, a pesar de la expansión de esta terapia, los estudios publicados en los que se analizan de forma sistemática, prospectiva y a largo plazo las complicaciones del implante de DAI son escasos. El mayor análisis disponible incluye 30.984 implantes de DAI en Estados Unidos durante 2003, año en el que se notificó una incidencia del 10,8% de complicaciones previas al alta hospitalaria con una mortalidad en torno al 1%74. El mayor estudio de seguimiento a largo plazo incluye a 440 pacientes con DAI de un solo centro seguidos durante 46 meses, con un 10% de complicaciones relacionadas con el implante y una mortalidad del 0,2%75.
INFECCIONESLa disrupción de la barrera cutánea asocia un riesgo de infección generalmente por gérmenes saprófitos de la piel, en especial estafilococos76. Las inmunodeficiencias congénitas o adquiridas (diabetes, insuficiencia renal, etc.) y, quizá, la menor experiencia del centro pueden incrementar este riesgo o la infección por gérmenes inhabituales.
Para su prevención son fundamentales todas las medidas de asepsia y antisepsia propias de una intervención quirúrgica, lo que incluye el empleo de antibioterapia profiláctica endovenosa generalmente con cefazolina o vancomicina, usualmente en dosis única o repetida (< 24h) si el procedimiento se prolonga. Aunque infrecuentes, estos fármacos no están exentos de efectos secundarios que pueden acontecer hasta en el 1% de los casos75. Una hemostasia cuidadosa y la correcta sutura de la herida evitan hematomas o necrosis cutánea que podrían facilitar la infección. El empleo local sobre el campo quirúrgico de sustancias selladoras derivadas de fibrina con antibióticos añadidos también podría disminuirlas77.
La incidencia de infección ronda en la actualidad el 0,5-1,2%6,78 en los implantes prepectorales de dispositivos para el ritmo cardiaco (marcapasos o DAI), algo mayor si se emplean parches subcutáneos79, y bastante mayor en los DAI abdominales78. En los últimos años, en Estados Unidos se ha registrado un incremento en la incidencia de estas infecciones, en probable relación con la mayor comorbilidad de los pacientes, la expansión de las terapias a centros de menor experiencia y, quizá, con un aumento en la tasa de notificaciones80.
La infección del sistema puede aparecer de forma tardía a partir de su colonización durante el implante o de forma secundaria a bacteriemias de otro origen81. Los principales signos que alertan sobre su presencia incluyen síntomas locales (dolor, eritema con signos flogóticos en la herida y bolsa, supuración por la herida, erosión cutánea sobre el sistema o «decúbito»), o con menor frecuencia generales, como la fiebre persistente, en ocasiones con escalofríos y respuesta inflamatoria sistémica (astenia, anorexia, sudoración, taquicardia o leucocitosis con neutrofilia), y raras veces embolia pulmonar, insuficiencia cardiaca derecha o soplo de nueva aparición82.
En ocasiones se registra una elevación de la temperatura postimplante que no necesariamente implica una infección del sistema por ser de origen farmacológico, asociada con la presencia de hematoma o comorbilidad del paciente. En esos casos es recomendable la toma de hemocultivos y realizar un tratamiento antibiótico empírico prolongado ante la posibilidad de una bacteriemia que podría colonizar el sistema y que, de hacerse persistente o acompañarse de signos o síntomas indicativos locales o sistémicos, obliga a descartar una infección83.
El máximo exponente es la endocarditis asociada con el dispositivo (generalmente en las sondas, aunque en ocasiones puede afectar al endotelio valvular o parietal), cuyo origen puede radicar en infecciones de la bolsa que progresan hacia el espacio endovascular por las sondas o en bacteriemias relacionadas o no con la intervención que colonizan el sistema83. Su incidencia en la actualidad es menor del 1%, pero su mortalidad es hasta del 35%84. La ecografía transesofágica tiene una gran eficacia diagnóstica y para su tratamiento se ha demostrado que la antibioterapia endovenosa apropiada prolongada (4-6 semanas) asociada con un obligado y precoz explante del sistema disminuye llamativamente la mortalidad84. En la mayoría de casos, la extracción de las sondas infectadas puede ser realizada de forma percutánea con el empleo de sistemas apropiados, con posibilidad de una embolia pulmonar séptica que en general no supone un riesgo significativo añadido, si bien en caso de vegetaciones de gran tamaño con riesgo de obstrucción de un tronco pulmonar principal, o en sondas crónicas de difícil extracción, puede ser preferible la cirugía con circulación extracorpórea85.
El implante de un nuevo dispositivo se recomienda que sea realizado en una nueva intervención, distinta de la extracción del infectado, en una localización lo más distante posible del sistema previo y tras cumplir un ciclo de antibioterapia endovenosa y confirmar la negatividad de hemocultivos, al menos durante 3 días si la infección sólo afectaba a la bolsa o las sondas y al menos 2 semanas si hubiera vegetaciones que afectaran al endotelio76,82.
HEMATOMA/HEMORRAGIAEl riesgo de hematoma o hemorragia relevante tras el implante en posición pectoral de un dispositivo ronda el 2-5% en diferentes series, precisando reintervención en torno al 1%86,87. Los pacientes que precisan heparinización precoz a altas dosis tras el procedimiento presentan un riesgo mayor, de hasta el 20%87. Suelen aparecer en los primeros siete días y podrían facilitar la infección, aumentan el disconfort del paciente, alargan la estancia hospitalaria, incrementan el gasto y pueden precisar reintervención o drenaje86. La reintervención suele indicarse por dolor invalidante o signos de inminente perforación cutánea (hematoma a tensión), y ocasionalmente, por sospecha de infección86. No parece recomendable su evacuación percutánea sin una revisión quirúrgica del sistema por el riesgo de infección que supone y la posibilidad de que persista la fuente de sangrado.
Aunque no hay evidencia clara al respecto, tras el implante y para su prevención puede ser de utilidad emplear un peso (a veces frío) sobre la bolsa durante las primeras horas, manteniendo al paciente en reposo (puede ser útil elevar el cabecero de la cama 30°) durante ese período, seguido del empleo de un cabestrillo en el miembro superior ipsolateral durante varios días para evitar movimientos bruscos del área pectoral que pudiesen facilitar el sangrado. Una alternativa sería la colocación de un vendaje elástico compresivo sobre la zona pectoral que permitiría la movilización precoz del paciente.
En un análisis sobre 3.164 implantes de dispositivos (DAI o marcapasos) en un solo centro se detectaron como factores predisponentes para la aparición de hematoma la necesidad de heparinización en altas dosis (hazard ratio [HR] = 4,2), la combinación de ácido acetilsalicílico y tienopiridinas (HR = 5,2) y la menor experiencia del operador (HR = 1,6). El empleo de un único antiagregante no modificó la incidencia, ni tampoco la edad, el sexo, la morbilidad cardiovascular, la trombopenia leve o los sistemas de drenaje aspirativo. Mostraron tendencia hacia una mayor incidencia la punción subclavia frente a la disección cefálica (en centros con experiencia en esta última) y la bolsa en posición subpectoral frente a subcutánea86. El empleo de bolo de heparina tras el procedimiento asocia una tasa de hematoma del 28 frente al 12% (p = 0,05) si se inicia 12h después. En otro estudio, sin embargo, se obtuvo una tasa similar (el 22 frente al 17%) iniciando la heparina a las 6 o 24h postimplante87. La heparina de bajo peso molecular ajustada al peso parece asociar una similar o incluso mayor tasa de sangrado que la heparina convencional86.
Una alternativa prometedora parece ser la realización del implante durante el tratamiento adecuado (sin suspenderlo) con anticoagulantes orales; en dos pequeños estudios88,89 se ha demostrado que esta estrategia no incrementa la tasa de hematomas en implantes de marcapasos, aunque se precisan más datos para recomendarla extensivamente. Otra opción disponible es el empleo de sustancias selladoras procoagulantes en la bolsa en pacientes con necesidad de anticoagulación precoz90.
Para prevenir el sangrado es, pues, recomendable evitar en lo posible la heparinización precoz en altas dosis si el riesgo embólico asociado lo permite. A la luz de los datos disponibles, se han propuesto unas recomendaciones para la utilización del tratamiento antitrombótico periprocedimiento recogidas en la tabla 1.
Recomendaciones del tratamiento antitrombótico periimplante
| Situaciones clínicas | Actitud |
| Enfermedad coronaria o vascular | Mantener tratamiento con un solo antiagregante |
| Doble antiagregación (p. ej., tras implante de endoprótesis) | Realizar implante en centro de máxima experiencia o retrasarlo si es posible hasta cumplir el tratamiento completo. Si esto no es posible, valorar suspender clopidogrel periimplante |
| Anticoagulación crónica con bajo-moderado riesgo embólico | Suspender anticoagulación oral 4 días antes del implante y sustituir por heparina en dosis bajas* periimplante hasta restituir la anticoagulación oral |
| Anticoagulación crónica con alto riesgo embólico: prótesis valvular, embolia arterial previa, posiblemente estenosis mitral en fibrilación auricular, cardioversión reciente, trombosis venosa profunda o embolia pulmonar | Suspender anticoagulación oral 4 días antes del implante y sustituir por heparina en dosis alta ajustada (preferiblemente no fraccionada). Suspender 3-6h antes del implante. Reanudar heparina a dosis alta (con bolo inicial) en las primeras 6-12 horas y mantener hasta restituir la anticoagulación oral Considerar: realizar implante bajo tratamiento correcto con anticoagulación oral, empleo de agentes procoagulantes locales, disección cefálica frente a punción subclavia |
Adaptada de Wiegand et al86.
10.000-15.000 U/día de heparina no fraccionada subcutánea o perfusión de 400-600 U/h para un objetivo de tiempo de tromboplastina parcial activada < 35s, o bien heparina fraccionada subcutánea: enoxaparina 20mg/día o dalteparina 2.500 U/día, administradas la tarde previa y la posterior al implante.
En los casos que no reciban anticoagulación y se consideren de riesgo podría ser útil para la prevención perioperatoria de la trombosis venosa profunda el empleo de heparina no fraccionada o de bajo peso molecular en dosis bajas la tarde previa y la del implante (o más días si se prolonga la inmovilización)86.
ACCESO VASCULARProbablemente, la forma más rápida, sencilla y la que más familiar resulta al implantador para obtener el acceso venoso es la punción subclavia ciega. Esta técnica asocia un riesgo de neumotórax en torno al 1% (que en la mitad de los casos precisa drenaje endotorácico), más raramente hemotórax y de manera excepcional quilotórax o daño neurológico74,75. Para su prevención debe procederse a la punción durante la espiración forzada. Debe sospecharse ante la aparición de dolor pleurítico, disnea y/o desaturación, y la radioscopia permite apreciar el despegamiento pleural en casos importantes, incluso en decúbito. Para detectar grados menores se recomienda realizar una radiografía posteroanterior y lateral de tórax en inspiración y posteroanterior en espiración forzada, preferiblemente en bipedestación de manera sistemática tras el implante. Si bien es excepcional, el neumotórax puede ser a tensión y precisar una evacuación urgente. Los de escasa cuantía suelen resolverse de forma espontánea en unos días.
Otro problema de la punción subclavia es el efecto de cizalla que puede suponer para las sondas el trayecto de la punción, que puede producir su atrapamiento en el músculo subclavio, el ligamento costoclavicular o entre ambos, lo que puede favorecer su deterioro precoz91.
Para evitar estos problemas se dispone de técnicas, como la punción subclavia en su trayecto extratorácico guiado por referencias radioscópicas, por venografía con contraste o con Doppler, la punción de la vena axilar guiada por venografía con contraste, o el acceso a través de vena cefálica.
La disección cefálica se puede considerar el mejor método al evitar el riesgo de hemoneumotórax, asegurar una mayor durabilidad de la sonda y, quizá, asociar una menor tasa de sangrado en pacientes de alto riesgo86,92. Tiene inconvenientes por la variabilidad individual, con frecuentes trayectos tortuosos o un calibre demasiado fino que impiden la progresión de la sonda, así como la necesidad de entrenamiento y prolongación del procedimiento. Por estos motivos, la tasa de éxito en el implante por este acceso varía ampliamente en la literatura científica (30-90%)92.
OBSTRUCCIÓN-TROMBOSIS VENOSASe ha descrito obstrucción venosa completa en el 9% y parcial en el 15-17% de los pacientes portadores de DAI a largo plazo; el único predictor de riesgo es la presencia de más de una sonda, con una tendencia hacia una menor incidencia en pacientes con antiagregación o anticoagulación93.
Son frecuentes las obstrucciones parciales (o incluso completas) preexistentes en pacientes que precisan el implante de un dispositivo, sobre todo en la vena innominada, sin que en general lo impidan94. En los primeros meses tras el implante no es infrecuente la detección de una obstrucción venosa parcial o completa ni la de trombos adheridos a las sondas (9%), que precisan un diagnóstico diferencial con las verrugas endocárdicas95. A largo plazo pueden añadir dificultad a la hora de extraer o colocar sondas adicionales, y en las primeras horas o días tras el implante se estima una baja incidencia de trombosis del 0,7%75, con referencias de oclusión venosa subclavia-axilar, síndrome de cava superior, embolia pulmonar con trombo visible en la sonda o trombosis en la punta del electrodo que impide obtener umbrales correctos.
La oclusión aguda puede atribuirse a una punción arterial indeseada (ocurre hasta en el 5%, en pacientes que precisan múltiples intentos de punción) con la formación de un hematoma que comprime la vena, espasmo o trombosis in situ, especialmente en estados protrombóticos (insuficiencia cardiaca o renal, etc.). De hecho, a pesar de tratamiento antiagregante o anticoagulante preventivo, se detectaron trombos en las sondas con ecografía transesofágica en el 21% en una serie96, y en otra, la heparina en ciclo corto previno el desarrollo de pequeñas embolias pulmonares asintomáticas que no son excepcionales posprocedimiento97. En la actualidad no hay recomendaciones específicas sobre la profilaxis de la trombosis venosa periprocedimiento, y debe ser tenida en consideración en pacientes de alto riesgo.
DERRAME PERICÁRDICO, TAPONAMIENTOLa sondas apoyadas en las cavidades cardiacas pueden producir una perforación de la pared e irritación-disrupción del pericardio visceral que permita un continuo rezumar de sangre que origine derrame pericárdico, que en el 0,2-0,3% de los implantes se acompaña de taponamiento agudo o subabagudo74,75, o de una pericarditis que simule en ocasiones un síndrome pospericardiotomía98. Los esteroides sistémicos y la utilización de sondas de estimulación transitorias parecen incrementar el riesgo de perforación99.
Las sondas de fijación activa, en especial las auriculares fijadas en la pared lateral de la aurícula derecha, parecen asociarse con una mayor incidencia de derrame (hasta el 5%)100, y puede ser preferible fijarla en la base de orejuela o septo, al igual que los procedimientos en los que se precisa un frecuente reposicionamiento de la sonda por umbrales inadecuados. No es excepcional que el paciente sienta dolor en el momento de atornillar el helicoide, expresión de la irritación pericárdica que produce su protrusión, lo que obliga a estar alerta ante la posible perforación. No obstante, la perforación asintomática del helicoide detectada con escáner se ha observado hasta en el 15% de electrodos auriculares y el 14% de los ventriculares de desfibrilación101.
Los signos y síntomas del taponamiento son: hipotensión, taquicardia, oliguria, dolor pericardítico (no siempre presente), etc. Ante la sospecha, la desaparición del movimiento parietal con rectificación de la silueta cardiaca radioscópica señala la acumulación de líquido y el ecocardiograma confirma su presencia. La pericardiocentesis urgente es prioritaria. En dispositivos sin participación del seno coronario se ha propuesto un tratamiento conservador tras la pericardiocentesis y colocación de drenaje que permite la estabilización del paciente, procediéndose a recolocar las sondas implicadas y a valorar de manera cuidadosa la evolución inicial, con cirugía cardiaca disponible de apoyo para casos de inestabilidad o drenaje persistentes102. La cirugía cardiaca permite localizar el punto de sangrado y proceder a su cierre mediante sutura directa, parches o sustancias selladoras en la zona. Se han descrito casos anecdóticos de sellado eficaz del defecto mediante instilación percutánea pericárdica en la zona afectada de pegamento de cianoacrilato103.
En caso de pericarditis, el dolor característico facilita el diagnóstico y, con frecuencia, grados menores de derrame se resuelven espontáneamente, bajo control clínico y ecográfico intensivo, los primeros días, dado el riesgo de taponamiento tardío.
COMPLICACIONES ESPECÍFICAS DE SONDAS A TRAVÉS DEL SENO CORONARIOLa colocación de la sonda de ventrículo izquierdo en los dispositivos de TRC es la causa de una prolongación del procedimiento que asocia una mayor tasa de infección (hasta el 3%)104. Se ha descrito un 10% de complicaciones moderadas o graves en estos implantes, con una mortalidad en torno al 0,5-0,8%105.
La disección del seno coronario, visible mediante una mancha de contraste retenida en la pared del vaso tras la venografía, presenta una incidencia de hasta el 69%105,106, generalmente de escasa entidad y que no origina problemas, salvo la posibilidad de dificultar la navegación posterior. Se ha señalado que se produce con frecuencia durante la inyección de contraste para la venografía, y generalmente el pericardio visceral adyacente contiene la salida de sangre a baja presión que circula por el vaso107. En algunos casos, la perforación de la pared venosa alcanza la cavidad pericárdica y puede ocasionar taponamiento hasta en el 0,8% de implantes, que precisa una pericardiocentesis urgente y, en ocasiones, reparación quirúrgica105.
Para las disecciones de menor entidad sin derrame pericárdico asociado con mancha de contraste retenido de escasa cuantía, parece razonable continuar el procedimiento bajo vigilancia estricta de los signos de derrame, siempre que no haya dificultad para la navegación ni una disección amplia, en cuyo caso conviene esperar al menos 2 semanas antes de un nuevo intento107. La inyección directa a través del catéter guía sin oclusión con globo del vaso se podría acompañar de una menor tasa de disección108, así como la colocación directa sin empleo de catéter guía en el vaso ni venografía, que en manos expertas puede ser exitosa en un elevado porcentaje de casos109.
Otro problema lo constituye la posibilidad de captura frénica, que obligaría a la recolocación de la sonda hasta en el 3% de casos, por lo que en el implante es fundamental estimular transitoriamente con energías altas para asegurar la ausencia de captura frénica o, de forma subóptima, que ésta sólo aparezca con un muy amplio margen respecto al umbral de captura ventricular.
COMPLICACIONES MECÁNICAS RELACIONADAS CON LAS SONDASCualquiera de ellas, pero especialmente el electrodo ventricular izquierdo en los dispositivos de TRC, puede experimentar elevaciones de umbral bruscos por desplazamiento de la sonda que obliguen a una reintervención. Este problema aparece generalmente semanas o meses tras el implante, y a largo plazo se ha descrito una incidencia del 1-4% para el electrodo ventricular derecho, del 1-8% para el auricular y del 4-15% para el ventricular izquierdo38,74,75,104,108,110. Se ha postulado que la movilización precoz del paciente puede facilitar el desplazamiento de las sondas, aunque en un estudio comparativo entre 3 y 24h de reposo no se encontraron diferencias111.
En ciertos casos, el problema radica en la conexión de las sondas al generador, en los tornillos de fijación o en la presencia de fluido en el bloque conector, que producen interferencias en torno al 1,2% a largo plazo75. Es importante la limpieza exhaustiva de restos orgánicos del extremo de conexión de la sonda para evitarlo, y la presencia de impedancias de estimulación o descarga fuera de los límites recomendados para cada sonda permite detectar estos problemas en el implante.
Estas complicaciones mecánicas de las sondas pueden acontecer en los primeros días, y se ha notificado una incidencia antes del alta hospitalaria del 3,8-4,8%74. La radiografía torácica sistemática y la interrogación completa del dispositivo previos al alta son muy recomendables para detectarlas.
OTRAS COMPLICACIONESLos implantes complejos, especialmente de dispositivos de TRC, precisan elevados tiempos de radioscopia que suponen una dosis de radiación no despreciable para el paciente y los operadores, y para minimizar sus riesgos es necesario el mantenimiento periódico del equipo y el empleo de sistemas de protección radiológica, tanto para el paciente como para los operadores.
Debe evitarse una inmovilización prolongada del brazo ipsolateral al implante para evitar complicaciones articulares en el hombro (rigidez, dolor, «hombro congelado», etc.), que se han comunicado hasta en el 1-3% de los pacientes75,110.
Ante la posibilidad de inducción de arritmias ventriculares sostenidas, por la manipulación de las sondas o el fallo en la desfibrilación interna en pacientes en los que se realiza una prueba de desfibrilación, es recomendable disponer de un sistema de desfibrilación externo con máximas garantías, comprobar su integridad previamente a cada implante y colocar las «palas» adhesivas correctamente antes de la preparación del campo.
Asimismo, en pacientes con bloqueo de rama izquierda puede inducirse un bloqueo traumático de rama derecha que, aunque transitorio, puede generar un bloqueo completo en ocasiones sin ritmo de escape. En esos pacientes es recomendable utilizar un desfibrilador externo que disponga de estimulación transcutánea, y debe tenerse preparado el estimulador temporal externo (utilizado para la medición de parámetros en cada posición de la sonda) para conectarlo rápidamente por el mecanismo apropiado a la sonda ventricular con una elevada intensidad de salida, colocándola con rapidez en una posición que permita la captura ventricular durante el período sin ritmo de escape.
En el momento de cierre de la herida, es importante colocar los bucles «sobrantes» de las sondas bajo el generador en la bolsa para evitar cortarlos inadvertidamente cuando se proceda a su recambio. Asimismo, el bloque conector, del que sobresalen las sondas conectadas con cierta rigidez, debe quedar en una posición tal que estas sondas no protruyan hacia la herida, pues esa tensión mantenida podría facilitar su decúbito.
Aunque el daño valvular agudo es excepcional, en casos de atrapamiento de las sondas durante su manipulación en las cavidades cardiacas que precisen de maniobras importantes para su liberación es recomendable un control ecográfico tras el implante para asegurar su indemnidad.
Por último, la sedación profunda empleada para la prueba de desfibrilación puede tener consecuencias indeseadas (reacciones exageradas con depresión respiratoria que precise de ventilación mecánica o reacciones paradójicas) que pueden amenazar la finalización correcta del procedimiento y al propio paciente, por lo que se debe disponer de todo el personal y material necesarios para realizar reanimación cardiopulmonar avanzada o una anestesia más profunda.
CONCLUSIÓNEl implante de desfibriladores automáticos es en el momento actual un procedimiento habitual acometido por las unidades de arritmias. El primer paso, tras la indicación, lo constituye la elección del tipo de dispositivo implantado, que dependerá fundamentalmente de las características del paciente. Durante el implante hay que prestar atención a una serie de detalles técnicos, de los que dependerá la correcta detección e interrupción automática de las arritmias ventriculares. Del mismo modo, el exquisito cuidado de la asepsia y la técnica quirúrgica constituyen la mejor garantía de un índice bajo de complicaciones a medio y largo plazo.