Palabras clave
INTRODUCCIÓN
El implante valvular aórtico percutáneo se plantea como alternativa en el tratamiento de la estenosis valvular aórtica grave sintomática con alto riesgo quirúrgico, con una alta tasa de éxito durante el implante (cercana al 95%) y una baja mortalidad hospitalaria (inferior al 10% en las series iniciales1-4). Sin embargo, se ha descrito una alta incidencia de alteraciones electrocardiográficas y necesidad de marcapasos por bloqueo auriculoventricular (AV) avanzado con el implante percutáneo de la prótesis aórtica CoreValve® (Medtronic CV, Luxemburgo), que en algunas series alcanza el 33%5, a diferencia de lo ocurrido tras la cirugía de sustitución valvular6,7. Todavía se conoce poco de las causas, el comportamiento y la evolución de los trastornos electrocardiográficos de nueva aparición tras el implante percutáneo de la prótesis aórtica. Las guías de práctica clínica indican implantar marcapasos a los pacientes con alteraciones persistentes e irreversibles de los sistemas de generación y conducción del estímulo cardiaco; sin embargo, la fisiopatología que acontece en el sistema de conducción eléctrica de los pacientes tratados con el implante percutáneo de la prótesis aórtica queda poco claro. Recientemente, algunos autores han analizado los posibles factores asociados a las alteraciones de la conducción eléctrica precoz y persistente tras el implante de la prótesis aórtica8. Además, surge la necesidad de modelos que permitan detectar el grupo de pacientes con mayor riesgo de requerir marcapasos.
Nuestro objetivo es evaluar la incidencia de las alteraciones electrocardiográficas y analizar los predictores de la necesidad de marcapasos por bloqueo AV avanzado tras el implante percutáneo de la prótesis aórtica CoreValve®.
MÉTODOS
En 2008 se inició en nuestro centro un programa de evaluación e implante percutáneo con la prótesis aórtica CoreValve® para pacientes con alto riesgo quirúrgico y/o edad avanzada que rechazaban la cirugía de sustitución valvular. Todos los pacientes fueron evaluados por un equipo multidisciplinario, compuesto por cirujanos, cardiólogos clínicos e intervencionistas. En el proceso de selección de los pacientes candidatos a esta nueva técnica, se han seguido las recomendaciones del consenso elaborado conjuntamente por las diferentes sociedades científicas9, además de cumplir los criterios anatómicos necesarios para el implante percutáneo utilizando la prótesis aórtica CoreValve® 3,4.
En el periodo comprendido entre abril de 2008 y octubre de 2009, se trató a 65 pacientes con la prótesis aórtica percutánea CoreValve® por estenosis aórtica grave sintomática con alto riesgo quirúrgico. De los 65 pacientes incluidos en el estudio, se excluyó del análisis de los predictores a 3 por ser portadores de marcapasos definitivo por bloqueo AV avanzado y a 1 paciente que falleció durante el procedimiento antes de implantar la prótesis.
Inicialmente se evaluó a los pacientes clínicamente, se estimó el riesgo quirúrgico mediante el EuroSCORE logístico y se les realizó un ecocardiograma transtorácico, coronariografía y aortograma para evaluar la geometría de la raíz de aorta y el eje aorto-iliaco-femoral.
Descripción del dispositivo
La prótesis aórtica CoreValve#R es una prótesis biológica trivalva, de pericardio porcino, montada y suturada sobre una estructura autoexpandible de nitinol. Actualmente existen dos tamaños de válvulas: prótesis pequeña, que mide 26 mm en la porción insertada en el anillo nativo, y la prótesis grande, que mide 29 mm. La longitud de la prótesis es de 50 mm, la misma en ambos tamaños.
Procedimiento
Los pacientes tomaron ácido acetilsalicílico 100 mg antes del procedimiento y se mantuvo de forma indefinida. Además recibieron una dosis de carga de clopidogrel de 300 mg y posteriormente se los mantuvo con 75 mg de clopidogrel durante al menos 6 meses. Durante la intervención se administró heparina sódica intravenosa ajustada al peso (0,5 mg/kg). Se realizó profilaxis antibiótica con cefalosporinas o vancomicina en caso de alergia a los betalactámicos.
Todos los procedimientos se realizaron con anestesia local y sedación superficial. En la mayoría de los casos, la vía de acceso utilizada fue la arteria femoral, con introductor de 18 Fr, y se cerró la punción femoral con el dispositivo de cierre percutáneo Prostar XL 10 Fr (Abbot Vascular Devices, Redwood City, California). En 3 pacientes se utilizó la arteria subclavia izquierda como vía de abordaje, en colaboración con el cirujano cardiaco que realizó la apertura y el cierre de la arteria.
Tras colocar un catéter de marcapasos transitorio por vía yugular derecha, se puncionó la arteria femoral a través de la cual se implantó la válvula y se dejó montado el dispositivo de cierre vascular. A continuación se realizó valvuloplastia aórtica con sobreestimulación cardiaca a una frecuencia entre 150 y 180 lat/min para evitar el desplazamiento del balón. Posteriormente se liberó la prótesis aórtica de forma retrógrada guiada por fluoroscopia y control angiográfico. Tras el procedimiento se mantuvo la monitorización con telemetría durante 4 días y control ecocardiográfico a las 72 h.
Se consideró éxito del procedimiento el implante correcto y normofuncionante de la prótesis en ausencia de mortalidad durante el procedimiento.
Estudio electrocardiográfico
Se realizó a todos los pacientes electrocardiograma (ECG) antes y después del implante percutáneo. Se analizó el ritmo, la frecuencia cardiaca (con independencia del ritmo) y los intervalos PR, QT y complejo QRS (medidos en milisegundos y con una velocidad de 25 mm/s), así como la presencia de bloqueos de rama (completos e incompletos) o bloqueos AV avanzados según los criterios recomendados por la Organización Mundial de la Salud y la International Society and Federation for Cardiology Task Force para definir los hemibloqueos y bloqueos de rama derecha (BRD) y de rama izquierda (BRI)10. Se indicó el implante de marcapasos definitivo ante la presencia de bloqueo AV de tercer y segundo grado (Mobitz II), siguiendo las recomendaciones de la Sociedad Europea de Cardiología para los pacientes con bloqueo AV adquirido en situaciones especiales como la cirugía valvular11.
Durante el procedimiento todos los pacientes fueron monitorizados electrocardiográficamente con un registro de tres derivaciones, y se les introdujo el marcapasos transitorio por vía transyugular para realizar sobreestimulación cardiaca durante la valvuloplastia aórtica previa al implante de la prótesis y como prevención en caso de bloqueos AV avanzados tras el implante.
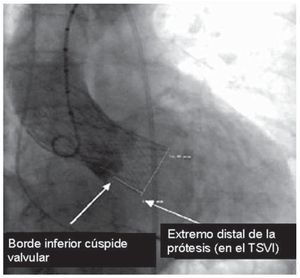
Mediante angiografía cuantitativa, se midió la profundidad de la estructura protésica en el tracto de salida como la distancia (en milímetros) desde la cúspide no coronariana hasta el extremo distal de la prótesis situado en el ventrículo izquierdo, descrito por Piazza et al8 (fig. 1). Se calculó en la proyección oblicua craneal izquierda, habitualmente elegida para realizar la liberación e implante de la prótesis, y comprobar el grado de regurgitación periprotésica. Todos los estudios fueron evaluados de forma independiente por dos cardiólogos. La interpretación de las imágenes se realizó sin conocimiento sobre la situación clínica. El grado de acuerdo entre observadores se evaluó mediante el coeficiente de correlación intraclase, que fue de 0,9 (intervalo de confianza [IC] del 95%, 0,85-0,94; p < 0,001), y se utilizó la media como la distancia a utilizar.
Fig. 1. Cuantificación angiográfica de la profundidad de la prótesis en el tracto de salida del ventrículo izquierdo (TSVI). Tomada de Piazza et al8.
SeguimientoTodos los pacientes fueron sometidos a un seguimiento clínico en la consulta de hemodinámica de nuestro centro. Se evaluó a cada uno de ellos 1, 3, 6 y 12 meses y posteriormente cada 6 meses tras el implante de la prótesis aórtica. En cada visita se les realizaba un ECG de superficie de 12 derivaciones y se consultaba el marcapasos de los pacientes que los portaban.
Análisis estadístico
Los valores de las variables continuas se expresaron como media ± desviación estándar y los de las variables cualitativas, como porcentajes. Se usó la prueba de la χ2 para las variables cualitativas, y para las variables continuas se usó el test de la t de Student para datos apareados, ya que las variables tenían distribución normal. El análisis multivariable para la predicción de la necesidad de marcapasos se llevó a cabo mediante regresión de Cox, incluyendo todas las variables que resultaron significativas en el análisis univariable y las que se consideró necesarias para ajustar el modelo correctamente. Los resultados se expresan con la odds ratio (OR) y el IC del 95%. Para evaluar el papel de la profundidad de la prótesis aórtica en el tracto de salida del ventrículo izquierdo (TSVI), se calculó la sensibilidad y la especificidad y se identificó el punto de corte a través de la construcción de una curva de características operativas para el receptor (ROC). El grado de concordancia entre ambos observadores se obtuvo mediante el coeficiente de correlación intraclase. Se consideró estadísticamente significativo un valor de p < 0,05. Los datos se analizaron con el programa estadístico SPSS versión 12.0 (Chicago, Illionis, Estados Unidos).
RESULTADOS
Características basales y eléctricas previas al procedimiento
Las características basales se resumen en la tabla 1. La media de edad de los pacientes era 79 ± 7,8 años y presentaban un EuroSCORE logístico medio del 20% ± 14%. El 27,8% de los pacientes se encontraban en fibrilación auricular y 44 pacientes (72,3%) estaban en ritmo sinusal antes de la implantación. Tres pacientes eran portadores de marcapasos en modo VVI por bloqueo AV avanzado.
Un 82% de los pacientes presentaban alteraciones electrocardiográficas (hemibloqueos, BRD y BRI). La frecuencia cardiaca basal era 72 ± 13 (48-107) lat/min.
Alteraciones electrocardiográficas tras el implante
Tras el implante de la prótesis aórtica, de un total de 61 pacientes, 21 precisaron marcapasos definitivo por bloqueo AV avanzado (considerándose como avanzados los bloqueos AV de segundo y tercer grado), lo que corresponde al 34,4%, tras excluir del análisis a los 3 pacientes portadores de marcapasos y al paciente que falleció antes del implante de la prótesis. El marcapasos definitivo se implantó entre 2 y 5 días tras el procedimiento. El 81% de los pacientes que requirieron marcapasos definitivo presentaron el bloqueo AV avanzado justamente tras implantárseles la prótesis y 4 pacientes lo sufrieron entre el tercer y el cuarto día.
La duración media de los intervalos PR y QRS se incrementó de 165 ± 52 a 185 ± 59 ms (p = 0,017) y de 87,6 ± 34 a 136 ± 34 ms (p < 0,001), respectivamente (tabla 2). Uno de los pacientes presentaba fibrilación auricular paroxística antes del procedimiento, y tras el implante dejó de tenerla.
Predictores de marcapasos definitivo
La necesidad de marcapasos definitivo se relacionó con la mayor profundidad de la estructura protésica a nivel del TSVI, con una distancia media de 13 ± 2,5 mm en los pacientes que requirieron marcapasos definitivo frente a 8,8 ± 2,8 mm en los que no lo precisaron (p < 0,001). No encontramos diferencias respecto a las dimensiones del anillo aórtico o la relación prótesis/anillo, el grado de hipertrofia ventricular izquierda o de calcificación valvular. Los pacientes con BRD precisaron más de marcapasos que los pacientes con BRI (tabla 3).
Además, la profundidad de la estructura protésica en el TSVI fue el único predictor del requerimiento de marcapasos en el análisis multivariable (OR = 1,9; IC del 95%, 1,19-3,05; p = 0,007) (tabla 4).
Sensibilidad y especificidad de la profundidad de prótesis en el tracto de salida del ventrículo izquierdo
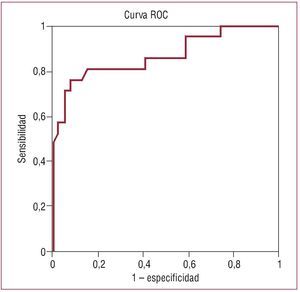
Para determinar el punto de corte, utilizamos la curva ROC (fig. 2). Una profundidad de 11,1 mm de la estructura protésica en el TSVI presentó una sensibilidad del 81% y una especificidad del 84,6%, con un área bajo la curva de 0,86 (0,75-0,96), para predecir la necesidad de marcapasos definitivo por bloqueo AV avanzado. Los valores predictivos positivo y negativo fueron del 74 y el 89,4% respectivamente, con una exactitud diagnóstica del 83,6%.
Fig. 2. Curva de características operativas para el receptor (ROC). Profundidad de la prótesis aórtica en el tracto de salida del ventrículo izquierdo. Área bajo la curva, 0,86 (0,75-0,96).
Seguimiento
Al alta, 29 pacientes (47,5%) presentaban BRI, 21 (34,4%) tenían ritmo de marcapasos y el resto carecía de alteraciones significativas en la conducción eléctrica.
Tras un seguimiento medio de 7,1 ± 5 meses, 6 (9,2%) pacientes fallecieron. Uno de los pacientes sufrió muerte súbita a los 3 meses del procedimiento. En el seguimiento no hubo empeoramiento o progresión de las alteraciones eléctricas (se mantenía el mismo número de pacientes con BRI), exceptuando al paciente que sufrió muerte súbita. No fue necesario implantar ningún marcapasos adicional y 3 pacientes a los que se había implantado el marcapasos recuperaron el ritmo propio, sin requerir estimulación, en un lapso de 3-6 meses tras el implante. El porcentaje de estimulación de los demás pacientes portadores de marcapasos fue superior al 90%.
DISCUSIÓN
Un 34,4% de los pacientes de nuestra serie precisaron marcapasos definitivo tras el implante protésico. Estas cifras son similares a las publicadas por Grube et al5 y superiores al 9,3% comunicado en un registro de 646 pacientes a los que se implantó la prótesis de CoreValve® 12 y a las presentadas en series quirúrgicas6,7,13, entre el 6 y el 6,5%, y con el implante percutáneo de la prótesis de Edwards-SAPIEN14, entre el 4,4 y el 5,4%. Esta alta tasa de implantes podría deberse a que muchas indicaciones son profilácticas, ya que desconocemos la evolución de las alteraciones de la conducción de nueva aparición como bradicardias o BRI y su impacto pronóstico. En nuestra serie, un paciente que tras el implante de la válvula sufrió un BRI (anchura del QRS, 180 ms) falleció de forma súbita durante el seguimiento. En cambio constatamos que 3 pacientes a los que se implantó marcapasos por presentar en las primeras 24-48 h tras el procedimiento bloqueo AV avanzado recuperaron el ritmo propio en un lapso de 3-6 meses tras el implante. Tras el procedimiento, un 47,5% de los pacientes de nuestra serie tenían BRI, que se mantuvo en el seguimiento a medio plazo.
La estrecha relación anatómica existente entre la compleja estructura valvular aórtica y la entrecruzada que representa el nodo AV y la salida del haz de His (en el diagrama presentado por Tawara15-17, la rama izquierda se localiza aproximadamente 2-3 mm por debajo del triángulo que separa la valva no coronariana y la valva coronaria derecha) podría proporcionar una explicación del incremento en las alteraciones eléctricas ocurridas tras la liberación y el impacto de la prótesis aórtica en dichas estructuras18. Además, un alto porcentaje de pacientes presentan algún trastorno de la conducción previo al procedimiento.
La mayor superficie protésica en contacto con el TSVI y las características del nitinol, que proporciona una autoexpansión persistente, podrían explicar las diferencias en el porcentaje de implante de marcapasos entre una y otra válvula percutánea8,19. Quizá cuando la bioprótesis y las estructuras cardiacas adyacentes se adapten al estrés tensional al que están sometidos, disminuya el efecto irritativo en el sistema de conducción y pueda restablecerse la conducción eléctrica propia. Esto explicaría la recuperación de un ritmo cardiaco propio observado en algunos pacientes de nuestra serie. En este sentido, Moreno et al20 demostraron, en una necropsia tras implantar una prótesis de Edwards-SAPIEN, la presencia histopatológica de un hematoma a nivel del septo interventricular que comprometía el haz de His, lo que podría justificar alteraciones en el sistema de conducción AV.
En nuestro estudio observamos que la profundidad de la estructura protésica en el TSVI fue mayor para los pacientes que precisaron marcapasos definitivo por bloqueo AV anvanzado (13 ± 2,5 frente a 8,8 ± 2,8 mm; p < 0,001). Además, una profundidad ≥ 11,1 mm podría detectar precozmente la necesidad de marcapasos con una sensibilidad y una especificidad altas. Estos datos indican que una posición más alta de la prótesis aórtica podría disminuir la incidencia de alteraciones eléctricas y la necesidad de marcapasos. De hecho, el implante de la válvula de CoreValve® se considera óptimo cuando la profundidad de la prótesis en el tracto de salida del ventrículo izquierdo es de 6 mm. Se necesitan estudios específicos que estudien estos aspectos para establecer las indicaciones de implante de marcapasos definitivo en estos pacientes.
Recientemente, varios estudios han demostrado que la necesidad de marcapasos se podría predecir con la combinación de algunas variables, como la presencia de BRI con desviación del eje a la izquierda, grosor del septo interventricular > 17 mm o espesor de la cúspide no coronariana > 8 mm, con un 75% de sensibilidad y un 100% de especificidad21. Este modelo predictivo, presentado por Jilaihawi et al21, debería ser validado en series con mayor número de pacientes; de confirmarse, se podría utilizar para seleccionar a los candidatos para implante preventivo de marcapasos y acelerar la recuperación tras el procedimiento. En los pacientes con un índice positivo en el modelo predictivo, se utilizaría una estrategia de implante de marcapasos preventivo y alta precoz, y para los pacientes con un índice negativo, se prolongaría la estancia hospitalaria al menos durante 6 días tras el procedimiento, con vistas a detectar alteraciones tardías de la conducción. Baan et al22, tras analizar los resultados de 30 pacientes, concluyen que la presencia de un TSVI pequeño, el calcio a nivel del anillo mitral y la presencia previa de trastornos de la conducción se asocian a la necesidad de marcapasos; sin embargo, la profundidad de la prótesis solamente se relacionó con la presencia de BRI de nueva aparición.
En nuestra serie, el 81% de los pacientes que requirieron marcapasos definitivo presentaron el bloqueo AV durante el procedimiento, y 4 pacientes lo desarrollaron entre el tercer y el cuarto día; el implante del marcapasos definitivo, en su mayoría, se realizó entre el segundo y el quinto día tras el procedimiento, sin demorar el alta, pero hubo una muerte súbita a los 3 meses del procedimiento y, por lo tanto, estos modelos predictivos son necesarios para prevenir eventos secundarios a alteraciones tardías de la conducción.
Consideración especial tienen los pacientes con BRD previo al procedimiento, ya que el 47,6% precisó marcapasos definitivo. Aunque en nuestra serie se asocia a la necesidad de marcapasos, no es un predictor en el modelo de regresión, posiblemente por el tamaño muestral, pero, dada la prevalencia del BRI de nueva aparición, es necesario vigilar y evaluar la necesidad de marcapasos en estos pacientes.
Por lo tanto, aparecen nuevas indicaciones de estimulación cardiaca, que será necesario estudiar y recopilar en las próximas guías de práctica clínica.
Este trabajo tiene limitaciones; se trata de un estudio monocéntrico, con un número de pacientes pequeño, con la prótesis aórtica CoreValve#R y, por lo tanto, se dificulta la generalización de los resultados. La reproducibilidad de los métodos cuantitativos debe ser validada sobre otras series con mayor número de pacientes, aunque nuestros datos concuerdan con los iniciales ya publicados y se haya minimizado la variabilidad del observador realizando la cuantificación angiográfica por dos observadores independientes. Además, surge la necesidad de conocer la técnica de imagen adecuada para cuantificar la profundidad de la prótesis aórtica en el TSVI y evitar algunas de las dificultades que podría tener la angiografía en la visualización de la cúspide no coronariana.
CONCLUSIONES
En nuestra serie, tras el implante de la prótesis aórtica CoreValve® un alto porcentaje de pacientes precisan marcapasos definitivo por bloqueo AV avanzado. El único predictor independiente es la profundidad de la prótesis en el TSVI y podría detectar precozmente la necesidad de marcapasos.
ABREVIATURAS
AV: auriculoventricular.
BRD: bloqueo de rama derecha.
BRI: bloqueo de rama izquierda.
ECG: electrocardiograma.
ROC: curva de características operativas para el receptor.
TSVI: tracto de salida del ventrículo izquierdo.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. A.J. Muñoz García.
Servicio de Cardiología. H.C.U. Virgen de la Victoria. Campus de Teatinos, s/n. 29010 Málaga. España.
Correo electrónico: ajmunozgarcia@secardiologia.es
Recibido el 16 de marzo de 2010.
Aceptado para su publicación el 15 de julio de 2010.