Palabras clave
INTRODUCCIÓN
La insuficiencia mitral (IM) está caracterizada por reversión de flujo en sístole desde el ventrículo izquierdo (VI) a la aurícula izquierda. La etiología predominantemente de la IM es primaria u orgánica (alteración intrínseca de las valvas); de ésta, la más frecuente en los países desarrollados es la degenerativa, aunque en los países menos desarrollados la etiología reumática continúa siendo la más frecuente. La IM funcional (valvas normales con dilatación del anillo o desplazamiento apical del punto de aposición de las valvas —tenting— secundaria a cardiopatía dilatada o isquémica del VI) continúa en ascenso debido a la epidemia mundial de enfermedad coronaria. La IM crónica orgánica es la enfermedad valvular más común en Estados Unidos, con una frecuencia de IM moderada o grave del 1,7% de la población general, el 6,4% de los individuos entre 65 y 74 años y el 9,3% de los de edad > 75 años1. La ecocardiografía Doppler ha resultado ser el método no invasivo por excelencia para su diagnóstico y para la toma de decisiones en su tratamiento. Esta revisión pretende discutir los conceptos actuales sobre historia natural, progresión, consecuencias y tratamiento de la IM grave. Hemos planteado un algoritmo que destaca la importancia de la evaluación ecocardiográfica exhaustiva de la IM como punto de partida, y se desarrolla teniendo en cuenta múltiples factores clínicos que deben aplicarse de modo individualizado para obtener el plan de tratamiento idóneo para cada paciente.
TRATAMIENTO DE LA INSUFICIENCIA MITRAL AGUDA
La IM aguda constituye una emergencia quirúrgica. La mortalidad es de un 15-20% a 30 días2. Las causas comunes son rotura de cuerdas tendinosas, endocarditis bacteriana, rotura isquémica de músculo papilar, carditis reumática aguda, cardiomiopatía aguda y disfunción protésica aguda. El paciente afectado presenta disnea, inestabilidad hemodinámica y síntomas de shock. Sin embargo, algunos pacientes presentan disnea sin clínica de deterioro hemodinámico. Estos pacientes pueden ser erróneamente diagnosticados con otro proceso, debido a que el examen físico puede ser poco revelador con un soplo sistólico leve, por lo que la sospecha clínica del médico es esencial. El ecocardiograma transtorácico muestra un VI hiperdinámico de tamaño normal y un jet de IM que puede ser poco llamativo, debido al predominio de energía potencial (presión-onda V gigante) y no cinética (velocidad) del jet. El ecocardiograma transesofágico en ese caso es fundamental, porque revela el mecanismo de la IM y se aprecia mejor su gravedad. El tratamiento médico con vasodilatadores, vasopresores y balón de contrapulsación aórtica sólo estabiliza al paciente en preparación para la cirugía inmediata y no debe retardarla. Hasta el 7% de los pacientes que presentan shock cardiogénico isquémico (infarto agudo) tienen IM grave y su mortalidad es mayor que la de quienes no sufren IM. Esta mortalidad se reduce con revascularización inmediata, de tal manera que, si está indicada la revascularización quirúrgica en estos pacientes, la IM grave debe suscitar, aún más, su pronta ejecución2.
HISTORIA NATURAL DE LA INSUFICIENCIA MITRAL GRAVE CRÓNICA
La IM es una enfermedad progresiva, con aumentos anuales medios de 5-8 ml en el volumen regurgitante (volR) y 4-6 mm2 en el orificio regurgitante efectivo (ORE). Los cambios anatómicos son determinantes de la progresión, que es más rápida en pacientes con prolapso de válvula mitral, en particular aquellos con rotura de cuerdas tendinosas (hasta 20 ml por año), y en los pacientes con dilatación del anillo mitral. La progresión de la IM es causa de remodelado adverso del VI, con desarrollo de disfunción ventricular3, que puede ocurrir inicialmente con fracción de eyección (FE) «normal» (> 50%) y sin síntomas, lo que presagia un pronóstico peor que el de la población no afectada. Las estimaciones publicadas sobre supervivencia a largo plazo en pacientes con IM son ampliamente dispares4,5. En la Clínica Mayo analizamos la historia natural de la IM causada por rotura de cuerdas tendinosas6 y observamos, en comparación con la expectativa de supervivencia de la población general, que la mortalidad en IM fue notable (el 6,3% anual). Hubo una alta morbilidad a los 10 años, con una incidencia del 30% de fibrilación auricular (FA) y el 63% de insuficiencia cardiaca. A los 10 años, el 90% de los pacientes habían fallecido o se les había practicado cirugía, lo que significa que la operación es casi inevitable en esta población. Los pacientes en clase funcional de la New York Heart Association (NYHA) III-IV, incluso transitoria, mostraron alta mortalidad (el 34% anual) si no eran operados, pero incluso en clase funcional I-II la mortalidad fue notable (el 4,1% anual). Los pacientes con FE < 60% también muestran un exceso de mortalidad respecto a aquellos con FE > 60% en tratamiento médico. De tal manera que esperar a una reducción de la FE < 60% o a la aparición de síntomas de clase funcional (NYHA) II no parece adecuado, ya que el pronóstico es peor en tratamiento médico.
La muerte súbita es un evento catastrófico en la IM grave con rotura de cuerdas tendinosas, que causa aproximadamente el 25% de las muertes de pacientes en tratamiento médico7. La tasa de muerte súbita es del 1,8% por año en general, e incluso en pacientes sin otros factores de riesgo (síntomas graves, disfunción del VI y FA) es del 0,8% por año. Estos datos ponen en evidencia el grave pronóstico que implica la IM grave orgánica, especialmente la relacionada con rotura de cuerdas, quizá porque ésta se asocia mayormente a IM masiva (volR > 100 ml por latido y ORE > 0,5 cm2) en el 85% de los casos.
DISFUNCIÓN VENTRICULAR IZQUIERDA: PARÁMETROS ECOCARDIOGRÁFICOS
Durante la sístole ventricular, el volR de la IM se dirige a la aurícula izquierda con disminución de la impedancia a la eyección, y la poscarga se mantiene normal. Una poscarga normal con sobrecarga de volumen permite conservar una FE normal o supranormal por un tiempo considerable, y puede coexistir la disfunción irreversible del VI con FE normal.
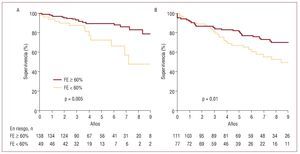
La FE y el diámetro telesistólico (DTS) del VI son los parámetros más prácticos para evaluar el VI, ya que resultan fáciles de cuantificar ecocardiográficamente y poseen poder predictivo porque representan una aproximación a la contractilidad intrínseca del VI. La disfunción del VI (FE < 60%) indica mal pronóstico con tratamiento conservador6 e incluso en el postoperatorio8, independientemente del tipo de corrección quirúrgica empleada (fig. 1). A pesar de que la muerte perioperatoria no es común, debido a los progresos de la anestesia y la protección del miocardio, la disfunción del VI es la causa más frecuente de muerte postoperatoria tardía8. De tal manera que, a pesar de la mejoría sintomática, la disfunción del VI ocurre en cerca de un tercio de los pacientes con IM orgánica operados con éxito y está asociada a baja supervivencia3,9, con alta incidencia de insuficiencia cardiaca10, que hay que prevenir.
Fig. 1. Curvas de Kaplan-Meier de supervivencia postoperatoria en la insuficiencia mitral grave, según fracción de eyección y técnica quirúrgica. A: aunque se haga reparación mitral, la supervivencia postoperatoria disminuye una vez que la fracción de eyección preoperatoria es < 60%. B: el mismo resultado se obtiene con recambio mitral. Reproducido de Enríquez-Sarano et al8, con permiso de la American Heart Association. FE: fracción de eyección.
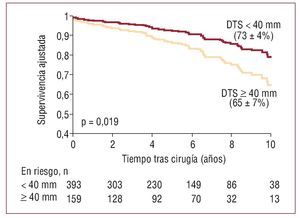
El DTS es también un parámetro esencial para predecir la reducción de la FE en el postoperatorio3 y la supervivencia. Recientemente se ha demostrado que esperar a que el DTS sea ≥ 40 mm se asocia independientemente con peor supervivencia postoperatoria a medio y largo plazo en la IM grave (fig. 2)11.
Fig. 2. Curva de Kaplan-Meier de supervivencia postoperatoria en la insuficiencia mitral grave según el diámetro telesistólico (DTS). La supervivencia está significativamente disminuida en pacientes con DTS ≥ 40 mm independientemente de que tengan síntomas. Reproducido de Tribouilloy et al11, con permiso de Elsevier.
Se debe considerar a los sujetos con FE < 60% y/o un DTS ≥ 40 mm como pacientes con disfunción ventricular izquierda manifiesta aunque estén asintomáticos, y deben recibir cirugía de rescate en ausencia de contraindicaciones12 (tabla 1). Por ello, hay discrepancia entre las recomendaciones actuales (tabla 1) y las de los autores (véase más adelante); la indicación quirúrgica determinada por los parámetros de FE < 60% y DTS ≥ 40 mm parece ser demasiado tardía y expone al paciente a una reducida supervivencia a medio y largo plazo (figs. 1 y 2).
CIRUGÍA MITRAL: AVANCES RECIENTES
La IM es el resultado de la disfunción mecánica de la válvula mitral y su corrección definitiva también es mecánica (quirúrgica). La válvula mitral no es un ente aislado; está íntimamente relacionada con el VI y garantiza su geometría y su función debido a su continuidad con él a través de las cuerdas tendinosas. Por lo tanto, la reparación mitral con conservación del aparato subvalvular constituye la base del tratamiento quirúrgico actual. En los pacientes con IM orgánica, la mortalidad quirúrgica ha disminuido considerablemente13, especialmente con reparación mitral (fig. 3). En la Clínica Mayo en Rochester, la mortalidad operatoria es de alrededor del 1% en pacientes menores de 75 años en casos de reparación o reemplazo mitral8 y < 1% en reparación aislada. Por el contrario, la mortalidad operatoria en pacientes mayores de 75 años es aproximadamente del 5% en nuestra institución. Sin embargo, la cirugía aproxima la supervivencia del paciente mayor de 75 años a la esperada en la población general14, de tal manera, que la cirugía en enfermedad orgánica (usualmente deficiencia fibroelástica en este grupo etario) se debe considerar en estos pacientes mayores para prevenir la disfunción del VI y restituir la supervivencia normal.
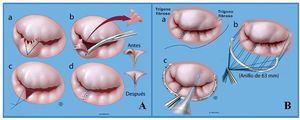
Fig. 3. Reparación mitral. Conceptos quirúrgicos básicos. A: a, segmento P2 de la valva posterior sin soporte debido a rotura de cuerda; esquema de resección triangular (línea punteada); b, resección triangular de P2; c y d, aposición y sutura de bordes libres. B: sutura de una banda de 63 mm (estándar en la Clínica Mayo) a los trígonos fibrosos del anillo mitral (a y b), seguido de prueba de integridad con solución salina (c).
Estudios previos señalan menor mortalidad operatoria y mayor supervivencia a largo plazo después de la reparación válvular15,16; en nuestra experiencia, ajustando las diferencias clínicas entre pacientes que reciben reparación frente a reemplazo, la reparación de la válvula per se es un predictor independiente de mejores resultados después de la cirugía en la IM10. La experiencia del centro en dicha técnica quirúrgica es esencial para lograr mejores resultados. Los hospitales que practican más de 140 reparaciones por año se acercan a una mortalidad quirúrgica del 1%, frente al 3% en los hospitales con menos de 140 reparaciones por año17. El ecocardiograma transesofágico intraoperatorio es un componente esencial del éxito de la reparación de la válvula y deben realizarlo médicos con experiencia para supervisar el procedimiento y asistir en la toma de decisiones intraoperatorias18.
Actualmente, el éxito de la reparación es de un 90-95%. Este alto porcentaje de éxito ha sido posible al culminar la curva de aprendizaje inicial del cirujano y utilizando técnicas especiales como la transposición de cuerdas tendinosas o la inserción de cuerdas artificiales, en particular para reparar la rotura de cuerdas tendinosas de la valva anterior19,20.
Desafortunadamente, la reparación mitral en lesiones reumáticas no tiene tanto éxito como en las lesiones degenerativas21. Sin embargo, la reparación mitral en la IM reumática debe practicarse cuando sea anatómica y funcionalmente posible, ya que está asociada a una mayor supervivencia que con el reemplazo valvular. El reemplazo mitral disminuye la reoperación en la IM reumática, pero limita la supervivencia y aumenta el riesgo de complicaciones embólicas22.
EL MOMENTO QUIRÚRGICO
Existen dos vertientes en el pensamiento actual en cuanto al momento quirúrgico en la IM grave. Una recomienda «esperar atentamente» hasta la aparición de síntomas o indicadores de disfunción subclínica en pacientes asintomáticos (p. ej., FE < 60%, DTS del VI > 40 mm), evaluando al paciente con ecocardiografía cada 6 o 12 meses. La otra recomienda considerar la «reparación mitral temprana» sin síntomas y sin alcanzar indicadores de disfunción subclínica del VI, siempre y cuando se tenga certeza de la gravedad de la IM con cuantificación ecocardiográfica apropiada (con información de los valores de volR y ORE) y se pueda ofrecer una probabilidad de reparación > 95%, con mortalidad operatoria del 1% o menos. Estas condiciones presuponen un cardiólogo capaz de cuantificar la IM y evaluar al paciente críticamente, un cirujano con experiencia en reparación mitral y un equipo posquirúrgico experimentado. La estimación de la gravedad de la IM debe incluir métodos cuantitativos e indicadores específicos o de soporte existentes (tabla 2)23. Las técnicas cuantitativas más ampliamente utilizadas son la cuantificación Doppler y el método PISA (proximal isovelocity surface area), sobre la base del análisis del flujo de convergencia proximal del área del ORE24,25. Ambos métodos permiten el cálculo del volR y el ORE26,27.
Sin embargo, consideramos que estas dos vertientes no son mutuamente excluyentes, sino complementarias y representativas del espectro de gravedad y riesgo relativos en la IM grave; no todos los pacientes con IM grave son iguales. En la Clínica Mayo, se estudió prospectivamente a 198 pacientes asintomáticos con IM grave (media de edad, 63 años; volR medio, 66 ml/latido; ORE medio, 0,4 cm2). La media del DTS del VI fue 37 mm y el diastólico, 61 mm28. Encontramos que un ORE > 0,4 cm2 en pacientes asintomáticos estaba independientemente asociado a menor supervivencia a 5 años (el 58 frente al 78%; p = 0,03) y la reparación quirúrgica, a mayor supervivencia; por lo tanto, recomendamos considerar la cirugía temprana en pacientes asintomáticos con IM grave. La incidencia de eventos clínicos en estos pacientes fue de un 10-15% por año. Por el contrario, Rosenhek et al29 evaluaron prospectivamente a 132 pacientes asintomáticos con IM orgánica grave, y encontraron que la supervivencia en 8 años era igual que la de la población general cuando se «esperaba atentamente» a la aparición de síntomas o indicadores ecocardiográficos; concluyeron que esta estrategia era apropiada. Sin embargo, la media de edad de estos pacientes era 55 años; la de DTS del VI, 34 mm, y la diastólica, 56 mm (IM grave); la IM no se cuantificó con Doppler cuantitativo o PISA, y la incidencia de eventos clínicos totales fue mucho menor que en el estudio anterior. De tal manera que este último estudio trató a pacientes más jóvenes con una IM que probablemente fuera moderada-grave, mientras que el nuestro incluyó a pacientes con IM de mayor gravedad. Un tercer grupo de investigadores, Kang et al30, estudió a 447 pacientes consecutivos con IM orgánica grave (media de edad, 50 años; media de ORE, 0,8 cm2) manejados con «reparación mitral temprana» o «espera atenta». Se constituyó un subgrupo de propensity matching de 127 pares de pacientes para controlar las características clínicas de base, y un alto porcentaje (44-46%) tenía rotura de cuerdas tendinosas, DTS del VI promedio de 36 mm y diastólico de 59 mm. La cirugía temprana electiva con reparación se asoció con una mortalidad nula en 7 años, frente al 5% en 7 años para la «espera atenta». Este tercer estudio se asemeja al nuestro en los rasgos ecocardiográficos de gravedad y el grado de dilatación del VI, aunque los pacientes eran más jóvenes. Así pues, ningún estudio es incorrecto, simplemente manejan a pacientes distintos con grados de gravedad diferentes dentro de la IM grave.
NO TODAS LAS INSUFICIENCIAS MITRALES ORGÁNICAS GRAVES SON IGUALES: FACTORES DE RIESGO
De la discusión previa se deriva que existen diferentes grados y factores de riesgo dentro de la IM grave (tabla 3). El primero de ellos es la edad. Los estudios coinciden en que pacientes > 55 años tienen mayor riesgo de complicaciones, lo que probablemente se deba a la disminución de la reserva contráctil asociada con la edad. Sin embargo, es difícil establecer un punto de corte de edad por encima del cual el riesgo aumenta significativamente. La rotura de cuerdas tendinosas y/o la IM masiva (volR > 100 ml y ORE > 0,5 cm2) son factores de riesgo dentro del espectro de la IM grave. La incidencia anual de la FA es del 5% de los pacientes con IM orgánica significativa, y su aparición se asocia a menor supervivencia31. Incluso después de reparar la válvula, la FA previa a la reparación se asocia a disminución en la supervivencia a 5 años respecto al ritmo sinusal previo a la reparación (el 87 frente al 96%; p = 0,002)32. Otro factor de riesgo es la elevación del péptido natriurético cerebral (BNP), estudiado prospectivamente en 124 pacientes con IM orgánica. Su elevación se relaciona con las consecuencias de la regurgitación (p. ej., volumen del VI y de la aurícula izquierda, FA y síntomas) y es un predictor independiente de mortalidad e insuficiencia cardiaca, independientemente de la presencia de síntomas33. Este concepto se ha revaluado prospectivamente y se ha validado en 269 pacientes consecutivos; se ha demostrado que un valor de BNP ≥ 105 pg/ml se asocia con 4,6 veces más riesgo de insuficiencia cardiaca, disminución de FE y muerte en pacientes asintomáticos con IM grave orgánica34.
La observación de hipertensión pulmonar por ecocardiografía es otro factor de riesgo predictivo de peor pronóstico12, recientemente analizado por el registro MIDA (datos no publicados), que ha demostrado un riesgo de muerte 2,5 veces mayor para pacientes con IM grave orgánica e hipertensión pulmonar no operados. Finalmente, que el paciente reconozca síntomas puede estar influido por diferencias de percepción idiosincrásicas, por temor a la cirugía o porque realiza poca actividad física o acomoda su actividad física a las restricciones impuestas por síntomas leves. En 134 pacientes con IM orgánica grave y FE normal, autoclasificados como asintomáticos, encontramos que 1 de cada 4-5 tenía una reducción significativa del consumo pico de oxígeno (< 85% de la predicción para la edad y el sexo) con evidencia de limitación del gasto cardiaco en ejercicio y baja capacidad funcional. Estos pacientes «asintomáticos» resultaron tener mayor número de eventos adversos o cirugía en 3 años de seguimiento35. Por ello resulta esencial evaluar con prueba de esfuerzo a los pacientes con cualquier grado de incertidumbre en cuanto a síntomas. Se debe tomar en cuenta estos factores de riesgo a la hora de decidir el momento quirúrgico idóneo para cada paciente (fig. 4).
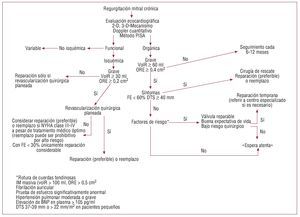
Fig. 4. Algoritmo para el tratamiento de la insuficiencia mitral. BNP: péptido natriurético cerebral; DTS: diámetro telesistólico; FE: fracción de eyección; IM: insuficiencia mitral; NYHA: New York Heart Association; ORE: orificio regurgitante efectivo; VolR: volumen regurgitante.
TRATAMIENTO CONTEMPORÁNEO DE LA INSUFICIENCIA MITRAL ORGÁNICA CRÓNICA GRAVE
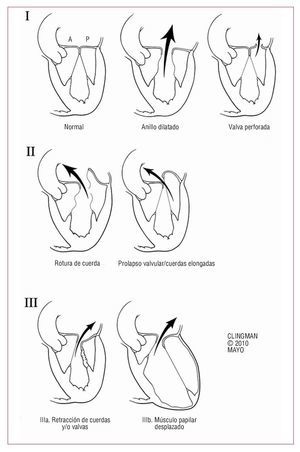
La figura 4 es un algoritmo sencillo que intenta resumir la complejidad del manejo de la IM grave en nuestra era. Cuando se refiere al paciente con IM, se debe determinar la etiología/mecanismo de la regurgitación. Existen tres mecanismos fundamentales basados en la movilidad de las valvas (fig. 5). El primero consiste en movilidad normal con mal coaptación, debida a dilatación del anillo o perforación de una valva. El segundo posee exceso de movilidad (prolapso o rotura de cuerdas tendinosas) y el tercero, disminución de la movilidad (retracción debido a proceso inflamatorio o enfermedad isquémica) (fig. 5). La IM orgánica puede deberse a una disfunción tipo 1 (p. ej., válvula mitral hendida), tipo 2 (p. ej., IM por enfermedad de Barlow) o tipo 3 (p. ej., enfermedad reumática de la válvula mitral). La IM funcional suele obedecer a una combinación de disfunción 1 y 3.
Fig. 5. Mecanismos en la insuficiencia mitral. I: movilidad normal de valvas con dilatación del anillo que causa un jet central o perforación de una valva (p. ej., válvula mitral hendida). II: movilidad excesiva con rotura de cuerdas o prolapso grave (p. ej., enfermedad de Barlow), que causan un jet dirigido al lado opuesto de la valva afectada. III: movilidad restringida debido a retracción del aparato subvalvular (IIIa; p. ej., enfermedad reumática) o desplazamiento del músculo papilar (remodelado isquémico) que causa desplazamiento apical (tethering) de la valva (IIIb); nótese que el jet está dirigido al mismo lado de la valva afectada en ambos casos.
La IM mediada por el segundo mecanismo es la más susceptible a la reparación, especialmente cuando está involucrada la valva posterior y el anillo no presenta calcificación grave. Sin embargo, la reparación en la enfermedad de Barlow grave con prolapso bivalvar extenso o prolapso aislado de la valva anterior actualmente es tan factible como la del prolapso aislado de la valva posterior, de tal manera que la gran mayoría de los casos de prolapso mitral es reparable21 en manos expertas. Una vez establecido el mecanismo orgánico, se debe confirmar que la IM es definitivamente grave (tabla 2). Si hay síntomas o FE < 60% o DTS del VI ≥ 40 mm, se debe referir al paciente para cirugía de rescate (fig. 4), ya que hay disfunción ventricular manifiesta, procurando reparar la válvula o reemplazarla si la reparación no es posible. En ausencia de disfunción ventricular manifiesta, se procede a estratificar el riesgo del paciente investigando la presencia de factores de riesgo (fig. 4). Si tiene factores de riesgo (tabla 3), se debe reparar la válvula tempranamente, no sin antes considerar factores intrínsecos del paciente y factores inherentes a la cirugía: si el paciente tiene buena expectativa de vida y la válvula es reparable, se debe reparar la válvula en un centro que garantice alto porcentaje de éxito quirúrgico y baja mortalidad operatoria (fig. 4). Si es necesario, se debe referir al paciente a un centro especializado. Si no se dan estas condiciones previas, se puede «esperar atentamente» (seguimiento por un cardiólogo con ecocardiograma cada 6 meses) a la aparición de signos ecocardiográficos y/o síntomas que indiquen necesidad de rescate, con reparación o reemplazo. Si el paciente tiene factores de riesgo (tabla 3), nosotros recomendamos la reparación temprana, dado que hay riesgo de progresión a corto plazo y el pronóstico se ve afectado. Hay discrepancia entre las recomendaciones actuales y las de los autores, quienes consideramos que hallar factores de riesgo debe ser una indicación tipo I para reparación temprana. Si no los hay, la «espera atenta» es segura y se recomienda.
INSUFICIENCIA MITRAL ISQUÉMICA: UN GRUPO DE ALTO RIESGO
El alto riesgo que la rotura isquémica de un músculo papilar conlleva es bien conocido y requiere de cirugía inmediata. La mortalidad quirúrgica por rotura de músculo papilar ha disminuido considerablemente (el 67% hasta 1990 y el 9% después), lo que refleja el frecuente uso de revascularización y los avances quirúrgicos36. Además, la supervivencia a 5 años en pacientes que sobreviven la rotura inicial es idéntica a la de los pacientes con infarto sin rotura de músculo papilar, lo cual resalta la importancia de un diagnóstico precoz y un tratamiento quirúrgico agresivo en esta complicación.
Después de un infarto de miocardio, la IM se puede desarrollar sin rotura del músculo papilar, esto como consecuencia del remodelado del VI, debido al desplazamiento apical e inferior de los músculos papilares (fig. 5, IIIb), los cuales tiran de las valvas mitrales y causan tenting de éstas, con el resultante desplazamiento apical del punto de coaptación. El fuerte impacto negativo de esta IM «funcional» isquémica posterior al infarto de miocardio se ha demostrado en dos estudios en los que la sola presencia de IM isquémica (aunque sea leve) implica baja supervivencia37,38. En pacientes con infarto previo, IM con un ORE ≥ 0,2 cm2, se asocia con el 30% de supervivencia en 5 años, comparado con el 60% sin IM. Por ello, nosotros consideramos que un ORE > 0,2 cm2 o volR > 30 ml en la IM isquémica es IM grave (fig. 4). La cuantificación ecocardiográfica exhaustiva en estos pacientes es esencial para determinar la gravedad de la IM, ya que la auscultación no revela un soplo sistólico significativo39.
El momento quirúrgico en la IM isquémica es más complicado que en la IM orgánica. A pesar de que es posible la reparación en la mayoría de los pacientes, el riesgo de la cirugía es mayor en la IM isquémica. Además, aunque se produzca mejoría sintomática con la corrección quirúrgica de la IM dilatada e isquémica (normalmente con anuloplastia)40, no se ha comprobado un beneficio real en la supervivencia a largo plazo de estos pacientes con corrección de la IM; sin embargo, nosotros estimamos que puede haber beneficio, sobre todo con técnicas de reparación específicamente dirigidas a resolver el tenting y que no se limiten a la anuloplastia. Son necesarios estudios prospectivos con distribución aleatoria de los pacientes.
Aún no se ha aclarado la pregunta de si la IM isquémica causa mal pronóstico per se o simplemente es un marcador de la gravedad de la cardiopatía isquémica41. Nosotros consideramos que el grado de IM isquémica es un marcador de la gravedad de la cardiopatía (infarto previo), pero también añade una sobrecarga de volumen adicional para un ventrículo débil. Parecería que ambos factores causan mal pronóstico.
La anuloplastia con anillo mitral protésico puede producir estenosis mitral42 y no corrige el problema básico de desplazamiento del músculo papilar que resulta en tenting de las valvas. Por esto, la reducción de la IM con anuloplastia mitral en IM isquémica, aunque suficiente en algunos casos de IM leve, no es duradera en muchos otros casos y se está estudiando nuevas técnicas para la reparación mitral. El concepto de reposicionar los músculos papilares parece prometedor y está en desarrollo43.
Cuando las valvas mitrales son sometidas a tensión debido a tenting, se reactivan procesos embriogénicos que resultan en activación celular y transformación de células endoteliales en intersticiales que resultan en depósito de nueva matriz celular. Todo esto resulta en aumento del área valvular y engrosamiento de cuerdas tendinosas, que puede conducir a aumento del área de coaptación de las valvas44. Éste es un descubrimiento importante que promete posibilidades en terapia celular para la IM secundaria. Recientemente se ha demostrado que la extensión quirúrgica de la valva posterior utilizando pericardio bovino aumenta el área de coaptación y también promete ser una posibilidad terapéutica con beneficio a corto y medio plazo45.
En la cardiopatía dilatada, ahora es posible predecir con mayor exactitud la posibilidad de reparación observando la movilidad del aspecto distal de la valva anterior. Si esta movilidad se conserva, la coaptación tiende a mantenerse aunque la valva posterior esté inmovilizada después de la reparación. La movilidad distal de la valva anterior se puede predecir con un parámetro simple de medir en el ecocardiograma preoperatorio46, de tal manera que se está avanzando hacia una mejor reparación de la IM funcional que aparenta ser más compleja y específica para cada paciente.
Actualmente, cuando la revascularización quirúrgica está planeada y la IM isquémica es leve o moderada (ORE < 0,2 cm2), se debe considerar su concomitante corrección con reparación (anuloplastia simple) (fig. 4); a los pacientes con un ORE > 20 mm2 se les debe ofrecer la reparación (preferible) o el reemplazo de la válvula mitral (fig. 4). Cuando la cirugía de revascularización miocárdica se considera no indispensable pero posible, la presencia de miocardio viable e IM con ORE > 20 mm2 debe llevar a la cirugía mitral combinada (reparación o reemplazo) con revascularización, especialmente si hay síntomas o antecedentes de insuficiencia cardiaca.
Cuando la cirugía de revascularización no es posible o no está indicada y la IM es isquémica con ORE > 0,2 cm2, la indicación de cirugía mitral es más restrictiva y se debe considerar exclusivamente en pacientes con síntomas de clase funcional (NYHA) III-IV a pesar de tratamiento médico máximo que incluya resincronización. En estos casos, el recambio puede ser prohibitivo por el alto riesgo quirúrgico, especialmente con FE < 30% (fig. 4), por lo que la reparación se hace indispensable. Alternativamente, el trasplante cardiaco puede considerarse en pacientes seleccionados y puede ofrecer resultados óptimos.
ABORDAJES PERCUTÁNEOS PARA LA INSUFICIENCIA MITRAL
La anuloplastia mitral percutánea basada en implantar un dispositivo en el seno coronario está en estudio. A pesar de que el seno coronario se encuentra anatómicamente situado en un plano superior al anillo mitral y existe la posibilidad real de comprometer el flujo de la coronaria circunfleja, se ha demostrado en 48 pacientes con cardiopatía dilatada que su uso es seguro en pacientes seleccionados y resulta en un aumento de la capacidad funcional (NYHA) tras la implantación de este dispositivo (CARILLON)47.
Otro abordaje percutáneo para la IM orgánica o funcional que se origina en el área A2 y P2 utiliza el E-valve/MitraClip basado en la sutura de Alfieri. Este clip crea una válvula mitral con doble orificio y se ha estudiado en 107 pacientes seleccionados, con un éxito del procedimiento del 74% y un 66% de pacientes libres de muerte y cirugía mitral y con IM < 2+ en 12 meses48.
CONCLUSIONES
La IM es prevalente en la población, así como su progresión a deterioro de la función del VI debido al remodelado adverso, lo cual pone de manifiesto el grave pronóstico que acarrea esta enfermedad en los pacientes que no reciben tratamiento adecuado.
La detección de la disfunción subclínica del VI mediante parámetros ecocardiográficos (FE y DTS) debe llevar a considerar una inmediata cirugía mitral de rescate. Los parámetros de uso actual (FE < 60% y DTS ≥ 40 mm) para pacientes asintomáticos resultan en cirugía de rescate tardía y hay que modificarlos. De igual manera, la detección de síntomas, así sean mínimos, debe llevar a cirugía de rescate. Los pacientes con sintomatología incierta deben ser evaluados con prueba de esfuerzo para determinar su capacidad funcional.
No todas las IM orgánicas graves son iguales. La presencia de factores de riesgo en la IM grave aumenta la probabilidad de deterioro de la función cardiaca, aparición de síntomas y peor pronóstico a largo plazo, por lo que es necesario considerar a cada paciente de forma individual. En ausencia de síntomas en pacientes con IM grave orgánica sin disfunción cardiaca (FE > 60%, DTS < 40 mm), los factores de riesgo deben tratarse con cirugía temprana con reparación si el riesgo quirúrgico es bajo, y la posibilidad de reparación de la válvula es de un 90-95%. Si es necesario, se debe referir a los pacientes a un centro especializado. El entrenamiento adecuado de los cirujanos en reparación mitral es esencial si se desea ofrecer la mejor supervivencia posible al paciente con IM orgánica grave e indicación quirúrgica. Una colaboración nacional e internacional para este adiestramiento es ineludible.
La IM isquémica acarrea un peor pronóstico, con mayor riesgo quirúrgico, y las decisiones en el tratamiento deben ser específicas para cada paciente, teniendo en cuenta la posibilidad de reparación, el riesgo quirúrgico y la necesidad de revascularización quirúrgica concomitante.
Están en estudio nuevos procedimientos percutáneos que prometen ser de potencial utilidad para pacientes seleccionados.
ABREVIATURAS
DTS: diámetro telesistólico.
FE: fracción de eyección.
IM: insuficiencia mitral.
ORE: orificio regurgitante efectivo.
VI: ventrículo izquierdo.
VolR: volumen regurgitante.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. H.I. Michelena.
Mayo Clinic.
200 First Street SW. Rochester. MN, 55905. Estados Unidos.
Correo electrónico: michelena.hector@mayo.edu
Recibido el 15 de noviembre de 2009.
Aceptado para su publicación el 6 de mayo de 2010.