Se revisan las ventajas terapéuticas de emplear la combinación de inhibidores de la enzima de conversión de la angiotensina y antagonistas de los receptores de la angiotensina II en patología cardiovascular. Los ensayos clínicos en insuficiencia cardiaca con la así denominada terapia dual han demostrado un beneficio de pequeña magnitud, aunque significativo, en rehospitalización y mortalidad cardiovascular. En la insuficiencia cardiaca o la disfunción ventricular tras infarto de miocardio, la combinación obtuvo la misma eficacia que el tratamiento con los fármacos por separado y, por el contrario, se asoció con un número de efectos adversos superior. La recomendación general de que se emplee antialdosterónicos en los casos de insuficiencia cardiaca avanzada limita el uso de la terapia dual en la práctica clínica, puesto que la terapia triple está contraindicada por el riesgo de inducir hiperpotasemia grave.
Palabras clave
El sistema renina-angiotensina-aldosterona (SRAA) constituye el eje neurohumoral por excelencia que controla la circulación sanguínea en los mamíferos actuando sobre los mecanismos de regulación homeostática de la presión arterial, la perfusión tisular, el volumen extracelular y el balance electrolítico del Na y el K1. Pero su importancia va mucho más allá, pues existe amplia evidencia sobre sus efectos en la función endotelial, la aterosclerosis y el remodelado cardiovascular2.
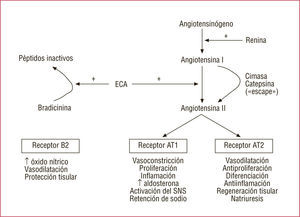
El esquema del funcionamiento del SRAA es sobradamente conocido (fig. 1), desde su punto inicial centrado en la síntesis del angiotensinógeno en el hígado, pasando por la formación de la inactiva angiotensina I y de la poderosa angiotensina II —considerada ésta núcleo central del eje tanto geográfico como por sus múltiples propiedades y actividades— para finalizar en la aldosterona, todo ello tras diversos pasos catalizados, entre otras, por la renina sintetizada en el riñón y por la convertasa angiotensínica, conocida por sus siglas ECA.
En líneas generales, se reconoce que el SRAA está excesivamente activado en una gran proporción de sujetos, especialmente con el paso de los años, lo que acaba conduciendo a elevar la presión arterial (PA) y a las diversas formas de enfermedad cardiaca, vascular y renal. Por consiguiente, obtener un adecuado bloqueo del eje es un elemento clave y, en general, los fármacos que lo han conseguido han podido demostrar con ello beneficios a corto, medio y largo plazo en la protección de los órganos diana en los que se concreta la enfermedad del sistema3,4.
La primera disyuntiva que aparece para el médico que trata patología cardiovascular surge de la amplia gama de fármacos de que dispone para bloquear o inhibir el SRAA, diseñados para ejercer su función en los diversos niveles del eje5-9. Históricamente, la primera clase farmacológica de que se dispuso fue la de los antialdosterónicos, pero su empleo decreció notablemente con el advenimiento de los inhibidores de la ECA (IECA). Los antagonistas de los receptores de la angiotensina II (ARA-II) aparecieron después, y hoy se está incorporando la última y más novedosa clase, la de los inhibidores de la renina10. Para finalizar, no hay que olvidar los bloqueadores beta, puesto que también inhiben la secreción de la renina, lo que contribuye a su efecto antihipertensivo y cardioprotector11.
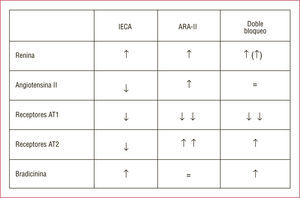
Desde un punto de vista teórico, podría parecer equivalente bloquear el sistema a cualquier nivel, pero hay diferencias, más importantes desde el punto de vista neurohumoral (fig. 2) que clínico (aunque también es cierto que las comparaciones directas entre las diferentes clases de fármacos han sido escasas). De hecho, de lo que sí hay evidencia es de que el bloqueo del SRAA en sí mismo produce grandes beneficios en todas las formas de afección cardiovascular6,8,12,13, mientras que se ignora el punto de bloqueo que da mayor beneficio. No obstante, este último aspecto escapa del objetivo de este capítulo, que va a abordar un tema de interés creciente: si el empleo simultáneo de dos fármacos que bloqueen el SRAA en diferentes puntos obtiene un bloqueo más completo del sistema y si con ello se obtienen mayores beneficios para el paciente. Es la controversia bloqueo simple frente a bloqueo combinado (también llamado dual).
El bloqueo combinado podría efectuarse de diversas formas, con diferentes fármacos y en diferentes niveles, pero el más estudiado hasta la fecha ha sido el que ha combinado un IECA con un ARA-II. Vamos a tratar los potenciales beneficios de esta forma de bloqueo combinado, y asimismo sus potenciales inconvenientes, en el campo exclusivo de la patología cardiovascular (con lo que se excluye, pues, la nefrovascular), pero sin entrar en los resultados del estudio ONTARGET, puesto que se abordan en otras partes de este número monográfico.
BLOQUEO COMBINADO. CONCEPTO Y BENEFICIOS TEÓRICOSVisto de un modo simplista, carece de sentido combinar dos fármacos que bloqueen el SRAA en dos tramos contiguos, puesto que aparentemente el objetivo se podría cumplir con uno solo de ellos. No obstante, hay diversas razones para pensar que un único fármaco puede dar lugar a un bloqueo incompleto e incluso perder eficacia a largo plazo, por lo que tendría lógica el bloqueo dual.
Al inicio del tratamiento con un IECA se consigue una reducción de la concentración plasmática de angiotensina II. Sin embargo, en el tratamiento a largo plazo, se ha observado una pérdida de efecto, de manera que las concentraciones de angiotensina II regresan a los valores iniciales. Este concepto ha sido denominado«fenómeno de escape»14.
Varios estudios han demostrado que incluso administrando las dosis máximas de IECA recomendadas no se consigue una supresión completa de la formación de angiotensina II. De hecho, se han detectado altas concentraciones de angiotensina II en pacientes con insuficiencia cardiaca tratados con IECA a dosis altas, y esto se ha asociado a un peor pronóstico15-17. Roig et al16 demostraron que en pacientes con insuficiencia cardiaca las altas concentraciones de angiotensina II a pesar del tratamiento con IECA conferían un peor pronóstico. En su muestra, el 50% de los pacientes tenían elevados valores de angiotensina II pese al tratamiento con captopril o enalapril, y junto con ello presentaban peor clase funcional, mayor activación neurohormonal y más mortalidad. Esta inhibición incompleta podría tener su explicación en la existencia de otras vías de formación de angiotensina II, diferentes de la ECA, como es el caso de la cimasa humana (fig. 1), que no se verían afectadas por el efecto de los IECA1,18.
Otro fenómeno que podría contribuir a la pérdida de efecto es el aumento de la concentración plasmática de renina que se produce por autorregulación positiva, de forma secundaria a la reducción de la angiotensina II producida por los IECA (fig. 2). Este aumento de las concentraciones y la actividad plasmática de la renina produce un incremento en la producción de angiotensina I (el sustrato de la ECA) y originaría el nuevo aumento de angiotensina II (la forma activa), de forma que el efecto total podría llegar a ser, a la larga, neutro. Los ARA-II, que bloquean directamente el receptor AT1 de la angiotensina II, inducirían a su vez el mismo fenómeno, que también conduciría a un aumento de la secreción de renina y, por lo tanto, una síntesis incrementada de angiotensina I. Como la ECA no está inhibida, este aumento de angiotensina I conlleva lógicamente el mismo efecto en la angiotensina II. Se ha especulado que estos mecanismos se deben en parte a que tanto los IECA como los ARA-II, a las dosis diarias habituales, no llegan a cubrir las 24h su respectiva inhibición o bloqueo14. Por lo tanto, el«fenómeno de escape»que se produce en el tratamiento con IECA o ARA-II en monoterapia podría explicarse por la reducción de la concentración del fármaco al final del intervalo de dosificación y por aumento reactivo de la concentración plasmática de renina que conduce a un aumento de las angiotensinas I y II.
Los ARA-II tienen un beneficio teórico sobre los IECA, pues a pesar de que producen un incremento de la angiotensina II (fig. 2) al bloquear el receptor AT1 (que se encarga de la acción presora y tiene efectos deletéreos en el sistema cardiovascular), en principio este aumento no supondría un problema (como sí ocurre en el caso de los IECA, que no inhiben el receptor AT1). Además, dado que los ARA-II bloquean selectivamente el receptor AT1, la angiotensina II podría actuar por la vía del receptor AT2, cuya activación tiene potenciales efectos vasodilatadores, natriuréticos y antiproliferativos1,14,19. Por otro lado, los IECA también inhiben la cininasa II, que se encarga de degradar la bradicinina y otros péptidos relacionados. Por lo tanto, producen un aumento de la bradicinina, que estimula la secreción de prostaglandina y óxido nítrico, con lo que se produce un efecto vasodilatador añadido. Como contrapartida, la inhibición de la cininasa II produce la acumulación de la sustancia P, que se cree causa de la tos que aparece como efecto adverso de los IECA. Dado que los ARA-II no inhiben la degradación de la bradicinina, los efectos beneficiosos de este péptido se verían disminuidos respecto a los IECA, a pesar de que la activación de los receptores AT2 pueda estimular dicho sistema20.
El tratamiento dual, utilizando simultáneamente un IECA y un ARA-II, minimizaría o neutralizaría el«fenómeno de escape»previamente descrito, y además podría tener un efecto aditivo o incluso sinérgico en la protección de los órganos diana. Como ya se ha mencionado, ambos fármacos tienen efectos protectores contra el daño cardiovascular, cerebral y renal, aunque difieren en los mecanismos por los que llegan a estos beneficios. En el caso de los IECA, son consecuencia de la reducción de la concentración de angiotensina II y la estimulación de los efectos de la bradicinina, como la producción de óxido nítrico. Los ARA-II, en cambio, bloquean el receptor AT1 y favorecen la estimulación del receptor AT2, que también favorece la acción del óxido nítrico. Sus mecanismos de acción son algo diferentes, en cierta forma incluso complementarios, y se ha especulado con que la combinación de ambos sería superior a la monoterapia en el tratamiento de la insuficiencia cardiaca, el infarto de miocardio y la enfermedad renal2.
Varios estudios experimentales indican que el bloqueo dual podría ser superior al bloqueo simple en hipertrofia ventricular izquierda e insuficiencia cardiaca. En un modelo de ratas hipertensas, se ha demostrado que el bloqueo combinado del SRAA consigue una mayor reducción de la hipertrofia ventricular izquierda, mejora la función diastólica y logra un incremento de la supervivencia en comparación con la monoterapia con un IECA o un ARA-II, todo ello independientemente del descenso en las cifras de PA21. En modelos experimentales de insuficiencia cardiaca, el bloqueo dual ha sido superior al bloqueo simple en la mejoría del gasto cardiaco y en parámetros hemodinámicos y de activación neurohumoral22. Asimismo, el bloqueo dual también se ha demostrado más eficaz, o al menos equivalente, para prevenir el remodelado del ventrículo izquierdo después de un infarto de miocardio en animales de experimentación23,24.
En cuanto a la clínica y en el área cardiovascular, hasta ahora disponemos de información en los campos de la insuficiencia cardiaca y en la disfunción ventricular tras el infarto de miocardio. Los resultados del estudio ONTARGET, en sujetos con alto riesgo cardiovascular, se detallan en otro trabajo publicado en este mismo monográfico.
BLOQUEO COMBINADO EN LA INSUFICIENCIA CARDIACA SISTÓLICA (tabla 1)La insuficiencia cardiaca con disfunción sistólica fue el primer campo en que se ensayó el bloqueo dual, probablemente porque en esta entidad la hiperactividad neurohumoral es máxima, y por ello se esperaba también los máximos beneficios. Inicialmente se publicaron algunos ensayos pequeños que demostraron que el bloqueo combinado del SRAA producía mejorías significativas respecto al bloqueo simple en ciertas variables de menor valor clínico, como es la función ventricular, la prevención del remodelado, el incremento en la capacidad de ejercicio y la reducción de la activación neurohormonal25-27. El estudio más importante de esta serie fue el RESOLVD28 (Randomized Evaluation of Strategies for Left Ventricular Dysfunction), realizado en 768 pacientes afectos de insuficiencia cardiaca en clase funcional II-IV y fracción de eyección (FE)<40%, que fueron tratados con candesartán (4, 8 o 16mg), enalapril (20mg) o la combinación de ambos (20mg de enalapril más 4 u 8mg de candesartán) durante 43 semanas. El tratamiento combinado, comparado con la monoterapia, se demostró beneficioso para prevenir la dilatación ventricular izquierda (menos incremento en el diámetro telediastólico y telesistólico del ventrículo izquierdo) y redujo la activación neurohormonal (reducción o menor incremento de la aldosterona y el BNP). Sin embargo, no se encontraron diferencias en la FE, la clase funcional o la calidad de vida. A pesar de que el estudio no fue diseñado con esta finalidad, tampoco se encontraron diferencias significativas entre los tres grupos en hospitalización y mortalidad.
Bloqueo combinado en la insuficiencia cardiaca crónica
| Estudio | Diseño del estudio | Población | Resultados |
| RESOLVD | Comparación de tres ramas de tratamiento: candesartán 4, 8 o 16mg/día; candesartán 4 u 8mg/día+enalapril 20mg/día, y enalapril 20mg/día | 768 pacientes con clase funcional II-IV de la NYHA y FEVI ≤40% | El tratamiento combinado candesartán+enalapril demostró reducción en los volúmenes telediastólico y telesistólico del VI (p<0,01), mayor reducción de la PA (p<0,05) y reducción de aldosterona (p<0,05) y BNP (p<0,01) |
| Seguimiento medio, 43 semanas | Tratamiento asociado: IECA (94%), bloqueador beta (15%), diurético (84%) o digoxina (69%) | ||
| Val-HeFT | Valsartán 160mg dos veces al día o placebo agregados al tratamiento de base (el 93% recibía IECA) | FEVI media, 27-28% 5.010 pacientes con clase funcional II-IV de la NYHA y FEVI≤40% | La combinación de valsartán+IECA redujo la combinada morbilidad+mortalidad (p=0,009). También hubo mejoría en variables secundarias: NYHA, FEVI y calidad de vida. En el subgrupo con bloqueador beta, IECA y ARA-II, se encontró una mayor mortalidad |
| Seguimiento medio, 23 meses | Tratamiento agregado: IECA (93%), bloqueador beta (35%), diurético (85%), digoxina (67%) o espironolactona (5%) | ||
| CHARM-Added | Candesartán 32mg/día o placebo agregados al tratamiento de base con IECA | FEVI media, 27%2.548 pacientes con clase funcional II-IV de la NYHA y FEVI≤40% | La combinación candesartán+IECA redujo la mortalidad cardiovascular (p=0,021) y la hospitalización por insuficiencia cardiaca (p=0,018). No hubo diferencias entre los subgrupos con y sin bloqueadores beta |
| Seguimiento medio, 41 meses | Tratamiento agregado: IECA (99,9%), bloqueador beta (55%), diurético (90%), digoxina (58%) o espironolactona (17%)FEVI media, 28% |
BNP: péptido natriurético tipo B; FEVI: fracción de eyección ventricular izquierda; IECA: inhibidores de la enzima de conversión de angiotensina; NYHA: clase funcional de la New York Heart Association; PA: presión arterial; VI: ventrículo izquierdo.
Esos estudios, considerados preliminares, dieron lugar a ensayos de mayor magnitud que intentaban verificar si el bloqueo dual podía aportar beneficios en cuanto a rehospitalización e incluso supervivencia. Básicamente, disponemos actualmente de dos macroestudios que evaluaron la eficacia del bloqueo combinado IECA+ARA-II en la insuficiencia cardiaca: ValHeFT29 y CHARM-Added30.
El Valsartan in Chronic Heart Failure Trial (ValHeFT) fue el primer ensayo con una gran muestra y un seguimiento a largo plazo. En total, 5.010 pacientes con insuficiencia cardiaca en clase funcional II-IV de la NYHA y FE<40% fueron asignados aleatoriamente a recibir valsartán (dos dosis diarias de 160mg) o placebo, además del tratamiento habitual (el 93% recibía IECA). El estudio demostró una reducción significativa del 13,2% (p=0,009) en la variable combinada primaria de morbilidad-mortalidad en el grupo de valsartán respecto al grupo a placebo. Sin embargo, no se encontraron diferencias en la variable primaria de mortalidad, y la reducción en la variable combinada fue sobre todo a expensas de la hospitalización por insuficiencia cardiaca. El riesgo de hospitalización por insuficiencia cardiaca se redujo el 27,5% en el grupo de tratamiento (p<0,001). Con el tratamiento con valsartán añadido a la terapia de base también se demostró una mejoría (aunque muy discreta) en la FE (p=0,001), así como en la clase funcional (p<0,001) y la calidad de vida (p=0,005). Inesperadamente, en el Val-HeFT, agregar valsartán al tratamiento de los pacientes que ya recibían un IECA y un bloqueador beta empeoró la mortalidad respecto a placebo (p=0,009), aunque sólo un 30% de la población recibía la triple terapia. Este hecho hizo crecer las dudas sobre la conveniencia del bloqueo combinado con IECA y ARA-II en los pacientes que reciben tratamiento con bloqueadores beta, y apareció la hipótesis de que el bloqueo excesivo de distintos sistemas neurohormonales en pacientes con insuficiencia cardiaca podría ser deletéreo.
El estudio CHARM-Added (The Candesartan in Heart failure: Assesment of Reduction in Mortality and Morbidity) comparó candesartán (32mg/día) y placebo en 2.548 pacientes en clase funcional II-IV de la NYHA y FE<40% que ya recibían tratamiento con un IECA. Se realizó un seguimiento de 41 meses de mediana, y la variable primaria analizada fue el combinado de hospitalización por insuficiencia cardiaca o muerte cardiovascular. El tratamiento con candesartán mostró una reducción significativa en cada uno de los componentes de la variable principal, con un riesgo relativo (RR) de 0,85 para la variable combinada (p=0,010), RR=0,83 para la muerte cardiovascular (p=0,021) y RR=0,83 para la hospitalización por insuficiencia cardiaca (p=0,018). Sin embargo, la mortalidad por todas las causas no se modificó significativamente (el 30% del grupo a candesartán y el 32% del grupo placebo). Por otro lado, el tratamiento con candesartán se asoció a una mayor reducción de la PA sistólica (4,6mmHg respecto a placebo; p=0,007) y de la PA diastólica (3mmHg respecto a placebo; p=0,004).
A diferencia de los resultados del estudio Val-HeFT, en el CHARM-Added los pacientes que recibían tratamiento con IECA y bloqueador beta (un 55% del total) también se beneficiaron de agregar un ARA-II. Sin embargo, la reducción en la mortalidad cardiovascular en este subgrupo de triple terapia no llegó a ser significativa (el 25% en el grupo a candesartán y el 27% en el grupo a placebo; p=0,22); aunque si se comparaba con los pacientes que no tomaban bloqueador beta, se objetivaba que la mortalidad en este grupo era mayor (de los pacientes sin bloqueador beta, el 35% en el grupo a candesartán y el 39% en el grupo a placebo; p=0,20).
El programa de estudio CHARM también abordó el tema de los pacientes con insuficiencia cardiaca que no toleraban los IECA (CHARM-Alternative) y el de los pacientes con insuficiencia cardiaca exclusivamente diastólica, con FE>40% (CHARM-Preserved). El CHARM-Overall, finalmente, recogió los resultados de los tres estudios y confirmó la idea de que agregar un ARA-II produce un beneficio añadido a los pacientes que ya están en tratamiento con un IECA31,32.
El CHARM low-left ventricular ejection fraction trial33, que incluyó a los pacientes del CHARM-Alternative y el CHARM-Added (todos ellos con clase funcional II-IV y FE<40%), confirmó la reducción en la variable muerte cardiovascular y hospitalización por insuficiencia cardiaca. En ese estudio también fue significativa la reducción en mortalidad por todas las causas (28% en el grupo candesartán y 31% en el grupo placebo; p=0,018). Además, demostró que la reducción en la variable combinada se mantenía en todos los subgrupos definidos, tratados con bloqueadores beta, IECA o espironolactona, solos o en combinación.
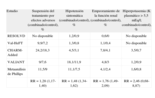
Un metaanálisis posterior34 que analizó conjuntamente los resultados de los tres estudios (RESOLVD, Val-HeFT y CHARM-Added) demostró que el bloqueo combinado con IECA y ARA-II conseguía un beneficio en la variable combinada de mortalidad y morbilidad (odds ratio [OR]=0,89; intervalo de confianza [IC] del 95%, 0,81-0,98), sin lograr una mejoría en la mortalidad por todas las causas (tabla 2). Asimismo, utilizando los datos del Val-HeFT y del CHARM-Added, se realizó un análisis sobre las diferencias entre el bloqueo combinado con tratamiento bloqueador beta y sin éste. En los pacientes que tomaban IECA y bloqueador beta, no se demostró que agregar un ARA-II consiguiera ninguna mejora en mortalidad ni en el combinado de mortalidad-morbilidad. En los pacientes que no tomaban bloqueador beta, se mantenía el beneficio demostrado en el estudio general (reducción del combinado de mortalidad-morbilidad, OR=0,83; IC del 95%, 0,73-0,94).
Efectos del bloqueo combinado en la insuficiencia cardiaca crónica, en función del uso concomitante de bloqueadores beta
| Tratamiento | Efecto en mortalidad por todas las causas | Efecto en la variable combinada morbilidad-mortalidad |
| Bloqueo combinado (independientemente del tratamiento con bloqueadores beta) | Sin diferencias significativas (OR=0,97; IC del 95%, 0,87-1,08) | Beneficio a favor del bloqueo combinado (OR=0,89; IC del 95%, 0,81-0,98) |
| Bloqueo combinado en los pacientes con bloqueador beta | Sin diferencias significativas (OR=1,08; IC del 95%, 0,90-1,29) | Sin diferencias significativas (OR=0,94; IC del 95%, 0,80-1,10) |
| Bloqueo combinado en los pacientes sin bloqueador beta | Sin diferencias significativas (OR=0,93; IC del 95%, 0,81-1,06) | Beneficio a favor del bloqueo combinado (OR=0,83; IC del 95%, 0,73-0,94) |
IC: intervalo de confianza; OR: odds ratio.
Modificado del metaanálisis de Dimopoulos et al35.
Una posible explicación para los resultados discordantes de los estudios Val-HeFT y CHARM-Added en los pacientes que toman IECA y bloqueador beta podría ser las diferencias en las características basales de la muestra de ambos estudios. En el Val-HeFT la mayoría de los pacientes se encontraban en clase funcional II de la NYHA, mientras que en el segundo la mayoría se encontraba en clase funcional III. Así pues, dado que los pacientes del CHARM-Added tenían una insuficiencia cardiaca más avanzada, probablemente también tenían una mayor activación neurohormonal, lo que tal vez explicaría los resultados favorables de la triple terapia en este grupo, resultado que no llegó a alcanzarse en el Val-HeFT. Por lo tanto, es posible que la triple terapia IECA+ARA-II+bloqueador beta sea beneficiosa en el grupo de pacientes con peor situación clínica.
Debe mencionarse que, tras la publicación de los estudios y los metaanálisis mencionados, las guías de la Sociedad Europea de Cardiología para el diagnóstico y el tratamiento de la insuficiencia cardiaca crónica recomiendan considerar la combinación con un ARA-II en los pacientes que persisten sintomáticos a pesar del tratamiento con un IECA35, una recomendación que se matiza más adelante.
BLOQUEO COMBINADO TRAS INFARTO DE MIOCARDIOEl estudio VALIANT36 (The Valsartan in Acute Myocardial Infarction Trial) analizó el efecto del tratamiento con valsartán, captopril o la combinación de ambos en 14.703 pacientes con infarto de miocardio complicado con insuficiencia cardiaca o disfunción ventricular izquierda. Los pacientes fueron asignados aleatoriamente en los primeros 10 días tras el infarto a recibir uno de los tres tratamientos, que fueron añadidos a la terapia estándar. Después de una mediana de seguimiento de 24,7 meses, no se encontraron diferencias significativas en la variable principal muerte por cualquier causa ni en otras variables secundarias que incluían varias combinaciones de mortalidad y morbilidad cardiovascular, así como en las hospitalizaciones por insuficiencia cardiaca. Además, el tratamiento combinado con valsartán y captopril mostró mayores tasas de efectos adversos (incluso insuficiencia renal) y abandono del tratamiento.
Aparentemente, estos resultados son contradictorios con los hallazgos de los estudios Val-HeFT29 y CHARM-Added30, que demostraron que el bloqueo combinado ofrecía beneficios respecto a la monoterapia en los pacientes con insuficiencia cardiaca y disfunción ventricular. Se han propuesto múltiples razones para explicar estas diferencias. En primer lugar, en el VALIANT todos los enfermos se encontraban, en el momento de la inclusión, afectos de un infarto de miocardio en fase aguda. Además, en ese estudio se inició el tratamiento con IECA y ARA-II simultáneamente, mientras que en los anteriores se añadía el ARA-II al tratamiento previo con IECA. Otra diferencia es los diferentes fármacos y dosis que se usó en cada ensayo; en el VALIANT el tratamiento con captopril se administraba a dosis de 50mg cada 8h por protocolo. mientras que en el CHARM-Added los investigadores elegían la dosis del IECA. Una de las opiniones más aceptadas es que el exceso de hipotensión inducido por la combinación podría haber perjudicado a una proporción de pacientes que necesitaban cierta presión de perfusión coronaria por tener la arteria coronaria reabierta parcialmente, lo que habría contrarrestado los posibles beneficios en los demás pacientes del estudio.
Por otro lado, las poblaciones estudiadas también mostraban diferencias importantes respecto a sus características basales y su riesgo cardiovascular (p. ej., en el Val-HeFT y el CHARM-Added la FE media era del 27 y el 28% respectivamente, mientras que en el VALIANT era del 35%).
Por último, aproximadamente el 70% de los pacientes del estudio VALIANT recibían tratamiento con bloqueadores beta, y no se demostraron diferencias en mortalidad ni en los eventos cardiovasculares en el análisis de subgrupos según llevaran dicho tratamiento o no. Este resultado indicaba que la triple terapia con bloqueador beta, IECA y ARA-II podía ser segura, a diferencia de los resultados adversos que se encontraron en el estudio Val-HeFT.
Así pues, el bloqueo combinado con valsartán y captopril en los pacientes con infarto agudo de miocardio e insuficiencia cardiaca no se ha demostrado beneficioso en supervivencia o morbilidad, y además incrementa el riesgo de efectos adversos, por lo que en la actualidad no está indicado.
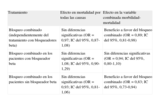
SEGURIDAD Y RIESGOS DEL BLOQUEO COMBINADO (tabla 3)Teóricamente, el bloqueo combinado del SRAA mediante la combinación de IECA y ARA-II podría tener implicaciones importantes en cuanto a seguridad y la posible suma de efectos adversos. Además, muchos de los pacientes que podrían beneficiarse de esta estrategia reciben tratamiento con varios fármacos y tienen comorbilidades (como la insuficiencia renal) que podrían incrementar los posibles riesgos. Los efectos secundarios más importantes de la doble terapia son el empeoramiento de la función renal, la hiperpotasemia y la hipotensión sintomática.
Efectos adversos del bloqueo combinado
| Estudio | Suspensión del tratamiento por efectos adversos (combinado/control), % | Hipotensión sintomática (combinado/control), % | Empeoramiento de la función renal (combinado/control), % | Hiperpotasemia (K plasmático>5,5mEq/l; combinado/control), % |
| RESOLVD | No disponible | 1,2/0,9 | 0,6/0 | No disponible |
| Val-HeFT | 9,9/7,2 | 1,3/0,8 | 1,1/0,4 | No disponible |
| CHARM-Added | 24,2/18,3 | 4,5/3,1 | 7,8/4,1 | 3,5/0,7 |
| VALIANT | 9/7,6 | 18,1/11,9 | 4,8/3 | 1,2/0,9 |
| Metaanálisis de Phillips | 11,5/9 | 11,1/7,5 | 4,1/2,4 | 1,6/0,8 |
| RR=1,28 (1,17-1,40) | RR=1,48 (1,34-1,62) | RR=1,76 (1,49-2,09) | RR=2,46 (0,68-8,87) |
RR: razón de riesgo.
Modificado de Phillips et al37.
El metaanálisis de Phillips et al37 evaluó los efectos adversos del bloqueo combinado en la disfunción ventricular izquierda con los datos de los estudios RESOLVD, Val-HeFT, CHARM-Added y VALIANT. La población total agrupaba a 17.337 pacientes, con un seguimiento medio de 25 meses. La combinación de IECA y ARA-II se asoció con un incremento significativo en la suspensión del tratamiento por la aparición de efectos adversos en los pacientes con insuficiencia cardiaca crónica (el 15 frente al 11%; RR=1,38; IC del 95%, 1,22-1,55) y en los pacientes con infarto agudo de miocardio y disfunción ventricular izquierda sintomática (el 9 frente al 7,6%; RR=1,17; IC del 95%, 1,03-1,34). Asimismo, se asoció con un aumento significativo de la aparición de hipotensión sintomática para toda la cohorte estudiada (el 11,1 frente al 7,5%; RR=1,48; IC del 95%, 1,34-1,62). El empeoramiento de la función renal y la hiperpotasemia son los efectos adversos más importantes, por los riesgos para el paciente que pueden conllevar. En ese metaanálisis, el bloqueo combinado se asoció a un aumento en la frecuencia de empeoramiento de la función renal, definida como un incremento de la creatinina>0,5mg/dl (el 4,1 frente al 2,4%; RR=1,76; IC del 95%, 1,492,09). La combinación de IECA y ARA-II también produjo un mayor riesgo de hiperpotasemia, definida como concentración plasmática de K>5,5mEq/l en los pacientes con insuficiencia cardiaca crónica (el 3,5 frente al 0,7%; RR=4,87; IC del 95%, 2,39-9,94) y un aumento no significativo en los pacientes con infarto agudo de miocardio y disfunción ventricular izquierda sintomática (el 1,2 frente al 0,9%; RR=1,33; IC del 95%, 0,90-1,98).
Estos resultados llevan a la conclusión de que, si se utiliza el bloqueo combinado en los pacientes con disfunción ventricular izquierda, es importante la monitorización estricta del aclaramiento de creatinina y de la concentración plasmática de K. El empeoramiento de la función renal puede producir, entre otros efectos, un aumento de la concentración circulante de otros fármacos, con el consiguiente riesgo de aparición de efectos adversos o de intoxicación; por otro lado, la hiperpotasemia puede llegar a constituir por sí sola un riesgo para la vida del paciente. Por lo tanto, conocer los potenciales efectos adversos del bloqueo combinado es imprescindible para el uso correcto de esta estrategia de tratamiento.
CONCLUSIONESLos estudios efectuados hasta el momento con bloqueo dual en patología cardiovascular (excluyendo el ONTARGET) se han circunscrito a la insuficiencia cardiaca crónica y la situación tras el infarto con insuficiencia cardiaca, y no existen estudios amplios (de morbimortalidad) en otros ámbitos (hipertensión esencial, angina estable, síndrome coronario agudo sin insuficiencia cardiaca o sin disfunción ventricular, arritmias, etc.). Concretando los datos en insuficiencia cardiaca y tras el infarto, los resultados han sido pobres, muy levemente favorables en la insuficiencia cardiaca sistólica y negativos en pacientes infartados (ausencia de eficacia y mayores efectos indeseables). Aunque podría defenderse el empleo del bloqueo dual específicamente en el campo de la insuficiencia cardiaca con disfunción sistólica y, de hecho, las guías europeas35 defienden la combinación en sujetos que no responden a la terapia simple con IECA, ha sido muy escasa su implementación en la práctica real.
Las razones del poco éxito del bloqueo dual en la insuficiencia cardiaca radican en las dificultades con que a menudo se encuentran los médicos en la insuficiencia cardiaca, situación en la que los pacientes suelen presentar PA muy bajas, lo que motiva reticencias a añadir un tipo de fármaco que también es potencialmente hipotensor, como los ARA-II (en sujetos que ya reciben normalmente tres formas de hipotensores: diuréticos de asa, IECA y bloqueadores beta). Pero hay otro aspecto que ha limitado enormemente su uso: los hallazgos de los estudios con antialdosterónicos en RALES (insuficiencia cardiaca crónica) y Ephesus (postinfarto)12,13. Sus resultados han sido muchísimo más favorables que los del bloqueo combinado, con beneficios directamente en mortalidad por todas las causas (la variable sin duda de mayor peso en un ensayo clínico), algo que la combinación IECA+ARA-II no ha logrado en absoluto. Por lo tanto, el bloqueo dual que se impone en todo caso es IECA+antialdosterónico (o ARA-II+antialdosterónico, si hay intolerancia a los IECA). La posibilidad de una terapia combinada triple (IECA+ARA-II+antialdosterónico) en la insuficiencia cardiaca es excesivamente arriesgada, todos los expertos coinciden en ello, por la obvia tendencia a la hipotensión y, especialmente, a la hiperpotasemia. De hecho, las guías de la AHA38 desaconsejan formalmente la triple combinación. Además, como no se plantea la combinación IECA+ARA-II si no es en casos de insuficiencia cardiaca avanzada, y en ellos es de obligado cumplimiento el tratamiento antialdosterónico, en la práctica no se dan las circunstancias que permitan dicha combinación.