Palabras clave
INTRODUCCIÓN
La progresión de la insuficiencia cardiaca se caracteriza por una serie de mecanismos de compensación, donde intervienen fuerzas hemodinámicas y factores hormonales y genéticos que alteran el tamaño, la forma y la función del ventrículo1. Pese a la importancia del núcleo y del transporte de macromoléculas núcleo-citoplasma2, todavía no se ha estudiado su papel en la insuficiencia cardiaca.
Los objetivos de nuestro estudio son analizar en el cardiomiocito humano con insuficiencia cardiaca de origen isquémico (MCI) o dilatado (MCD), la estereología de su núcleo (tamaño y forma, masas de cromatina), y determinar los valores de nucleoporina p62 del complejo de poro nuclear (CPN) implicada directamente en el transporte nuclear3-5, y su relación con los distintos parámetros nucleares.
MÉTODOS
Obtención de muestras
Corazones humanos explantados, 10 pacientes con MCI (54 ± 4 años, el 100% varones) y 10 pacientes con MCD (52 ± 6 años, el 100% varones) (tabla 1), sometidos a trasplante cardiaco. Todos ellos tenían historia clínica, ECG, estudio eco-Doppler y coronariografía, estaban clasificados funcionalmente y en tratamiento.
Las muestras transmurales de tejido se tomaron del ápex y de la base del ventrículo izquierdo; se mantuvieron en NaCl al 0,9% durante la extracción y se almacenaron a 4 °C por un máximo de 8 h desde la pérdida de la circulación coronaria. Las muestras fueron obtenidas mediante consentimiento informado de los pacientes. El estudio fue aprobado por el comité ético del hospital y se realizó de acuerdo con la Declaración de Helsinki.
Análisis de microscopia óptica
Las muestras se fijaron en solución de glutaraldehído (1,5%), formaldehído (1%) y tampón cacodilato 0,05 mol (pH 7,4) durante 60 min a 4 °C, deshidratadas y embebidas en resina epoxi Epon 812. Se obtuvieron cortes semifinos (50 µm) teñidos con azul de toluidina al 0,1%, y se observaron a un aumento de x60. Las imágenes ópticas, obtenidas con cámara digital, se cuantificaron mediante el programa de imagen Scion Image Beta 4.02 (Scion, MD, Estados Unidos).
Electroforesis y Western blot
Se homogeneizaron 50 mg de ventrículo izquierdo en un tubo que contenía tampón de muestra. Los homogeneizados se calentaron a 100 °C, se centrifugaron (13.000 rpm, 5 min a TA) y, el sobrenadante obtenido fue alicuotado. El contenido de proteínas se determinó mediante el método de Lowry. Las muestras se separaron mediante electroforesis en geles NU-PAGE Tris-acetato en gradiente 3-8% (Invitrogen). Las proteínas se transfirieron desde el gel a una membrana de nitrocelulosa (diámetro de poro, 0,45 nm). Las membranas se incubaron 2 h con el anticuerpo primario (policlonal IgG de conejo, dilución 1/300. Santa Cruz Biotechnology, Estados Unidos) y, por último, las bandas se visualizaron mediante un anticuerpo secundario IgG anti-conejo conjugado con fosfatasa alcalina y un sistema sustrato (Sigma Aldrich). La cuantificación del Western blot se realizó mediante el programa Scion Image Beta 4.02.
Análisis estadístico
Los datos se expresaron como media ± desviación estándar. Se utilizó la prueba de Kolmogorov-Smirnov para estudiar la normalidad de las variables; éstas mostraron una distribución normal y se compararon mediante el test de la t de Student. Las diferencias entre los porcentajes se analizaron mediante el test exacto de Fisher. Se utilizó el coeficiente de correlación de Pearson para determinar la relación entre parámetros estereológicos y las cifras de p62. Se realizó una regresión lineal múltiple introduciendo como variable dependiente los valores de p62 y como independientes: diagnóstico, edad, área del núcleo, heterocromatina (%) y superficie invaginada (%). Se asumió una diferencia estadísticamente significativa si p < 0,05. Todos los análisis se realizaron mediante el paquete SPSS para Windows 11.0 (SPSS Inc.).
RESULTADOS
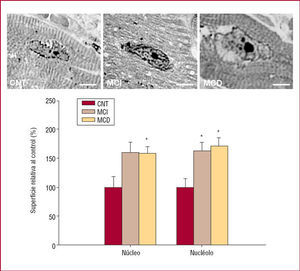
Se analizaron imágenes de microscopio óptico de 10 corazones isquémicos y 10 corazones dilatados (27 núcleos por corazón), al igual que en controles. Los corazones enfermos mostraron aumento del área del núcleo y el nucléolo, que para los isquémicos y dilatados fueron un 60%, un 66% (p = 0,03) y un 59% (p = 0,02) y un 75% (p = 0,03), respectivamente, mayores que los CNT (fig. 1). Además, se observaron pequeñas diferencias en la superficie de membrana nuclear invaginada, una disminución del 5% en los isquémicos y un aumento del 11% en los dilatados, comparados con CNT. Los valores de cromatina se mantuvieron similares en ambas miocardiopatías, con un ligero aumento del 4 y el 6%, respectivamente, frente a las muestras de CNT.
Fig. 1. Microscopia óptica de secciones del ventrículo izquierdo que representan la superficie de núcleo y el nucléolo en la miocardiopatía isquémica (MCI), dilatada (MCD) y controles (CNT). El gráfico de barras muestra el análisis cuantitativo de las superficies relativas nucleares y nucleolares de los corazones con MCI y MCD respecto a los corazones sanos, que representan el 100%. Escala = 3 µm. Los valores están representados como media ± error estándar de la media. *p < 0,05.
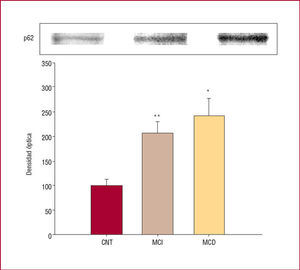
En cuanto al análisis electroforético, los inmunoblots de p62 de los corazones enfermos mostraron un aumento significativo frente al grupo CNT (n = 3), tanto en la MCI (n = 10; 210 ± 48 y 100 ± 15; p = 0,01) como en la MCD (n = 10; 245 ± 87 y 100 ± 11; p = 0,04) (fig. 2). No hubo diferencias estadísticamente significativas entre ambas miocardiopatías.
Fig. 2.Western blot de concentración de nucleoporina p62 en corazones control (CNT), con miocardiopatía isquémica (MCI) y dilatada (MCD). Los datos empleados para el análisis estadístico se representan como la media ± error estándar de la media de 5 experimentos independientes. *p = 0,04. **p = 0,01.
Los valores de p62 mostraban una correlación directa con el área del núcleo (r = 0,615; p = 0,05) en la MCI. También, existe una correlación inversa entre el porcentaje de heterocromatina nuclear (r = -0,707; p = 0,02) y la superficie de membrana nuclear invaginada (r = 0,561), aunque ésta no alcanzó significación (p = 0,09). A su vez, obtuvimos correlación directa entre el valor de heterocromatina y la superficie de membrana nuclear invaginada (r = 0,708; p = 0,005) (fig. 3). En la MCD no obtuvimos correlación significativa. Por último, al realizar una regresión lineal múltiple obtuvimos que solamente la variable diagnóstico influyó directamente en los valores de p62 (r2 = 0,46).
Fig. 3. Correlaciones entre área del núcleo (A), porcentaje de heterocromatina (B) y porcentaje de membrana nuclear invaginada (C) y las concentraciones de p62 en los corazones con miocardiopatía isquémica (MCI). La correlación entre porcentaje de membrana invaginada y cantidad de heterocromatina se muestra en la ventana D.
DISCUSIÓN
En el primer objetivo de nuestro estudio hemos observado alteraciones estructurales en los núcleos de los cardiomiocitos isquémicos y dilatados frente al grupo control, y hay un aumento significativo del área del núcleo y nucléolo. El tamaño de los nucléolos es reflejo directo de su actividad, lo que explicaría que nuestros pacientes con insuficiencia cardiaca de origen isquémico y dilatado muestren un gran aumento de su tamaño, ya que el remodelado ventricular conlleva una mayor expresión que conduce a mecanismos de adaptación del corazón6,7. Sin embargo, no encontramos grandes diferencias en el porcentaje de superficie de membrana nuclear invaginada, ni tampoco en el porcentaje de heterocromatina nuclear en ambas miocardiopatías.
En cuanto a los valores de la proteína p62, observamos un aumento significativo en ambas miocardiopatías. Este hecho se explicaría como una consecuencia de la activación de la expresión génica en los cardiomiocitos con insuficiencia cardiaca, con el consiguiente aumento del transporte a través de los CPN y de sus componentes, como la nucleoporina p62. Se acompaña del aumento en el área del núcleo, con un mayor número de CPN embebidos en la envoltura nuclear, como indica la correlación entre el área del núcleo y los valores de p62.
Por último, hemos relacionado los parámetros estereológicos nucleares con la expresión de p62 en ambas miocardiopatías, y se han obtenido correlaciones significativas entre la p62 y el área del núcleo, el porcentaje de heterocromatina y de membrana invaginada, pero tan sólo en el grupo con MCI. Esta diferencia obtenida podría deberse a la activación de un patrón de expresión génica diferente en ambas miocardiopatías, que conducen a una secuencia de mecanismos de adaptación del miocardio al estrés biomecánico diferente según la etiología de la insuficiencia cardiaca7,8.
Una limitación, al tratarse de un estudio transversal, sería la imposibilidad de establecer la secuencia de la actuación de factores o efectos causales. Además, el tamaño muestral limita, en cierta manera, el análisis por subgrupos etiológicos, aunque hemos obtenido correlaciones significativas que permiten desarrollar nuestras hipótesis. Al tratarse de un estudio novedoso sobre el papel del núcleo en el desarrollo de esta enfermedad, no hemos podido comparar nuestros datos con los de otros autores.
En conclusión, los corazones con insuficiencia cardiaca de origen isquémico o dilatado mostraron alteraciones en la morfología nuclear, con un importante aumento de nucleoporina p62, cuyos valores se relacionaron con las alteraciones en el tamaño y la forma del núcleo del cardiomiocito. Estos cambios morfológicos y en la expresión de p62 podrían afectar a la función nuclear dependiendo de la etiología de este síndrome.
AGRADECIMIENTOS
Al Servicio de Coordinación de Trasplantes (Hospital Universitario La Fe, Valencia) por su colaboración para la obtención de las muestras, así como a Inmaculada Montserrat, técnico de laboratorio de la Unidad de Biología y Patología Celular del Centro de Investigación del Hospital Universitario La Fe.
Full English text available from: www.revespcardiol.org
ABREVIATURAS
CNT: control.
CPN: complejo de poro nuclear.
MCD: miocardiopatía dilatada.
MCI: miocardiopatía isquémica.
Correspondencia: Dr. M. Portolés Sanz.
Unidad de Biología y Patología Celular. Centro de Investigación. Hospital Universitario La Fe.
Avda. Campanar, 21. 46009 Valencia. España.
Correo electrónico: portoles_man@gva.es
Recibido el 14 de febrero de 2007.
Aceptado para publicación el 15 de junio de 2007.