Palabras clave
INTRODUCCIÓN
La presencia de dehiscencias perivalvulares tras la cirugía de sustitución valvular es una complicación no infrecuente (un 2-17% según las series)1,2 que depende de la técnica de sutura, y es más frecuente cuando hay calcificación anular severa o tras endocarditis. La mayor parte de las veces, estas fugas periprotésicas son pequeñas y no tienen consecuencias clínicas, pero en algunas ocasiones producen hemolisis severa que requiere transfusiones repetidas o, si son demasiado grandes, insuficiencia cardiaca no controlable con tratamiento médico. El tratamiento quirúrgico en algunos de estos pacientes conlleva una gran morbimortalidad, que aumenta con el número de procedimientos quirúrgicos previos3-5. El cierre por vía percutánea puede ser una alternativa para la mejoría sintomática de estos pacientes.
MÉTODOS
Se incluyó a 8 pacientes (el 75% varones; media de edad, 63,7 ± 23,7 años) desde noviembre de 2002 hasta febrero de 2007. Sus características basales se describen en la tabla 1. Todos ellos fueron valorados conjuntamente con el servicio de cirugía cardiaca y se desestimó nueva intervención por alto riesgo quirúrgico. La indicación del procedimiento fue insuficiencia cardiaca no controlable médicamente y/o anemia hemolítica que requiriera transfusiones repetidas.
El procedimiento se realizó con anestesia general utilizando el ecocardiograma transesofágico (ETE) como técnica de imagen adicional a la radioscopia. Previamente al procedimiento, se realizó ETE a todos los pacientes para localizar la fuga y determinar el grado de la insuficiencia periprotésica.
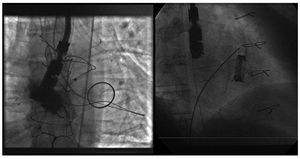
Se realizó punción transeptal en todos los pacientes intentando pasar la fuga por vía anterógrada. Se utilizaron catéteres multipropósito, Judkins de derecha y de mamaria izquierda atravesando la fuga con una guía hidrófila de Terumo® (Terumo Medical Corp., Somerset, New Jersey, Estados Unidos), siendo posible esta vía en 5 pacientes. En 2 pacientes, por imposibilidad del sondaje anterógrado, se logró pasar de forma retrógrada desde el ventrículo izquierdo pasando la guía hidrófila a la aurícula izquierda donde se atrapaba con un catéter lazo estableciendo un circuito arteriovenoso (fig. 1A). En 1 paciente no se logró sondar la fuga.
Fig. 1. A: abordaje retrógrado de la fuga; imagen de radioscopia en la que se observa cómo el catéter lazo atrapa la guía en la aurícula izquierda para formar el circuito arteriovenoso. B: implantación de un tercer dispositivo Amplatzer ductal en un paciente con varias fugas periprotésicas.
En todos los casos en que se sondó la fuga, se pasó una vaina de forma anterógrada y se colocó el dispositivo Amplatzer ductal arterioso (AGA Medical, Minnesota, Estados Unidos) (fig. 1B). Los tamaños variaron desde el 4/6 mm hasta 14/16 mm. La elección se realizó a criterio del operador en función del tamaño de la fuga en su base por ETE. En 4 casos se utilizó un único dispositivo y en 1 paciente se pusieron tres en el mismo procedimiento (tabla 1). Se realizó una valoración de la insuficiencia mitral inmediatamente tras la implantación del dispositivo mediante ETE (leve, moderada o grave según área por Doppler color y espectral de onda continua). Se realizó seguimiento clínico y ecocardiográfico de todos los pacientes.
RESULTADOS
En todos los casos se practicó un único procedimiento, que fue exitoso en 5 pacientes. En 3 casos no fue posible implantarlo, en 2 de ellos por interferencia con los discos protésicos. De éstos, en 1 se bajó hasta el tamaño mínimo y persistió la interferencia y en el otro, con una dehiscencia muy amplia, se intentó con el dispositivo inmediatamente inferior, pero seguía bloqueando la prótesis y no parecía estable, por lo que se desestimó un nuevo intento. El tercer fracaso era 1 paciente con hemolisis grave, una fuga pequeña y una doble prótesis metálica mitral y aórtica. No fue posible el sondaje de la dehiscencia mitral a pesar de tolerar de forma adecuada el paso retrógrado al ventrículo izquierdo a través de una prótesis metálica aórtica.
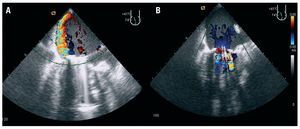
De los 5 pacientes en que se implantaron correctamente los dispositivos, se constató disminución de la insuficiencia mitral por ETE de forma inmediata en 4 de ellos (fig. 2), que se mantuvo en los controles de ecocardiograma transtorácico (ETT) durante el seguimiento. En 1 paciente en el que no se observaron cambios significativos inmediatos se comprobó mejoría de la insuficiencia mitral mediante ETT seriados en el seguimiento, pasando de severa a moderada, con mejoría clínica acompañante.
Fig. 2. A: ecografía transesofágica que muestra insuficiencia mitral periprotésica lateral en situación basal. B: desaparición de la insuficiencia mitral tras la implantación de un dispositivo Amplatzer ductal.
En los 2 pacientes (6 y 7) con anemia en los que se implantó correctamente mejoró la concentración de lactatodeshidrogenasa, sin modificación significativa de las cifras de hemoglobina. Ambos presentaban insuficiencia renal crónica y uno de ellos hemorragias digestivas recurrentes secundarias a diverticulosis colónica, que precisaron transfusiones sanguíneas.
De los 5 pacientes con éxito inicial, 1 falleció a los 22 días del procedimiento. Era un paciente en situación de fallo multiorgánico que, a pesar de mejorar significativamente la insuficiencia mitral (de severa a leve), falleció por cuadro séptico de origen respiratorio. El paciente 7 falleció a los 3 años por complicaciones digestivas, aunque se había constatado mejoría de la insuficiencia mitral durante el seguimiento. Tres pacientes están vivos tras un seguimiento medio de 15 ± 5 meses, con mejoría de la clase funcional de disnea en todos ellos y disminución del grado de insuficiencia mitral (tabla 2).
De los 3 pacientes a los que no se logró implantar el dispositivo, 1 falleció a las pocas horas por un ictus masivo a pesar de una anticoagulación adecuada durante el procedimiento (paciente 1). Se reevaluó al segundo paciente y finalmente se optó por asumir el riesgo de una nueva reintervención quirúrgica (paciente 5). En el seguimiento a los 36 meses está en clase funcional II de disnea. El último, con indicación exclusiva por anemia hemolítica, mejoró progresivamente con la administración de eritropoyetina (paciente 8).
DISCUSIÓN
Aunque la cirugía sigue siendo la técnica de elección para la reparación de las dehiscencias periprotésicas, la mortalidad aumenta con el número de intervenciones previas2, y es del 13, el 15 y el 37% después de la primera, la segunda y la tercera intervención, respectivamente, por lo que las clasificaciones de riesgo quirúrgico actuales tienden a subestimar el riesgo en estos pacientes3.
El cierre percutáneo de dehiscencias periprotésicas fue descrito por primera vez en 1992 por Hourihan et al6, que cerró con éxito dos fugas periaórticas usando dispositivos de doble paraguas de Rashkind. Después se han descrito casos aislados de cierres de fugas mitrales con coils7-9 y Cardioseal Clamshell® (Nitinol Medical Technologies, Boston, Massachusetts, Estados Unidos) y las series más recientes con dispositivos Amplatzer9-14.
Los resultados de estas series muestran que la implantación del dispositivo es factible en un alto porcentaje de pacientes y, aunque raramente cierra por completo el defecto, produce una disminución significativa del grado de insuficiencia mitral y mejoría de los síntomas. Esto probablemente se deba a que, al menos en los defectos grandes, el cierre completo es poco factible por su forma de media luna. Serían convenientes, pues, diseños específicos para este tipo de defectos para aumentar el porcentaje de cierre completo de las fugas. Entre los dispositivos disponibles actualmente, el Amplatzer ductal quizá sea el más adecuado por su forma15,16, con un disco distal suficiente para soportar la presión del ventrículo izquierdo y con menos probabilidades de interferir con la prótesis valvular.
Hein et al15 observaron en su serie un empeoramiento de la hemolisis en el 45% de sus pacientes, probablemente en relación con el cierre incompleto de la fuga. En nuestra serie, en los 2 pacientes en que la indicación fue por insuficiencia cardiaca y hemolisis, se observó disminución en el grado de ésta. Con los datos actuales11,13,14, consideramos que habría que ser cautos cuando la indicación es exclusivamente hemolisis.
Aunque se trata de una serie con pocos pacientes para sacar conclusiones sobre su efectividad, el cierre percutáneo es técnicamente posible y puede mejorar el grado de insuficiencia mitral y los síntomas en los pacientes considerados de alto riesgo quirúrgico.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. R. García-Borbolla Fernández. Brunete, 6, 1o. 11007 Cádiz. España.
Correo electrónico: rafaelgborbolla@hotmail.com
Recibido el 6 de febrero de 2008.
Aceptado para su publicación el 27 de mayo de 2008.