Paciente diabética de 83 años ingresada en nuestro centro por infarto agudo de miocardio posteroinferior en evolución. Al cuarto día de estancia presentó un soplo pansistólico en mesocardio y ápex de nueva aparición. El ecocardiograma transtorácico puso de manifiesto acinesia de la pared posterior e inferior con imagen indicativa de disección de la pared posterior del ventrículo izquierdo, que se originaba en el segmento medio-distal de la misma, con orificio de entrada de 7 mm de diámetro.Se apreciaba flujo turbulento en el interior de la aurícula derecha, indicativo de proceder del seno coronario. Con el ecocardiograma transesofágico se confirmó la disección intramiocárdica de la pared posterior del ventrículo izquierdo y su comunicación con el seno coronario, identificando el flujo turbulento de la aurícula derecha como procedente del mismo. Tras optar por el tratamiento médico, la paciente ha sido seguida por espacio de dos años. El diámetro del orificio de entrada del trayecto disecante permaneció sin cambios, si bien se observó crecimiento del diámetro de la zona disecada y del seno coronario, aunque no dilatación significativa de las cavidades derechas.
Palabras clave
Disección intramiocárdica
Shunt izquierda-derecha
Seno coronario
Infarto agudo de miocardio
INTRODUCCIÓN
Las disecciones intramiocárdicas y las comunicaciones entre el ventrículo izquierdo (VI) y la aurícula derecha (AD) son complicaciones mecánicas infrecuentes que aparecen en el postinfarto temprano tras necrosis inferiores o posteroinferiores. Hasta el momento se habían descrito disecciones de tracto irregular que comprometían el septo interventricular (SIV) y acababan comunicando ambos ventrículos a través del mismo septo, o incluso alcanzando el ápex del ventrículo derecho (VD). Por otro lado, las comunicaciones entre el VI y la AD se habían descrito en infartos que afectaban la porción más basal de la cara inferior y el septo, con rotura secundaria de este último directamente en la AD.
Éste es el primer caso del que tenemos constancia de una disección intramiocárdica postinfarto de la pared posterior del VI que acaba comunicando éste y la AD a través del seno coronario.
CASO CLÍNICO
Paciente de 83 años que acudió a nuestro centro por sensación de inestabilidad. El día anterior había tenido un episodio similar acompañado de disnea que se siguió de síncope. No refirió angina en ningún momento. Entre sus antecedentes personales cabe destacar diabetes no insulinodependiente como único dato de valor. La analítica de urgencias proporcionó los siguientes datos: creatinfosfocinasa (CPK) de 1.018 con MB del 18%, y en el electrocardiograma (ECG) se apreció un infarto agudo de miocardio (IAM) inferoposterior evolucionado. La paciente fue ingresada en la unidad de cuidados intensivos. No se realizó fibrinólisis ya que no presentaba criterios clínicos ni electrocardiográficos, y permaneció asintomática durante su estancia en la unidad coronaria.
El pico máximo de CPK fue de 1.144 con MB del 17% a las 10 h del ingreso. El segundo día se le realizó un ecocardiograma transtorácico (ETT), en el que aparecía hipocinesia severa posteroinferior con función sistólica del VI conservada.
Al cuarto día fue trasladada al servicio de geriatría. En el momento del ingreso en éste la paciente presentaba como único cambio en la exploración física un soplo pansistólico III/IV audible en mesocardio y ápex. Por este motivo se solicitó un nuevo ETT. En él aparecía un VI de dimensiones normales, con fracción de eyección del 40% y acinesia posteroinferior.
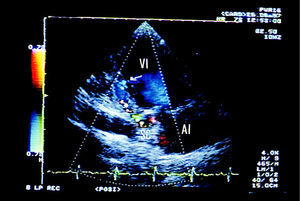
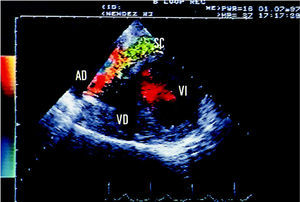
En el espesor de la cara posterior, y comunicando con el VI en la porción mediodistal de la misma a través de un orificio de 7 mm de diámetro, se observaba una cavidad alargada de 8 X 30 mm con flujo predominantemente sistólico, rodeada de pared muscular, indicativa de disección miocárdica de la pared posterior del VI (fig. 1). Por otro lado, existía un flujo turbulento en el interior de la AD que parecía provenir del seno coronario (SC). La AD, al igual que el VD, no se encontraba dilatada. Se realizó a continuación un ecocardiograma transesofágico (ETE), que confirmó la presencia de la disección de la pared posterior del VI, y se identificó claramente el flujo turbulento en la AD como proveniente del SC dilatado, con el que conectaba el trayecto disecante (fig. 2).
Fig. 1. Imágenes del ecocardiograma transtorácico en proyección apical de dos cámaras, en modo 2D y Doppler color. En 2D se aprecia una cavidad en el miocardio ventricular (*), que se comunica con el ventrículo izquierdo (VI) a traves de un orificio de entrada (flecha). Con Doppler color se observa que existe flujo desde el VI hacia el interior de esta cavidad, y que dicho flujo alcanza el seno coronario (SC), donde se hace mas turbulento. AI: aurícula izquierda.
Fig. 2. Imagen de ecocardiograma transesofágico en proyección de cuatro cámaras. Se aprecia el seno coronario (SC) dilatado, con flujo turbulento en su interior desembocando en la aurícula derecha (AD). VE: ventrículo derecho. VI: ventrículo izquierdo.
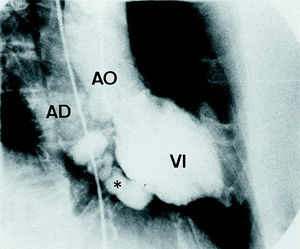
Pocos días después se realizó una coronariografía en la que aparecían lesiones severas en descendente anterior y coronaria derecha media (70 y 100%, respectivamente). En la ventriculografía se apreciaba salida de contraste desde la pared posterolateral del VI hacia un trayecto anfractuoso que luego drenaba en la AD. No se cuantificó el shunt (fig. 3) .
Fig. 3. Imagen de la ventriculografía en proyección oblicua derecha a 45¡. Se observa cómo el tracto disecante (*) surge del segmento medio de la pared inferior del ventrículo izquierdo (VI), y cómo a través del mismo se rellena la aurícula derecha (AD).
Dado el elevado riesgo quirúrgico de la paciente, se optó por el tratamiento médico con aspirina, nitratos y vasodilatadores -inhibidores de la enzima conversora de la angiotensina (IECA)-. En las revisiones posteriores la paciente se ha mantenido asintomática. En los ecocardiogramas seriados se ha observado crecimiento del diámetro del tracto disecante, que ha pasado de 8 a 11 mm, disminuyendo al mismo tiempo la turbulencia del flujo tanto en su interior como dentro de la AD. El diámetro del orificio de entrada ha permanecido constante (7 mm). Las cavidades derechas no se han dilatado significativamente.
El VI sí ha aumentado sensiblemente de tamaño, con empeoramiento de la función sistólica, que en la revisión a los seis meses era del 30%, hecho que hemos atribuido al remodelado ventricular.
COMENTARIO
Las disecciones intramiocárdicas son un hallazgo excepcional tras la necrosis miocárdica. Normalmente se han descrito tras IAM inferiores o inferoposteriores que han dado origen a tractos serpinginosos que, partiendo del VI, se extendían a lo largo del SIV y que, o bien no progresaban hacia otra cavidad evolucionando hacia la trombosis 1, o bien acababan comunicando con el VD tanto a través del mismo septo 2, como alcanzando el ápex del VD 3,4.
Por otro lado, también han sido esporádicas las notificaciones de comunicaciones entre el VI y la AD. Éstas se suelen producir en infartos que afectan la porción más basal del septo y la cara inferior del VI, en la zona más proximal del SIV, dado el ligero desplazamiento de la válvula tricúspide respecto a la mitral, que pone en contacto esta pequeña porción del SIV con la AD 5-7. El caso que exponemos es el primero del que tenemos constancia en el que se reúnen en una misma paciente las características de ambas complicaciones a las que hemos hecho referencia anteriormente, ya que se trata de una disección miocárdica que se origina en la porción distal de la cara posterior del VI, desde donde progresa, siguiendo un trayecto longilíneo, hacia el surco auriculoventricular, desembocando allí en el seno coronario y, a través de éste, en la AD. También, como en las otras dos complicaciones descritas, se ha producido en una mujer de edad avanzada, que sufría su primer IAM transmural y en la primera semana de evolución de éste. Así mismo, la ecocardiografía, tanto ETT como ETE, ha sido fundamental para el diagnóstico de todos estos procesos al proporcionar una visión directa de la disección y de su comunicación con el SC, y por último, de la dilatación del mismo en su trayecto final hasta la AD 2,3,6. La coronariografía puso de manifiesto las lesiones coronarias de la paciente, la entrada de contraste en la disección, la visión de ésta y la salida del mismo en la AD sin evidenciar la comunicación entre la disección y el SC. La cateterización permite calcular la cuantía del shunt, si bien en este caso no se realizó 7. La resonancia magnética nuclear, por su parte, permite la visualización de la trombosis dentro del trayecto disecante 1.
En general, el pronóstico de las comunicaciones entre el VI y la AD, y de las disecciones intramiocárdicas, siempre se ha considerado como poco alentador, a pesar de la intervención quirúrgica, si bien mejora parcialmente cuando ésta es temprana 4,7. Éste no ha sido el caso de nuestra paciente, que permanecía asintomática a los dos años de evolución. Probablemente el trayecto largo y serpinginoso de la disección ha disminuido la cuantía del shunt y, de esta manera, la repercusión sobre las cavidades cardíacas, mejorando así el pronóstico. Otros autores han confirmado este punto 2.
En conclusión, la disección intramiocárdica que alcanzando el SC crea una comunicación entre VI y AD es una complicación mecánica excepcional en el post-infarto, cuyo diagnóstico debe efectuarse por ecocardiografía. En casos con trayecto disecante largo y anfractuoso y shunt de escasa cuantía el tratamiento farmacológico puede ser la alternativa a la cirugía cuando el riesgo quirúrgico es elevado.
Las disecciones intramiocárdicas y las comunicaciones entre el ventrículo izquierdo (VI) y la aurícula derecha (AD) son complicaciones mecánicas infrecuentes que aparecen en el postinfarto temprano tras necrosis inferiores o posteroinferiores. Hasta el momento se habían descrito disecciones de tracto irregular que comprometían el septo interventricular (SIV) y acababan comunicando ambos ventrículos a través del mismo septo, o incluso alcanzando el ápex del ventrículo derecho (VD). Por otro lado, las comunicaciones entre el VI y la AD se habían descrito en infartos que afectaban la porción más basal de la cara inferior y el septo, con rotura secundaria de este último directamente en la AD.
Éste es el primer caso del que tenemos constancia de una disección intramiocárdica postinfarto de la pared posterior del VI que acaba comunicando éste y la AD a través del seno coronario.
CASO CLÍNICO
Paciente de 83 años que acudió a nuestro centro por sensación de inestabilidad. El día anterior había tenido un episodio similar acompañado de disnea que se siguió de síncope. No refirió angina en ningún momento. Entre sus antecedentes personales cabe destacar diabetes no insulinodependiente como único dato de valor. La analítica de urgencias proporcionó los siguientes datos: creatinfosfocinasa (CPK) de 1.018 con MB del 18%, y en el electrocardiograma (ECG) se apreció un infarto agudo de miocardio (IAM) inferoposterior evolucionado. La paciente fue ingresada en la unidad de cuidados intensivos. No se realizó fibrinólisis ya que no presentaba criterios clínicos ni electrocardiográficos, y permaneció asintomática durante su estancia en la unidad coronaria.
El pico máximo de CPK fue de 1.144 con MB del 17% a las 10 h del ingreso. El segundo día se le realizó un ecocardiograma transtorácico (ETT), en el que aparecía hipocinesia severa posteroinferior con función sistólica del VI conservada.
Al cuarto día fue trasladada al servicio de geriatría. En el momento del ingreso en éste la paciente presentaba como único cambio en la exploración física un soplo pansistólico III/IV audible en mesocardio y ápex. Por este motivo se solicitó un nuevo ETT. En él aparecía un VI de dimensiones normales, con fracción de eyección del 40% y acinesia posteroinferior.
En el espesor de la cara posterior, y comunicando con el VI en la porción mediodistal de la misma a través de un orificio de 7 mm de diámetro, se observaba una cavidad alargada de 8 X 30 mm con flujo predominantemente sistólico, rodeada de pared muscular, indicativa de disección miocárdica de la pared posterior del VI (fig. 1). Por otro lado, existía un flujo turbulento en el interior de la AD que parecía provenir del seno coronario (SC). La AD, al igual que el VD, no se encontraba dilatada. Se realizó a continuación un ecocardiograma transesofágico (ETE), que confirmó la presencia de la disección de la pared posterior del VI, y se identificó claramente el flujo turbulento en la AD como proveniente del SC dilatado, con el que conectaba el trayecto disecante (fig. 2).
Fig. 1. Imágenes del ecocardiograma transtorácico en proyección apical de dos cámaras, en modo 2D y Doppler color. En 2D se aprecia una cavidad en el miocardio ventricular (*), que se comunica con el ventrículo izquierdo (VI) a traves de un orificio de entrada (flecha). Con Doppler color se observa que existe flujo desde el VI hacia el interior de esta cavidad, y que dicho flujo alcanza el seno coronario (SC), donde se hace mas turbulento. AI: aurícula izquierda.
Fig. 2. Imagen de ecocardiograma transesofágico en proyección de cuatro cámaras. Se aprecia el seno coronario (SC) dilatado, con flujo turbulento en su interior desembocando en la aurícula derecha (AD). VE: ventrículo derecho. VI: ventrículo izquierdo.
Pocos días después se realizó una coronariografía en la que aparecían lesiones severas en descendente anterior y coronaria derecha media (70 y 100%, respectivamente). En la ventriculografía se apreciaba salida de contraste desde la pared posterolateral del VI hacia un trayecto anfractuoso que luego drenaba en la AD. No se cuantificó el shunt (fig. 3) .
Fig. 3. Imagen de la ventriculografía en proyección oblicua derecha a 45¡. Se observa cómo el tracto disecante (*) surge del segmento medio de la pared inferior del ventrículo izquierdo (VI), y cómo a través del mismo se rellena la aurícula derecha (AD).
Dado el elevado riesgo quirúrgico de la paciente, se optó por el tratamiento médico con aspirina, nitratos y vasodilatadores -inhibidores de la enzima conversora de la angiotensina (IECA)-. En las revisiones posteriores la paciente se ha mantenido asintomática. En los ecocardiogramas seriados se ha observado crecimiento del diámetro del tracto disecante, que ha pasado de 8 a 11 mm, disminuyendo al mismo tiempo la turbulencia del flujo tanto en su interior como dentro de la AD. El diámetro del orificio de entrada ha permanecido constante (7 mm). Las cavidades derechas no se han dilatado significativamente.
El VI sí ha aumentado sensiblemente de tamaño, con empeoramiento de la función sistólica, que en la revisión a los seis meses era del 30%, hecho que hemos atribuido al remodelado ventricular.
COMENTARIO
Las disecciones intramiocárdicas son un hallazgo excepcional tras la necrosis miocárdica. Normalmente se han descrito tras IAM inferiores o inferoposteriores que han dado origen a tractos serpinginosos que, partiendo del VI, se extendían a lo largo del SIV y que, o bien no progresaban hacia otra cavidad evolucionando hacia la trombosis 1, o bien acababan comunicando con el VD tanto a través del mismo septo 2, como alcanzando el ápex del VD 3,4.
Por otro lado, también han sido esporádicas las notificaciones de comunicaciones entre el VI y la AD. Éstas se suelen producir en infartos que afectan la porción más basal del septo y la cara inferior del VI, en la zona más proximal del SIV, dado el ligero desplazamiento de la válvula tricúspide respecto a la mitral, que pone en contacto esta pequeña porción del SIV con la AD 5-7. El caso que exponemos es el primero del que tenemos constancia en el que se reúnen en una misma paciente las características de ambas complicaciones a las que hemos hecho referencia anteriormente, ya que se trata de una disección miocárdica que se origina en la porción distal de la cara posterior del VI, desde donde progresa, siguiendo un trayecto longilíneo, hacia el surco auriculoventricular, desembocando allí en el seno coronario y, a través de éste, en la AD. También, como en las otras dos complicaciones descritas, se ha producido en una mujer de edad avanzada, que sufría su primer IAM transmural y en la primera semana de evolución de éste. Así mismo, la ecocardiografía, tanto ETT como ETE, ha sido fundamental para el diagnóstico de todos estos procesos al proporcionar una visión directa de la disección y de su comunicación con el SC, y por último, de la dilatación del mismo en su trayecto final hasta la AD 2,3,6. La coronariografía puso de manifiesto las lesiones coronarias de la paciente, la entrada de contraste en la disección, la visión de ésta y la salida del mismo en la AD sin evidenciar la comunicación entre la disección y el SC. La cateterización permite calcular la cuantía del shunt, si bien en este caso no se realizó 7. La resonancia magnética nuclear, por su parte, permite la visualización de la trombosis dentro del trayecto disecante 1.
En general, el pronóstico de las comunicaciones entre el VI y la AD, y de las disecciones intramiocárdicas, siempre se ha considerado como poco alentador, a pesar de la intervención quirúrgica, si bien mejora parcialmente cuando ésta es temprana 4,7. Éste no ha sido el caso de nuestra paciente, que permanecía asintomática a los dos años de evolución. Probablemente el trayecto largo y serpinginoso de la disección ha disminuido la cuantía del shunt y, de esta manera, la repercusión sobre las cavidades cardíacas, mejorando así el pronóstico. Otros autores han confirmado este punto 2.
En conclusión, la disección intramiocárdica que alcanzando el SC crea una comunicación entre VI y AD es una complicación mecánica excepcional en el post-infarto, cuyo diagnóstico debe efectuarse por ecocardiografía. En casos con trayecto disecante largo y anfractuoso y shunt de escasa cuantía el tratamiento farmacológico puede ser la alternativa a la cirugía cuando el riesgo quirúrgico es elevado.
Bibliografía
[1]
Dissappearing false aneurysm of the ventricular septum without rupture: a complication of acute inferior myocardial infarction -a case report. Angiology 1988; 263-271.
[2]
Verna E, Repetto S, Saveri C..
Myocardial dissection following successful chemical ablation of ventricular tachycardia..
Europ Heart J, (1992), 13 pp. 844-846
[3]
Amico A, Iliceto S, Rizzo D..
Color Doppler findings in ventricular septal dissection following myocardial infarction..
Am Heart J, (1989), 117 pp. 195-198
[4]
Tighe D, Paul J, Maniet AR..
Survival in infarct related intramyocardial dissection..
Echocardiography, (1997), 14 pp. 403-408
[5]
Newman J, Rozanski L, Kreulen T..
Adquired left ventricular to right atrial intracardiac shunt after myocardial infarction: a case report and review of the literature..
J Am Soc Echocard, (1996), 9 pp. 716-720
[6]
Doig JC, Au J, Dark JH..
Post-infarction comunication between a left ventricular aneurysm and the right atrium..
European Heart J, (1992), 13 pp. 1006-1007
[7]
Jovic Y, Verdum F, Guillo P..
Postinfarction atrioventricular septal rupture..
J Am Soc Echocard, (1997), 10 pp. 680-684
[8]
Hodsden J, Nanda N..
Dissecting aneurysm of the ventricular septum following acute myocardial infarction: diagnosis by real time two-dimensional echocardiography..
Am Heart J, (1981), 101 pp. 761-762