El implante percutáneo de válvula aórtica (TAVI) es actualmente la principal opción terapéutica para los pacientes con estenosis aórtica grave considerados inoperables o de alto riesgo quirúrgico. La extensión de las indicaciones del TAVI a una población con un perfil de riesgo inferior puede verse limitada por las tasas relativamente altas de eventos cerebrovasculares asociados a la intervención. Estudios realizados con resonancia magnética cerebral con ponderación de difusión demuestran una alta incidencia de infartos cerebrales subclínicos de probable origen embólico tras el TAVI. Algunos estudios han relacionado estas lesiones con un deterioro cognitivo posterior. Los dispositivos de protección embólica nacen como una protección mecánica para impedir la embolización de partículas de material diverso hacia el cerebro durante la intervención. Se presenta una revisión de la evidencia y las incertidumbres existentes respecto a los tres dispositivos actuales (Embrella, TriGuard y Claret) diseñados específicamente para TAVI. Los estudios realizados tienen carácter exploratorio y evalúan el daño neurológico en tres aspectos: clínico, subclínico y cognitivo. El implante de los tres dispositivos parece viable y seguro. Por lo que respecta a la eficacia, ninguno ha mostrado una reducción significativa de las tasas de eventos clínicos. Sin embargo, los dispositivos Embrella y Claret han mostrado reducciones significativas del volumen total de lesión cerebral en las imágenes de resonancia magnética con ponderación de difusión. Los estudios que han evaluado los efectos en la capacidad cognitiva han mostrado resultados poco concluyentes. En conclusión, a pesar de que los dispositivos de protección embólica muestran reducciones del volumen total de lesión cerebral en la resonancia magnética con ponderación de difusión, la eficacia clínica en prevención del ictus/deterioro cognitivo deberá confirmarse en estudios más amplios.
Palabras clave
En la última década, los tratamientos percutáneos han revolucionado el tratamiento de los pacientes con valvulopatías1. Actualmente, el implante percutáneo de válvula aórtica (TAVI) es la principal opción terapéutica para los pacientes con estenosis aórtica grave considerados inoperables o de alto riesgo para la cirugía cardiaca convencional2–4. El porcentaje de tratamiento de la estenosis aórtica por vía percutánea ha aumentado exponencialmente en los últimos años5–7. Por otro lado, cada vez es mayor la evidencia de la efectividad del TAVI en pacientes considerados de riesgo quirúrgico intermedio o incluso de bajo riesgo8–10. Sin embargo, una ampliación de las indicaciones del TAVI a pacientes de menor riesgo se ve limitada por una incidencia de eventos neurológicos relativamente alta. A pesar de las mejoras significativas alcanzadas últimamente en los dispositivos, los eventos cerebrovasculares (ECV) clínicos siguen siendo una de las complicaciones más temidas tras el TAVI. El ictus es una fuente importante de morbilidad y mortalidad y multiplica por más de 3,5 el riesgo de muerte a los 30 días y el consumo de los recursos sanitarios disponibles11,12.
La importancia de los eventos neurológicos durante el periprocedimiento del TAVI queda patente en los ensayos publicados previamente. El ensayo PARTNER puso de manifiesto la mayor incidencia de ictus/accidentes isquémicos transitorios (AIT) a 30 días en el grupo de TAVI que en los grupos de tratamiento médico (el 6,7 frente al 1,7%; p = 0,03) y tratamiento quirúrgico (el 5,5 frente al 2,4%; p = 0,04)13,14. En el U.S. Pivotal CoreValve se registró una incidencia de ictus/AIT a 30 días del 4,9% con la prótesis autoexpandible CoreValve15. Eggebrecht et al.12 publicaron un metanálisis con más de 10.000 pacientes tratados con TAVI entre 2004 y 2011. La tasa general de ictus/AIT a 30 días fue del 3,3%, y la mayoría de los casos fueron ictus mayores (2,9%). Además, la ampliación de las indicaciones de TAVI a una población de riesgo quirúrgico intermedio no se ha acompañado de una reducción de las tasas de eventos neurológicos. En el ensayo PARTNER 2, recientemente publicado, se observó una tasa de ictus/AIT a 30 días del 6,4% con el empleo de una válvula expandible con balón de segunda generación SAPIEN XT10.
Momento de aparición de los eventos cerebrovasculares durante el TAVILos ECV aparecen en dos situaciones diferentes de los pacientes tratados con TAVI: a) durante la fase aguda, en relación con la intervención, y b) durante la fase crónica, con una tasa constante de nuevos episodios durante el seguimiento. Aunque la patogenia del ictus o el AIT en la fase aguda tras el TAVI probablemente sea multifactorial, es probable que la embolización sea el mecanismo dominante16–18, dada la distribución arterial y el patrón temporal de los infartos cerebrales periintervención. Nombela-Franco et al.17 observaron que un 50% de los ictus/AIT de la fase aguda aparecen en las primeras 24 h tras el TAVI, lo cual indica que la manipulación del catéter en el contexto de aortas con importante carga aterosclerótica y de válvulas aórticas intensamente calcificadas podría tener un papel relevante. El resto de los ictus de la fase aguda aparecen después de transcurridas las primeras 24 h tras la intervención, con un periodo de vulnerabilidad de hasta 2 meses. En este contexto, la tromboembolia originada directamente en el propio complejo de válvula nativa-válvula percutánea o como resultado de una fibrilación auricular crónica o de nueva aparición probablemente contribuya a la incidencia de ictus tras el TAVI. Otros mecanismos propuestos son las complicaciones vasculares y una carga aterosclerótica. Por otro lado, la incidencia de ictus durante la fase crónica tras el TAVI es similar a la de los pacientes en tratamiento médico o sometidos a cirugía convencional, lo cual apunta a que el riesgo de eventos neurológicos en este periodo se da más por el perfil de riesgo basal subyacente de los pacientes con estenosis aórtica que por factores asociados a la intervención18–22.
Estudios de DWIEl ictus clínicamente manifiesto es solo la punta del iceberg respecto a la embolización cerebral durante el TAVI. El espectro del daño cerebrovascular tras el TAVI incluye también los infartos cerebrales subclínicos detectados mediante resonancia magnética con ponderación de difusión (DWI), a los que se ha relacionado con un posible deterioro cognitivo a largo plazo23–31.
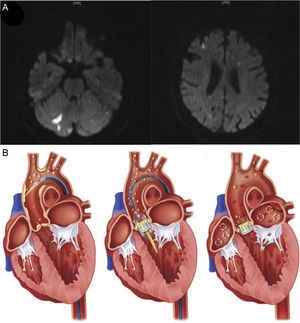
La DWI cerebral es una técnica que aporta una perspectiva in vivo, permite diferenciar el ictus agudo del crónico y de las lesiones inespecíficas de la sustancia blanca. Es sensible a los cambios de la movilidad de las moléculas de agua que pasan del compartimento extracelular al intracelular en las fases iniciales de la cascada isquémica que se produce en los tejidos. En consecuencia, la DWI aporta una información temporal, ya que las lesiones agudas presentan una hiperintensidad creciente durante los primeros días, pero se atenúan en las semanas posteriores (figura 1). Además, la DWI tiene alta sensibilidad en la identificación de las lesiones isquémicas pequeñas. Por otro lado, ciertos patrones de imagen, como infartos corticales o subcorticales múltiples que afectan a ambos hemisferios o las circulaciones cerebrales anterior y posterior, indican una embolización de origen cardiaco o aórtico. Sin embargo, es importante tener presente que estos patrones de imagen no son exclusivos de isquemia cerebral, puesto que otros mecanismos, como los procesos protrombóticos, inflamatorios o infecciosos, también pueden expresar un patron de imagen similar23.
A: imágenes de resonancia magnética cerebral con ponderación de difusión tras un procedimiento de TAVI realizado con éxito en un paciente de 82 años que muestran lesiones isquémicas agudas (imágenes hiperintensas) distribuidas en ambos hemisferios y dentro de territorios anteriores y posteriores, lo cual indica etiología embólica. B: origen de las fuentes de embolización después del TAVI. Los principales orígenes de émbolos asociados al TAVI son la rotura de la placa aórtica o de la válvula aórtica durante el paso del catéter y la guía, la formación de un trombo durante la intervención y la tromboembolia subaguda originada directamente en el propio complejo de válvula cardiaca nativa-válvula percutánea, la carga aterosclerótica o causada por una fibrilación auricular crónica o de nueva aparición. TAVI: implante percutáneo de válvula aórtica. Reproducido con permiso de Kahlert et al.27 y Fanning et al18.
Varios estudios han demostrado la presencia casi ubicua de lesiones cerebrales subclínicas o silentes detectadas mediante la DWI tras el TAVI, con un patrón cerebral que indica claramente un proceso embólico (tabla 1)24–30. De igual modo, las exploraciones de Doppler transcarotídeo han puesto de manifiesto la existencia de una alta incidencia de señales transitorias de alta intensidad (high-intensity transient signal [HITS]) durante el TAVI, sobre todo durante la colocación y el implante de la válvula, lo cual indica la importancia de la embolización durante estas etapas de la intervención31,32. Por estos motivos, algunos autores han señalado un probable origen común de estas lesiones cerebrales subclínicas observadas en la DWI de las generadas por los macroémbolos que causan ictus con manifestación clínica. Es importante señalar que la potencia del escáner utilizado (1,5 o 3 T) y el momento en que se realiza la DWI tras el TAVI pueden influir en la sensibilidad para la detección de infartos cerebrales silentes, puesto que estas lesiones tienden a desaparecer con el tiempo y estar totalmente ausentes a los 30 días de la intervención23,31–33. En consecuencia, en los estudios que evalúan los dispositivos de protección embólica (DPE), se ha propuesto el uso del volumen total de lesión (VTL) isquémico detectado por DWI cerebral como criterio indirecto de valoración del ictus clínico34,35. Sin embargo, a pesar de la plausibilidad biológica y de las razones de coste-eficacia en el diseño del estudio, este supuesto se debe confirmar en estudios más amplios antes de utilizarlo. De hecho, la guía actual de la American Heart Association no recomienda el uso de los infartos cerebrales silentes detectados en las exploraciones de imagen cerebrales como criterio indirecto de valoración de ictus, a menos que se realicen a todos los pacientes exploraciones de imagen estandarizadas en momentos específicos y siguiendo un protocolo establecido por el estudio36,37.
Resonancia magnética craneal con ponderación de difusión en el reemplazo percutáneo de la válvula aórtica
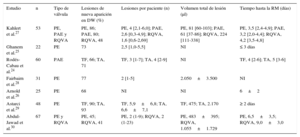
| Estudio | n | Tipo de válvula | Lesiones de nueva aparición en DW (%) | Lesiones por paciente (n) | Volumen total de lesión (μl) | Tiempo hasta la RM (días) |
|---|---|---|---|---|---|---|
| Kahlert et al.27 | 53 | PE, PAE y RQVA | PE, 86; PAE, 80; RQVA, 48 | PE, 4 [2,1-6,0]; PAE, 2,6 [0,3-4,9]; RQVA, 1,6 [0,6-2,69] | PE, 81 [60-103]; PAE, 61 [37-86]; RQVA, 224 [111-338] | PE, 3,5 [2,4-4,9]; PAE, 3,2 [2,0-4,4]; RQVA, 4,2 [3,5-4,8] |
| Ghanem et al.25 | 22 | PE | 73 | 2,5 [1,0-5,5] | NI | ≤ 3 días |
| Rodés-Cabau et al.24 | 60 | PAE | TF, 66; TA, 71 | TF, 3 [1-7]; TA, 4 [2-9] | NI | TF, 4 [2-6]; TA, 5 [3-6] |
| Fairbairn et al.28 | 31 | PE | 77 | 2 [1-5] | 2.050±3.500 | NI |
| Arnold et al.26 | 25 | PE | 68 | NI | NI | 6±2 |
| Astarci et al.29 | 48 | PE | TF, 90; TA, 93 | TF, 5,9±6,8; TA, 6,6±7,1 | TF, 475; TA, 2.170 | ≥ 2 días |
| Abdul-Jawad et al.30 | 67 | PE y RQVA | PE, 45; RQVA, 41 | PE, 2 (1-9); RQVA, 2 (1-23) | PE, 483±395; RQVA, 1.055±1.729 | PE, 6,5±3,5; RQVA, 9,0±3,0 |
DW: ponderación de difusión; NI: no se indica; PAE: prótesis autoexpandible; PE: prótesis expandible con balón; RM: resonancia magnética; RQVA: reemplazo quirúrgico de válvula aórtica; TA: transapical; TF: transfemoral.
Salvo otra indicación, los valores expresan media±desviación estándar, mediana [intervalo intercuartílico] o mediana (intervalo).
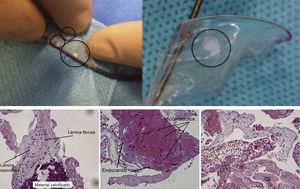
La embolia gaseosa, un estado proinflamatorio asociado a la intervención, el trombo o la embolización de material de la pared aórtica o la válvula aórtica durante ella son las principales etiologías propuestas de los defectos cerebrales silentes detectados en la DWI tras intervenciones cardiacas percutáneas. Keeley et al.38 detectaron la presencia de residuos embólicos en el 51% de los pacientes a los que se practicó un cateterismo en un estudio prospectivo con más de 1.000 pacientes. Van Mieghem et al.19,39 estudiaron las características histopatológicas de los residuos que se desplazaban hasta el cerebro y eran capturados por el filtro Claret en 81 pacientes a los que se practicó un TAVI. Se halló material trombótico en un 74% de los pacientes pero, sorprendentemente, se encontraron restos de tejidos procedentes de la pared aórtica, la válvula aórtica o el miocardio en un 63% de los pacientes (figura 2). Estas observaciones pueden explicarse por la fisiopatología todavía mal conocida de los ECV que se producen tras la manipulación de la válvula aórtica. La alteración de la íntima aórtica, la válvula nativa o el miocardio tras la manipulación por el catéter durante el TAVI pueden causar microtrombosis y las consiguientes complicaciones embólicas, con la posterior aparición de nuevas lesiones cerebrales silentes40.
Residuos que se desplazan hacia el cerebro capturados por el dispositivo de protección embólica Claret durante el reemplazo percutáneo de la válvula aórtica. Imágenes histológicas de residuos capturados procedentes de un fragmento de valva aórtica degenerada, músculo cardiaco o pared arterial. Co: tejido colagenoso; En: recubrimiento endotelial; Fi: fibrina. Reproducido con permiso de Van Mieghem et al19,39.
La relación entre los infartos cerebrales subclínicos y el deterioro cognitivo durante el periodo de seguimiento tras el TAVI continúa siendo incierta. En estudios recientes realizados en pacientes tratados con TAVI, no se ha podido encontrar asociación entre las lesiones cerebrales de nueva aparición y el deterioro cognitivo durante el seguimiento30,41. En cambio, en algunas series quirúrgicas de pacientes tratados con reemplazo de la válvula aórtica, se ha observado relación entre las lesiones cerebrales de nueva aparición en la DWI tras la intervención y el deterioro cognitivo detectado durante el seguimiento42. De igual modo, los infartos cerebrales silentes detectados con la DWI en los pacientes sanos se asocian a mayor riesgo de demencia43. Hay varios aspectos que es preciso resaltar para comprender mejor estas aparentes discrepancias. En primer lugar, actualmente no se dispone de ningún modelo validado que permita evaluar el estado neurocognitivo de los pacientes a los que se practica un TAVI. Las diferencias entre los estudios podrían explicarse en parte por el empleo de diferentes tipos de baterías de tests cognitivos o por la existencia de diferencias en las definiciones de deterioro cognitivo utilizadas. En segundo lugar, generalmente se documenta cierto grado de deterioro cognitivo basal en una parte importante de los pacientes a los que se practica un TAVI. En esta situación, el efecto suelo (es decir, la incapacidad de detectar cambios debidos a las puntuaciones basales bajas) debe tenerse en cuenta al interpretar los resultados de los tests neurocognitivos, sobre todo en los estudios con resultados negativos44. Por otro lado, parte de la leve mejoría observada en las puntuaciones de los tests de algunos estudios en los que se repiten las pruebas en varios momentos puede estar relacionada con un «efecto de aprendizaje» del test32. En tercer lugar, la evaluación cognitiva se ve influida por la alta prevalencia de la variabilidad interobservadores e intraobservador, por lo que el riesgo de sesgo es alto en ausencia de un grupo de control comparable37.
Para evitar estos motivos de preocupación expresados con anterioridad, algunos autores han propuesto el uso de tests normalizados realizados a individuos comparables con los del grupo de pacientes de interés en cuanto a las características demográficas, de salud y de lenguaje, así como la inclusión de controles comparables y específicos para el estudio, además de ajustes de fiabilidad de test-retest. Todo ello con el objetivo de mejorar la generalización y la comparabilidad de los resultados entre los estudios30,32,44–46. Es de destacar que ninguna de estas recomendaciones se ha aplicado todavía en los estudios publicados de los DPE.
ESTRATEGIAS DE PROTECCIÓN EMBÓLICALa mayoría de los ECV en pacientes tratados con TAVI tienen un origen embólico. Así pues, en teoría, los DPE deben reducir la cantidad de material embólico que se desplaza hacia el cerebro durante el procedimiento y minimizar, por lo tanto, el grado de lesión neurológica. Básicamente, las estrategias de protección embólica tienen dos objetivos principales: reducir la formación de tromboembolia o residuos (empleando medicaciones como los fármacos antitrombóticos o anticoagulantes o con la mejora del rendimiento del dispositivo o el perfeccionamiento de las técnicas utilizadas) y proteger el cerebro una vez se han formado los residuos o trombos (mecánicamente, empleando un DPE).
Por lo que respecta al primer objetivo, actualmente se están realizando varios ensayos clínicos aleatorizados para evaluar diferentes estrategias antitrombóticas en pacientes a los que se practica un TAVI, y ello aportará datos de gran valor en este campo: el ensayo Aspirin Versus Aspirin + ClopidogRel Following Transcatheter Aortic Valve Implantation (ensayo ARTE, NCT01559298), que compara dos estrategias diferentes de tratamiento antiagregante plaquetario (ácido acetilsalicílico solo frente a ácido acetilsalicílico más clopidogrel); el ensayo Antiplatelet Therapy for Patients Undergoing Transcatheter Aortic Valve Implantation (ensayo POPular-TAVI, NCT02247128), en el que se evalúan diferentes estrategias antiagregantes plaquetarias y antitrombóticas en pacientes con y sin indicación de anticoagulación oral, y el ensayo Anti-Thrombotic Strategy After Trans-Aortic Valve Implantation for Aortic Stenosis (ensayo ATLANTIS, NCT02664649), en el que se ha previsto evaluar la superioridad de una estrategia de anticoagulación con apixabán en comparación con la asistencia estándar actual en más de 1.500 pacientes, entre los que habrá pacientes con y sin indicación de tratamiento anticoagulante47.
Las barreras mecánicas (o DPE) se han diseñado para capturar o desviar los émbolos que se desplazan hacia el cerebro durante las intervenciones de TAVI (figura 3)48–50, con la finalidad de proteger los vasos supraaórticos de los residuos embólicos empleando filtros durante la intervención. Sin embargo, la implementación de los DPE presenta varias dificultades. En primer lugar, dispositivos similares diseñados para la cirugía cardiaca y carotídea han producido datos contradictorios por lo que respecta a la prevención de los ECV clínicamente manifiestos. A este respecto, un ensayo multicéntrico aleatorizado que se llevó a cabo en 1.289 pacientes tratados con cirugía cardiaca no pudo demostrar la eficacia del Embol-X-Filter para prevenir los ECV clínicos51. Además, un metanálisis en el que se incluyó a 357 pacientes a los que se implantaron stents en la arteria carótida no observó un efecto beneficioso de la protección cerebral con filtros en comparación con el uso de una técnica de oclusión con balón proximal para prevenir las lesiones cerebrales isquémicas de nueva aparición detectadas mediante la DWI52. En segundo lugar, las placas de aterosclerosis situadas en la proximidad del ostium de los vasos supraaórticos dificultan el implante y la colocación de los DPE, lo cual por sí solo puede fomentar la rotura de la placa y la consiguiente embolización cerebral. Este escenario no es inusual en los pacientes a los que se practica un TAVI, en los que una aterosclerosis aórtica difusa es la norma más que la excepción. Por último, la aplicación del TAVI a una población con un perfil de riesgo más bajo cuya carga aterosclerótica sea inferior puede asociarse a una reducción de la incidencia de eventos neurológicos durante el periodo periintervención, lo cual puede resultar en que el uso de estas estrategias sea poco útil en dicha población37.
Las experiencias iniciales en humanos han puesto de manifiesto la viabilidad y la seguridad del empleo de DPE durante el TAVI32,49,50. Actualmente se dispone de tres dispositivos comercializados con los que se están realizando estudios para la evaluación de su eficacia32,53,54. Sin embargo, estos estudios son exploratorios y ninguno tiene la potencia adecuada para evaluar adecuadamente la eficacia en prevención del ictus clínico (tabla 2 y tabla 3). En vez de ello, todos estos ensayos han utilizado los resultados de la DWI para evaluar diversos objetivos indirectos sustitutivos del daño cerebral. El pequeño tamaño muestral y las altas tasas de pérdida del seguimiento en todos los estudios resaltan las dificultades que conlleva la realización de estudios en ese contexto, puesto que requieren metodologías complejas, con evaluación de tres aspectos: clínico (prevención de ictus/AIT), subclínico (reducción de la frecuencia y el volumen de las lesiones isquémicas en la DWI) y cognitivo (prevención de la disfunción cognitiva en el seguimiento).
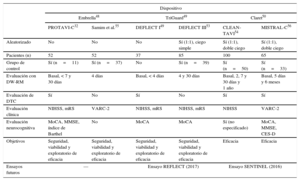
Características de los estudios más relevantes que han evaluado dispositivos de protección embólica
| Dispositivo | ||||||
|---|---|---|---|---|---|---|
| Embrella48 | TriGuard49 | Claret50 | ||||
| PROTAVI-C32 | Samim et al.55 | DEFLECT I49 | DEFLECT III53 | CLEAN-TAVI54 | MISTRAL-C56 | |
| Aleatorizado | No | No | No | Sí (1:1), ciego simple | Sí (1:1), doble ciego | Sí (1:1), doble ciego |
| Pacientes (n) | 52 | 52 | 37 | 85 | 100 | 65 |
| Grupo de control | Sí (n=11) | Sí (n=37) | No | Sí (n=39) | Sí (n=50) | Sí (n=33) |
| Evaluación con DW-RM | Basal, < 7 y 30 días | 4 días | Basal, < 4 días | 4 y 30 días | Basal, 2, 7 y 30 días y 1 año | Basal, 5 días y 6 meses |
| Evaluación de DTC | Sí | No | Sí | No | Sí | Sí |
| Evaluación clínica | NIHSS, mRS | VARC-2 | NIHSS, mRS | NIHSS, mRS | NIHSS | VARC-2 |
| Evaluación neurocognitiva | MoCA, MMSE, índice de Barthel | No | MoCA | MoCA | Sí (no especificado) | MoCA, MMSE, CES-D |
| Objetivos | Seguridad, viabilidad y exploratorio de eficacia | Seguridad, viabilidad y exploratorio de eficacia | Seguridad, viabilidad y exploratorio de eficacia | Seguridad, viabilidad y exploratorio de eficacia | Eficacia | Eficacia |
| Ensayos futuros | — | Ensayo REFLECT (2017) | Ensayo SENTINEL (2016) | |||
CES-D: Centre for Epidemiologic Studies Depression Scale; DPE: dispositivo de protección embólica; DTC: Doppler transcarotídeo; DW-RM: resonancia magnética con ponderación de difusión; MMSE: Mini-Mental State Examination; MoCA: Montreal Cognitive Assessment; mRS: puntuación de Rankin modificada; NIHSS: National Institutes of Health Stroke Scale; VARC-2: criterios del Valve Academy Research Consortium-2.
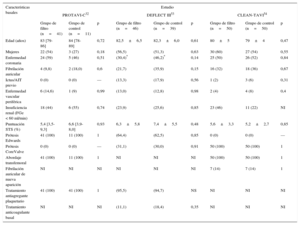
Resultados de los dispositivos y viabilidad de los dispositivos de protección embólica
| Resultados de los dispositivos | Embrella48 | TriGuard49 | Claret50 |
|---|---|---|---|
| Abordaje | Radial/humeral | Femoral | Radial |
| Posición | Aorta | Aorta | Tronco braquiocefálico y CCI |
| Mecanismo | Deflexión | Deflexión | Captura |
| Calibre del sistema de aplicación (Fr) | 6 | 9 | 6 |
| Tamaño del poro (μm) | 100 | 250a y 130b | 140 |
| Arterias cubiertas | Tronco braquiocefálico y CCI | Tronco braquiocefálico, CCI y SCI | Tronco braquiocefálico y CCI |
| Criterios de exclusión anatómicos | Estenosis significativa de SCD o tronco braquiocefálico | Cayado aórtico intensamente calcificado o anatomía aórtica desfavorable. Solamente TF-TAVI | CCI ≥ 5 mm y tronco braquiocefálico ≤ 9 mm, sin estenosis (≥ 70%) |
| Viabilidad de los DPE en los estudios | ProTAVI-C32 | Samim et al.55 | DEFLECT-I49 | DEFLECT-III53 | CLEAN-TAVI54 | MISTRAL-C5,6,c |
|---|---|---|---|---|---|---|
| Despliegue satisfactorio | 40/41 (97,6) | 15 (93,3) | 33/37 (89,2) | 40/45 (88,9) | 48/50 (96) | 30/32 (94) |
| Éxito del DPEd | 40/41 (97,6) | 14 (93,3) | 28/35 (80,0) | 40/45 (88,9) | 47/50 (94) | NI |
| Integridad del dispositivo al final de la intervención | 41/41 (100) | 15 (100) | 41/41 (100) | 45/45 (100) | NI | NI |
| Complicaciones vasculares relacionadas con el DPE | 2/41 (4,9) | 0 (0,0) | 3/37 (8,1) | NI | NI | NI |
| Uso de más de 1 dispositivo | 2/41 (4,9) | 0 (0,0) | 4/41 | 1/45 (2,2) | NI | NI |
| Tiempo hasta completar el despliegue (min) | 2 [1-3] | NI | 13,3±11,6 | NI | NI | NI |
| Aumento de tiempo de radiación (min) | NI | 4,2 | NI | 10 | 2,7±2,6 | NI |
| Aumento de contraste (ml) | NI | 15 | NI | 21 | –6,0±4,0 | 13 |
CCI: arteria carótida común izquierda; DPE: dispositivo de protección embólica; NI: no se indica; SCD: arteria subclavia derecha; SCI: arteria subclavia izquierda; TF-TAVI: implante percutáneo de válvula aórtica por vía transfemoral.
Salvo otra indicación, los valores expresan n/N (%), media±desviación estándar, mediana [intervalo intercuartílico] o mediana (intervalo).
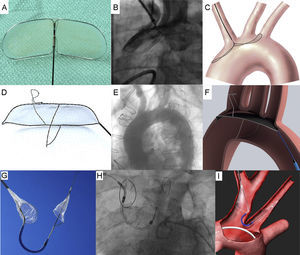
El dispositivo Embrella Embolic Deflector (DE) (Edwards Lifesciences; Irvine, California, Estados Unidos) es un sistema mecánico diseñado para desviar los residuos que se desplazan hacia el cerebro y tienen su origen en la válvula aórtica o la aorta ascendente durante el TAVI. El DE se despliega en el cayado aórtico y se ha diseñado para cubrir el ostium del tronco braquiocefálico y la arteria carótida común izquierda sin cubrir sistemáticamente el ostium de la arteria subclavia izquierda. El DE cuenta con dos membranas de poliuretano recubiertas de heparina, con un tamaño de poro de 100 μm, denominadas pétalos. Los pétalos están acoplados a una estructura de nitinol autoexpandible unida a un eje de nitinol de 110 cm de longitud. Los pétalos se orientan en direcciones opuestas para cubrir las arterias supraaórticas (el dispositivo se extiende a lo largo de un trayecto de 58 mm con una anchura de 25 mm). El sistema puede aplicarse a través de una vaina de aplicación de calibre 6 Fr introducida por las arterias radial derecha o humeral derecha. Tres marcadores radioopacos facilitan el despliegue con guía fluoroscópica (figura 3A, 3B, 3C y tabla 3)48.
En dos estudios se ha explorado la eficacia del DE: ProTAVI-C y el de Samim et al.32,55 (tabla 2). Ninguno de estos estudios fue aleatorizado. El ProTAVI-C es el primer estudio en que se exploró la eficacia de un DPE durante el TAVI, y hasta la fecha es el estudio más completo que se ha realizado para evaluar este dispositivo. Se incluyó en el estudio a 52 pacientes tratados con TAVI en seis hospitales. Se implantó el DE a 41 pacientes, mientras que los otros 11 constituyeron un grupo de control. Un laboratorio central independiente validó todos los eventos utilizando enmascaramiento de los datos clínicos. Los pacientes incluidos en este estudio tenían un riesgo preoperatorio intermedio, la mediana de edad era 83 (intervalo, 79-86) años y se excluyó a los pacientes con antecedentes de ictus/AIT (tabla 4). Se demostraron la viabilidad y la seguridad del DE (tabla 3). Los pacientes a los que se practicó un TAVI con el DE no presentaron complicaciones adicionales significativas. El DE se desplegó con éxito en la curvatura mayor aórtica de todos los pacientes. Se alcanzó éxito del implante del dispositivo en todos los pacientes excepto 1 (97,6%), y la mediana de tiempo adicional de intervención motivado por el despliegue del DE fue 2 [intervalo intercuartílico, 1-3] min. No hubo ningún caso de rotura de membrana del dispositivo y se produjeron 2 complicaciones relacionadas con la intervención de implante: 1 trombosis radial sin consecuencias y 1 seudoaneurisma de la arteria humeral que requirió reparación quirúrgica. Se realizaron exploraciones de imagen de Doppler transcarotídeo a todos los pacientes. Se detectaron HITS durante cada etapa de la intervención de TAVI. Los más significativos se produjeron al atravesar la válvula aórtica nativa y colocar la válvula percutánea. Tiene interés señalar que el grupo de DE mostró un número de HITS superior al de los controles (632 [347-893] en el grupo de DE frente a 279 [0-505] en el grupo de control; p < 0,001), lo que indica que la manipulación del DE también es un posible origen de residuos embólicos. En el aspecto clínico, se produjeron 2 ictus y 1 AIT, todos ellos en el grupo de DE (la tasa de ECV clínicos en el grupo de DE fue del 7,3%, todos ellos aparecidos después de la intervención). La incidencia de lesiones cerebrales isquémicas silentes detectadas mediante la DWI no se redujo con el empleo del DE. En la totalidad de los 40 pacientes con DWI basales y tras la intervención disponibles (34 del grupo de DE y 6 del grupo control), hubo defectos de nueva aparición en la DWI y la mayoría de estos pacientes presentaron múltiples defectos. Sin embargo, el uso de un sistema de DE fue un factor protector para reducir el VTL isquémico en comparación con los controles (tabla 5). Todos los tests neurocognitivos excepto uno mostraron ausencia de diferencias significativas entre los grupos de tratamiento y la batería MoCa (Montreal Cognitive Assessment) evidenció una mejoría leve en el grupo de DE (24 [21-27] puntos en el grupo de DE frente a 25 [23-28] puntos en el de control; p < 0,001). Las principales limitaciones del estudio fueron el bajo número de pacientes, especialmente en el grupo control, y la falta de aleatorización.
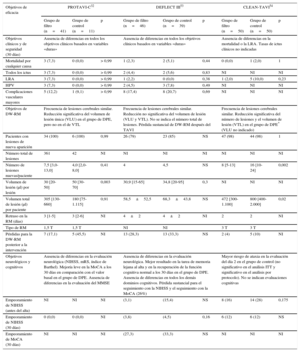
Características de las poblaciones de los estudios más relevantes que han evaluado dispositivos de protección embólica
| Características basales | Estudio | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| PROTAVI-C32 | DEFLECT III53 | CLEAN-TAVI54 | |||||||
| Grupo de filtro (n=41) | Grupo de control (n=11) | p | Grupo de filtro (n=46) | Grupo de control (n=39) | p | Grupo de filtro (n=50) | Grupo de control (n=50) | p | |
| Edad (años) | 83 [79-86] | 84 [78-89] | 0,72 | 82,5±6,5 | 82,3±6,0 | 0,61 | 80±5 | 79±4 | 0,47 |
| Mujeres | 22 (54) | 3 (27) | 0,18 | (56,5) | (51,3) | 0,63 | 30 (60) | 27 (54) | 0,55 |
| Enfermedad coronaria | 24 (59) | 5 (46) | 0,51 | (30,4)* | (46,2)* | 0,14 | 25 (50) | 26 (52) | 0,84 |
| Fibrilación auricular | 4 (9,8) | 2 (18,0) | 0,6 | (21,7) | (35,9) | 0,15 | 16 (32) | 18 (36) | 0,67 |
| Ictus/AIT previo | 0 (0) | 0 (0) | — | (13,3) | (17,9) | 0,56 | 1 (2) | 3 (6) | 0,31 |
| Enfermedad vascular periférica | 6 (14,6) | 1 (9) | 0,99 | (13,0) | (12,8) | 0,98 | 2 (4) | 4 (8) | 0,4 |
| Insuficiencia renal (FGe < 60 ml/min) | 18 (44) | 6 (55) | 0,74 | (23,9) | (25,6) | 0,85 | 23 (46) | 11 (22) | NI |
| Puntuación STS (%) | 5,4 [3,5-9,3] | 6,6 [3,9-8,0] | 0,93 | 6,3±5,8 | 7,4±5,5 | 0,48 | 5,6±3,3 | 5,2±2,7 | 0,85 |
| Prótesis Edwards | 41 (100) | 11 (100) | 1 | (64,4) | (62,5) | 0,85 | 0 (0) | 0 (0) | — |
| Prótesis CoreValve | 0 (0) | 0 (0) | — | (31,1) | (30,0) | 0,91 | 50 (100) | 50 (100) | 1 |
| Abordaje transfemoral | 41 (100) | 11 (100) | 1 | NI | NI | NI | 50 (100) | 50 (100) | 1 |
| Fibrilación auricular de nueva aparición | NI | NI | NI | NI | NI | NI | 7 (14) | 7 (14) | 1 |
| Tratamiento antiagregante plaquetario | 41 (100) | 41 (100) | 1 | (95,5) | (94,7) | NS | NI | NI | NI |
| Tratamiento anticoagulante basal | NI | NI | NI | (11,1) | (18,4) | 0,35 | NI | NI | NI |
AIT: accidente isquémico transitorio; FGe: filtrado glomerular estimado; NI: no se indica; STS: puntuación de riesgo de mortalidad predicho de la Society of Thoracic Surgeons.
Salvo otra indicación, los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Objetivos de eficacia de los estudios más relevantes que han evaluado dispositivos de protección embólica
| Objetivos de eficacia | PROTAVI-C32 | DEFLECT III53 | CLEAN-TAVI54 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Grupo de filtro (n=41) | Grupo de control (n=11) | p | Grupo de filtro (n=46) | Grupo de control (n=39) | p | Grupo de filtro (n=50) | Grupo de control (n=50) | p | |
| Objetivos clínicos y de seguridad (30 días) | Ausencia de diferencias en todos los objetivos clínicos basados en variables «duras» | Ausencia de diferencias en todos los objetivos clínicos basados en variables «duras» | Ausencia de diferencias en la mortalidad o la LRA. Tasas de ictus clínicos no indicadas | ||||||
| Mortalidad por cualquier causa | 3 (7,3) | 0 (0,0) | > 0,99 | 1 (2,3) | 2 (5,1) | 0,44 | 0 (0,0) | 1 (2,0) | 1 |
| Todos los ictus | 3 (7,3) | 0 (0,0) | > 0,99 | 2 (4,4) | 2 (5,6) | 0,83 | NI | NI | NI |
| LRA | 3 (7,3) | 0 (0,0) | > 0,99 | 1 (2,2) | 0 (0,0) | 0,38 | 1 (2,0) | 5 (10,0) | 0,23 |
| HPV | 3 (7,3) | 0 (0,0) | > 0,99 | 2 (4,5) | 3 (7,8) | 0,49 | NI | NI | NI |
| Complicaciones vasculares mayores | 5 (12,2) | 1 (9,1) | > 0,99 | 8 (17,4) | 8 (20,7) | 0,69 | NI | NI | NI |
| Objetivos de DW-RM | Frecuencia de lesiones cerebrales similar. Reducción significativa del volumen de lesión única (VLU) en el grupo de DPE, pero no en el de VTL | Frecuencia de lesiones cerebrales similar. Reducción no significativa del volumen de lesión (VLU y VTL). No se indica el número total de lesiones. Pérdida sustancial de DW-RM después del TAVI | Frecuencia de lesiones cerebrales similar. Reducción significativa del número de lesiones y el volumen de lesión (VTL) en el grupo de DPE* (VLU no indicado) | ||||||
| Pacientes con lesiones de nueva aparición | 34 (100) | 6 (100) | 0,99 | 26 (79) | 23 (85) | NS | 47 (98) | 44 (98) | 1 |
| Número total de lesiones | 361 | 42 | NI | NI | NI | NI | NI | NI | NI |
| Número de lesiones nuevas/paciente | 7,5 [3,0-13,0] | 4,0 [2,0-8,0] | 0,41 | 4 | 4,5 | NS | 8 [5-13] | 16 [10-24] | 0,002 |
| Volumen de lesión (μl) por lesión | 30 [20-50] | 50 [30-70] | 0,003 | 30,9 [15-65] | 34,8 [20-95] | 0,3 | NI | NI | NI |
| Volumen total de lesión (μl) por paciente | 305 [130-660] | 180 [75-1.115] | 0,91 | 58,5±52,5 | 68,3±43,8 | NS | 472 [300-1.100] | 800 [400-2.000] | 0,02 |
| Retraso en la RM (días) | 3 [1-5] | 3 [2-6] | NI | 4±2 | 4±2 | NI | 2 | 2 | NI |
| Tipo de RM | 1,5 T | 1,5 T | NI | NI | 3 T | 3 T | |||
| Pérdidas para la DW-RM posterior a la intervención | 7 (17,1) | 5 (45,5) | NI | 13 (28,3) | 13 (33,3) | NS | 2 (4) | 5 (10) | NI |
| Objetivos neurológicos y cognitivos | Ausencia de diferencias en la evaluación neurológica (NIHSS, mRS, índice de Barthel). Mejoría leve en la MoCA a los 30 días en comparación con el valor basal en el grupo de DPE. Ausencia de diferencias en la evaluación del MMSE | Ausencia de diferencias en la evaluación neurológica. Mejor resultado en la tarea de memoria lejana al alta y en la recuperación de la función cognitiva normal a los 30 días en el grupo de DPE. Ausencia de diferencias en todos los demás dominios cognitivos. Pérdida sustancial para el seguimiento con la NIHSS y el seguimiento con la MoCA (26%) | Mayor riesgo de ataxia en la evaluación del día 2 en el grupo de control (no significativo en el análisis ITT y significativo en el análisis por protocolo). No se indican evaluaciones cognitivas | ||||||
| Empeoramiento de NIHSS (antes del alta) | NI | NI | NI | (3,1) | (15,4) | NS | 8 (16) | 14 (28) | 0,175 |
| Empeoramiento de NIHSS (30 días) | 0 (0,0) | 0 (0,0) | NI | (3,8) | (4,5) | 0,16 | 6 (12) | 6 (12) | NS |
| Empeoramiento de MoCA (30 días) | NI | NI | NI | (27,3) | (33,3) | NS | NI | NI | NI |
DPE: dispositivo de protección embólica; DW-RM: resonancia magnética con ponderación de difusión; HPV: hemorragia con peligro para la vida; ITT: análisis por intención de tratar; LRA: lesión renal aguda; MMSE: Mini-Mental State Examination; MoCA: Montreal Cognitive Assessment; mRS: puntuación de Rankin modificada; NI: no se indica; NIHSS: National Institutes of Health Stroke Scale; NS: no significativo; RM: resonancia magnética; TAVI: implante percutáneo de válvula aórtica; VLU: volumen de lesión única; VTL: volumen total de lesión.
Se presentan los resultados del análisis por intención de tratar de los ensayos DEFLECT III y CLEAN-TAVI. Los intervalos intercuartílicos de los ensayos DEFLECT III y CLEAN-TAVI se obtuvieron mediante la estimación visual de los gráficos.
Salvo otra indicación, los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
El DPE TriGuard (TG) (Keystone Heart Ltd., Herzliya, Israel) es un sistema mecánico concebido para desviar los residuos que se desplazan hacia el cerebro y proceden de la válvula aórtica o la aorta ascendente durante el TAVI. El dispositivo TG es el único que se ha diseñado para cubrir las tres arterias principales originadas en el cayado aórtico (tronco braquiocefálico, arteria carótida común izquierda, arteria subclavia izquierda). El dispositivo tiene cinco partes funcionales: una estructura de nitinol con un doble marco, un filtro de malla recubierta de nitinol con poros de 250 μm (o 130 μm en el dispositivo de segunda generación), estabilizadores superior e inferior y el extremo en cola (distal al corazón) que va unido al émbolo durante la intervención. La malla recubierta tiene unas propiedades químicas y físicas que reducen la probabilidad de formación de un trombo. Los estabilizadores se anclan al ostium del tronco innominado y la curvatura interna del cayado aórtico respectivamente, con objeto de facilitar la colocación del filtro. El estabilizador superior requiere un diámetro mínimo de 8 × 11 mm en el tronco innominado a 15 mm del ostium. El estabilizador inferior requiere un cayado aórtico de 35 mm o menos para un anclaje adecuado. Las irregularidades de la anatomía del tronco innominado o un diámetro del ostium menor que el recomendado pueden hacer que la colocación y la estabilidad del dispositivo sean subóptimas. Debe tenerse especial cuidado con las aortas intensamente calcificadas, sobre todo en la proximidad del ostium del tronco innominado. El ángulo del estabilizador superior en el tronco innominado no debe desviarse más de 45° de la perpendicular al cayado. El sistema puede aplicarse a través de una vaina de aplicación de 9 Fr y 75 cm de longitud que se introduce por la arteria femoral (figura 3D, 3E, 3F y tabla 3)49.
El ensayo DEFLECT III es hasta la fecha el estudio de mayor interés en el que se ha evaluado el dispositivo TG. El DEFLECT III es un ensayo clínico aleatorizado y con diseño ciego53. Se incluyó en el estudio a 85 pacientes (39 controles) de 13 centros para evaluar la viabilidad, la seguridad y la eficacia del dispositivo TG en pacientes tratados con TAVI (tabla 2). En el ensayo se incluyó a pacientes considerados de riesgo quirúrgico intermedio (tabla 4). Se alcanzó el éxito técnico (definido como cobertura cerebral completa de los tres vasos) en el 88,9% (40 de 45) de los pacientes (tabla 3). El tiempo transcurrido hasta el despliegue completo fue de 13 min en el estudio DEFLECT I, pero no se evaluó en el ensayo DEFLECT III. Por lo que respecta a la eficacia clínica, no hubo diferencias entre los grupos en cuanto al objetivo principal de seguridad (que incluía muerte, ictus, hemorragia invalidante o con peligro para la vida, lesión renal aguda de estadio 2 o 3 y complicaciones vasculares mayores) (tabla 5). En el análisis por intención de tratar, el uso del dispositivo TG se asoció a ausencia no significativa de lesiones cerebrales de nueva aparición en la DWI (el 21,2 frente al 11,5%) y reducción no significativa del «deterioro neurológico de nueva aparición» (un objetivo de valoración post-hoc definido como empeoramiento en la puntuación de la National Institutes of Health Stroke Scale respecto al valor inicial con signos de isquemia en la DWI). Aunque los autores observaron una reducción del VTL cerebral en el grupo de TG, cuando se clasificó el VTL en los tamaños pequeño, medio y grande, el porcentaje de pacientes con un volumen isquémico grande fue similar en los dos grupos (el 46% en el grupo de TG frente al 48% de los controles). Aunque la evaluación cognitiva mediante el MoCA y la batería Cogstate Research no mostró diferencias significativas entre los grupos al alta ni en la evaluación a los 30 días, en el International Shopping List Test (una medida de la memoria episódica [recuerdo tardío]), se observaron diferencias significativas al evaluar a los pacientes al alta, con un resultado más favorable en el grupo de intervención (el 65,4 frente al 30,4%; p = 0,022). La principal limitación del DEFLECT III es las altas tasas de pérdidas en el seguimiento (un 31% de los pacientes en la DWI posterior a la intervención y un 26% de los pacientes en las evaluaciones cognitiva y neurológica posteriores a la intervención).
Dispositivo ClaretEl dispositivo de protección embólica Claret (DC) (Claret Medical, Inc.; Santa Rosa, Caliornia, Estados Unidos) es el único sistema mecánico diseñado para capturar y no para desviar los residuos que se desplazan hacia el cerebro. El DC se despliega en el ostium del tronco braquiocefálico y en el de la arteria carótida común izquierda. El sistema consta de dos filtros de poliuretano con poros de 140 μm fijados a una estructura radioopaca de nitinol flexible que está unida a un catéter de 100 cm de longitud. El filtro proximal se aplica al tronco braquiocefálico (lado derecho) y permite la aposición en vasos que tengan un diámetro de 9-15 mm. El sistema permite la aplicación del filtro distal (filtro del lado izquierdo) en la arteria carótida común izquierda. Todo el sistema se coloca a través de las arterias radial derecha o humeral derecha empleando una vaina de 6 Fr. El DC se despliega antes de introducir el sistema de aplicación del TAVI en el cayado aórtico y se retira tras la extracción del sistema de aplicación del TAVI (figura 3G, 3H, 3I y tabla 3)50.
Dos ensayos clínicos aleatorizados están explorando la eficacia del DC: el ensayo Claret Embolic Protection and TAVI (CLEAN-TAVI, NCT01833052) con el sistema Medtronic CoreValve y el MISTRAL-C (tabla 2) con el sistema Edwards-SAPIEN 3. Hasta la fecha, no se ha publicado ninguno de estos estudios. El ensayo CLEAN-TAVI es el de mayor interés. El objetivo principal es evaluar las repercusiones del uso del DC en el número de lesiones cerebrales de los pacientes tratados con TAVI. Se practicó a los pacientes una DWI los días 2 y 7 tras el TAVI, y después se realizaron evaluaciones neurológicas y cognitivas seriadas. Los resultados iniciales han sido alentadores (Linke et al., presentación oral, TCT 2014, datos no publicados). Se incluyó a 100 pacientes (50 con DC y 50 controles) entre abril de 2013 y junio de 2014 en el Hospital Universitario de Leipzig (Alemania). En el grupo de DC, los pacientes tenían mayoritariamente un riesgo preoperatorio intermedio (la puntuación media de la Society of Thoracic Surgeons fue del 5,6%), había un porcentaje de mujeres relativamente alto (60%) y la incidencia de fibrilación auricular previa era alta (32%) (tabla 4). Se alcanzó el despliegue/éxito del dispositivo en el 96% de los participantes (tabla 3). Las causas del despliegue inadecuado del dispositivo fueron la gran tortuosidad de los troncos supraaórticos (arteria carótida común izquierda en 1 caso y arteria subclavia en el otro). Además, hubo desplazamiento accidental de un filtro correctamente desplegado con la manipulación del catéter pigtail. Tiene interés señalar que la evaluación mediante la National Institutes of Health Stroke Scale reveló una incidencia sustancial de déficit neurológicos a los 2 días del TAVI, tanto en el grupo de control como en el del dispositivo (el 28 frente al 13%; p = 0,8), principalmente por una incidencia de ataxia excepcionalmente alta (el 24% de los controles frente al 9% del grupo de DC; riesgo relativo = 1,56 [1,08-2,21]; p < 0,05). Sin embargo, a los 7 y 30 días del TAVI, la incidencia de aparición de algún síntoma neurológico fue menor, sin que hubiera diferencias entre los grupos (día 7, el 10 frente al 13%; día 30, el 12 frente al 12%). Por lo que respecta a la reducción de las lesiones cerebrales subclínicas, el DC no redujo la incidencia de lesiones de nueva aparición en la DWI cerebral (el 98% de incidencia de lesiones de nueva aparición en la DWI a los 2 días del TAVI). Sin embargo, en el grupo del filtro hubo una reducción del 50% en el número de lesiones por paciente (filtros frente a control: día 2, una mediana de 8 frente a 16 lesiones; p = 0,023; día 7, 5 frente a 10 lesiones; p = 0,012). Además, también hubo una reducción del 41% del VTL en el grupo de DC (471 frente a 800 μl; p = 0,024) en la resonancia magnética (RM) realizada el día 2 y del 53% (220 frente a 472μl; p = 0,013) en la RM realizada en los 7 días tras el TAVI. Estos cambios se observaron en gran parte en territorios cerebrales protegidos por el filtro (día 2 después del TAVI, 246 frente a 527 μl; p = 0,002 en regiones anatómicas cerebrales protegidas por el DC) (tabla 5). Hasta la fecha, no se dispone de datos publicados de las evaluaciones neurocognitivas54.
El MISTRAL-C es un ensayo clínico multicéntrico, aleatorizado y a doble ciego en el que se incluyó a 63 pacientes con estenosis aórtica grave sintomática sometidos a TAVI, con aleatorización 1:1 respecto al uso de un DPE Claret Sentinel de segunda generación (tabla 2)56. El uso de este dispositivo se asoció a una tendencia a menor número de lesiones cerebrales en la RM realizada a los 5 días del TAVI, sobre todo en las regiones cerebrales correspondientes a áreas para las que el dispositivo ofrecía protección (Van Mieghem et al., presentación oral, TCT 2015, datos no publicados). Sin embargo, se debe interpretar con precaución estos resultados, dado que solamente se pudo realizar la RM al 57% de los pacientes aleatorizados.
PERSPECTIVAS FUTURASActualmente se están realizando varios ensayos clínicos aleatorizados en los que se evalúa la eficacia de los DPE durante el TAVI. El ensayo Cerebral Protection in Transcatheter Aortic Valve Replacement (SENTINEL, NCT02214277) está utilizando un DC de tercera generación y el TriGuard Embolic Deflection Device to Reduced Impact of Cerebral Embolic Lesions After Transcatheter Aortic Valve Implantation (REFLECT, NCT02536196) utiliza el dispositivo TG. Las estimaciones del tamaño muestral de estos estudios son sustancialmente mayores que las de los previos (n = 357 en el SENTINEL y n = 285 en el REFLECT). En ambos estudios el objetivo principal es la reducción del VTL isquémico cerebral evaluado mediante la DWI. Se prevé que se presenten los resultados a finales de 2016 en el caso del ensayo SENTINEL y durante 2017 en el REFLECT. Estos ensayos, realizados de manera estandarizada y validados por laboratorios centrales con amplia experiencia en neuroimagen, aportarán datos fundamentales sobre la eficacia de la protección mecánica de los DPE durante el TAVI.
En conclusión, los estudios iniciales de evaluación del papel de los DPE durante el TAVI muestran la viabilidad y la seguridad de los tres sistemas hoy disponibles. En general, aunque no se ha demostrado que los DPE reduzcan las tasas de lesiones isquémicas cerebrales silentes evaluadas mediante DWI, algunos subanálisis han documentado reducciones del volumen isquémico cerebral total. Las repercusiones clínicas de estas observaciones en la prevención de ictus/AIT y el potencial deterioro cognitivo durante el seguimiento deberán confirmarse en ensayos clínicos más amplios y con un diseño adecuado. La introducción del TAVI en poblaciones de menor riesgo no parece que conlleve reducciones relevantes de los ECV clínicos, mientras que la posible eficacia de distintos fármacos antitrombóticos en la prevención del ictus/AIT durante el TAVI está actualmente en fase de investigación. A la espera de que se disponga de esos datos, el papel actual de los DPE durante el TAVI continúa siendo incierto.
FINANCIACIÓNO. Abdul-Jawad Altisent cuenta con una beca de investigación doctoral de la Fundación Alfonso Martín Escudero (Madrid, España).
CONFLICTO DE INTERESESJ. Rodés-Cabau ha recibido subvenciones de investigación de Edwards Lifesciences.