Palabras clave
INTRODUCCIÓN
El endotelio vascular genera diferentes sustancias vasoactivas entre las que destaca el óxido nítrico (NO). Una de las principales funciones del NO es regular el tono vascular mediante la activación de la guanilato ciclasa soluble (GCs). La GCs aumenta las concentraciones intracelulares de GMP cíclico (GMPc) en las células de músculo liso vascular, induciendo así su relajación1,2. Una segunda función importante del GMPc generado en respuesta al NO es la inhibición de la activación de las plaquetas3. Los nitrovasodilatadores, como el nitroprusiato sódico (NPS), activan directamente la GCs liberando NO4.
La GCs se encuentra formando un heterodímero compuesto por dos subunidades denominadas *1 y ß15. En la actualidad, los mecanismos implicados en la regulación de la expresión y de la actividad de la GCs no son bien conocidos. La incubación de células de músculo liso vascular en cultivo con agentes que aumentan las concentraciones de AMPc reducen la expresión de la GCs en la pared vascular de ratas espontáneamente hipertensas6-8.
Diversos procesos patológicos de origen cardiovascular, como la hipertensión arterial, la hipercolesterolemia, la arteriosclerosis y la enfermedad coronaria, se encuentran asociados con la existencia de disfunción endotelial9,10. La disfunción endotelial se ha definido como una disminución en la respuesta vasodilatadora endotelio y NO dependientes. Se han estudiado los mecanismos implicados en la disfunción del endotelio y se ha sugerido que ésta se debe a una deficiente actividad de la enzima que genera el NO en el endotelio, la óxido nítrico sintasa endotelial, a la falta de cofactores necesarios para la actividad de esta enzima, a la reducción de su expresión o incluso a una menor biodisponibilidad de NO debido a la concomitante formación de radicales libres11-13. No obstante, el sistema de la GCs ha sido menos estudiado. En este sentido, se ha puesto de manifiesto en algunas situaciones de disfunción endotelial que no sólo ocurre un déficit en la respuesta que causa una vasodilatación endotelio-dependiente, sino también en la endotelio-independiente a dadores exógenos de NO6. El objetivo del presente estudio fue analizar, en un modelo animal de ratas espontáneamente hipertensas que desarrollan accidentes cerebrovasculares (SHRSP), el nivel de expresión de la GCs y su relación con la respuesta al NO. Además, ya que el sistema nervioso simpático se encuentra estimulado en situaciones de hipertensión14,15, se determinó el efecto de la administración de doxazosina sobre la expresión de la GCs. La doxazosina es un antagonista *1-adrenérgico que, además de reducir la presión arterial, ha demostrado modificar las concentraciones lipídicas y tener incluso propiedades antioxidantes16,17.
MATERIALES Y MÉTODOS
Animales de experimentación
El estudio ha sido realizado en ratas SHRSP macho (n = 24) de 20 semanas de edad (Iffa-Credo, Lábresle, Francia) y sus correspondientes controles normotensos Wistar Kyoto (WKY, n = 12). Un grupo de SHRSP (n = 12) fue tratado con el antagonista selectivo de los receptores *1-adrenérgicos doxazosina (Pfizer Pharmaceuticals, Nueva York.) en una dosis de 10 mg/kg/día administrado en el agua de bebida, durante 2 semanas.
Los animales fueron manipulados de acuerdo con los procedimientos aprobados por el Comité de Experimentación Animal de la Fundación Jiménez Díaz. La presión arterial media (PAM) se determinó en la cola de los animales utilizando un sistema computarizado LE 5007 Pressure Computer System (Power Lab, AD Instruments, Castherhill, New South Wales, Australia).
Preparación de los anillos vasculares
Los animales fueron anestesiados con pentobarbital sódico (20 mg/kg de peso). Las ratas fueron decapitadas y se obtuvo la aorta torácica desde el arco aórtico hasta el diafragma. Las aortas se transfirieron a una solución fría de Krebs (en mmol/l 118,4 NaCl, 4,7 KCl, 2,5 Ca Cl2, 1,2 MgSO4, 25 NaHCO3, 11 glucosa pH = 7,4). Las aortas se limpiaron de tejido conectivo y se cortaron transversalmente en 4 anillos (de aproximadamente 3 mm de longitud). Un segmento superior de cada aorta fue inmediatamente congelado en nitrógeno líquido para la posterior realización de las técnicas de biología molecular. Otro de los fragmentos se recogió en paraformaldehído al 4% para el posterior análisis inmunohistoquímico. Cada anillo fue suspendido en un baño de órganos que contenía 5 ml de solución de Krebs, mantenida a 37 ºC y burbujeando con una mezcla del 95% de O2 y del 5% de CO2. Los anillos fueron colocados entre dos soportes de acero inoxidable, uno de los cuales estaba conectado a un transductor de fuerza. Los anillos se equilibran durante 1 h, cambiando la solución de Krebs cada 15 min. La tensión basal se ajustó a 2 g. Los anillos fueron precontraídos con prostaglandina F2* (107mol/l) y posteriormente se analizó la respuesta endotelio-independiente añadiendo dosis crecientes (109 a 104 mol/l) del dador de NO, nitroprusiato sódico (NPS).
Expresión de la subunidad ß1 de la GCs
Se determinó la expresión de la subunidad ß1 de la GCs mediante la técnica de Western blot. La solubilización de las proteínas se realizó mediante la incubación de las muestras con tampón de lisis (0,25 mol/l de Cl2Mg; 10% glicerol; 5% Nonidet; 0,025 mol/l Hepes; 104 mol/l PMSF; 10 µg/ml leupeptina; 10 µg/ml pepstatina A) durante 1 h a 4 °C. Tras la centrifugación de los extractos a 13.000 rpm a 4 ºC durante 30 min se determinó la concentración de proteínas mediante el método de Bradford. Las proteínas se mezclaron en tampón de Laemmli18 que contenía 2-ß-mercaptoetanol.
Las proteínas (30 µg) fueron separadas mediante electroforesis en un gel de 12,5% de poliacrilamida y se transfirieron a membranas de nitrocelulosa. La membrana de nitrocelulosa se bloqueó mediante incubación a 4 ºC durante toda la noche con un 5% de albúmina en TBS-T (20 mmol/l Tris-ClH; 137 mmol/l ClNa; 0,1% Tween 20). El análisis por Western blot se hizo utilizando un anticuerpo policlonal frente a la subunidad ß1 de la GCs (Alexis Corporation). Para ello, las membranas se incubaron con el primer anticuerpo (1:750) durante 1 h a temperatura ambiente y tras sucesivos lavados con TBS-T se expusieron a un segundo anticuerpo (anti-IgG de conejo conjugado con peroxidasa) a una dilución de 1:2.500 durante 45 min a temperatura ambiente. La expresión de ß1-GCs se detectó por quimioluminiscencia (ECL, Amersham) y se evaluó la expresión de la proteína por densitometría.
Para la determinación del peso molecular se usaron estándares de peso molecular conocido. Para determinar la especificidad del anticuerpo se utilizó un lisado de plaquetas obtenido de ratas WKY.
Inmunolocalización de la subunidad ß1 en la pared arterial
Los fragmentos de aorta se fijaron en una solución de formaldehído al 4% durante un período de 16-24 h. Posteriormente se procedió a su deshidratación e inclusión en parafina en un procesador de tejidos automático TISSU-TEK® VIP (Bayer) como hemos descrito con anterioridad19. Se obtuvieron secciones histológicas de los bloques de parafina de 4 µm de grosor con un microtomo (Microm HM 325, Microm Gmbh, Walldorf, Alemania). Los cortes así obtenidos fueron desparafinados e hidratados de forma habitual. Se utilizaron portaobjetos cargados electrostáticamente (DAKO-Golstrup, Dinamarca).
La técnica de inmunohistoquímica se realizó de manera semiautomática en un aparato TECH-MATE 500 (DAKO-Golstrup, Dinamarca). Como anticuerpo primario se utilizó un anticuerpo policlonal de conejo frente a la subunidad ß1 de la GCs (Alexis Corporation), diluido 1:200 durante 1 h a temperatura ambiente. Posteriormente, las muestras fueron incubadas con el anticuerpo secundario unido a peroxidasa de rábano, ENVision TM (DAKO- Golstrup, Dinamarca). Como cromógeno se utilizó la diaminobenzidina (DAB) (DAKO-Golstrup, Dinamarca).
Determinación de la actividad de la GCs
Los segmentos aórticos obtenidos de los grupos en estudio fueron congelados de inmediato en nitrógeno líquido. Estos segmentos fueron pulverizados mecánicamente mediante un émbolo en frío y resuspendidos e una solución que contenía 200 mmol/l de ácido perclórico. Los homogenados obtenidos de esta manera se centrifugaron a 12.000 rpm durante 15 min a 4 °C, los sobrenadantes se recogieron y se lavaron cinco veces con cinco volúmenes de éter-dietílico. Posteriormente se eliminó el contenido de agua mediante la evaporación en atmósfera de N2.
El contenido en GMPc se determinó en muestras acetiladas utilizando un equipo comercial de Amersham Internacional como hemos descrito con anterioridad9. La sensibilidad del ensayo fue de 0,5 fmol. Las variaciones intraensayo fueron < 8,09% y < 16%, respectivamente.
Análisis estadístico
Los resultados cuantitativos se expresan como valor medio y error estándar de la media (X ± EEM). Para determinar la significación estadística de los valores obtenidos se realizó un análisis de la variancia de una entrada. Para todos los casos se consideró que existían diferencias significativas cuando la p fue menor de 0,05. Los análisis estadísticos se realizaron mediante la utilización del programa SPSS para Windows.
RESULTADOS
Efecto de la administración de doxazosina sobre la presión arterial media (PAM)
La PAM se encontró significativamente aumentada en el grupo de SHRSP. Respecto a las ratas WKY normotensas (WKY: 125 ± 4 mmHg y SHRSP: 220 ± 12 mmHg; p < 0,05), la administración de doxazosina (10 mg/kg/día) durante 15 días disminuyó de forma significativa la PAM en ratas SHRSP. No obstante, las ratas tratadas con doxazosina tenían una PAM significativamente mayor que las ratas normotensas WKY (SHRSP + doxazosina = 180 ± 6 mmHg; p < 0,05 con respecto a SHRSP y WKY).
Respuesta vasodilatadora al nitroprusiato sódico (NPS)
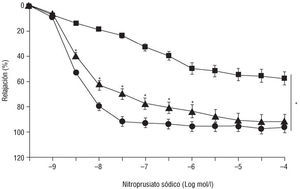
Como se observa en la figura 1, los anillos aislados de ratas SHRSP tenían disminuida la respuesta vasodilatadora al dador de NO, NPS. El EC50 para las ratas SHRSP fue de 5 * 106 mol/l, mientras que para los anillos obtenidos de ratas normotensas WKY fue de 5 * 109 mol/l (p < 0,05). Además, existió una diferencia significativa en la respuesta máxima al NPS entre ambos grupos de animales. El tratamiento con doxazosina mejoró de forma significativa la respuesta al NPS en las ratas SHRSP. La EC50 de los anillos aórticos de las ratas SHRSP tratadas con doxazosina fue de 5 * 108 mol/l. La respuesta al NPS de los anillos aislados de las ratas tratadas con doxazosina fue similar a la obtenida en las ratas WKY a partir de la concentración de NPS de 105 mol/l.
Fig. 1. Relajación a dosis crecientes del dador exógeno de óxido nítrico (NO), nitroprusiato sódico (NPS) en segmentos aórticos aislados de ratas normotensas (círculos), SHRSP (cuadrados), SHRSP tratados con doxazosina (10 mg/kg/día) durante 15 días (triángulos). Los resultados están expresados como media ± error estándar de la media de 12 ratas por grupo experimental. *p < 0,05 con respecto al grupo de ratas Wister normotensas; p < 0,05 con respecto a las ratas SHRSP.
El contenido en GMPc de los segmentos aórticos de las ratas SHRSP se encontró significativamente disminuido respecto al contenido en GMPc observado en la pared vascular del grupo de ratas WKY (WKY: 173 ± 22, SHRSP: 98 ± 12 fmol/mg proteína; p < 0,05). El tratamiento con doxazosina incrementó las concentraciones de GMPc, aunque continuaron reducidas respecto a las ratas WKY normotensas (144 ± 8 fmol/mg proteína, p < 0,05, con respecto a las ratas WKY).
Expresión de la GCs
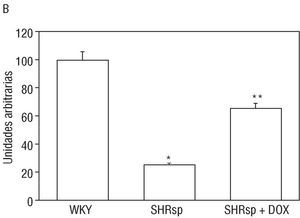
Las modificaciones en el nivel de expresión de la subunidad ß1 de la GCs se detectaron mediante Western blot. Como se aprecia en las figuras 2A y B, el nivel de expresión de la subunidad1 fue menor en las ratas SHRSP que en las ratas WKY. El tratamiento durante 15 días con doxazosina aumentó la expresión de la subunidad ß1 de la GCs en las ratas SHRSP (figs. 2A y B). No obstante, la expresión de la subunidad ß1 continuó siendo mayor en las ratas WKY que en las ratas SHRSP tratadas con doxazosina (figs. 2A y B).
Fig. 2. A: Westen blot representativo de la expresión de la subunidad ß1 de la guanilato ciclasa soluble en la pared vascular de ratas normotensas, SHRSP y SHRSP tratadas con doxazosina. Se expone la expresión de la subunidad ß1 en plaquetas de rata normotensa como control positivo. B: gráfico en el que se observa el análisis densiométrico de los Western blot. Los resultados se expresan como media ± error estándar de la media de 12 ratas por grupo experimental. *p < 0,05 con respecto al grupo de ratas normotensas.
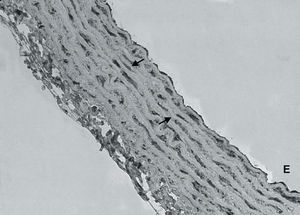
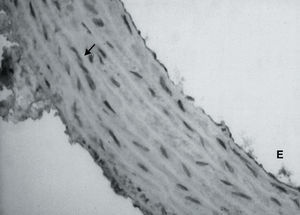
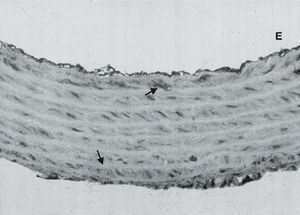
El examen histológico también reveló que en la pared vascular de las ratas SHRSP existía una menor expresión de la subunidad ß1 que en la pared vascular de las ratas WKY (figs. 3A y B). Además, se observó que la falta de expresión de la subunidad1 ocurría en la capa media, lo que indicaba que el defecto de expresión de la subunidad ß1 de la GCs ocurría fundamentalmente en las células del músculo liso vascular. La pared vascular de las ratas SHRSP tratadas con doxazosina tenía una expresión mayor de la subunidad ß1 de la GCs que las ratas SHRSP no tratadas, aunque ésta continuó siendo menor que en la pared vascular de las ratas WKY (fig. 3C).
Fig. 3. Análisis inmunohistoquímico de la expresión de la subunidad ß1 de la guanilato ciclasa soluble en la pared vascular de ratas Wistar normotensas (A) SHRSP (B) y SHRSP tratadas con doxazosina (C). Las flechas indican la guanilato ciclasa soluble (*350). E: endotelio.
DISCUSIÓN
Nuestros resultados demuestran que las ratas SHRSP tienen reducida la respuesta vasodilatadora independiente del endotelio al dador exógeno de NO nitroprusiato sódico. Al mismo tiempo, se encontró que la expresión de una de las subunidades del receptor del NO, la GCs, estaba disminuida en la pared vascular de estos animales. El tratamiento con un antagonista *1, la doxazosina, mejoró la respuesta vasodilatadora endotelio-independiente, lo que se asoció con un aumento de la expresión de la subunidad ß1 de la GCs.
La GCs se encuentra formando un heterodímero *1/ß1 y es necesaria la presencia de ambas subunidades para que la enzima sea funcional5,20. Tanto la subunidad *1 como la ß1 son activadas por el NO. Estímulos como la elevación de las concentraciones de AMP cíclico o la edad han demostrado reducir los niveles de expresión de la GCs6,7. También en el modelo de hipertensión de la rata espontáneamente hipertensa se ha sugerido la existencia de una reducción en la expresión de la GCs21. En este sentido, en nuestro estudio hemos observado cómo la expresión de la subunidad ß1 de la GCs se encuentra disminuida en la pared vascular de las ratas SHRSP. En los estudios de immunohistoquímica se observó que los cambios en la expresión de la subunidad ß1 de la GCs ocurren fundamentalmente en la capa media de la pared vascular y no de la íntima.
Diferentes estudios han demostrado la existencia de disfunción endotelial, tanto en modelos animales como en pacientes hipertensos10,22. La mayoría de estos estudios se han centrado en el análisis de la capacidad del endotelio para producir NO, y existen resultados contradictorios que demuestran tanto un aumento como una disminución de la capacidad de la pared vascular de generar NO durante el estado hipertensivo23,24. No obstante, nuestros resultados sugieren que, con independencia de la capacidad de la pared vascular de generar NO, el sistema de la GCs, la expresión de la enzima por la que el NO ejerce su efecto vasodilatador, se encuentra deprimido en las ratas SHRSP.
Estudios clínicos y experimentales han demostrado que la reducción en las cifras de presión arterial mejora la funcionalidad endotelial en situaciones de hipertensión. La inhibición de la síntesis o de la acción de la angiotensina II, así como el tratamiento con diuréticos o antagonistas del calcio, han demostrado mejorar la disfunción endotelial asociada a la hipertensión25-28. No obstante, a pesar de que el sistema simpático está estimulado en las situaciones de hipertensión14,15, el efecto del bloqueo de los receptores *1-adrenérgicos sobre la respuesta vasodilatadora dependiente del sistema NO/GMPc no ha sido estudiado.
Los resultados presentados en este trabajo demuestran que la pared vascular de las ratas tratadas con doxazosina tiene mejorada su capacidad de relajarse en respuesta a un dador exógeno de NO, el NPS. Este hecho se asoció con una mayor expresión de la subunidad ß1 de la GCs y con un mayor contenido en GMPc en la pared vascular. Es interesante señalar que la respuesta vasodilatadora endotelio-independiente no se normalizó por completo en las ratas tratadas con doxazosina, ya que con dosis bajas de NPS se encontró una mayor respuesta vasodilatadora en las ratas WKY que en las SHRSP tratadas con doxazosina. Esto puede asociarse con los hallazgos sobre la expresión de la subunidad ß1 de la GCs, ya que las ratas SHRSP tratadas con doxazosina presentan una mayor expresión de la subunidad ß1 de la CGSc que las ratas SHRSP no tratadas, aunque no alcanzó los niveles observados en las ratas WKY normotensas.
En relación con nuestros resultados, Baan et al han demostrado recientemente que la inhibición de los receptores *1 en sujetos sometidos a depleción de sodio, en los que el sistema simpático está activado, mejora la relajación endotelio-dependiente29. Nuestro estudio demuestra un mecanismo por el que la funcionalidad del sistema NO/GMPc puede estar preservado en los animales hipertensos tratados con doxazosina.
El diseño experimental de nuestro estudio no permite analizar si el efecto de la doxazosina sobre la expresión de la GCs se debe a una reducción de la PAM o al efecto directo del fármaco. En este sentido, se han demostrado efectos de la doxazosina independientes de su acción hemodinámica. Así, Raij et al30 han demostrado que la doxazosina mejora la respuesta vasodilatadora endotelio-dependiente en ratas normotensas deficientes en vitamina E. Kowala et al han observado que la doxazosina reduce la formación de estría grasa y reduce las concentraciones de colesterol ligado a lipoproteínas de baja densidad (cLDL) en un modelo de hámster hipercolesterolémico31. Otros estudios han sugerido efectos en el miocardio de la doxazosina independientes de su acción hemodinámica sobre fenómenos apoptósicos32.
En resumen, nuestros resultados demuestran que, independientemente de la capacidad que tenga el endotelio de generar NO, en las ratas SHRSP existe una disfunción de las células de músculo liso vascular de relajarse en respuesta al NO. Esta disfunción está asociada a una reducción en la expresión de la subunidad ß1 de la GCs en la pared vascular. Por tanto, la preservación de la expresión de la GCs podría ser también un foco de atención terapéutica para el tratamiento global del fenómeno de la disfunción endotelial.
AGRADECIMIENTO
Este estudio ha sido financiado con ayudas de los Laboratorios Pfizer, S.A. J.A. Rodríguez-Feo es becario de la Fundación Conchita Rábago de Jiménez Díaz. Los autores agradecen a Begoña Larrea su labor como secretaria.
Correspondencia: Dr. A. López-Farré. Laboratorio de Investigación Cardiovascular e Hipertensión. Fundación Jiménez Díaz. Avda. Reyes Católicos, 2. 28040 Madrid. Correo electrónico: alopeza@fjd.es Recibido el 4 de agosto del 2000. Aceptado para su publicación el 2 de febrero del 2001.