La activación tanto del sistema nervioso simpático como del sistema renina-angiotensina-aldosterona está estrechamente relacionada con la hipertensión arterial pulmonar. Nuestra hipótesis era que la simpatectomía renal reduce la actividad del sistema renina-angiotensina-aldosterona e inhibe la progresión de la hipertensión arterial pulmonar.
MétodosSe asignó aleatoriamente a un total de 22 perros beagle a tres grupos de estudio. Se efectuaron determinaciones de la dinámica pulmonar de esos animales antes y 8 semanas después de la inyección de 0,1 ml/kg de dimetilformamida (perros de control) o de 2 mg/kg de deshidromonocrotalina (perros con hipertensión arterial pulmonar y perros con hipertensión arterial pulmonar + simpatectomía renal). Ocho semanas después de la inyección, se determinaron las concentraciones de neurohormonas y se evaluó la morfología del tejido pulmonar.
ResultadosSe observó un aumento significativo de la concentración de angiotensina II y endotelina-1 en plasma después de 8 semanas en los perros con hipertensión arterial pulmonar, y los valores obtenidos en los tejidos pulmonares de estos animales eran superiores a los de los perros del grupo de control y el grupo de simpatectomía renal (medias: angiotensina II, 65±9,8 frente a 38±6,7 y 46±8,1; endotelina-1, 96±10,3 frente a 54±6,2 y 67±9,4; p < 0,01). La deshidromonocrotalina aumentó la presión arterial pulmonar media (16±3,4 frente a 33±7,3mmHg; p < 0,01), y la simpatectomía renal evitó que se produjera este aumento. La proliferación celular del músculo liso pulmonar fue mayor en los perros con hipertensión arterial pulmonar que en los animales de los grupos de control y de hipertensión arterial pulmonar + simpatectomía renal.
ConclusionesLa simpatectomía renal atenúa el remodelado vascular pulmonar y reduce la presión arterial pulmonar en la hipertensión arterial pulmonar experimental. El efecto de la simpatectomía renal puede contribuir a reducir las concentraciones de neurohormonas.
Palabras clave
La hipertensión arterial pulmonar (HAP) es una enfermedad mortal que se caracteriza por un remodelado vascular pulmonar excesivo que conduce a aumento de la presión en el sistema vascular pulmonar y del lado derecho del corazón1. Aunque se continúa sin conocer por completo la patogenia de la HAP, en estudios previos se ha involucrado al aumento de la actividad del sistema nervioso simpático y el sistema renina-angiotensina-aldosterona2,3. Se ha señalado que el aumento de la activación del sistema nervioso simpático podría contribuir a producir la hiperventilación alveolar observada en los pacientes con HAP4,5. Se ha observado que el aumento de las concentraciones plasmáticas de renina y angiotensina II (AII) tiene estrecha relación con la progresión y el pronóstico de la HAP6. Existen numerosos tratamientos que se han demostrado útiles para reducir la HAP, pero ninguno de ellos tiene efectos a largo plazo7,8.
En estudios previos se ha confirmado que puede alcanzarse una reducción significativa de la liberación de noradrenalina renal y de la presión tras una simpatectomía renal percutánea (SR)9,10. En el estudio previo se demostró que las concentraciones plasmáticas de AII se atenuaban tras una SR11,12. No se sabe si la SR influye en las demás neurohormonas y la progresión de la HAP. En consecuencia, en el presente estudio, se examinaron las repercusiones de la SR en el remodelado vascular pulmonar y las neurohormonas en la HAP experimental.
MÉTODOSPreparación del modelo animalEn el presente estudio se utilizaron 22 perros beagle de ambos sexos, con una media±desviación estándar de peso de 13,5±2,4kg. El estudio se atuvo a lo establecido en la versión actual de Guide for the care and use of laboratory animals (Guía para el cuidado y uso de animales de laboratorio), publicada por los National Institutes of Health (n.o 85-23, revisión de 1996). El protocolo del estudio fue aprobado por el Comité de Ética de la Universidad de Wuhan. El manejo de los animales se realizó según lo establecido por la Directiva de Investigación con Animales de Wuhan.
Se administró una inyección intramuscular de sulfato de quetamina (25mg/kg) antes de la medicación de pentobarbital sódico. Se administró a todos los perros pentobarbital sódico (30mg/kg por vía intravenosa), se les intubó y se les ventiló con aire ambiental con suplemento de oxígeno utilizando un respirador (MAO01746, Harvard Apparatus; Holliston, Montana, Estados Unidos). Se realizó una monitorización continua del electrocardiograma empleando las derivaciones I, II y III. El grupo 1 lo formaron 7 perros a los que se administró dimetilformamida (0,1 ml/kg). El grupo 2 lo formaron 8 perros a los que se administró deshidromonocrotalina (DHMC). El grupo 3 lo formaron 7 perros a los que se administró DHMC y se les practicó ablación arterial renal. El grupo 1 se consideró de control (con objeto de descartar el efecto de la dimetilformamida sobre la HAP, se utilizó la dimetilformamida como control), el grupo 2 fue el grupo de HAP, y el grupo 3 fue el grupo de HAP + SR.
La DHMC se sintetizó artificialmente según lo descrito por Mattocks et al13. La pureza de la DHMC se determinó mediante cromatografía líquida de alto rendimiento14. La DHMC se disolvió en dimetilformamida (0,1 ml/kg) inmediatamente antes de la inyección.
Protocolo del estudioDespués de obtener una anestesia estable, se inyectaron a todos los animales 1.000 U de heparina y se introdujeron vainas hemostáticas en la vena femoral derecha. Con guía de fluoroscopia, se introdujo por la vena un catéter pulmonar Swan-Ganz 6 Fr (Edwards Lifesciences; Irvine, California, Estados Unidos) lleno de una solución salina heparinizada. El catéter se conectó a un transductor de presión y a un sistema de monitorización Vigilance. El catéter arterial pulmonar se introdujo en las arterias pulmonares pequeñas a través de la aurícula y el ventrículo derechos. A continuación se retiró el catéter, y se realizaron determinaciones de la presión capilar pulmonar enclavada, la presión arterial pulmonar sistólica, la presión arterial pulmonar media, la presión sistólica ventricular derecha y la presión media ventricular derecha. Se determinó el gasto cardiaco con el método de termodilución continua utilizando el sistema de monitorización Vigilance. Se calculó la resistencia vascular pulmonar según la fórmula (resistencia vascular pulmonar = 80 × [presión arterial pulmonar media – presión capilar pulmonar enclavada] / gasto cardiaco). Después de las determinaciones hemodinámicas basales, a los animales de los grupos de HAP y de HAP + SR se les inyectó DHMC (2mg/kg), y a los animales de control, dimetilformamida (0,1ml/kg) mediante un catéter arterial pulmonar Swan-Ganz introducido en la aurícula derecha. En el grupo de HAP + SR, después de las determinaciones hemodinámicas basales, se llevó a cabo la intervención de SR igual que en un estudio previo15. A continuación se dejó que todos los animales se recuperaran durante 8 semanas. Después de 8 semanas, se repitieron todas las determinaciones hemodinámicas en los tres grupos.
EcocardiografíaSe realizó una ecocardiografía transtorácica bidimensional y Doppler en todos los animales (IE33, S5-1, PHILIPS; Países Bajos) en la situación basal y nuevamente al cabo de 8 semanas. Se obtuvieron proyecciones estándares bidimensionales paraesternales cortas y largas, así como proyecciones apicales tetracamerales, bicamerales y tricamerales. Se determinaron las dimensiones auricular izquierda, auricular derecha, diastólica ventricular izquierda y diastólica ventricular derecha mediante la fórmula biplanar de Simpson. Las determinaciones de todos los volúmenes se realizaron por triplicado, y se presentaron los valores medios. Se analizó el strain longitudinal telesistólico ventricular derecho mediante la técnica de speckle tracking (rastreo de marcas) bidimensional. Un experto en ecocardiografía independiente revisó las imágenes y los parámetros.
Análisis bioquímicosSe extrajeron 4ml de sangre venosa en tubos Vacutainer con EDTA (ácido etilendiaminotetraacético) y se centrifugaron a 2.310g durante 10min a 4°C (Beckman Coulter, Avanti J-E) en la situación basal y de nuevo al cabo de 8 semanas. Se separó el suero, se colocó en microtubos y se conservó a –80°C hasta el momento del análisis. Se determinaron las concentraciones de creatinina, AII, prostaglandina E2 y endotelina-1 (ET-1) mediante un ELISA. Se aisló el lóbulo inferior del pulmón izquierdo tras una toracotomía. Se determinaron las concentraciones de AII, prostaglandina E2 y ET-1 en el pulmón con un método descrito con anterioridad16. Se obtuvieron muestras de tejido de la base del ventrículo derecho de todos los animales al cabo de 8 semanas. Se determinaron las concentraciones de aldosterona y péptido natriurético tipo B mediante un ELISA.
Exámenes histológicosLos pulmones izquierdos extirpados se procesaron para el examen de microscopia óptica aplicando métodos convencionales. Se trocearon las muestras de tejido en fragmentos pequeños, se incluyeron en parafina, se realizaron cortes de 3μm de grosor y se tiñeron con hematoxilina y eosina. Los cortes se observaron, se analizaron y se fotografiaron con un microscopio óptico Nikon eclipseCi. Se identificaron las arterias pulmonares como vasos con dos láminas elásticas claramente definidas, con una capa de células de músculo liso entre las dos láminas. Se midió el grosor de la pared de las arterias de 15 arterias musculares a 400 aumentos.
Se determinó la expresión del receptor de AII tipo 1 (AT1) y los receptores de AII tipo 2 (AT2) en la arteria pulmonar mediante el método de Western blot. Se bloquearon las membranas con leche seca sin grasa al 5% en solución salina tamponada Tris con Tween durante 1h y se incubaron durante una noche a 4°C con los anticuerpos primarios (anticuerpos anti-AT1 y anti-AT2 monoclonales de conejo [Santa Cruz Biotechnology Inc.; Dallas, Texas, Estados unidos], utilizados a 1:500; anticuerpo antiactina de conejo [Santa Cruz Biotechnology Inc.], utilizado a 1:1.000). A continuación se lavaron en solución salina tamponada Tris con Tween tres veces, se incubaron con el segundo anticuerpo durante 1h a 37°C, y se realizó el revelado con sustrato de peroxidasa de rábano Inmun-Star. Se determinó la expresión relativa de proteína con un programa informático analizador de imagen (AlphaEase FC, Estados Unidos).
Se disecaron del corazón cortes del ventrículo y se conservaron rápidamente a –80°C. Se obtuvieron cortes ventriculares derechos del infundíbulo de salida ventricular derecho. Se utilizó la tinción de tricrómico de Masson para identificar el aumento de concentración de fibrosis intersticial. El tejido conjuntivo se diferenció por su color y se expresó como porcentaje del área de tejido de referencia (NIKON Ti-s, Japón). Se excluyeron de la cuantificación del tejido conjuntivo los vasos sanguíneos y las células intersticiales perivasculares. Se determinó la fracción de volumen de colágeno intersticial mediante morfometría cuantitativa con un analizador de imagen (IPP 6.0, Media Cybemetics; Georgia, Estados Unidos).
Análisis estadísticoLos valores se presentan en forma de media±desviación estándar. Los resultados de la ecocardiografía en los grupos de HAP y de HAP + SR se compararon para el periodo posterior al estudio mediante la prueba de la t para datos apareados, y se utilizaron pruebas de la t de Student para dos muestras independientes en la comparación de las medias de los dos grupos. Se utilizaron pruebas de análisis de la varianza en forma de pruebas de Neuman-Keuls para la comparación de las medias de las variables continuas en múltiples grupos, y toda diferencia significativa observada se analizó luego con la prueba de Tukey-Kramer. Todas las pruebas estadísticas fueron bilaterales, y se exigió un valor de probabilidad < 0,05 para establecer la significación estadística.
RESULTADOSCaracterísticas de los modelos animalesNo hubo diferencias significativas de la presión arterial, la frecuencia cardiaca o el peso corporal en la situación basal entre los tres grupos experimentales. En el grupo de HAP + SR, la presión arterial sistólica se redujo después de 8 semanas, pero esta disminución no alcanzó significación estadística. Los perros con HAP empezaron a presentar una respiración rápida y disminución del apetito a partir del décimo día tras la inyección. El color del pulmón fue más pálido en los perros con HAP y con HAP + SR que en los animales de control. Las características existentes en la situación basal y después de 8 semanas se presentan en la tabla 1.
Características de los modelos animales
| Presión arterial (mmHg) | FC (lpm) | Peso corporal (kg) | FR (rpm) | ||
|---|---|---|---|---|---|
| Sistólica | Diastólica | ||||
| Control | |||||
| Basal | 139±14 | 96±13 | 160±21 | 13,0±2,3 | 36,6±3,7 |
| Tras 8 semanas | 138±13 | 94±12 | 157±22 | 14,2±2,1 | 34,3±3,2 |
| HAP | |||||
| Basal | 140±15 | 93±11 | 157±23 | 13,2±2,5 | 35,2±3,9 |
| Tras 8 semanas | 141±13 | 96±14 | 164±25 | 14,9±2,4 | 46,7±4,4* |
| HAP + SR | |||||
| Basal | 137±12 | 95±14 | 155±24 | 13,1±2,2 | 34,1±3,3 |
| Tras 8 semanas | 125±11 | 83±6 | 149±19 | 14,5±2,3 | 38,4±3,9 |
FC: frecuencia cardiaca; FR: frecuenencia respiratoria; HAP: hipertensión arterial pulmonar; lpm: latidos por minuto; rpm: respiraciones por minuto; SR: simpatectomía renal.
Los datos expresan media±desviación estándar.
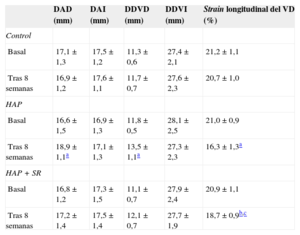
En cambio, el diámetro auricular derecho aumentó significativamente después de 8 semanas en los perros con HAP (p = 0,02). No se observaron diferencias significativas en el diámetro auricular derecho antes o después de 8 semanas en los grupos de control y de HAP + SR. Se observaron también aumentos significativos del diámetro diastólico ventricular derecho en los perros con HAP. El diámetro diastólico ventricular derecho presentó un aumento en el grupo de HAP + SR después de 8 semanas, pero este aumento no tuvo significación estadística (p = 0,09). Después de 8 semanas, el strain longitudinal de la pared lateral del ventrículo derecho se redujo en el grupo de HAP y en el grupo de HAP + SR. Sin embargo, el strain longitudinal fue superior en el grupo de HAP + SR que en el de HAP (tabla 2).
Cambios de los parámetros ecocardiográficos en la situación basal y a las 8 semanas en los 3 grupos
| DAD (mm) | DAI (mm) | DDVD (mm) | DDVI (mm) | Strain longitudinal del VD (%) | |
|---|---|---|---|---|---|
| Control | |||||
| Basal | 17,1±1,3 | 17,5±1,2 | 11,3±0,6 | 27,4±2,1 | 21,2±1,1 |
| Tras 8 semanas | 16,9±1,2 | 17,6±1,1 | 11,7±0,7 | 27,6±2,3 | 20,7±1,0 |
| HAP | |||||
| Basal | 16,6±1,5 | 16,9±1,3 | 11,8±0,5 | 28,1±2,5 | 21,0±0,9 |
| Tras 8 semanas | 18,9±1,1a | 17,1±1,3 | 13,5±1,1a | 27,3±2,3 | 16,3±1,3a |
| HAP + SR | |||||
| Basal | 16,8±1,2 | 17,3±1,5 | 11,1±0,7 | 27,9±2,4 | 20,9±1,1 |
| Tras 8 semanas | 17,2±1,4 | 17,5±1,4 | 12,1±0,7 | 27,7±1,9 | 18,7±0,9b,c |
DAD: diámetro auricular derecho; DAI: diámetro auricular izquierdo; DDVD: diámetro diastólico ventricular derecho; DDVI: diámetro diastólico ventricular izquierdo; HAP: hipertensión arterial pulmonar; SR: simpatectomía renal; VD: ventrículo derecho.
Los datos expresan media±desviación estándar.
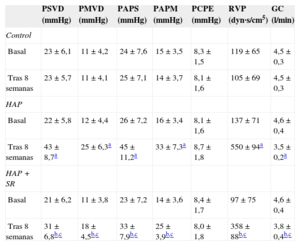
Los datos hemodinámicos en la situación basal y después de 8 semanas de los tres grupos se presentan en la tabla 3. No hubo diferencias significativas en los índices hemodinámicos pulmonares basales de los tres grupos. En comparación con el valor basal, la presión arterial pulmonar y la presión ventricular derecha fueron superiores después de 8 semanas en el grupo de HAP. No hubo diferencias significativas en los parámetros hemodinámicos en la situación basal y después 8 semanas en el grupo de control. La presión arterial pulmonar y la presión ventricular derecha aumentaron después de 8 semanas en el grupo de HAP + SR, pero estos parámetros hemodinámicos fueron inferiores en los perros del grupo de HAP + SR que en el grupo de HAP.
Cambios de los parámetros ecocardiográficos en la situación basal y a las 8 semanas en los tres grupos
| PSVD (mmHg) | PMVD (mmHg) | PAPS (mmHg) | PAPM (mmHg) | PCPE (mmHg) | RVP (dyn·s/cm5) | GC (l/min) | |
|---|---|---|---|---|---|---|---|
| Control | |||||||
| Basal | 23±6,1 | 11±4,2 | 24±7,6 | 15±3,5 | 8,3±1,5 | 119±65 | 4,5±0,3 |
| Tras 8 semanas | 23±5,7 | 11±4,1 | 25±7,1 | 14±3,7 | 8,1±1,6 | 105±69 | 4,5±0,3 |
| HAP | |||||||
| Basal | 22±5,8 | 12±4,4 | 26±7,2 | 16±3,4 | 8,1±1,6 | 137±71 | 4,6±0,4 |
| Tras 8 semanas | 43±8,7a | 25±6,3a | 45±11,2a | 33±7,3a | 8,7±1,8 | 550±94a | 3,5±0,2a |
| HAP + SR | |||||||
| Basal | 21±6,2 | 11±3,8 | 23±7,2 | 14±3,6 | 8,4±1,7 | 97±75 | 4,6±0,4 |
| Tras 8 semanas | 31±6,8b,c | 18±4,5b,c | 33±7,9b,c | 25±3,9b,c | 8,0±1,8 | 358±88b,c | 3,8±0,4b,c |
GC: gasto cardiaco; HAP: hipertensión arterial pulmonar; PAPM: presión arterial pulmonar media; PAPS: presión arterial pulmonar sistólica; PCPE: presión capilar pulmonar enclavada; PMVD: presión media ventricular derecha; PSVD: presión sistólica ventricular derecha; RVP: resistencia vascular pulmonar; SR: simpatectomía renal.
Los datos expresan media±desviación estándar.
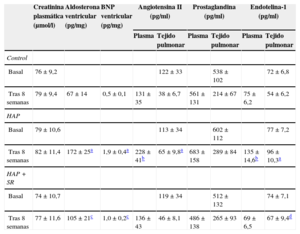
El grupo de HAP presentó un aumento estadísticamente significativo de las concentraciones de AII en plasma y en tejido pulmonar al final del protocolo (p < 0,01) en comparación con el valor basal (tabla 4). No hubo diferencias significativas en las concentraciones plasmáticas de AII entre la determinación basal y el final del estudio en los grupos de control y de HAP + SR. Entre la situación basal y el final del estudio, no se observaron diferencias significativas en las concentraciones de creatinina en plasma ni en las de prostaglandina E2 en tejido pulmonar de los tres grupos.
Cambios de las concentraciones de neurohormonas en sangre, tejido pulmonar y tejido ventricular en la situación basal y después de 8 semanas en los tres grupos
| Creatinina plasmática (μmol/l) | Aldosterona ventricular (pg/mg) | BNP ventricular (pg/mg) | Angiotensina II (pg/ml) | Prostaglandina (pg/ml) | Endotelina-1 (pg/ml) | ||||
|---|---|---|---|---|---|---|---|---|---|
| Plasma | Tejido pulmonar | Plasma | Tejido pulmonar | Plasma | Tejido pulmonar | ||||
| Control | |||||||||
| Basal | 76±9,2 | 122±33 | 538±102 | 72±6,8 | |||||
| Tras 8 semanas | 79±9,4 | 67±14 | 0,5±0,1 | 131±35 | 38±6,7 | 561±131 | 214±67 | 75±6,2 | 54±6,2 |
| HAP | |||||||||
| Basal | 79±10,6 | 113±34 | 602±112 | 77±7,2 | |||||
| Tras 8 semanas | 82±11,4 | 172±25a | 1,9±0,4a | 228±41b | 65±9,8a | 683±158 | 289±84 | 135±14,6b | 96±10,3a |
| HAP + SR | |||||||||
| Basal | 74±10,7 | 119±34 | 512±132 | 74±7,1 | |||||
| Tras 8 semanas | 77±11,6 | 105±21c | 1,0±0,2c | 136±43 | 46±8,1 | 486±138 | 265±93 | 69±6,5 | 67±9,4d |
BNP: péptido natriurético tipo B; HAP: hipertensión arterial pulmonar; SR: simpatectomía renal.
Los datos expresan media±desviación estándar.
No se dieron diferencias significativas en la situación basal entre los tres grupos en cuanto a las concentraciones de ET-1 en suero. Después de 8 semanas, las concentraciones de ET-1 en suero aumentaron (p < 0,01) en los perros con HAP, pero no se observaron diferencias estadísticamente significativas en los animales de control. En el grupo de HAP + SR, la concentración de ET-1 en suero se redujo después de 8 semanas, pero esta disminución no alcanzó significación estadística (p = 0,19). La concentración de ET-1 en el tejido pulmonar fue significativamente superior en el grupo de HAP que en el de control (p < 0,01). Además, la concentración de ET-1 en el tejido pulmonar fue superior en el grupo de HAP + SR que en el de control (p = 0,01).
Se estudió con mayor detalle las concentraciones de aldosterona y de péptido natriurético tipo B en el ventrículo derecho. Los resultados indicaron que las cifras de aldosterona y péptido natriurético tipo B en las muestras de tejido de la base del ventrículo derecho eran más altas en los dos grupos en que se había inducido HAP que en los animales de control. Tiene interés señalar que las concentraciones de aldosterona y de péptido natriurético tipo B en el ventrículo derecho del grupo de HAP fueron superiores a las observadas en el de HAP + SR. Esto confirma que el grupo de HAP + SR presentó un remodelado ventricular derecho menos intenso que el grupo de HAP (tabla 4).
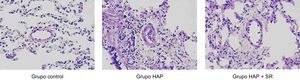
Estudios de morfología y de Western blotLa tinción de hematoxilina-eosina mostró en el grupo de HAP un engrosamiento significativo de la íntima y estenosis luminal en comparación con el grupo de HAP + SR. En la figura 1 se muestran cambios representativos observados en la estructura vascular de los tres grupos. La oclusión por neoíntima se evaluó mediante puntuación de oclusión vascular. Se calculó una puntuación de oclusión vascular media de los 30 vasos seleccionados para cada uno de los perros como índice de la oclusión vascular. Los resultados pusieron de manifiesto que se producían lesiones de neoíntima en el 64% de las arterias pulmonares pequeñas seleccionadas del grupo de HAP. La media de la puntuación de oclusión vascular fue de 1,17 en esas arterias. En cambio, los perros del grupo de HAP + SR desarrollaron lesiones de neoíntima en el 27% de las arterias pulmonares seleccionadas, y la media de la puntuación de oclusión vascular fue de 0,24. La diferencia entre el grupo de HAP y el grupo de HAP + SR fue significativa (1,17±0,13 frente a 0,24±0,10; p < 0,01). Las arterias pulmonares pequeñas del grupo de control mostraron una media de puntuación de oclusión vascular de 0.
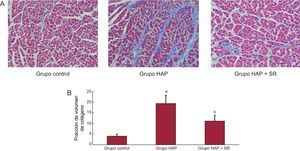
En la figura 2 se muestra un ejemplo de la tinción de tricrómico de Masson en los cortes de tejido. Los cortes ventriculares de los animales del grupo de HAP + SR presentaron significativamente menos fibrosis que los perros con HAP, mientras que los animales del grupo de HAP + SR presentaron más fibrosis que los perros de control. Por ejemplo, las imágenes de los corazones de animales con HAP revelaron la presencia de una gran cantidad de fibrosis (19,4 [3,8%]), mientras que en los perros de control se observó un tejido fibroso mínimo (4,1 [0,9%]) y los perros con HAP + SR presentaron un tejido fibroso moderado (11,2 [2,6%]).
Cambios histológicos representativos en los tres grupos. Las áreas rojas corresponden a miocitos y las azules, a colágeno (×400). A: ejemplos del infundíbulo de salida del ventrículo derecho en los tres grupos. B: resumen de los cambios en el infundíbulo de salida del ventrículo derecho. En cambio, los cortes del ventrículo derecho de perros con hipertensión arterial pulmonar presentaron más fibrosis que los de los animales de control o con hipertensión arterial pulmonar + simpatectomía renal y tuvieron más fibrosis los perros con hipertensión arterial pulmonar + simpatectomía renal que los animales de control. HAP: hipertensión arterial pulmonar; SR: simpatectomía renal. ap < 0,01 frente a los grupos control e hipertensión arterial pulmonar + simpatectomía renal. bp < 0,01 frente al grupo de control. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
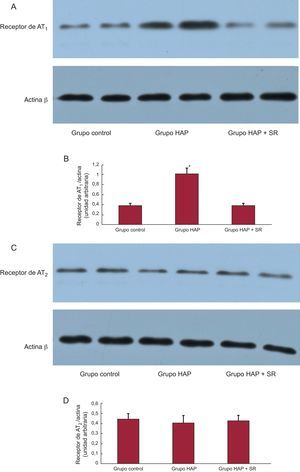
En la figura 3 se comparan los resultados del Western blot de la arteria pulmonar en los tres grupos. Todas las mediciones de las bandas de inmunoblot se normalizaron respecto a la intensidad de la banda de actina β de la muestra cargada. Se determinaron las densidades de bandas y se realizó una cuantificación relativa de las densidades de AT1 y AT2. Tal como se muestra en las figuras 3A y B, la expresión de AT1 en la arteria pulmonar fue mayor en el grupo de HAP que en los grupos de control y de HAP + SR (1,02±0,11 frente a 0,39±0,04 y 0,38±0,05; p < 0,01). No hubo diferencias significativas en la densidad de AT2 de los tres grupos (0,44±0,04 frente a 0,41±0,05 y 0,42±0,04; p = 0,38) (figuras 3C y D).
Análisis de Western blot de los receptores de angiotensina II tipo 1 y angiotensina II tipo 2 en los extractos de muestras de proteínas procedentes de la arteria pulmonar. A: ejemplos de las bandas de Western blot identificadas con los anticuerpos para el receptor de angiotensina II tipo 1. B: densidades medias de las bandas expresadas como proporciones de los tres grupos (grupo de hipertensión arterial pulmonar frente a grupo control y grupo de hipertensión arterial pulmonar + simpatectomía renal). C: ejemplos de las bandas de Western blot identificadas con los anticuerpos para el receptor de angiotensina II tipo 2. D: densidades medias de las bandas expresadas como proporciones de los tres grupos; no hubo diferencias significativas en las densidades de angiotensina II tipo 2 de los tres grupos. AT1: angiotensina II tipo 1; AT2: angiotensina II tipo 2; HAP: hipertensión arterial pulmonar; SR: simpatectomía renal. *p < 0,01.
El presente estudio exploró las repercusiones de la SR en el remodelado vascular pulmonar en la HAP experimental. Se presentan evidencias indicativas de que: a) la SR atenuó la HAP inducida por el tratamiento de DHMC en los perros beagle, según indica la ausencia de un aumento significativo de la presión arterial pulmonar, el grosor de la pared vascular y el aumento del gasto cardiaco, y b) la disminución de las concentraciones de AII y ET-1 después de la SR se asoció al remodelado vascular pulmonar, el cual fue inducido por el tratamiento de DHMC. Los resultados de este estudio indican que la SR percutánea podría ser una alternativa efectiva para el tratamiento de la HAP.
La HAP se caracteriza por elevaciones de la presión arterial pulmonar y la resistencia vascular pulmonar. En la patogenia de la HAP intervienen múltiples factores, como la vasoconstricción, el remodelado de los vasos pulmonares y la trombosis17,18. La actividad nerviosa simpática es también un factor causal importante en el desarrollo de la HAP2,19. En el modelo animal de la HAP aguda, el aumento de la presión arterial pulmonar fue abolido por completo por la denervación de la arteria pulmonar20,21. En los pacientes con HAP, se ha apuntado que la actividad sistémica del sistema renina-angiotensina-aldosterona está aumentada, dada la observación de un aumento de la actividad del SNS. En estudios previos se ha demostrado que la AII puede causar crecimiento/proliferación e hipertrofia de las células musculares de la arteria pulmonar, induciendo con ello la resistencia arterial pulmonar22,23.
En algunos estudios previos se ha realizado análisis para determinar las concentraciones de AII antes y después de la SR. Se observó que la disminución de la liberación de AII indicaba la efectividad del dispositivo para conseguir una SR eferente12,24. Para investigar si la SR tiene repercusiones en el remodelado vascular pulmonar, en el presente estudio se utilizó el modelo de HAP experimental. La monocrotalina es una toxina vegetal alcaloide de pirrolizidina que, cuando se activa, causa un remodelado estructural de los vasos sanguíneos pulmonares y un aumento de la presión arterial pulmonar25,26. Estos resultados concuerdan con los de investigaciones previas que han mostrado que la presión de la arteria pulmonar y la presión ventricular derecha en los perros con HAP fueron significativamente superiores y que el gasto cardiaco fue inferior a lo observado en los perros de control. Tiene interés señalar que, en el presente estudio, se observó que la presión arterial pulmonar y la presión ventricular derecha en el grupo de HAP + SR fueron significativamente inferiores a las observadas en el grupo de HAP. Además, el engrosamiento de la pared arterial pulmonar se redujo después de la SR. Un estudio previo ha indicado que las concentraciones plasmáticas de ET-1 circulante están elevadas en los animales tratados con monocrotalina27. Estos datos ponen de manifiesto que la SR reduce las concentraciones de AII en plasma y las de ET-1 en el tejido pulmonar. Las concentraciones plasmáticas de ET-1 circulante están elevadas en los pacientes con HAP, y el aumento de las concentraciones de ET-1 circulante se correlaciona con el aumento de la resistencia vascular pulmonar y el aumento de la mortalidad de los pacientes con HAP23,28. Los estudios iniciales realizados por Nakamura y Johns29 señalaron que una estimulación nerviosa renal leve aumentaba las concentraciones de angiotensinógeno en el riñón de la rata. En otro estudio, Girchev et al30 demostraron que la SR reduce la concentración papilar de ET-1 en las ratas Wistar-Kyoto. Estos resultados indicaron que los nervios renales participan en la regulación de la producción de ET-1 por los riñones30. Un estudio reciente ha demostrado que la SR previno los aumentos de las concentraciones renales de noradrenalina y AII inducidos por la insuficiencia aórtica31. La infusión de AII produjo un aumento de la ET vascular que convierte la actividad enzimática y el contenido de ET-1 renal en la rata. Estos resultados indican que la AII es un estímulo intenso para la síntesis de ET-132.
Tiene interés señalar que, en el presente estudio, se observó que la expresión del receptor de AT1 estaba aumentada en la HAP experimental, pero este cambio quedó anulado tras la SR. El efecto de la AII en la HAP se produce a través de los receptores de AT1. De Man et al6 han demostrado que el aumento de la señalización de los receptores de AT1 se asoció a un aumento de la proliferación celular en el músculo liso de la arteria pulmonar en los pacientes con HAP en comparación con los controles. Estos datos indican el concepto de que, después de la SR, la actividad sistémica del sistema renina-angiotensina-aldosterona estaba inhibida, y ello daba lugar a una regulación negativa de la expresión de la actividad local del sistema renina-angiotensina-aldosterona y del receptor de AT1. Considerados conjuntamente, los resultados obtenidos indican que el tratamiento con SR antes de la inducción de la HAP previno los aumentos de la presión sistólica ventricular derecha y atenuó el engrosamiento de los vasos pulmonares. La influencia de la SR en la HAP se produce principalmente a través de la actividad del sistema renina-angiotensina-aldosterona y el sistema de la ET.
Posible trascendenciaLa HAP es una enfermedad rápidamente progresiva que conduce, en última instancia, a la insuficiencia cardiaca derecha y la muerte. Los avances realizados en el conocimiento de la biopatología a lo largo de las últimas dos décadas han conducido a tratamientos dirigidos a revertir la vasoconstricción pulmonar. A pesar de estos avances, la progresión de la enfermedad es frecuente, incluso con el empleo de pautas de tratamiento combinadas que abordan múltiples vías en su mecanismo de acción. Se ha demostrado que la presión arterial pulmonar fue atenuada por la SR en la HAP experimental. La SR puede modificar el remodelado vascular pulmonar al inhibir el sistema renina-angiotensina-aldosterona y la actividad de la ET. Los datos del presente estudio son preliminares, pero la ablación arterial renal puede ser una alternativa efectiva para el tratamiento de los pacientes con HAP. Esta observación podría plantear una preocupación respecto a la patogenia convencional de la HAP e indicar la efectividad de la SR para la HAP, un nuevo concepto similar al del efecto de la denervación arterial pulmonar para el tratamiento de los pacientes con HAP33.
LimitacionesEl presente estudio tiene ciertas limitaciones. En primer lugar, no se estudió la evolución temporal de las alteraciones hemodinámicas y estructurales inducidas por la DHMC. En consecuencia, no se sabe si el remodelado hemodinámico y estructural se inicia inmediatamente después de la inyección de DHMC y si estas alteraciones son reversibles o no. En segundo lugar, se realizó la simpatectomía renal al mismo tiempo que la inducción farmacológica de la HAP. Por consiguiente, no es posible determinar los efectos de la SR aplicada cuando la HAP está ya bien establecida, como ocurre en el contexto clínico. Sin embargo, los resultados apuntan a que la SR fue eficaz en las fases iniciales de la HAP. En futuros estudios se deberá investigar los efectos de la SR en la HAP establecida. En tercer lugar, en los animales de control y los perros con HAP, el catéter de ablación por radiofrecuencia no se colocó en las arterias renales. Los grupos de control y de HAP no fueron grupos con un tratamiento simulado real. Sin embargo, los resultados obtenidos revelaron que la SR no solo atenuó las alteraciones hemodinámicas, sino que inhibió el remodelado vascular pulmonar. Estos resultados sientan las bases para la realización de un estudio de mecanismo de acción más completo. En cuarto lugar, no se investigó en los animales de control y los tratados con SR la distribución anatómica de los nervios simpáticos periarteriales alrededor de las arterias mediante tinción de inmunofluorescencia doble con anticuerpos dirigidos a la tirosina hidroxilasa y el péptido relacionado con el gen de calcitonina. No se sabe si se destruyó o no la totalidad del plexo existente alrededor de la arteria renal. Por último, Aguero et al34 han descrito que el remodelado ventricular derecho fue estructural, histológico y molecular en un modelo de aplicación de la hipertensión pulmonar poscapilar basado en la colocación de una banda en la vena pulmonar. En el presente estudio se observó que el ventrículo derecho presentó unas cifras superiores de aldosterona, péptido natriurético tipo B y fibrosis intersticial en los perros con HAP. Sin embargo, no se investigaron los cambios de la masa ventricular derecha y los cambios moleculares en la HAP experimental producida por DHMC. Será preciso investigar con mayor detalle las alteraciones estructurales y moleculares del ventrículo derecho en la HAP experimental producida por DHMC.
CONCLUSIONESLa simpatectomía renal inhibió el remodelado vascular pulmonar y redujo la presión arterial pulmonar en la HAP experimental. El efecto de la SR en la HAP puede contribuir a producir la disminución de las concentraciones de neurohormonas.
FINANCIACIÓNEste estudio fue financiado por el National Science and Technology Pillar Program de China (2011BAI11B12), el National Key Basic Research Development Program de China (programa «‘973», 2012CB518604) y la National Natural Science Foundation de China (81070144).
CONFLICTO DE INTERESESNinguno.