El ácido acetilsalicílico, sintetizado en un contexto industrial en 1897, se introdujo en el mercado bajo la marca Aspirina® en 1899. Durante alrededor de 70 años constituyó la piedra angular del tratamiento farmacológico analgésico/antiinflamatorio y sus acciones farmacológicas sirvieron de patrón para la síntesis de nuevos fármacos antiinflamatorios no esteroideos. Tras varios descubrimientos fundamentales sobre su mecanismo de acción como antiagregante plaquetario en los años setenta del siglo xx, el ácido acetilsalicílico ha tenido una segunda vida como fármaco antitrombótico y ha pasado a ser un componente fundamental de la prevención y el tratamiento cardiovasculares1. El salto de una medicación analgésica de venta mayoritaria sin receta médica a un fármaco de prescripción que puede salvar la vida de los pacientes constituye un ejemplo del éxito de la investigación traslacional independiente. Los componentes clave de este éxito son: a) conocimiento del mecanismo de acción por el que el ácido acetilsalicílico inhibe la función plaquetaria; b) meticulosos estudios de la farmacología clínica de su efecto antiagregante plaquetario, que establecieron la necesidad poco habitual de una dosis baja y un largo intervalo de administración para conseguir una inhibición plaquetaria óptima, y c) un número elevado de ensayos clínicos controlados con placebo y de tamaño suficiente para demostrar su eficacia y su seguridad en diversos situaciones clínicas caracterizadas por alto riesgo cardiovascular2.
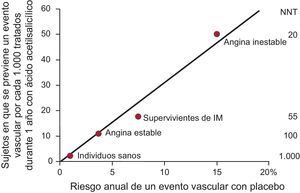
Al igual que ocurre con otras estrategias de prevención cardiovascular (p. ej., fármacos antihipertensivos o hipolipemiantes), el ácido acetilsalicílico en dosis bajas tan sólo puede reducir una parte (alrededor de un cuarto) del total de eventos vasculares mayores, no porque haya «resistencia» a sus efectos antiagregantes plaquetarios, sino como consecuencia de la naturaleza multifactorial de la aterotrombosis3. Tal como ocurre con las estatinas o los fármacos antihipertensivos, los efectos beneficiosos absolutos del ácido acetilsalicílico (número de eventos vasculares que se puede prevenir tratando a 1.000 pacientes durante 1 año) muestran una relación lineal con el riesgo cardiovascular subyacente de los pacientes (fig. 1)4.
El riesgo absoluto de complicaciones vasculares es el principal factor determinante del beneficio absoluto aportado por la profilaxis antiagregante plaquetaria. Se representan en el gráfico los datos de ensayos sobre ácido acetilsalicílico controlados con placebo en diferentes contextos clínicos. Para cada categoría de pacientes, el eje de abscisas indica el riesgo absoluto de sufrir un evento vascular registrado en el grupo de placebo del ensayo. El beneficio absoluto proporcionado por el tratamiento antiagregante plaquetario se indica en el eje de ordenadas como número de individuos en que se previene un evento vascular importante (infarto de miocardio no mortal, ictus no mortal o muerte de causa vascular) tratando con ácido acetilsalicílico a 1.000 sujetos durante 1 año. A la derecha de la figura, se indica también el número de pacientes que es necesario tratar para prevenir 1 evento en cada contexto clínico. IM: infarto de miocardio; NNT: número de pacientes que es necesario tratar. Modificado con permiso de Patrono et al4.
Muchas publicaciones han descrito una inhibición de la función plaquetaria inferior a la esperada (lo que a menudo se denomina «resistencia») en un porcentaje variable de los pacientes tratados con ácido acetilsalicílico4. Sin embargo, no se han determinado los mecanismos por los que se producen la variabilidad de la respuesta y su reversibilidad. Las principales limitaciones de que adolecen los estudios previos son las relativas a: a) evaluación insuficiente del cumplimiento del tratamiento; b) lapso entre el momento de la administración del ácido acetilsalicílico y la determinación de la inhibición plaquetaria mayormente por definir; c) definición dicotómica del carácter de los pacientes como «respondedores» o «no respondedores» basada en una sola determinación de la función plaquetaria usando umbrales de respuesta que son arbitrarios, y d) falta de estudios de intervención para esclarecer los mecanismos que subyacen a la variabilidad en la respuesta al ácido acetilsalicílico.
Para superar estas limitaciones, Rocca et al han planteado recientemente un enfoque de investigación basado en las siguientes características innovadoras: a) administración del fármaco presenciada; b) obtención de muestras de sangre en momentos exactos a las 12, 15, 18, 21 y 24 h de la administración, con objeto de evaluar el nivel máximo de inhibición plaquetaria y la cinética de su reversión; c) uso de una variable de valoración bioquímica basada en el mecanismo de acción, es decir, concentración sérica de tromboxano B2 (TXB2), que tiene las máximas especificidad y sensibilidad para el seguimiento farmacodinámico del ácido acetilsalicílico, y d) estudios de intervención con asignación aleatoria para evaluar la reproducibilidad del fenotipo bioquímico anormal y su posible reversión aumentando la dosis de ácido acetilsalicílico o reduciendo el intervalo entre dosis5,6.
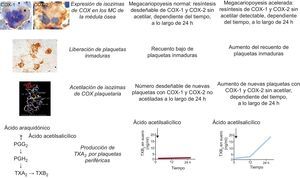
Estos estudios han observado una importante variabilidad interindividual en lo relativo a la recuperación de la actividad de la ciclooxigenasa (COX) 1 plaquetaria durante el intervalo de administración de ácido acetilsalicílico de 12 a 24 h en pacientes con diabetes mellitus (DM) tipo 2 bien controlados, así como en pacientes sin DM con indicación de tratamiento antiagregante plaquetario para prevención primaria o secundaria5. Aunque hubo una supresión muy profunda de la producción plaquetaria de tromboxano en la inmensa mayoría de los pacientes a las 12 h de una administración presenciada de ácido acetilsalicílico, con las determinaciones repetidas se evidenció un aumento lineal variable de la producción de TXB2 sérico entre las 12 y las 24 h5. Mientras que los pacientes diabéticos con una pendiente más pronunciada de recuperación de la COX-1 mostraron unos valores significativamente superiores del volumen plaquetario medio y el índice de masa corporal, el mayor peso corporal fue el único factor predictivo independiente para la recuperación más rápida en los no diabéticos5. Este fenotipo bioquímico anormal fue relativamente estable y se pudo revertirlo por completo administrando ácido acetilsalicílico en dosis de 100 mg dos veces al día5. Así pues, la diversidad existente en la rapidez de renovación de la diana del fármaco (es decir, la COX-1 plaquetaria) parece ser el principal mecanismo que contribuye a producir la variabilidad interindividual en la respuesta al fármaco. Mediante un enfoque metodológico similar, nosotros hemos demostrado recientemente que la megacariopoyesis anormal que caracteriza la trombocitemia esencial origina una menor duración del efecto antiagregante plaquetario del ácido acetilsalicílico en dosis bajas, a través de una renovación más rápida de la COX-1 plaquetaria no acetilada (fig. 2), y que se puede obtener un rescate del deterioro de la inhibición plaquetaria modulando el intervalo entre dosis de ácido acetilsalicílico en vez de modular la dosis6.
Modelo de la alteración farmacodinámica del ácido acetilsalicílico en la trombocitemia esencial (TE). En condiciones de megacariopoyesis normal, el ácido acetilsalicílico en dosis bajas acetila las isozimas de la ciclooxigenasa (COX) tanto en las plaquetas circulantes como en los megacariocitos (MC) de la médula ósea, pero vuelven a sintetizarse cantidades desdeñables de las enzimas sin acetilar durante el intervalo de 24 h entre dosis. Este patrón farmacodinámico se asocia a una supresión prácticamente completa de la producción de tromboxano (TX) A2 plaquetario en la sangre periférica durante todo el intervalo entre dosis. En condiciones de megacariopoyesis anormal, biológicamente es plausible que haya una tasa acelerada de nueva síntesis de isozimas de la COX en los MC de la médula ósea, acompañada de una liberación más rápida de plaquetas inmaduras con enzimas sin acetilar durante el intervalo entre dosis de ácido acetilsalicílico, y en particular entre 12 y 24 h tras la administración. Este patrón farmacodinámico se asocia a una supresión incompleta de la producción de TXA2 plaquetario en la sangre periférica y una recuperación, dependiente del tiempo, de la función plaquetaria dependiente del TXA2 durante el intervalo de 24 h entre dosis. Los paneles de inmunohistoquímica muestran los MC de un paciente con TE teñidos para la COX-1 y los de un individuo normal teñidos para la COX-2 y las plaquetas periféricas lavadas de un paciente con TE teñidas para la COX-2. PG: prostaglandina. Reproducido con permiso de Pascale et al6. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Según lo indicado por estudios observacionales a gran escala, el ácido acetilsalicílico en dosis bajas aumenta aproximadamente al doble el riesgo de aparición de hemorragias extracraneales mayores, en especial las hemorragias digestivas altas7. En el metaanálisis de los datos de los participantes individuales de seis ensayos de prevención primaria llevados a cabo por la Antithrombotic Trialists’ Collaboration8, el ácido acetilsalicílico aumentó las hemorragias digestivas y otras hemorragias extracraneales mayores en alrededor de la mitad (el 0,10 frente al 0,07% por año; riesgo relativo [RR]=1,54; intervalo de confianza del 95% [IC95%], 1,30-1,82; p<0,0001). Las hemorragias mayores se registraron sólo en 5 de los 16 ensayos de prevención secundaria, por lo que un metaanálisis podría ser poco fiable. Sin embargo, se observó nuevamente un exceso significativo de hemorragias mayores en los individuos que tomaron ácido acetilsalicílico (RR=2,69; IC95%, 1,25-5,76; p=0,01), sin que hubiera una heterogeneidad significativa entre los RR de los seis ensayos de prevención primaria y estos cinco de prevención secundaria8. Es interesante señalar que los principales factores de riesgo de eventos coronarios, incluida la DM, se asociaron también a eventos hemorrágicos, aunque en su mayor parte las asociaciones fueron ligeramente más débiles para la hemorragia que para los eventos oclusivos8.
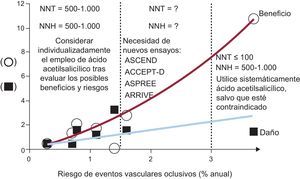
El perfil de beneficio/riesgo del ácido acetilsalicílico en dosis bajas puede presentar diferencias sustanciales dentro del espectro continuo del riesgo cardiovascular, entre una zona de riesgo alto en que los beneficios compensan claramente el mayor riesgo de complicaciones de hemorragias mayores y una zona de riesgo bajo en que el número de eventos vasculares evitados es igual al número de hemorragias mayores causadas por el uso de ácido acetilsalicílico (fig. 3)9–15. Aunque la evidencia obtenida en ensayos clínicos aleatorizados llevados a cabo en esas zonas del espectro del riesgo cardiovascular es bastante clara y constituye la base de las actuales guías y recomendaciones de tratamiento16, existe también una zona de riesgo intermedio en la que hay clara necesidad de nuevos ensayos. Actualmente se están llevando a cabo al menos cuatro ensayos aleatorizados en unos 40.000 individuos considerados en riesgo cardiovascular aumentado a causa de la DM (ASCEND17 y ACCEPT-D18), la edad avanzada (ASPREE19) o una combinación de factores de riesgo que no incluyen la DM (ARRIVE20).
Beneficios y riesgos del ácido acetilsalicílico en dosis bajas en los ensayos de prevención primaria. Se representa gráficamente el número de eventos vasculares evitados (círculos) y el de episodios de hemorragia mayor (cuadrados) por cada 1.000 pacientes tratados con ácido acetilsalicílico por año, según los resultados de seis ensayos distintos de ácido acetilsalicílico controlados con placebo, en diferentes poblaciones caracterizadas por diversos grados de riesgo cardiovascular, tal como se indica en el eje de abscisas: Women's Health Study9, Physicians’ Health Study10, Primary Prevention Project11, Hypertension Optimal Treatment Study12, British Doctors Trial13 y Thrombosis Prevention Trial14, y un ensayo en pacientes con angina estable crónica, el Swedish Angina Pectoris Aspirin Trial15. Se indican también el número de pacientes que es necesario tratar (NNT) y el número necesario para causar daño (NNH) calculados. Modificado con permiso de Patrono et al2.
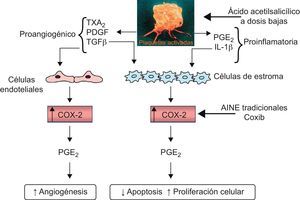
Por último, gran cantidad de pruebas indican que el ácido acetilsalicílico puede interferir en las fases iniciales de la transformación neoplásica del epitelio intestinal normal (en especial en la zona colorrectal) y conducir a la formación de adenomas esporádicos y su progresión a cáncer21. Las observaciones recientes de una reducción de la incidencia y la mortalidad debidas al cáncer colorrectal en sujetos expuestos a regímenes de tratamiento con ácido acetilsalicílico una vez al día y la aparente saturabilidad del efecto quimiopreventivo a dosis bajas22–24 han planteado la interesante posibilidad de que este efecto pueda estar relacionado con una regulación negativa de los eventos de señalización generados por la activación plaquetaria en lugares de lesión de la mucosa intestinal21,25 (fig. 4).
Hipótesis sobre el mecanismo por el que la inhibición de la COX-1 producida en las plaquetas por el ácido acetilsalicílico en dosis bajas puede inhibir la inducción de la COX-2 en las células nucleadas adyacentes de la mucosa intestinal en el estadio inicial de la neoplasia. La activación plaquetaria en los lugares de lesión de la mucosa intestinal podría desencadenar procesos de señalización distales que llevaran a reducción de la apoptosis y aumento de la proliferación celular y la angiogénesis. Se representa el mecanismo propuesto por el que la inhibición de la COX-1 en las plaquetas por la acción del ácido acetilsalicílico en dosis bajas puede inhibir la inducción de la COX-2 en células nucleadas adyacentes de la mucosa intestinal en el estadio inicial de la neoplasia. La intervención secuencial de la COX-1 y la COX-2 explicaría los efectos inhibitorios similares de la deleción de uno u otro gen en la tumorogénesis intestinal en el ratón, así como los efectos similares del ácido acetilsalicílico en dosis bajas y los coxib en la prevención de recurrencias del adenoma colorrectal esporádico en el ser humano. AINE: antiinflamatorios no esteroideos; COX: ciclooxigenasa; IL: interleucina; PDGF: factor de crecimiento de origen plaquetario; PGE2: prostaglandina E2; TGFβ: factor de crecimiento transformador beta; TX: tromboxano. Reproducido con permiso de Thun et al21.
Tras el éxito del paradigma traslacional inicial que llevó al desarrollo de la pauta de tratamiento con ácido acetilsalicílico en dosis bajas como agente antitrombótico, hay urgente necesidad de nuevos trabajos de colaboración entre el ámbito académico y la industria para determinar su mecanismo de acción como fármaco quimiopreventivo, definir la dosis y la pauta de administración óptimas para alcanzar su efecto y establecer su eficacia y su seguridad en la prevención del cáncer. Se ha planteado que incluso una reducción del 10% en la incidencia total del cáncer empleando un tratamiento profiláctico con ácido acetilsalicílico inclinaría la balanza de beneficios y riesgos y ampliaría sustancialmente la indicación para el tratamiento de poblaciones de riesgo medio21,26.
FinanciaciónLos estudios realizados por el autor fueron financiados por subvenciones de la Comisión Europea (Proyecto Integrado EICOSANOX 005033), el Séptimo Programa Marco de la Unión Europea (FP7/2007-2013) para la Iniciativa de Medicina Innovadora, bajo el contrato de subvención número IMI/115006 (consorcio SUMMIT) y Bayer AG.
Conflicto de interesesEl Prof. Patrono ha recibido pagos por consultoría y por conferencias de AstraZeneca, Bayer AG, Eli Lilly y Merck.
Se agradece especialmente la experta ayuda editorial de la Sra. Daniela Basilico.