Palabras clave
INTRODUCCIÓN
La anomalía de Ebstein (AE) debe su nombre al Dr. Wihelm Ebstein, quien en 1866 describió con detalle esta cardiopatía congénita al realizar la autopsia a un paciente de 19 años1. Son pocos los estudios morfológicos realizados sobre el nodo auriculoventricular (AV) en la edad pediátrica y si el nodo cambia con la edad2-4. Estudios previos en corazones fetales han observado que en la AE el nodo AV se localiza dentro de los límites del triángulo de Koch y más cerca de su base que en los corazones normales5. Dados la baja incidencia y el amplio espectro de presentación de la AE, no existe un tratamiento de ablación estandarizado en casos de aleteo auricular, taquicardia por reentrada nodal AV o vías accesorias AV, las cuales tienen un sustrato morfológico en la vecindad del triángulo de Koch (TK); la complejidad de la ablación en los pacientes pediátricos es aún mayor6. Por ello, el objetivo de este estudio es analizar el área del TK y la disposición en dicha estructura del sistema de conducción (nodo AV y haz de His) en la AE durante la edad perinatal.
MÉTODOS
Se han estudiado 17 corazones humanos perinatales fijados previamente en formol, 11 con AE y 6 controles. Como perinatal definimos el periodo entre la semana 24 de gestación hasta los 28 días de vida. Las 11 muestras (6 varones y 5 hembras) con AE pertenecen a la colección del Servicio de Pediatría del Hospital Cruces de Baracaldo. La edad de los pacientes varía entre 37 semanas de gestación a 1 semana después de nacer. La media de peso de los corazones en la autopsia fue de 33,7 ± 6,4 g (intervalo, 19-42,7). Las 6 muestras (4 varones y 2 hembras) con corazones estructuralmente normales procedían de fetos de edad entre 35 semanas de gestación y 2 días después de nacer. El peso medio de estos corazones fue 23,5 ± 4,5 (17-35) g. El estudio fue aprobado por el Comité Ético de la Universidad de Extremadura.
Para la disección del TK, la aurícula derecha fue abierta desde la punta del apéndice auricular hasta la unión AV junto al borde derecho del corazón; la incisión se extendió después al ventrículo derecho y a la vena cava superior. El TK se expuso, se inspeccionó y se fotografió para documentar el nivel de la unión AV. Las dimensiones de los lados del TK se tomaron mediante un compás y se verificaron cuantitativamente con un calibrador (fig. 1) y se calculó el área del TK (área = base × lado del triángulo / 2). También se midió el diámetro transversal del orificio del seno coronario (OSC) y del anillo tricuspídeo mediante un hilo y luego la longitud del hilo sobre un calibrador.
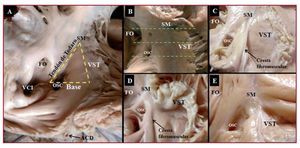
Fig. 1. Triángulo de Koch en 2 corazones de control (A y B) y 3 con AE (C-E). En B se ha indicado con tres líneas discontinuas verdes tres posibles secciones, una a nivel de la base del triángulo de Koch (orificio del seno coronario), otra a nivel de la zona media del triángulo y una tercera a nivel del vértice (localización del His). Nótese en las muestras con anomalía de Ebstein (AE) la cresta fibromuscular en relación con la inserción normal del velo septal del anillo tricúspide (VST) y la displasia del velo. En fotografías de aumento similar, se puede observar el menor tamaño del triángulo en las muestras con AE. ACD: arteria coronaria derecha; FO: fosa oval; OSC: orificio seno coronario; SM: septum membranoso; VCI: vena cava inferior.
Estudio histológico
El área de unión septal AV se extirpó en bloque de cada uno de los corazones. Esta área no sólo contiene los límites del TK y las partes adyacentes del septum interauricular e interventricular, sino también la zona superior al OSC. Los bloques fueron deshidratados, incluidos en parafina y seccionados seriadamente a 10 μm de espesor, según un eje perpendicular al anillo tricuspídeo. De cada 10 secciones, 1 se montó y se tiñó con tricrómico de Masson o van Gieson.
La longitud del nodo AV y las extensiones, así como la del haz de His, se calculó a partir de las secciones histológicas escaneadas utilizando un programa de análisis de imagen (SigmaScan/Image Pro 5.0; Jandel Scientific, San Rafael, California, Estados Unidos). La proporción entre miocitos especializados y tejido conectivo del cuerpo del nodo AV se calculó sobre imágenes digitales a 40 aumentos a las que se colocó una rejilla de 11 líneas verticales y 11 horizontales, lo que proporciona 121 puntos de intersección en el total de la rejilla. Los puntos de intersección en los que hay tejido conectivo se expresan como el porcentaje de tejido conectivo del total de la rejilla de 121 puntos (que es el 100%). Los vasos sanguíneos y el tejido perivascular intersticial fueron excluidos de la cuantificación del tejido conectivo.
Con el fin de obtener más información sobre la estructura y la organización tridimensional de las células especializadas del nodo AV y el haz de His, auriculares de trabajo y transicionales, se ha realizado un estudio ultraestructural mediante microscopia electrónica de barrido. Para ello, los portaobjetos o fragmentos que contienen una sección histológica de al menos 20 μm de espesor se trataron con tres pases sucesivos de 15 min en xilol, hasta eliminar por completo la parafina en la cual estaban inmersos. Posteriormente, estos se secaron a temperatura ambiente, se colocaron en un soporte de aluminio y se introdujeron en un vaporizador Bal-Tec SCD005, para efectuar un sombreado con oro durante 4 min, y después se observaron en un microscopio electrónico de barrido Jeol JSM-5600.
Análisis estadístico
Los resultados se expresan como media ± desviación estándar. Se comparó los datos cuantitativos mediante el test de la t de Student. Se consideró estadísticamente significativo el valor p < 0,05.
RESULTADOS
El triángulo de Koch en las muestras de control y con anomalía de Ebstein
En la superficie endocárdica paraseptal de la aurícula derecha, se localiza el TK (fig. 1), delimitado anteriormente por la inserción del velo septal de la válvula tricúspide. El límite posterior del triángulo es el tendón de Todaro, que forma la hipotenusa del triángulo. La base del triángulo la forman el OSC y el vestíbulo de la aurícula derecha. El ápex o vértice (septum membranoso) se sitúa anterosuperior, en la zona de intersección de los límites anterior y posterior del triángulo. En las muestras con AE, hay un desplazamiento apical del velo septal hacia el ventrículo derecho, al cual se encuentra adherido. Por ello, se tomó como vértice del triángulo la intersección del tendón de Todaro con la verdadera unión AV, que en la mayoría de las muestras está marcada por una cresta fibromuscular (7 muestras, 64%) o su remanente, debido a que en los otros 4 corazones fue una línea fibrosa apenas perceptible. Las medidas en longitud de los diferentes lados del triángulo y su área se exponen en la tabla 1.
La válvula tricúspide está mal formada en mayor o menor medida en todos los casos con AE, con una dilatación significativa del anillo de la válvula tricúspide —55,1 ± 10,7 (43-75) mm— si lo comparamos con los controles —28 ± 4 (22-35) mm (p < 0,05)—. La longitud de los lados del TK y su área en los corazones con AE muestra un menor tamaño de este triángulo que los corazones control (17,5 ± 4,5 frente a 25,5 ± 6,5 mm2; p < 0,05) (tabla 1). Además, el diámetro transversal del OSC es significativamente mayor en las muestras con AE que en los controles: 3,6 ± 1,2 (1,5-7) frente a 2,2 ± 0,7 (1,5-4) mm (p < 0,05).
El nodo auriculoventricular y el haz de His en las muestras de control y con anomalía de Ebstein
En todos los corazones, el cuerpo del nodo compacto AV se localiza en el interior del TK (fig. 2). Cuando se toma el OSC como punto de referencia en las secciones histológicas, en las muestras normales el cuerpo del nodo no llega al OSC, sino solamente las extensiones inferiores del nodo. Sin embargo, en la mayoría de las muestras con AE (8 corazones, 73%), las dimensiones más pequeñas del TK y el mayor diámetro del OSC hacen que el cuerpo del nodo AV esté situado a nivel de la base del triángulo en relación con el OSC (fig. 2).
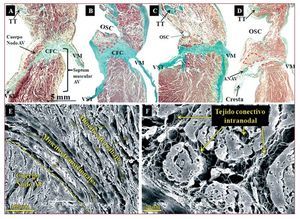
Fig. 2. Secciones histológicas sagitales (perpendiculares al anillo tricuspídeo) teñidas con tricrómico de Masson de un corazón control (A) y 3 muestras con AE (B-D) a nivel del cuerpo del nodo AV (delimitado con una línea discontinua roja). Nótese que en las muestras con AE el cuerpo se encuentra a nivel del orificio del seno coronario (OSC) y el septum muscular AV (área muscular entre la inserción de los anillos tricúspide y mitral) es inapreciable y tiene una disposición horizontal. E y F: imágenes de microscopia electrónica de barrido de un corazón normal (E) y uno con AE (F). Nótese la relación del nodo AV con los miocitos transicionales y de éstos con los miocitos auriculares de trabajo. La matriz de tejido conectivo (fundamentalmente colágeno) envuelve y se sitúa entre las células nodales. AE: anomalía de Ebstein; ANAV: arteria del nodo AV; AV: auriculoventricular; CFC: cuerpo fibroso central; TT: tendón de Todaro; VM: válvula mitral; VST: velo septal de la válvula tricúspide.
El cuerpo del nodo AV en las muestras de control tiene forma semioval y está inclinado sobre el cuerpo fibroso central (CFC) y el septum muscular AV formado por la diferencia de inserción de los anillos tricúspide y mitral en el septum interventricular y la arteria del nodo AV, la cual se sitúa en el espesor del nodo. En las muestras con AE, el cuerpo del nodo tiene una forma muy irregular (semiluna, ovoidea, coma, huso) que se adapta al TK y el septum muscular AV, que casi es inapreciable en la AE, como se observa en la figura 2B-D, por lo que el nodo se encuentra dispuesto en posición casi horizontal sobre el cuerpo fibroso central (CFC) y a una distancia del endocardio de la aurícula derecha que varía entre 0,1 y 1 mm. En las secciones histológicas de la cresta fibromuscular, se ha observado en 3 muestras con AE (27%) que la arteria del nodo AV caminaba en el espesor de esta cresta con dirección al nodo (fig. 2).
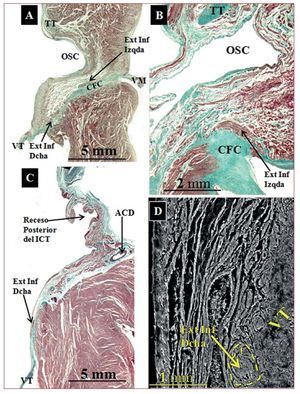
El cuerpo del nodo AV se extiende desde el comienzo de la bifurcación del nodo en extensiones inferiores hasta el comienzo del haz penetrante de His en el CFC. No hemos encontrado diferencias significativas en la longitud del cuerpo del nodo AV entre los controles y las muestras con AE. Su longitud calculada a partir de las secciones histológicas en las muestras de control fue de 1,5 ± 0,5 (0,8-2,5) mm y en las de AE, 1,7 ± 0,5 (1,1-2,4) mm (tabla 2). El cuerpo del nodo AV está constituido por miocitos especializados (menor tamaño que los miocitos de trabajo), entrelazados entre sí sin una orientación precisa y rodeados por una matriz de tejido conectivo (fig. 2) y localizados entre el CFC y una capa o más de miocitos transicionales. Aún más hacia el endocardio, se localizan los miocitos auriculares de trabajo. Se ha observado un mayor porcentaje de tejido conectivo que envuelve las células nodales en el cuerpo de las muestras con AE que en las de control: 15,3% ± 2,3% (8%-22%) frente a 8,7% ± 2,5% (4%-15%) (p < 0,05). El cuerpo del nodo AV presenta extensiones inferiores. La derecha, hacia la inserción del velo septal de la válvula tricúspide. La izquierda, hacia el OSC y la válvula mitral (fig. 3), aunque la derecha es más frecuente que la izquierda (derecha, 16 muestras; izquierda, 12). Su longitud puede observarse en la tabla 2. No hemos encontrado diferencias significativas en longitud entre las extensiones inferiores de los controles y los corazones con AE. Sin embargo, en los controles las extensiones no sobrepasan la base del TK, a nivel del OSC, y en las muestras con AE la extensión derecha (7 corazones; 64%) es más inferior, discurre por la base del TK y llega a nivel del istmo cavotricuspídeo (ICT) (fig. 3).
Fig. 3. Secciones histológicas sagitales teñidas con tricrómico de Masson de un corazón de control (A) y 2 con AE (B y C) a nivel de las extensiones inferiores derecha e izquierda del cuerpo del nodo AV. En A se observa que la extensión derecha se localiza en relación con el velo septal de la válvula tricúspide (VT) y la izquierda, en relación con el orificio del seno coronario (OSC). En B puede observarse la extensión izquierda. En C la extensión derecha se localiza al mismo nivel del receso posterior del istmo cavotricuspídeo. D: micrografía electrónica de barrido de una extensión derecha (junto a la válvula tricúspide) en una muestra con AE a nivel del istmo cavotricuspídeo. ACD: arteria coronaria derecha; CFC: cuerpo fibroso central; TT: tendón de Todaro; VM: válvula mitral.
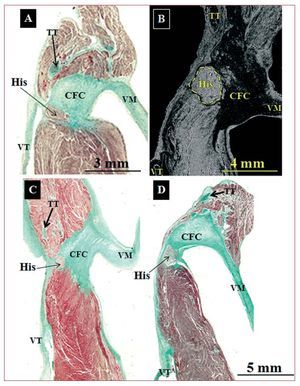
Cuando el cuerpo del nodo AV se dirige hacia el vértice del TK, penetra en el CFC, y se lo denomina haz penetrante de His (fig. 4), que está aislado eléctricamente (por tejido conectivo) del resto del miocardio auricular. Esta entrada se produce en la zona de intersección de los límites anterior y posterior del triángulo (septum membranoso). En las muestras con AE, se consideró como el límite anterior la cresta fibromuscular o su remanente que marca la verdadera unión AV. Histológicamente, el comienzo del haz de His se produce antes de llegar al vértice en el 50% de los corazones de control (3 muestras) y en el 91% (10 muestras) con AE (fig. 4). Además, en los casos de AE el haz de His es de longitud significativamente menor que en los controles (tabla 2).
Fig. 4. Secciones histológicas sagitales teñidas con tricrómico de Masson (A, C y D). Corazones control (A y B) y corazones con anomalía de Ebstein (C y D). B: micrografía electrónica de barrido de un corazón de control a nivel del haz penetrante de His. Excepto en la imagen A, donde el haz His atraviesa el cuerpo fibroso central (CFC) en el ápex del triángulo (unión del velo septal del anillo tricuspídeo con el CFC y el tendón de Todaro), en las restantes imágenes (B-D) el haz de His atraviesa el CFC antes de llegar al vértice del triángulo. TT: tendón de Todaro; VM: válvula mitral; VT: válvula tricúspide.
DISCUSIÓN
Principales hallazgos
Nuestro estudio muestra que morfológica y cuantitativamente el TK es más pequeño en los corazones con AE que en los controles. La unión AV a nivel del TK está marcada en la mayoría de las muestras con AE por una cresta fibromuscular. El cuerpo del nodo AV y sus extensiones inferiores están desplazados hacia la base del TK y a nivel del ICT respectivamente. Las muestras con AE presentaban alteración en el desarrollo del septum muscular AV, debido a que la inserción de los anillos de la válvula tricúspide y mitral se encuentran prácticamente a la misma altura. Histológicamente, en nuestros casos con AE la entrada del haz de His en el septum membranoso se produce antes de llegar al vértice del TK (10 muestras; 91%).
El triángulo de Koch y el nodo auriculoventricular en las muestras con anomalía de Ebstein. Implicaciones clínicas
Los electrofisiólogos reconocen el riesgo potencial de lesionar el sistema específico de conducción y, en consecuencia, inducir bloqueo AV durante la ablación con catéter en el área del TK y sus proximidades anatómicas como el ICT. La variabilidad en las dimensiones y la morfología del TK y la presencia dentro de sus límites del nodo AV compacto y sus extensiones son determinantes anatómicos esenciales durante el procedimiento de ablación de pacientes pediátricos.
Las dimensiones del TK obtenidas en nuestro estudio en los corazones normales del grupo control fueron similares a las descritas previamente por Waki et al4 en niños menores de 1 año. Sin embargo, el TK resultó ser más pequeño en los corazones con AE, con dos hallazgos anatómicos relevantes, un mayor OSC y la presencia de una cresta fibromuscular endocárdica que marca el límite anterior del triángulo. Esta cresta fue descrita en adultos por Cabrera et al7 y posteriormente en fetos por Ho et al5. En el espesor de esta cresta camina la arteria del nodo AV en el 27% de los corazones con AE. La topografía de la arteria requiere un conocimiento exacto del cirujano o electrofisiólogo a fin de evitar lesionarla al aplicar el catéter de ablación.
El cuerpo del nodo AV y sus extensiones en las muestras con AE son similares en longitud a los corazones normales y a los de niños de menos de 1 año4. En este sentido, una menor área del TK, como ocurre en la AE, implica un mayor contenido de tejido de conducción en su interior y un mayor riesgo de lesionarlo durante la ablación con catéter. Además, el menor espacio en el interior del TK podría explicar por qué el cuerpo del nodo AV tiende a desplazarse hacia la base del TK en el 73% de los casos de corazones con AE. Este desplazamiento se observa también en corazones fetales con AE5, aunque en ese trabajo no se estudió el tamaño del triángulo.
Se ha descrito que en el corazón normal de aproximadamente 1 año de edad el cuerpo del nodo AV es de forma semioval en el septo muscular AV apoyado en el CFC, el cual está en pendiente oblicua entre las válvulas tricúspide y mitral4. En contraste con los nodos AV de control, la forma del cuerpo del nodo en las muestras con AE es muy irregular (semiluna, ovoidal, coma, huso, etc.) para adaptarse al septum muscular AV, el cual, a diferencia de los corazones control, no está inclinado, sino horizontal, debido a que no hay diferencias significativas entre la inserción de los anillos de las válvulas tricúspide y mitral.
Nuestros resultados muestran un incremento significativo del tejido conectivo que rodea y envuelve el cuerpo del nodo AV en las muestras con AE, en comparación con los controles. Es un hecho conocido que la concentración de tejido conectivo aumenta durante el desarrollo y el crecimiento hacia la madurez o en circunstancias patológicas, como la fibrilación auricular8. En nuestro estudio, al tratarse de muestras de edades similares, el incremento de tejido conectivo en la AE se justifica por la insuficiencia cardiaca derecha debido a la dilatación de la válvula tricúspide y la sobrecarga del ventrículo derecho.
Extensiones inferiores del nodo auriculoventricular. Implicaciones clínicas
En un estudio relativamente reciente, Inoue et al9 redescribieron lo que ya Tawara había descrito en 1906, y es que el cuerpo compacto del nodo AV posee extensiones inferiores (derecha e izquierda) y que estas extensiones, en un 44% de los corazones adultos, pueden pasar el orificio del seno coronario y alcanzar el nivel del receso subeustaquiano (posterior) del ICT. En un estudio posterior4, en corazones estructuralmente normales, pusieron de manifiesto que las extensiones aumentaban en longitud en relación con la edad del individuo, pero que en corazones de niños menores de 1 año las extensiones inferiores no pasaban del OSC. Nuestro estudio muestra que en los corazones con AE en edad perinatal las extensiones inferiores, sobre todo la derecha (7 muestras; 64%) pasan la base del TK y se sitúan a nivel del ICT. Se ha señalado que estas extensiones podrían proporcionar un sustrato anatómico para la llamada «vía lenta» en la taquicardia por reentrada nodal AV10.
Haz penetrante de His: ¿vértice del triángulo de Koch?
A medida que nos acercamos al vértice del TK, el nodo AV se transforma en el haz penetrante de His; la transición está marcada por la entrada en el CFC en su unión con el velo septal y tendón de Todaro, que como son tejido conectivo aíslan eléctricamente el His. Anatómicamente, se considera el haz penetrante de His como el vértice del TK que coincide en la fluoroscopia con el área en que se obtiene un registro del electrograma de His con mayor amplitud. Sin embargo, nuestras observaciones histológicas han mostrado que la entrada del haz de His en la zona fibrosa suele ser antes de llegar al vértice del triángulo, sobre todo en muestras con AE. Esta observación ya se había descrito en algunos corazones adultos dependiendo de un mayor o menor grosor del CFC11. En el laboratorio de electrofisiología se ha demostrado una variabilidad en la posición del registro del electrograma de His en relación con los límites del TK visualizados mediante angiografía de aurícula derecha12. El registro del electrograma del His no siempre en el vértice del TK, definido por el borde anterosuperior del anillo de la válvula tricúspide, respalda nuestros hallazgos obtenidos post mórtem en corazones del grupo control. Además, en los corazones con AE, el haz de His tiene una longitud significativamente más corta que en los controles, lo que podría deberse a que en la AE no sólo se produce una alteración del desarrollo del septum muscular AV, sino también del CFC y su contenido (haz de His). Estudios futuros en el laboratorio de electrofisiología deberán correlacionar nuestros hallazgos anatómicos con registros del electrograma de His en pacientes con AE.
Limitaciones del estudio
La obtención de corazones mal formados destinados a estudio histológico es actualmente difícil, sobre todo si se trata de cardiopatías raras como es la AE. Por ello, la mayoría de los corazones con AE de este estudio tienen ya 25-30 años. Durante esos años los corazones se han mantenido fijados en formol, sin que se observen por ello alteraciones estructurales del tejido. En los corazones con AE, el espectro morfológico de la displasia del velo septal era muy variable y se acompañaba de malformaciones cardiacas asociadas, como defecto septal interauricular y, a veces, estenosis de la válvula pulmonar o ductus arterioso, aunque ninguna historia clínica de las muestras con AE presentaba alteraciones arrítmicas.
CONCLUSIONES
Conocer las dimensiones del TK y la situación del nodo AV y sus extensiones en la AE puede ser clínicamente útil en la escena del tratamiento quirúrgico de la válvula tricúspide y electrofisiológico de vías accesorias u otros sustratos arrítmicos en las proximidades de la base del TK, para evitar complicaciones como el bloqueo AV completo.
ABREVIATURAS
AE: anomalía de Ebstein.
AV: auriculoventricular.
CFC: cuerpo fibroso central.
ICT: istmo cavotricuspídeo.
OSC: orificio del seno coronario.
TK: triángulo de Koch.
Full English text available from: www.revespcardiol.org
VÉASEEDITORIALENPÁGS. 633-4
Este trabajo ha sido financiado por la Consejería de Infraestructuras y Desarrollo Tecnológico de la Junta de Extremadura [PRI 06B186 M.M y D.S.Q.], España.
Correspondencia: Prof. D. Sánchez-Quintana.
Departamento de Anatomía y Biología Celular. Facultad de Medicina. Universidad de Extremadura.
Avda. de Elvas, s/n. 06071 Badajoz. España.
Correo electrónico: damians@unex.es; dasaqui55@yahoo.com
Recibido el 4 de agosto de 2009.
Aceptado para su publicación el 2 de febrero de 2010.