El objetivo principal en el abordaje del paciente con fibrilación auricular es la reducción del riesgo de ictus mediante el tratamiento antitrombótico adecuado. Sin embargo, a pesar de una adecuada anticoagulación, sigue habiendo un importante riesgo residual de eventos isquémicos, particularmente infarto de miocardio y muerte de origen cardiovascular, que exige una protección más completa. Por lo tanto, en el paciente con fibrilación auricular, el tratamiento anticoagulante debería perseguir este doble objetivo, la reducción tanto del riesgo de ictus como de las complicaciones isquémicas. Diferentes estudios han demostrado que los antagonistas de la vitamina K solo disminuyen el riesgo de ictus y de eventos isquémicos cuando el control de la anticoagulación es óptimo, cosa que ocurre en un pequeño número de pacientes. Con respecto a los anticoagulantes orales de acción directa, aunque en general muestran un perfil de eficacia y seguridad mejor que los antagonistas de la vitamina K, parece que no todos ofrecerían la misma protección en cuanto a la reducción de los eventos isquémicos. Está demostrado que el rivaroxabán reduce de manera significativa (18%) el riesgo de infarto de miocardio. De hecho, los estudios muestran que el rivaroxabán proporciona una protección vascular más completa en diferentes contextos clínicos, no solo en el paciente con fibrilación auricular, sino también en el paciente con enfermedad vascular ateroesclerótica.
Palabras clave
ACOD: anticoagulantes orales de acción directa
AVK: antagonistas de la vitamina K
FA: fibrilación auricular
HR: hazard ratio
IC95%: intervalo de confianza del 95%
Importancia de la cardiopatìa isquémica en la fibrilación auricularLa fibrilación auricular (FA) quintuplica el riesgo de sufrir un ictus1. La anticoagulación es necesaria para la mayoría de los pacientes con FA para la prevención del ictus y la embolia sistémica2, y su uso ade-cuado ha disminuido la tasa de ictus isquémico y la mortalidad asociada3,4. Sin embargo, en los ensayos clínicos realizados en pacientes tratados con anticoagulantes, la tasa anual de ictus ronda el 1,5%, pero la de muerte por cualquier causa asciende hasta el 3%, y el ictus es la causa solo de una porción de dichas muertes2. Así, en un metanálisis realizado en más de 70.000 pacientes con los datos provenientes de los 4 ensayos clínicos principales con los anticoagulantes orales de acción directa (ACOD), con un seguimiento de 134.046 pacientes-años, la mortalidad total fue del 9% (4,72%/año). Ahora bien, del total de muertes, solo el 6% fue por ictus/embolia sistémica o hemorragia, mientras que el 64% fue de causa vascular y el 46%, de causa cardiaca5. En los últimos años se han publicado bastantes estudios que mues-tran cómo los pacientes con FA tienen mayor riesgo de complicacio-nes cardiovasculares, en particular muerte cardiovascular, infarto de miocardio e insuficiencia cardiaca, independientemente de los ante-cedentes de enfermedad cardiovascular previa, la edad o el sexo (tabla 1)6-13. En un reciente metanálisis de 15 estudios de cohortes, los pacientes con FA tenían un riesgo hasta 1,5 veces más alto de infarto de miocardio, el doble de riesgo de muerte por cualquier causa y más de 4 veces de contraer insuficiencia cardiaca13. Incluso en pacientes con riesgo tromboembólico bajo (CHA2DS2-VASc 0-1), el riesgo de infarto de miocardio se encuentra marcadamente elevado (hazard ratio [HR] ajustada [HRa] = 2,93; intervalo de confianza del 95% [IC95%], 2,21-3,87)14. Además, parece que este riesgo aumenta con el tiempo. En un estudio de cohortes prospectivo estadounidense con cerca de 24.000 sujetos sin cardiopatía isquémica basal, la FA duplicó en general el riesgo de infarto de miocardio (HR = 1,96; IC95%, 1,52-2,52). Además, a lo largo del seguimiento las curvas de supervivencia se van separando9. Por lo tanto, aunque la anticoagulación disminuye el riesgo de ictus de los pacientes con FA anticoagulados, sigue habiendo un riesgo residual cardiovascular significativo.
Impacto de la presencia de fibrilación auricular en el riesgo de complicaciones cardiovasculares
| Estudio (año) | Población incluida | Resultados principales |
|---|---|---|
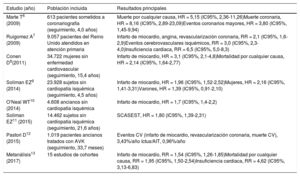
| Marte T6 (2009) | 613 pacientes sometidos a coronariografía (seguimiento, 4,0 años) | Muerte por cualquier causa, HR = 5,15 (IC95%, 2,36-11,26)Muerte coronaria, HR = 8,16 (IC95%, 2,89-23,09)Eventos coronarios mayores, HR = 3,80 (IC95%, 1,45-9,94) |
| Ruigomez A7 (2009) | 9.057 pacientes del Reino Unido atendidos en atención primaria | Infarto de miocardio, angina, revascularización coronaria, RR = 2,1 (IC95%, 1,6-2,9)Eventos cerebrovasculares isquémicos, RR = 3,0 (IC95%, 2,3-4,0)Insuficiencia cardiaca, RR = 6,5 (IC95%, 5,0-8,3) |
| Conen D8(2011) | 34.722 mujeres sin enfermedad cardiovascular (seguimiento, 15,4 años) | Infarto de miocardio, HR = 3,1 (IC95%, 2,1-4,8)Mortalidad por cualquier causa, HR = 2,14 (IC95%, 1,64-2,77) |
| Soliman EZ9 (2014) | 23.928 sujetos sin cardiopatía isquémica (seguimiento, 4,5 años) | Infarto de miocardio, HR = 1,96 (IC95%, 1,52-2,52)Mujeres, HR = 2,16 (IC95%, 1,41-3,31)Varones, HR = 1,39 (IC95%, 0,91-2,10) |
| O‘Neal WT10 (2014) | 4.608 ancianos sin cardiopatía isquémica | Infarto de miocardio, HR = 1,7 (IC95%, 1,4-2,2) |
| Soliman EZ11 (2015) | 14.462 sujetos sin cardiopatía isquémica (seguimiento, 21,6 años) | SCASEST, HR = 1,80 (IC95%, 1,39-2,31) |
| Pastori D12 (2015) | 1.019 pacientes ancianos tratados con AVK (seguimiento, 33,7 meses) | Eventos CV (infarto de miocardio, revascularización coronaria, muerte CV), 3,43%/año Ictus/AIT, 0,96%/año |
| Metanálisis13 (2017) | 15 estudios de cohortes | Infarto de miocardio, RR = 1,54 (IC95%, 1,26-1,85)Mortalidad por cualquier causa, RR = 1,95 (IC95%, 1,50-2,54)Insuficiencia cardiaca, RR = 4,62 (IC95%, 3,13-6,83) |
AIT: accidente isquémico transitorio; CV: cardiovasculares; HR: hazard ratio; IC95%: intervalo de confianza del 95%; RR: riesgo relativo; SCASEST: síndrome coronario agudo sin elevación del ST.
Por otra parte, hasta un 30% de los pacientes con cardiopatía isqué-mica además tienen FA15-17. Varios estudios han puesto de manifiesto que la enfermedad coronaria en general y el infarto agudo de miocar-dio en particular incrementan el riesgo de FA18-20, incluso en pacientes con cardiopatía isquémica silente21. En el contexto del infarto de mio-cardio, la presencia de FA se asocia con mayor mortalidad22. Parece que los pacientes con mayor carga de factores de riesgo cardio-vascular, disfunción del ventrículo izquierdo, hipertensión pulmonar, enfermedad valvular, aurícula izquierda dilatada, mayor edad y fre-cuencia cardiaca basal más alta en el momento del ingreso tendrían más riesgo de FA22,23. En el registro GARFIELD-AF, los pacientes con FA de nuevo diagnóstico y antecedentes de síndrome coronario agudo tuvieron peor pronóstico (mayor riesgo de ictus, hemorragias graves, mortalidad cardiovascular y general y recidiva de síndrome coronario agudo), además de llevar en menor proporción tratamiento anticoa-gulante y mayor proporción de tratamiento antiagregante plaquetario que los que no tenían antecedentes de síndrome coronario agudo24. Asimismo, el riesgo de FA es particularmente elevado tras una revas-cularización coronaria quirúrgica, y conlleva peor pronóstico25.
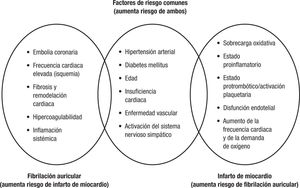
Aunque los mecanismos exactos que explican la interrelación entre la FA y el infarto de miocardio no son completamente conocidos, se han descrito varios factores que podrían justificar esta asociación (Figura 1 )18,20,26-28. En primer lugar, hay factores de riesgo, como la hipertensión arterial, la diabetes o la insuficiencia cardiaca, entre otros, comunes a las dos entidades y por ello pueden facilitar la apari-ción de ambas. Por otra parte, la FA acelera el desarrollo de fibrosis y remodelación cardiaca y promueve un estado de hipercoagulabilidad y de inflamación sistémica, lo que aumenta el riesgo de infarto de mio-cardio. Además, en la FA con respuesta ventricular elevada, hay mayor riesgo no solo de insuficiencia cardiaca, sino también de isquemia por incremento de la demanda de oxígeno. La FA aumenta asimismo el riesgo de embolia sistémica, incluida la coronaria. Por su parte, los pacientes con infarto de miocardio presentan mayor sobrecarga oxida-tiva y un estado proinflamatorio y protrombótico que, conjuntamente con la disfunción endotelial, facilitan la aparición de FA18,20,26-28.
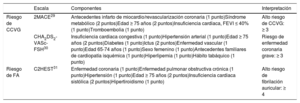
Por lo tanto, es importante conocer qué pacientes con FA tienen mayor riesgo de complicaciones cardiovasculares y, al contrario, qué pacientes están en riesgo de sufrir FA. En este sentido, se han elabo-rado diversos baremos, escalas 2MACE y CHA2DS2-VASc-FSH, para identificar a los pacientes en riesgo de sufrir eventos cardiacos mayo-res y enfermedad coronaria grave respectivamente; por otro lado, la escala C2HEST pretende identificar a los sujetos con alto riesgo de FA (tabla 2). La cardiopatía isquémica se encuentra incluida en las 3 esca-las mencionadas29-31. La escala 2MACE se ha validado en diferentes poblaciones con FA, incluidas cohortes españolas32,33.
Escalas de riesgo de eventos cardiovasculares en el paciente con fibrilación auricular y de riesgo de fibrilación auricular en pacientes tras un ictus
| Escala | Componentes | Interpretación | |
|---|---|---|---|
| Riesgo de CCVG | 2MACE29 | Antecedentes infarto de miocardio/revascularización coronaria (1 punto)Síndrome metabólico (2 puntos)Edad ≥ 75 años (2 puntos)Insuficiencia cardiaca, FEVI ≤ 40% (1 punto)Tromboembolia (1 punto) | Alto riesgo de CCVG: ≥ 3 |
| CHA2DS2-VASc-FSH30 | Insuficiencia cardiaca congestiva (1 punto)Hipertensión arterial (1 punto)Edad ≥ 75 años (2 puntos)Diabetes (1 punto)Ictus (2 puntos)Enfermedad vascular (1 punto)Edad 65-74 años (1 punto)Sexo femenino (1 punto)Antecedentes familiares de cardiopatía isquémica (1 punto)Hiperlipemia (1 punto)Hábito tabáquico (1 punto) | Riesgo de enfermedad coronaria grave: ≥ 3 | |
| Riesgo de FA | C2HEST31 | Enfermedad coronaria (1 punto)Enfermedad pulmonar obstructiva crónica (1 punto)Hipertensión (1 punto)Edad ≥ 75 años (2 puntos)Insuficiencia cardiaca sistólica (2 puntos)Hipertiroidismo (1 punto) | Alto riesgo de fibrilación auricular: ≥ 4 |
CCVG: complicaciones cardiovasculares graves; CV: cardiovascular; FA: fibrilación auricular.
En los pacientes con cardiopatía isquémica y FA, es fundamental la prevención de las complicaciones tromboembólicas mediante un tra-tamiento anticoagulante adecuado. De hecho, la escala CHA2DS2-VASc incluye la enfermedad vascular (definida como antecedentes de infarto de miocardio, enfermedad arterial periférica o placa aórtica) como una de las variables que considerar en la estratificación de riesgo de ictus2. Aunque la gran mayoría de los pacientes con cardio-patía isquémica y FA tienen otras enfermedades o situaciones asocia-das que van a hacer que el paciente tenga una puntuación CHA2DS2- VASc ≥ 2 y, por lo tanto, indicación clara de anticoagulación, recientemente se ha descrito que los pacientes que solamente pade-cen enfermedad vascular sin ningún otro factor de riesgo tromboem-bólico (CHA2DS2-VASc de 1 en varones y 2 en mujeres), se debería indicar la anticoagulación con ACOD a partir de los 55 años de edad34.
El tratamiento antiagregante forma parte esencial del abordaje del paciente con cardiopatía isquémica35. Sin embargo, la adición de tra-tamiento antiagregante al tratamiento con antagonistas de la vita-mina K (AVK) para los pacientes con FA y cardiopatía isquémica esta-ble no consigue reducir las recidivas de eventos coronarios o tromboembólicos, pero aumenta significativamente el riesgo hemo-rrágico36. Esto no solo ocurre con los AVK, sino también con los ACOD. Recientemente se han publicado los resultados del estudio AFIRE, en el que se incluyó a 2.236 pacientes japoneses con FA sometidos a revascularización (percutánea o quirúrgica) al menos 1 año antes de la inclusión o con enfermedad coronaria confirmada. Se aleatorizó a los pacientes a tratamiento con rivaroxabán solo (15 mg/día o 10 mg si el aclaramiento de creatinina era de 15-49 ml/min) o combinado con un único antiagregante. Es importante recordar que esta dosis de rivaroxabán es la que se usa habitualmente para los pacientes asiáti-cos, puesto que los estudios farmacocinéticos han demostrado que con estas dosis las concentraciones plasmáticas son las mismas que con las dosis estándar (20 mg/día o 15 mg con aclaramientos de crea-tinina de 15-49 ml/min) en pacientes caucásicos, por lo que los resul-tados de este estudio también serían aplicables a otras poblaciones. El estudio tuvo que ser interrumpido anticipadamente por el incre-mento de la mortalidad observado en el grupo de tratamiento combi-nado. La adición de un antiagregante al rivaroxabán no se tradujo en reducción de la variable combinada de ictus, embolia sistémica, infarto de miocardio, angina inestable que requiriese revasculariza-ción o muerte por cualquier causa, y sí se asoció con aumento signifi-cativo del riesgo hemorrágico37. En el estudio ROCKET-AF, aunque la eficacia y la seguridad del rivaroxabán frente a la warfarina fueron independientes del tratamiento con ácido acetilsalicílico, los pacien-tes que recibían tratamiento concomitante con este fármaco presen-taron mayor riesgo hemorrágico y de muerte por cualquier causa, más pronunciado en los pacientes sin cardiopatía isquémica cono-cida38. En un reciente metanálisis en el que se incluyó a cerca de 8.900 pacientes con FA no valvular y enfermedad coronaria estable (infarto de miocardio o revascularización percutánea más de 1 año antes), no se encontraron diferencias entre el grupo de pacientes tratados con anticoagulante oral y un antiagregante plaquetario y el de los que solo tomaban un anticoagulante oral en cuanto a la reducción de eventos cardiovasculares graves o ictus, pero el tratamiento combinado aumentó significativamente el riesgo de hemorragias mayores39. Todos estos datos indican que, para los pacientes con FA y cardiopatía isquémica estable, el tratamiento de elección sería la anticoagulación oral en monoterapia40.
Con respecto al tratamiento anticoagulante con AVK, un análisis retrospectivo del estudio SPORTIF III mostró que el control adecuado de la anticoagulación tenía un impacto positivo en el riesgo de even-tos cardiovasculares graves41. Lo mismo se observó en el brazo de war-farina del estudio RE-LY, en el que el mejor control del tiempo en rango terapéutico (> 65% frente a ≤ 65%) se asociaba con menor riesgo de infarto de miocardio42,43. En otro estudio realizado en pacientes con FA anticoagulados con AVK, conforme aumentaba el tiempo en rango terapéutico disminuían no solo el riesgo de ictus, sino también el de eventos cardiovasculares graves, que fue menor en el grupo que mos-traba tiempos en rango terapéutico ≥ 75%44. Todos estos datos indican la importancia que tiene el adecuado control de la INR, para la pre-vención no solo del ictus, sino también de los eventos cardiovascu-lares graves.
En cuanto a los ACOD, en el clásico metanálisis de Ruff et al. se observó que, comparados con warfarina, los ACOD se asociaban con una reducción del 19% del riesgo de ictus o embolia sistémica, del 10% de la mortalidad general, del 52% del riesgo de hemorragia intracra-neal y del 14% del riesgo de hemorragias graves, aunque el riesgo de hemorragias gastrointestinales era algo mayor16. En otro metanálisis realizado con más de 100.000 pacientes con FA no valvular o trombo-embolia venosa, en comparación con warfarina, los ACOD se asocia-ron con reducciones del 47% del riesgo de hemorragias mortales, del 12% de la mortalidad cardiovascular y del 9% de la mortalidad por cualquier causa45. Recientemente, en el registro SAKURA AF, en los pacientes con cardiopatía isquémica, el riesgo de hemorragias mayo-res fue un 88% más bajo con los ACOD que con warfarina (HR = 0,22; IC95%, 0,05-0,78; p = 0,019)46. En los 4 ensayos clínicos fundamentales de los 4 ACOD comercializados frente a warfarina, también se ha ana-lizado de manera general el riesgo de infarto de miocardio, y se ha observado una reducción no significativa con los anti-Xa, si bien la reducción numérica fue mayor con el rivaroxabán, y un aumento sig-nificativo con el dabigatrán (riesgo relativo [RR] = 1,38; IC95%, 1,1-1,7; p = 0,005)47. En un registro danés, en su conjunto, los ACOD fueron superiores a la warfarina en cuanto al riesgo de infarto de miocardio, sin diferencias significativas entre ellos48. Sin embargo, en un reciente metanálisis en el que se analizaron 28 ensayos clínicos con 196.761 pacientes incluidos, se observó que el tratamiento con rivaroxabán se asoció con el riesgo más bajo de sufrir un infarto de miocardio, seguido del apixabán y el edoxabán, mientras que el riesgo fue mayor con el dabigatrán. En consecuencia, los autores concluyeron que estas diferencias en el riesgo de infarto de miocardio podrían influir a la hora de escoger el mejor tratamiento anticoagulante49.
Al analizar individualmente cada ensayo clínico fundamental, aun-que en el estudio RE-LY se observó un aumento no significativo del riesgo de infarto de miocardio en comparación con warfarina50, en 2 metanálisis sí se ha observado un aumento significativo51,52. Estos resultados podrían estar en relación con que el dabigatrán estimula la actividad plaquetaria y la expresión del receptor de trombina plaque-taria53.
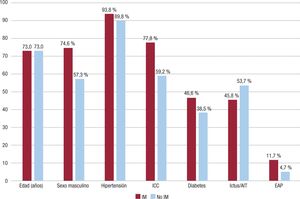
En el estudio ROCKET-AF, si bien los pacientes con antecedentes de infarto de miocardio tenían más enfermedades asociadas, excepto ictus, (Figura 2) y mayor riesgo de eventos cardiacos, los beneficios del rivaroxabán frente a la warfarina fueron independientes de los antece-dentes de infarto de miocardio. Sin embargo, en los que tenían antece-dentes de infarto de miocardio, en comparación con warfarina, se observó una reducción no significativa del 14% (OR = 0,86; IC95%, 0,73-1,00; p = 0,0509) en los eventos cardiacos (muerte cardiovascular, infarto de miocardio o angina inestable) con el rivaroxabán54. En un metanálisis de 9 ensayos clínicos, con cerca de 54.000 pacientes incluidos, en comparación con el grupo de control, el rivaroxabán redujo significativamente el riesgo de infarto de miocardio en un 18% (OR = 0,82; IC95%, 0,72-0,94; p = 0,004)55. Los estudios en práctica clí-nica real han confirmado estos buenos resultados con rivaroxabán. Así en el estudio RELIEF, en comparación con warfarina, el rivaroxabán redujo significativamente el riesgo de la variable compuesta por ictus isquémico, accidente isquémico transitorio, hemorragia cerebral, otras hemorragias intracraneales no traumáticas e infarto de miocardio en un 46% (HR = 0,54; IC95%, 0,31-0,92)56. En el estudio XANTUS, la inci-dencia de infarto de miocardio durante el seguimiento fue de tan solo 0,4/100 pacientes-año57. Más recientemente, en una cohorte española de pacientes con FA no valvular tratados con rivaroxabán durante 2 años, la mortalidad cardiovascular fue del 1,8% y no se reportó ningún caso de infarto de miocardio no mortal58.
Características basales de los pacientes incluidos en el estudio ROCKET-AF54 en función de la presencia de infarto de miocardio (n = 2.468; 17,3%). AIT: accidente isqué-mico transitorio; EAP: enfermedad arterial periférica; ICC: insuficiencia cardiaca congestiva; IM: infarto de miocardio.
En el estudio ARISTOTLE, los beneficios del apixabán frente a la warfarina en cuanto a la eficacia y seguridad fueron consistentes, independientemente de los antecedentes de cardiopatía isquémica, si bien hubo una reducción no significativa de infarto de miocardio con el apixabán59. En el ENGAGE AF-TIMI 48, si bien el efecto en el riesgo de infarto de miocardio fue muy similar entre el edoxabán 60 mg y la warfarina, hubo un aumento no significativo con la dosis de 30 mg60.
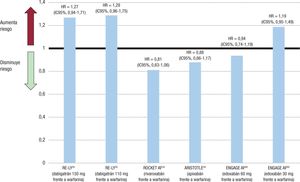
En la Figura 3 se señala el impacto que tienen los diferentes ACOD en el riesgo de infarto de miocardio en comparación con warfarina en los diferentes ensayos clínicos principales. En resumen, hubo una tendencia a un mayor riesgo con ambas dosis de dabigatrán y edoxabán 30 mg, y una tendencia a un menor riesgo con el resto de las opciones terapéuti-cas, que fue numéricamente superior con el rivaroxabán42,50,54,59-62.
Intervención coronaria percutánea en el paciente con fibrilación auricularAproximadamente un 5-15% de los pacientes con FA y cardiopatía isquémica requerirán en algún momento una intervención coronaria percutánea. La doble antiagregación disminuye el riesgo de complica-ciones isquémicas tras una revascularización percutánea. Pero tam-bién aumenta de manera significativa el riesgo de hemorragias cuando se administra conjuntamente con la anticoagulación15,17,63,64.
En los últimos años se han publicado varios ensayos clínicos que han analizado si el tratamiento antitrombótico triple con doble antia-gregación y AVK está justificada o si basta con el tratamiento doble con anticoagulación y un antiagregante plaquetario para prevenir el riesgo de complicaciones isquémicas y tromboembólicas, además de disminuir el riesgo hemorrágico. En el estudio WOEST, se incluyó a pacientes que requiriesen tomar anticoagulantes orales (no solo por FA) y fuesen a someterse a intervención coronaria percutánea. En comparación con el tratamiento antitrombótico triple con ácido ace-tilsalicilico, clopidogrel y AVK, la combinación de clopidogrel y AVK se asoció con una reducción significativa en el riesgo hemorrágico, sin un aumento en la tasa de eventos trombóticos65.
Con respecto a los ACOD, se han publicado los estudios PIONEER AF-PCI (rivaroxabán), RE-DUAL PCI (dabigatrán), AUGUSTUS (apixabán) y más recientemente, el ENTRUST-AF PCI (edoxabán)66-69. Aunque en el diseño y las variables de eficacia y seguridad hay diferencias relevantes entre los diferentes estudios, en general muestran que el tratamiento antitrombótico doble con un antiagregante y un ACOD se asoció signi-ficativamente con menos hemorragias en comparación con el trata-miento antitrombótico triple (con edoxabán no alcanzó significación estadística), sin aumento de los eventos isquémicos66-69. Además, el estudio AUGUSTUS demostró que el tratamiento antitrombótico doble con AVK o apixabán se asociaba con menor riesgo hemorrágico que con el tratamiento antitrombótico triple con AVK o apixabán, y que el ACOD se asociaba con menos hemorragias que con AVK, independientemente de que el tratamiento antitrombótico fuese doble o triple68. En conse-cuencia, a la luz de todas estas evidencias y de recientes metanálisis70,71, el tratamiento antitrombótico triple con AVK no puede seguir conside-rándose como el tratamiento estándar habitual para el tratamiento del paciente con FA no valvular que va a someterse a intervención corona-ria percutánea. De acuerdo con la última guia, para el paciente con alto riesgo de eventos isquémicos se recomienda el tratamiento antitrom-bótico triple de 1 a 6 meses y posteriormente hasta los 12 meses el tratamiento doble (anticoagulación más un antiagregante), mientras que para el paciente con elevado riesgo hemorrágico se recomienda bien el tratamiento triple durante 1 mes y luego el tratamiento anti-trombótico doble (anticoagulación más un antiagregante) hasta los 12 meses, bien el tratamiento antitrombótico doble desde el inicio. En todos los casos, a partir del año se recomienda solo la anticoagulación oral, y son preferibles los ACOD a los AVK72,73.
Subestudios del PIONEER AF-PCI indican que los resultados en cuanto a las variables de seguridad (hemorragias) y de eficacia (muerte de causa cardiovascular, infarto de miocardio, trombosis del stent o ictus isquémico/embolia sistémica) concordaban independientemente de que se tratara de una revascularización urgente o electiva, del acceso (femoral o radial), de la arteria coronaria implicada y del tipo o la longitud de los stents o su número74. Igualmente, el beneficio del rivaroxabán en cuanto a la reducción del riesgo hemorrágico fue inde-pendiente de la estabilidad de la INR con warfarina75. Además, los rein-gresos tanto de origen cardiovascular como por hemorragia fueron menos frecuentes en los grupos tratados con rivaroxabán66. Asimismo, al considerar al paciente de manera integral, las estrategias de trata-miento basadas en rivaroxabán se asociaron con menor coste que el tratamiento antitrombótico triple con AVK y doble antiagregación76.
Beneficios del rivaroxabán para el paciente con cardiopatìa isquémica (sin fibrilación auricular)El tratamiento antitrombótico es esencial en la prevención de nue-vos eventos cardiovasculares en el paciente con cardiopatía isqué-mica. El tratamiento antiagregante hoy se considera la base del trata-miento antitrombótico en el paciente con cardiopatía isquémica crónica. No obstante, la anticoagulación podria desempeñar un papel positivo en este contexto. Asi, el riesgo de eventos adversos cardio-vasculares mayores (muerte cardiovascular, infarto de miocardio o ictus) fue menor en los pacientes con infarto de miocardio tratados con warfarina, con o sin ácido acetilsalicílico, en comparación con el ácido acetilsalicílico solo, pero se acompañó de mayor riesgo hemo-rrágico77. Sin embargo, con respecto a los ACOD, el único del que se han demostrado beneficios clinicos en el paciente con cardiopatía isquémica sin FA ha sido el rivaroxabán a la dosis «vascular» (2,5 mg 2 veces al dia). En el estudio RE-DEEM con dabigatrán, si bien se redujo la actividad anticoagulante en los pacientes con un infarto de miocar-dio reciente, hubo un aumento del riesgo hemorrágico en dependen-cia de la dosis78. En el estudio APPRAISE-2, en pacientes con un riesgo elevado tras un sindrome coronario agudo, la adición de apixabán 5 mg 2 veces al dia al tratamiento antiagregante no redujo el riesgo de recidiva de complicaciones isquémicas y aumentó el riesgo de hemo-rragias graves79.
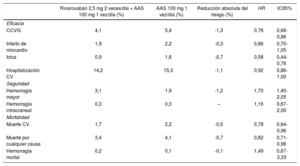
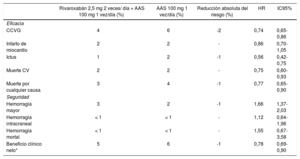
En cambio, el rivaroxabán 2,5 mg 2 veces al dia se ha demostrado beneficioso en el paciente con cardiopatía isquémica, tanto en el con-texto agudo como en el crónico. Asi, en el estudio ATLAS ACS 2-TIMI 51 en pacientes con un sindrome coronario agudo reciente, el trata-miento con rivaroxabán añadido al tratamiento antiagregante están-dar redujo el riesgo de muerte cardiovascular, infarto de miocardio o ictus en comparación con placebo, si bien hubo un incremento del riesgo de hemorragias mayores y de hemorragia intracraneal, pero no de hemorragias mortales80. En el estudio GEMINI-ACS-1 en pacientes con un sindrome coronario agudo, se observó el mismo riesgo de hemorragias clinicamente significativas al añadir rivaroxabán 2,5 mg 2 veces al dia o ácido acetilsalicílico 100 mg/dia al tratamiento de base con clopidogrel (44%) o ticagrelor (56%)81. En pacientes con enfermedad coronaria ateroesclerótica estable (cardiopatía isqué-mica y/o enfermedad arterial periférica), en comparación con ácido acetilsalicílico 100 mg/dia en monoterapia, la combinación de rivaro-xabán 2,5 mg 2 veces al dia y ácido acetilsalicílico 100 mg/dia se aso-ció con reducciones significativas del 24% del riesgo de complicacio-nes cardiovasculares graves, del 22% del riesgo de muerte de origen cardiovascular y del 18% del riesgo de muerte por cualquier causa. Aunque hubo mayor riesgo de hemorragias mayores, el de hemorra-gia mortal fue similar. En términos absolutos, la reducción de la mor-talidad cardiovascular y general fue mucho mayor que el riesgo de hemorragia mortal (tabla 3)82. El análisis ulterior del estudio COM-PASS realizado especificamente en pacientes con cardiopatía isqué-mica mostró resultados acordes con los generales del estudio, con un beneficio clinico neto y una reducción significativa del 23% a favor del rivaroxabán (tabla 4)83. A raiz del estudio COMPASS, la última guia de práctica clinica europea para el tratamiento del paciente con sin-drome coronario crónico recomienda el uso de rivaroxabán 2,5 mg 2 veces al dia añadido al ácido acetilsalicílico para los pacien-tes con enfermedad coronaria multivaso o después de 1 año tras el infarto de miocardio35.
Resultados principales del estudio COMPASS
| Rivaroxabán 2,5 mg 2 veces/día + AAS 100 mg 1 vez/día (%) | AAS 100 mg 1 vez/día (%) | Reducción absoluta del riesgo (%) | HR | IC95% | |
|---|---|---|---|---|---|
| Eficacia | |||||
| CCVG | 4,1 | 5,4 | -1,3 | 0,76 | 0,66-0,86 |
| Infarto de miocardio | 1,9 | 2,2 | -0,3 | 0,86 | 0,70-1,05 |
| Ictus | 0,9 | 1,6 | -0,7 | 0,58 | 0,44-0,76 |
| Hospitalización CV | 14,2 | 15,3 | -1,1 | 0,92 | 0,86-1,00 |
| Seguridad | |||||
| Hemorragia mayor | 3,1 | 1,9 | -1,2 | 1,70 | 1,40-2,05 |
| Hemorragia intracraneal | 0,3 | 0,3 | – | 1,16 | 0,67-2,00 |
| Mortalidad | |||||
| Muerte CV | 1,7 | 2,2 | -0,5 | 0,78 | 0,64-0,96 |
| Muerte por cualquier causa | 3,4 | 4,1 | -0,7 | 0,82 | 0,71-0,96 |
| Hemorragia mortal | 0,2 | 0,1 | -0,1 | 1,49 | 0,67-3,33 |
Tabla elaborada con datos de Eikelboom et al82. AAS: ácido acetilsalicílico; CCVG: complicaciones cardiovasculares graves (muerte CV, infarto de miocardio, ictus); CV: cardiovascular; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Resultados principales del estudio COMPASS en el subgrupo de pacientes con enfermedad coronaria estable
| Rivaroxabán 2,5 mg 2 veces/ día + AAS 100 mg 1 vez/día (%) | AAS 100 mg 1 vez/día (%) | Reducción absoluta del riesgo (%) | HR | IC95% | |
|---|---|---|---|---|---|
| Eficacia | |||||
| CCVG | 4 | 6 | -2 | 0,74 | 0,65-0,86 |
| Infarto de miocardio | 2 | 2 | - | 0,86 | 0,70-1,05 |
| Ictus | 1 | 2 | -1 | 0,56 | 0,42-0,75 |
| Muerte CV | 2 | 2 | - | 0,75 | 0,60-0,93 |
| Muerte por cualquier causa | 3 | 4 | -1 | 0,77 | 0,65-0,90 |
| Seguridad | |||||
| Hemorragia mayor | 3 | 2 | -1 | 1,66 | 1,37-2,03 |
| Hemorragia intracraneal | < 1 | < 1 | - | 1,12 | 0,64-1,96 |
| Hemorragia mortal | < 1 | < 1 | - | 1,55 | 0,67-3,58 |
| Beneficio clínico neto* | 5 | 6 | -1 | 0,78 | 0,69-0,90 |
Tabla elaborada con datos de Connolly et al83. AAS: ácido acetilsalicílico; CCVG: complicaciones cardiovasculares graves (muerte CV, infarto de miocardio, ictus); CV: cardio-vascular; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Para conseguir una protección completa en el paciente con FA no debemos limitarnos al intento de disminuir el riesgo de ictus o embo-lia sistémica, sino también el de otras complicaciones cardiovascu-lares como el infarto de miocardio o la muerte de causa cardio-vascular. Esto es particularmente relevante en el paciente con FA y antecedentes de cardiopatía isquémica. Por lo tanto, el tratamiento antitrombótico más adecuado debería buscar este doble objetivo. En este sentido, para la valoración integral del paciente es importante tener en cuenta el beneficio clínico neto, donde se toma en considera-ción no solo el riesgo de ictus o hemorragia, sino también el de otras variables como la muerte o el infarto de miocardio. Así, en un reciente trabajo se ha observado el mayor beneficio clínico neto del rivaroxa-bán en comparación con la warfarina, principalmente por mayor reducción de los eventos isquémicos y de las hemorragias mortales o de órgano crítico84.
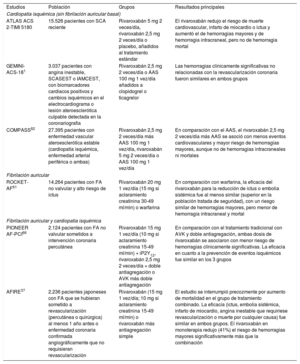
En cuanto a cuál es el mejor tratamiento antitrombótico para conseguir este doble objetivo, aunque está demostrado que los AVK disminuyen tanto el riesgo de ictus como el de eventos isquémicos, esto solo ocurre cuando el tiempo en rango terapéutico es óptimo41-44. Lamentablemente, el control adecuado de la anticoagu-lación con los AVK se alcanza en un porcentaje inadmisiblemente bajo de pacientes85. En consecuencia, los ACOD son una mejor opción, ya que en comparación con warfarina poseen en general un mejor perfil de eficacia y seguridad16. Aunque todos los ACOD se han demostrado eficaces en cuanto a la reducción del riesgo de ictus, parece que no todos ofrecerían la misma protección en cuanto a la prevención de los eventos isquémicos, y el rivaroxabán es el que ofrecería un perfil más favorable en este sentido, con un descenso significativo del 18% del riesgo de infarto de miocardio55. Esto es bio-lógicamente plausible, pues no solo ejerce su efecto en la cascada de la coagulación mediante la inhibición directa del factor Xa, sino que también actúa en la activación plaquetaria y componentes esencia-les de la aterotrombosis, lo que proporciona una protección vascular adicional86,87. En ese sentido, en los últimos años se ha desarrollado un programa amplio de investigación con rivaroxabán tanto en el paciente con FA como con cardiopatía isquémica; son varios los ensayos clínicos en este contexto que apoyan el uso del rivaroxabán como tratamiento de primera línea en el abordaje del paciente con FA y enfermedad coronaria (tabla 5)37,61,66,80-82.
Estudios con el rivaroxabán en pacientes con cardiopatía isquémica (con o sin fibrilación auricular)
| Estudios | Población | Grupos | Resultados principales |
| Cardiopatía isquémica (sin fibrilación auricular basal) | |||
| ATLAS ACS 2-TIMI 5180 | 15.526 pacientes con SCA reciente | Rivaroxabán 5 mg 2 veces/día, rivaroxabán 2,5 mg 2 veces/día o placebo, añadidos al tratamiento estándar | El rivaroxabán redujo el riesgo de muerte cardiovascular, infarto de miocardio o ictus y aumentó el de hemorragias mayores y de hemorragia intracraneal, pero no de hemorragia mortal |
| GEMINI-ACS-181 | 3.037 pacientes con angina inestable, SCASEST o IAMCEST, con biomarcadores cardiacos positivos y cambios isquémicos en el electrocardiograma o lesión ateroesclerótica culpable detectada en la coronariografia | Rivaroxabán 2,5 mg 2 veces/día o AAS 100 mg 1 vez/día añadidos a clopidogrel o ticagrelor | Las hemorragias clínicamente significativas no relacionadas con la revascularización coronaria fueron similares en ambos grupos |
| COMPASS82 | 27.395 pacientes con enfermedad vascular ateroesclerótica estable (cardiopatía isquémica, enfermedad arterial periférica o ambas) | Rivaroxabán 2,5 mg 2 veces/día más AAS 100 mg 1 vez/día, rivaroxabán 5 mg 2 veces/día o AAS 100 mg 1 vez/día | En comparación con el AAS, el rivaroxabán 2,5 mg 2 veces/día más AAS se asoció con menos eventos cardiovasculares y mayor riesgo de hemorragias mayores, aunque no de hemorragias intracraneales ni mortales |
| Fibrilación auricular | |||
| ROCKET-AF61 | 14.264 pacientes con FA no valvular y alto riesgo de ictus | Rivaroxabán 20 mg 1 vez/día (15 mg si aclaramiento creatinina 30-49 ml/min) o warfarina | En comparación con warfarina, la eficacia del rivaroxabán para la reducción de ictus o embolia sistémica fue al menos similar (superior en la población tratada de seguridad), con un riesgo similar de hemorragias mayores, pero menor de hemorragia intracraneal y mortal |
| Fibrilación auricular y cardiopatìa isquémica | |||
| PIONEER AF-PCI66 | 2.124 pacientes con FA no valvular sometidos a intervención coronaria percutánea | Rivaroxabán 15 mg 1 vez/día (10 mg si aclaramiento creatinina 15-49 ml/min) + iP2Y12, rivaroxabán 2,5 mg 2 veces/día + doble antiagregación o AVK más doble antiagregación | En comparación con el tratamiento tradicional con AVK y doble antiagregación, ambas dosis de rivaroxabán se asociaron con menor riesgo de hemorragias clínicamente significativas. La eficacia en cuanto a la prevención de eventos isquémicos fue similar en los 3 grupos |
| AFIRE37 | 2.236 pacientes japoneses con FA que se hubieran sometido a revascularización (percutánea o quirúrgica) al menos 1 año antes o enfermedad coronaria confirmada angiográficamente que no requisieran revascularización | Rivaroxabán (15 mg 1 vez/día; 10 mg si aclaramiento creatinina 15-49 ml/min) o rivaroxabán más antiagregación simple | El estudio se interrumpió precozmente por aumento de mortalidad en el grupo de tratamiento combinado. La eficacia (ictus, embolia sistémica, infarto de miocardio, angina inestable que requiriese revascularización o muerte por cualquier causa) fue similar en ambos grupos. El rivaroxabán en monoterapia redujo (41%) el riesgo de hemorragias mayores significativamente más que la combinación |
AAS: ácido acetilsalicílico; AVK: antagonistas de la vitamina K; FA: fibrilación auricular; IAMCEST: infarto agudo de miocardio con elevación del ST; iP2Y12: inhibidores del receptor P2Y12; SCA: síndrome coronario agudo; SCASEST: síndrome coronario agudo sin elevación del ST.
Aunque la antiagregación es uno de los pilares del tratamiento del paciente con enfermedad coronaria, se ha demostrado que en el paciente anticoagulado la adición de un antiagregante no disminuye los eventos cardiovasculares y sí incrementa el riesgo hemorrá- gico36,37. Solo estaría justificado añadir un antiagregante al trata-miento del paciente anticoagulado, principalmente ACOD, en el caso de intervención coronaria percutánea, concretamente un único anti-agregante, y reservar la doble antiagregación para los pacientes con mayor riesgo de eventos isquémicos y solo un corto tiempo72,73.
ConclusionesAunque el objetivo principal en el paciente con FA es la reducción del riesgo de ictus mediante el tratamiento antitrombótico adecuado, sigue habiendo un importante riesgo residual de eventos isquémicos, particularmente infarto de miocardio y muerte de origen cardio-vascular, a pesar de la adecuada anticoagulación, lo cual exige un tra-tamiento protector más completo. En un programa amplio de ensayos clínicos, se ha demostrado que el rivaroxabán reduce significativa-mente el riesgo de infarto de miocardio y proporciona un beneficio clínico neto que va más allá de la reducción del riesgo de ictus, pues además es capaz de proporcionar una mayor protección vascular.
AgradecimientosContent Ed Net (Madrid) proporcionó asistencia editorial en la redacción de este manuscrito, con financiación de Bayer Hispania.
Conflicto de interesesE. Alegría Ezquerra ha participado ocasionalmente en consultorías para Bayer. M.A. Fernández Fernández ha recibido remuneraciones por colaboraciones con Bayer y Pfizer. J.M. Vazquez Rodríguez ha reci-bido gratificaciones por participar en actos científicos, actividades docentes o consejo científico de Bayer, Pfizer, Boerhinger Ingelheim y Daichii Sankyo. O. Díaz Castro ha recibido remuneraciones por parti-cipación en programas de formación y asesoría por parte de Boehrin-ger, Bayer y Pfizer/BMS. M. Bravo Amaro ha participado en consultoría para Bayer y ha colaborado en actividades científicas y formativas con Pfizer, Bayer, Boheringer, Amgen, MSD, Rovi. R. Agra Bermejo, R. Ríos Vázquez y J. Martí-Almor no tienen conflictos de intereses en relación con esta publicación.