El uso apropiado de las técnicas de diagnóstico y de tratamiento es muy importante para asegurar una terapéutica óptima y efectiva de los pacientes cardiológicos, así como para conseguir una relación coste-beneficio adecuada.Las guías de práctica clínica intentan cumplir ese cometido, pero son difíciles de establecer en cardiología pediátrica, a pesar de los casi 50 años de experiencia en este campo.Gracias a la mejora de las técnicas diagnósticas y los mejores resultados en el tratamiento de las cardiopatías congénitas en el recién nacido, un grupo importante de pacientes pueden beneficiarse de estas guías.Se han intentado establecer protocolos en algunas de ellas y, si no ha sido posible, se han efectuado análisis descriptivos y de actuación.
Palabras clave
Cardiopatías congénitas
Edad pediátrica
Diagnóstico
Tratamiento
Guías
INTRODUCCIÓN
Dada la imposibilidad de referirse a todas y cada una de las enfermedades cardíacas que constituyen la actividad de la cardiología pediátrica, en esta guía se ha intentado alcanzar una buena representación. Se han establecido grupos y subgrupos dependiendo de sus peculiaridades anatómicas, fisiológicas, su historia natural y el resultado del tratamiento médico, intervencionista o quirúrgico si pudiese ser efectuado.
El manejo inicial se representa como tiempo = 0 (t = 0) y, si se ha producido alguna actuación terapéutica, como corrección = 0 (c = 0). Los controles periódicos se representan tras el manejo o corrección inicial como número n, seguido de la cifra de semanas, meses o años en las que deben realizarse.
Las indicaciones para el diagnóstico y procedimientos terapéuticos que se han usado se basan en la «ACC/ AHA guidelines for the management of patients with valvular heart disease» 1.
Se considera clase I: la historia clínica orientada hacia la sintomatología cardiológica del niño, cualquiera que sea su edad; la exploración cardiológica completa incluyendo la toma de la presión arterial que, en la sospecha de coartación de aorta, se ampliará a los cuatro miembros; la profilaxis antiendocarditis (se especificará si en algunas cardiopatías no fuese necesaria), y el eco-Doppler, aunque esta exploración se remarcara en todas las cardiopatías por su importancia primordial.
Algunas enfermedades incluidas en este artículo no es posible protocolizarlas al máximo, de modo que se ha optado por describirlas, aplicar normas flexibles e intentar dar unas pautas prácticas. En algunos casos se han realizado algoritmos diagnóstico-terapéuticos.
ESTENOSIS VALVULAR PULMONAR
Referida exclusivamente a la estenosis pulmonar valvular aislada (típica y displásica). Se excluyen las estenosis localizadas en el área subvalvular (infundibular o intraventricular) y las supravalvulares (tronco o ramas) o si coexisten lesiones asociadas.
La estenosis pulmonar valvular se considera leve cuando el gradiente máximo por eco-Doppler es igual o inferior a 30 mmHg; moderada, entre 30 y 80 mmHg, y severa si supera los 80 mmHg.
Se establecen los siguientes apartados:
1. Grupo A. Estenosis pulmonar valvular severa.
2. Grupo B. Estenosis pulmonar valvular moderada.
3. Grupo C. Estenosis pulmonar valvular leve.
4. Grupo D. Estenosis pulmonar valvular sometida a valvuloplastia pulmonar o valvulotomía quirúrgica.
- Subgrupo D1. Efectiva.
- Subgrupo D2. Inefectiva.
Grupo A. Estenosis pulmonar valvular severa
Manejo inicial t = 0:
- Clase I: eco-Doppler. Valvuloplastia pulmonar percutánea. Prostaglandinas (PGE-1) en neonatos.
- Clase IIa: radiografía de tórax. ECG. Profilaxis antiendocarditis.
- Clase IIb: valvulotomía quirúrgica (puede estar indicada, junto con la ampliación con parche, en las válvulas displásicas).
- Clase III: cateterismo cardíaco diagnóstico.
La valvuloplastia pulmonar está indicada a todas las edades como primera elección terapéutica. La seguridad y eficacia de esta técnica han sido confirmadas por numerosos estudios 2.
No hay unanimidad respecto a si estos pacientes precisan profilaxis antiendocarditis, aunque si parece justificada después de una valvuloplastia 3. La endocarditis es infrecuente, con una incidencia de 0,94 por 10.000 pacientes y año 1.
Grupo B. Estenosis pulmonar valvular moderada
Manejo inicial t = 0:
- Clase I: eco-Doppler.
- Clase IIa: radiografía de tórax. ECG. Profilaxis antiendocarditis. Valvuloplastia pulmonar.
- Clase IIb: valvulotomía quirúrgica (mismo criterio que en las displásicas del grupo A).
- Clase III: cateterismo cardíaco diagnóstico.
Se considera indicada la valvuloplastia pulmonar y, por tanto, sería clase I si el gradiente es igual o superior de 50 mmHg en pacientes mayores de 2 años 4.
Seguimiento t = 0 + n1 año + n3 años:
- Clase I: eco-Doppler.
- Clase IIa: profilaxis antiendocarditis. Valvuloplastia percutánea. ECG.
- Clase IIb: radiografía de tórax. Valvulotomía quirúrgica (mismo criterio que displásicas del grupo A).
Clase III: cateterismo cardíaco diagnóstico.
La posibilidad de progresión del gradiente por encima de 40 mmHg sucede en el 14% de los pacientes. Es mayor en los niños menores de 4 años y más frecuente cuando el gradiente osciló entre 26 y 39 mmHg, que cuando fue inferior a 25 mmHg 3.
En los adolescentes asintomáticos con un gradiente de 40 a 49 mmHg, la valvuloplastia será clase IIa y, si se encuentra entre 30 y 39 mmHg, será clase IIb 1.
Grupo C. Estenosis valvular pulmonar leve
Manejo inicial t = 0:
- Clase I: eco-Doppler.
- Clase IIa: profilaxis antiendocarditis. ECG.
- Clase IIb: radiografía de tórax.
- Clase III: cateterismo cardíaco. Valvuloplastia pulmonar. Valvulotomía quirúrgica.
Seguimiento t = 0 + n1 año + n3 años, hasta los 4 años; después, n5 años:
Clase I: eco-Doppler.
Clase IIa: profilaxis antiendocarditis. ECG.
Clase IIb: radiografía de tórax.
Clase III: cateterismo cardíaco. Valvuloplastia pulmonar. Valvulotomía quirúrgica.
A 25 años de seguimiento, el 96,1% de los pacientes con gradiente inicial inferior a 25 mmHg estaban libres de tratamiento 5. El gradiente no progresa por encima de los 12 años de edad 6.
Si en la evolución el gradiente sobrepasa los 30 mmHg, el paciente pasaría al protocolo del grupo B.
Grupo D. Estenosis valvular pulmonar sometida a valvuloplastia pulmonar o valvulotomía quirúrgica
Subgrupo D1. Efectiva
Corrección t = 0. Posprocedimiento superado. Valvuloplastia o valvulotomía quirúrgica efectivas (gradiente por eco-Doppler inferior a 25 mmHg e insuficiencia pulmonar leve).
Seguimiento t = 0 + n6 meses en neonatos y lactantes; t = 0 + n1 año en los restantes
- Clase I: eco-Doppler. Profilaxis antiendocarditis. ECG.
- Clase IIb: radiografía de tórax.
- Clase III: cateterismo cardíaco. Valvuloplastia pulmonar. Valvulotomía quirúrgica.
Los resultados de la cirugía y, probablemente, de la valvuloplastia pulmonar son excelentes. Solamente el 4% de los pacientes precisaron un segundo procedimiento en un seguimiento de 15 años 3,6,7.
Subgrupo D2. Inefectiva
Corrección t = 0. Valvuloplastia o valvulotomía quirúrgica ineficaz (gradiente residual mayor de 30 mmHg y/o insuficiencia pulmonar de moderada a severa). El seguimiento y tratamiento de la insuficiencia pulmonar salen de estos protocolos.
Los pacientes seguirán los controles de los grupos A y B, a los que se añadirá como clase I la profilaxis antiendocarditis. Si la revalvuloplastia correcta no es efectiva, la valvulotomía quirúrgica, con o sin ampliación del tracto de salida del ventrículo derecho, será clase I.
ESTENOSIS VALVULAR AÓRTICA
La estenosis valvular aórtica se considera leve cuando el gradiente transvalvular aórtico máximo pico por eco-Doppler es menor de 40 mmHg; moderada cuando dicho gradiente oscila entre 40 y 75 mmHg y severa cuando es mayor de 75 mmHg y siempre que se mantenga el gasto cardíaco. En los neonatos con bajo gasto, el gradiente no es criterio de severidad.
Se establecen los siguientes apartados:
1. Grupo A. Estenosis valvular aórtica severa.
2. Grupo B. Estenosis valvular aórtica moderada.
3. Grupo C. Estenosis valvular aórtica leve.
4. Grupo D. Estenosis valvular aórtica sometida a valvuloplastia aórtica o valvulotomía quirúrgica.
- Subgrupo D1. Efectiva.
- Subgrupo D2. Inefectiva.
Grupo A. Estenosis valvular aórtica severa
Manejo inicial t = 0:
- Clase I: eco-Doppler. ECG. Ejercicio físico limitado. Valvuloplastia percutánea. En neonatos: PGE-1, perfusión de inotrópicos y ventilación mecánica.
- Clase IIb: radiografía de tórax. Valvulotomía quirúrgica. Operación de Ross.
- Clase III: cateterismo cardíaco diagnóstico. Prótesis valvular.
La valvuloplastia percutánea es el procedimiento de elección, y los resultados son satisfactorios, con una reducción de gradiente de aproximadamente el 60% 8.
En los menores de 10 años la estenosis severa se acompaña de manifestaciones electrocardiográficas 9,10.
Debe evitarse la implantación de prótesis valvular por la necesidad de anticoagulación y de reintervención para sustitución por crecimiento de los niños.
La operación de Ross abre nuevas perspectivas 11.
Grupo B. Estenosis valvular aórtica moderada
Manejo inicial t = 0:
- Clase I: eco-Doppler. ECG. Ejercicio físico limitado.
- Clase IIa: ergometría. Radiografía de tórax.
- Clase IIb: Holter.
- Clase III: cateterismo cardíaco diagnóstico. Valvuloplastia percutánea. Valvulotomía quirúrgica. Operación de Ross.
Seguimiento t = 0 + n6 meses + n1 año:
Se usarán los mismos criterios que en el diagnóstico inicial. Si el gradiente llega a ser severo, se entraría en los criterios del grupo A.
La ergometría y, eventualmente, el Holter, se realizarán cada 2 años. La ergometría está contraindicada en todos los pacientes sintomáticos (síncope, disnea o angina). Una respuesta inadecuada (hipotensión) indicaría tratamiento como grupo A.
La probabilidad de supervivencia en este grupo es del 81% a los 25 años. El 40% de los pacientes precisan tratamiento quirúrgico o valvuloplastia 10.
Estos niños pueden efectuar deportes de bajo componente estático y dinámico, no competitivos, con ECG basal normal y ergometría negativa. Dada la progresividad de la lesión, se debe orientar a actividades que no sean deportivas.
Grupo C. Estenosis valvular aórtica leve
Manejo inicial t = 0 y seguimiento t = 0 + n2 años:
- Clase I: eco-Doppler. ECG.
- Clase IIa: ergometría. Sin restricción de la actividad física.
- Clase IIb: radiografía de tórax.
- Clase III: cateterismo cardíaco diagnóstico. Valvuloplastia. Valvulotomía quirúrgica. Operación de Ross.
La progresión de la estenosis es de 18 a 27 mmHg cada década. El 20% de los pacientes continuarán con una estenosis leve al cabo de 30 años, y un 20% precisará actuación sobre la válvula. La probabilidad de supervivencia es del 92% a los 25 años.
La posibilidad de muerte súbita es de 1,1 por 1.000 pacientes y año, de ahí que pueda recomendarse una actividad física normal.
Grupo D. Estenosis valvular aórtica sometida a valvuloplastia aórtica o valvulotomía quirúrgica
Subgrupo D1. Efectiva
Corrección t = 0. Posprocedimiento superado. Gradiente residual igual o inferior a 40 mmHg. Insuficiencia aórtica leve.
Seguimiento t = 0 + n1 año + n2 años:
- Clase I: eco-Doppler. Actividad física limitada. ECG.
- Clase IIa: ergometría.
- Clase IIb: radiografía de tórax.
- Clase III: cateterismo cardíaco diagnóstico.
La reestenosis llega al 50% de los casos, siendo en niños mayores y adolescentes del 15 al 30%, con progresión de 10 mmHg anual del gradiente residual. Casi el 40% requiere una segunda intervención o revalvuloplastia 10.
La posibilidad de muerte súbita es de 3,1 por 1.000 pacientes y año.
Subgrupo D2. Inefectiva
Corrección t = 0. Posprocedimiento superado. Gradiente superior a 40 mmHg. Insuficiencia aórtica de moderada a severa.
Seguimiento similar a los grupos A y B.
Si la estenosis residual es severa y no hay insuficiencia aórtica significativa, la valvuloplastia será clase I y la valvulotomía quirúrgica clase IIb. Si hay estenosis e insuficiencia aórtica severas, la intervención de Ross será clase IIa y la prótesis valvular será clase IIb 11.
COARTACIÓN DE AORTA
Es una obstrucción en el istmo aórtico distal a la salida de la arteria subclavia izquierda, normalmente en la zona en la que el ductus arterioso se une a la aorta descendente. No se tratará de la coartación asociada a otras malformaciones significativas. La coartación aórtica del neonato ha sido tratada en el apartado referido al recién nacido.
Consideramos:
1. Grupo A. Coartación aórtica.
2. Grupo B. Coartación aórtica intervenida quirúrgicamente o sometida aangioplastia transluminal.
- Subgrupo C1. Efectiva.
- Subgrupo C2. Inefectiva.
Grupo A. Coartación aórtica
Manejo inicial t = 0:
- Clase I: eco-Doppler. Cirugía.
- Clase IIa: ECG. Resonancia nuclear magnética.
- Clase IIb: radiografía de tórax. Tomografía axial computarizada (TAC) helicoidal. Holter de presión arterial. Angioplastia primaria.
- Clase III: cateterismo cardíaco. Angiografía.
La angioplastia de la coartación de aorta nativa es motivo de controversia, pues con frecuencia se producen aneurismas (2-20%) y recoartaciones (31%) a medio plazo 12-14. Algunos grupos la indican incluso en el período neonatal como primer procedimiento 13. Existen factores que pueden ser determinantes de los malos resultados de la dilatación, relacionados con los diámetros del istmo aórtico y del segmento coartado 12.
El cateterismo cardíaco y la angiografía se indican para valorar la circulación colateral o cuando existen dudas diagnósticas por otras técnicas de imagen.
Grupo B. Coartación aórtica intervenida quirúrgicamente o sometida a angioplastia
Subgrupo B1. Efectiva
Corrección t = 0. Posprocedimiento superado. Gradiente transzona quirúrgica por eco-Doppler menor de 36 mmHg sin extensión diastólica, normalidad tensional. Angioplastia efectiva con gradiente residual menor de 36 mmHg sin extensión diastólica, normalidad tensional y sin sospecha de aneurisma.
Seguimiento t = 0 + n6 meses + n1 año + n3 años:<$>
- Clase I: eco-Doppler. Radiografía de tórax.
- Clase IIa: ECG. Ergometría. Holter de presión.
-Clase IIb: TAC helicoidal. Resonancia nuclear magnética.
- Clase III: cateterismo cardíaco. Angiografía.
La radiografía de tórax sirve como detección inicial de aneurisma y debe efectuarse, al menos, en la primera revisión.
La resonancia nuclear magnética debe efectuarse alguna vez en el seguimiento, a largo plazo.
Estos pacientes deben seguir siendo controlados, a pesar de que la supervivencia a los 44 años de la intervención quirúrgica es del 97%. Si la cirugía se practica antes de los 10 años de edad, la posibilidad de recoartación oscila entre el 11 y el 20%, que es mayor en menores de 2 años (estos datos corresponden a resultados quirúrgicos de series amplias del inicio de esta terapéutica e indudablemente han sido mejorados).
Subgrupo B2. Inefectiva
Corrección t = 0. Posprocedimiento superado. Paciente recoartado (gradiente mayor de 36 mm/Hg con extensión diastólica). Hipertensión.
- Clase I: eco-Doppler. Radiografia de tórax. Angioplastia en paciente operado. Cirugía en paciente sometido a angioplastia.
- Clase IIa: ECG.
- Clase IIb: resonancia nuclear magnética. TAC helicoidal. Holter de presión. Stent.
- Clase III: cateterismo cardíaco. Angiografía.
Se debe valorar el momento más adecuado para la angioplastia en los pacientes operados, nunca antes de los 3 meses poscirugía y a partir de los 2 años de vida 15.
En los adolescentes la colocación de un stent en la zona recoartada, una vez que la aorta ha alcanzado su diámetro definitivo, puede ser una buena alternativa terapéutica 16.
COMUNICACIÓN INTERAURICULAR
Referida a los defectos septales interauriculares tipo comunicación interauricular, ostium secundum.
Las recomendaciones se refieren a grupos específicos, derivados de la historia natural de la enfermedad.
1. Grupo A. Pacientes menores de 18 meses de edad.
2. Grupo B. Pacientes mayores de 18 meses de edad.
- Subgrupo B1. Comunicación interauricular igual o mayor de 8 mm.
- Subgrupo B2. Comunicación interauricular menor de 8 mm.
3. Grupo C. Pacientes con la comunicación operada o cerrada con dispositivo intravascular.
- Subgrupo C1. Comunicación interauricular operada.
- Subgrupo C2. Comunicación interauricular cerrada con dispositivo intravascular.
La división por edad está en función de la tendencia a la disminución del tamaño de las comunicaciones tipo ostium secundum en los primeros 18 meses de edad. Una reducción posterior es poco probable, especialmente en las grandes.
La oclusión con dispositivos intravasculares es un procedimiento de plena actualidad y que ha superado la fase de experimentación clínica 17.
Grupo A. Pacientes menores de 18 meses de edad
Manejo inicial t = 0:
- Clase I: eco-Doppler. ECG. Radiografía de tórax.
- Clase III: cateterismo cardíaco. Profilaxis antiendocarditis. Cierre.
Si existe sospecha de lesiones asociadas y/o insuficiencia cardíaca, se considerarán fuera de protocolo.
Seguimiento t = 0 + n6 meses:
- Clase I: eco-Doppler.
- Clase IIb: radiografía de tórax.
- Clase III: cateterismo cardíaco.
Grupo B. Pacientes mayores de 18 meses de edad
Subgrupo B1
Defecto igual o mayor de 8 mm. Movimiento septal ventricular anormal. Presión ventricular derecha igual o superior a 35 mmHg.
Manejo inicial t = 0:
- Clase I: eco-Doppler. Cierre quirúrgico (a partir de los 2 años).
- Clase IIa: eco transesofágico. Cierre con dispositivo intravascular.
- Clase IIb: radiografía de tórax.
- Clase III: cateterismo cardíaco.
Tras el cierre de la comunicación el paciente pasa a grupo C.
Subgrupo B2
Comunicación interauricular menor de 8 mm. No existe movimiento septal ventricular anormal. Presión ventricular derecha inferior a 35 mmHg 18.
Seguimiento t = 0 + n1 año:
- Clase I: eco-Doppler.
- Clase IIa: radiografía de tórax.
- Clase IIb: ECG. Cuantificación del QP/QS con isótopos.
Clase III: cateterismo cardíaco. Profilaxis antiendocarditis.
Si se comprueba movimiento septal anormal o presión ventricular derecha igual o mayor de 35 mmHg, la indicación de cierre será clase I.
Grupo C. Pacientes con la comunicación interauricular operada o cerrada con dispositivo intravascular
Subgrupo C1
Comunicación interauricular operada
Corrección t = 0. Postoperatorio resuelto y cierre comprobado por eco-Doppler.
Seguimiento t = 0 + n1 año + n5 años:
- Clase I: eco-Doppler. ECG.
- Clase IIb: Holter. Alta definitiva a n5 años.
- Clase III: cateterismo cardíaco. Profilaxis antiendocarditis.
Subgrupo C2. Comunicación interauricular cerrada con dispositivo intravascular
Corrección t = 0. Posprocedimiento resuelto y cierre comprobado por eco-Doppler
Seguimiento t = 0 + n6 meses +n1 año:<$>
- Clase I: eco-Doppler. ECG. Aspirina a dosis antiagregante durante 6 meses. Radiografía de tórax a los 6 meses y profilaxis antiendocarditis durante ese mismo tiempo.
- Clase IIb: Holter.
- Clase III: cateterismo cardíaco.
Si hay trastornos del ritmo, saldrían de protocolo.
Si en la comunicación interauricular operada se comprueba shunt residual, pasaría a t = 0 del grupo B.
En la comunicación cerrada con dispositivo, si se comprueba shunt residual significativo, será clase I la retirada del dispositivo y cierre quirúrgico.
DUCTUS ARTERIOSO PERMEABLE
Nos referimos a los casos de persistencia del conducto arterioso fuera del período neonatal y sin lesiones significativas asociadas.
Grupo A. Ductus arterioso permeable
Manejo inicial t = 0:
- Clase I: eco-Doppler. Cierre con dispositivo intravascular. Cierre quirúrgico.
- Clase IIa: radiografía de tórax. ECG.
- Clase IIb: cierre por toracoscopia.
- Clase III: cateterismo cardíaco.
La elección del cierre quirúrgico o con dispositivo intravascular dependerá de los datos anatómicos indicados por el eco-Doppler 19.
No entran en este protocolo los ductus silentes, que deben ser considerados no patológicos.
Grupo B. Ductus arterioso cerrado quirúrgicamente o con dispositivo intravascular
Corrección t = 0. Posprocedimiento resuelto. No existe shunt residual por eco-Doppler.
Seguimiento t = 0 + n6 meses:<$>
- Clase I: eco-Doppler.
- Clase IIa: radiografía de tórax (si hay dispositivo implantado).
- Clase III: cateterismo cardíaco.
En los casos quirúrgicos, si no existe shunt residual, debe darse el alta definitiva. Los cortocircuitos residuales con esta terapéutica no tienden al cierre, por lo que los pacientes regresan al grupo A.
Es posible el cierre tardío completo tras existir cortocircuito residual después del cierre con dispositivo. Puede suceder hasta 2 años después; si no ocurre, se regresaría al grupo A. Estos pacientes pueden ser dados de alta a los 5 años del cierre.
COMUNICACIÎN INTERVENTRICULAR
Excluimos las comunicaciones interventriculares múltiples y las que se acompañan de lesiones asociadas. Constituyen el 20% de todos los pacientes con cardiopatía congénita 20.
La historia natural de la enfermedad establece tres grupos 21:
1. Grupo A. Comunicación interventricular pequeña, con presiones normales en cavidades derechas.
2. Grupo B. Comunicación interventricular amplia con presiones anormales en las cavidades derechas.
- Subgrupo B1. Presión en el ventrículo derecho inferior a la del izquierdo.
- Subgrupo B2. Presión en ventrículo derecho igual a la del izquierdo.
3. Grupo C. Comunicación interventricular operada.
- Subgrupo C1. Sin cortocircuito residual.
- Subgrupo C2. Con cortocircuito residual.
Grupo A. Comunicación interventricular pequeña con presiones normales en las cavidades derechas
Manejo inicial t = 0:
- Clase I: eco-Doppler.
- Clase IIa: radiografía de tórax. ECG.
- Clase III: cateterismo cardíaco.
Si edad menor de 2 años, seguimiento t = 0 + n6 meses; si edad mayor de 2 años, seguimiento t = 0 + n1 año:
- Clase I: eco-Doppler.
- Clase IIb: ECG. Cuantificación del cortocircuito con isótopos. Radiografía de tórax.
- Clase III: cateterismo cardíaco.
Sale de protocolo si se comprueba cierre espontáneo de la comunicación o aparición de estenosis infundibular y/o incompetencia aórtica.
Grupo B. Comunicación interventricular amplia con presiones anormales en las cavidades derechas
Manejo inicial t = 0:
- Clase I: eco-Doppler.
- Clase IIa: radiografía de tórax. ECG.
- Clase IIb: cuantificación del cortocircuito con isótopos.
- Clase III: cateterismo cardíaco.
Subgrupo B1. Presión del ventrículo derecho inferior a la del izquierdo
Si edad menor de 4 años, seguimiento t = 0 + n6 meses:
- Clase I: eco-Doppler.
- Clase IIa: radiografía de tórax.
- Clase IIb: ECG. Cuantificación del cortocircuito con isótopos.
- Clase III: cateterismo cardíaco.
Si la presión del ventrículo derecho se hace normal, se aplicará protocolo del grupo A.
Existe tendencia a la reducción del tamaño de la comunicación. Si la edad pasa de 4 años, se debe efectuar corrección quirúrgica.
Subgrupo B2. Presión en el ventrículo derecho igual a la del izquierdo
Seguimiento t = 0 + n1 mes:
- Clase I: eco-Doppler. Tratamiento médico. Cirugía correctora antes del año de edad (salvo en síndrome de Down).
- Clase IIa: radiografía de tórax. ECG.
- Clase IIb: cateterismo cardíaco. Pruebas farmacológicas de vasorreactividad pulmonar.
Grupo C. Comunicación interventricular operada
Subgrupo C1
Corrección t = 0. Postoperatorio resuelto. Ausencia de comunicación interventricular residual.
Seguimiento t = 0 + n1 año hasta 0 + 5 años:
- Clase I: eco-Doppler. ECG.
- Clase IIa: radiografía de tórax.
- Clase III: cateterismo cardíaco.
Subgrupo C2
Corrección t = 0. Postoperatorio resuelto. Comunicación interventricular pequeña comprobada por eco- Doppler de aproximadamente el 10%, poscirugía 22.
Seguimiento t = 0 + n6 meses:
- Clase I: eco-Doppler. ECG.
- Clase IIa: radiografía de tórax.
- Clase IIb: cuantificación del cortocircuito por isótopos.
-Clase III: cateterismo cardíaco.
Si en la evolución desaparece el cortocircuito residual, se aplicará el protocolo del subgrupo C1.
Si la presión en el ventrículo derecho es superior a 35 mmHg o el cortocircuito es superior a 1,5 (relación QP/QS), se recomendará la reintervención como clase I.
CANAL AURICULOVENTRICULAR COMPLETO
Se incluyen los pacientes con lesiones del tipo de defecto de cojines endocárdicos con un solo anillo auriculoventricular. Se excluyen las lesiones con dos anillos, tipo comunicación interauricular ostium primum, hendidura mitral, así como las formas con un solo anillo y dominancia izquierda o derecha de grado severo y las asociadas a anatomía tipo Fallot en el tracto de salida ventricular derecho.
Se distinguen tres grupos:
1. Grupo A. Canal auriculoventricular completo no corregido.
2. Grupo B. Canal auriculoventricular completo corregido quirúrgicamente.
- Subgrupo B1. Sin lesiones residuales.
- Subgrupo B2. Con lesiones residuales.
3. Grupo C. Canal auriculoventricular completo con cerclaje de la arteria pulmonar (todavía se emplea en algunos pacientes).
Grupo A. Canal auriculoventricular completo no corregido
Se asume que, por su edad, no se contempla la presencia de enfermedad vascular pulmonar. La corrección se plantea precozmente 23.
Manejo inicial t = 0:
- Clase I: eco-Doppler. Tratamiento médico. Corrección completa antes de los 6 meses de edad. Eco transesofágico intraoperatorio.
- Clase IIa: radiografía de tórax. ECG.
- Clase IIb: cateterismo cardíaco.
- Clase III: cerclaje de la arteria pulmonar.
El cerclaje de la arteria pulmonar sólo debe efectuarse en situaciones especiales como prematuridad o existencia de enfermedad pulmonar importante.
Grupo B. Canal auriculoventricular corregido quirúrgicamente
Subgrupo B1
Corrección t = 0. Postoperatorio resuelto. Sin lesiones residuales significativas por eco-Doppler.
Seguimiento t = 0 + n6 meses + n1 año:
- Clase I: eco-Doppler. ECG.
- Clase IIb: radiografía de tórax.
- Clase III: cateterismo cardíaco.
Subgrupo B2
Corrección t = 0. Con lesiones residuales que pueden ser de varios tipos. La más frecuente es la insuficiencia valvular mitral.
Estos tipos de secuelas deben individualizarse, y se aconsejan las revisiones semestrales. El eco-Doppler sería clase I. La reintervención sobre la válvula mitral se plantea por el grado funcional, la severidad de la insuficiencia y en la repercusión sobre la aurícula y el ventrículo izquierdos y sobre la presión pulmonar, y será clase I.
Grupo C. Canal auriculoventricular con cerclaje de la arteria pulmonar
Existen pacientes con canal auriculoventricular completo en los que, por diversas razones, se ha realizado cerclaje de la arteria pulmonar.
Se considera que el mantenimiento prolongado del cerclaje implica una dificultad adicional para la corrección completa de la cardiopatía. Se recomienda efectuarla lo más próxima posible a la realización de la paliación, siempre que la situación clínica del paciente lo permita.
TETRALOGÍA DE FALLOT
Se considera la tetralogía de Fallot clásica (estenosis infundibular, comunicación interventricular subaórtica, no restrictiva por mala alineación del septum infundibular, acabalgamiento aórtico inferior al 50% e hipertrofia ventricular derecha). El grado de desarrollo del infundíbulo, junto con el tamaño del anillo, tronco y ramas pulmonares, determinan los extremos del espectro de esta afección.
Se entiende por anatomía favorable: tamaño adecuado de las arterias pulmonares, ausencia de anomalías coronarias y de otro tipo de comunicación interventricular asociada. Si no se cumple algunas de estas premisas, la consideramos no favorable 24.
El 70% de los pacientes con tetralogía de Fallot sintomáticos necesitan una intervención en el primer año de vida. Si se dejan a la evolución natural, sólo llega a la edad adulta un 5% 25.
Consideramos:
1. Grupo A. Tetralogía de Fallot sintomática del neonato o lactante menor de 6 meses.
- Subgrupo A1. Con anatomía favorable.
- Subgrupo A2. Con anatomía desfavorable.
2. Grupo B. Tetralogía de Fallot sintomática o no del niño mayor de 6 meses.
- Subgrupo B1. Con anatomía favorable.
- Subgrupo B2. Con anatomía desfavorable.
3. Grupo C. Tetralogía de Fallot operada.
- Subgrupo C1. Con cirugía paliativa.
- Subgrupo C2. Con cirugía correctora total.
Grupo A. Tetralogía de Fallot sintomática del neonato o lactante menor de 6 meses
Subgrupo A1. Con anatomía favorable
Manejo inicial t = 0:
- Clase I: eco-Doppler.
- Clase IIa: cateterismo cardíaco. Angiografía. Cirugía paliativa. Cirugía correctora.
- Clase IIb: ECG. Radiografía de tórax.
- Clase III: cirugía paliativa tipo Waterston.
El cateterismo cardíaco y la angiografía se indican para valorar las arterias pulmonares periféricamente, el origen y la distribución de las arterias coronarias (5% del total), o bien para descartar comunicaciones interventriculares múltiples 24.
La decisión entre cirugía paliativa o correctora dependerá de la experiencia y de los resultados de cada grupo.
En la cirugía paliativa deben evitarse las conexiones que pueden provocar hipertensión pulmonar o distorsiones de las arterias pulmonares.
Subgrupo A2. Con anatomía desfavorable
Manejo inicial t = 0:
- Clase I: eco-Doppler. Cateterismo cardíaco. Angiografía. Cirugía paliativa.
- Clase IIa: valvuloplastia pulmonar.
- Clase IIb: radiografía de tórax. ECG.
- Clase III: cirugía correctora.
La valvuloplastia pulmonar controlada puede retrasar hasta mayores edades el tratamiento quirúrgico, facilitar el crecimiento de las arterias pulmonares y evitar una fístula paliativa y sus secuelas 26.
Grupo B. Tetralogía de Fallot sintomática o no del niño mayor de 6 meses
Subgrupo B1. Con anatomía favorable
Manejo inicial t = 0:
- Clase I: eco-Doppler. Cirugía correctora.
- Clase IIb: radiografía de tórax. ECG. Cateterismo cardíaco. Angiografía. Resonancia nuclear magnética.
- Clase III: cirugía paliativa.
Subgrupo B2. Con anatomía desfavorable
Manejo inicial t = 0:
- Clase I: eco-Doppler. Cirugía paliativa.
- Clase IIa: cateterismo cardíaco. Angiografía. Valvuloplastia pulmonar. Cirugía correctora.
- Clase IIb: radiografía de tórax. ECG. Resonancia nuclear magnética.
- Clase III: cirugía paliativa tipo Waterston.
Grupo C. Tetralogía de Fallot operada
Subgrupo C1. Con cirugía paliativa (fístula)
Corrección t = 0. Postoperatorio superado. Fístula funcionante.
Seguimiento t = 0 + n6 meses:
- Clase I: eco-Doppler.
- Clase IIa: antiagregación plaquetaria. Cateterismo cardíaco. Angiografía. Gammagrafía pulmonar. Nueva cirugía paliativa. Angioplastia de la fístula. Cirugía correctora.
- Clase IIb: radiografía de tórax. ECG. Resonancia nuclear magnética.
- Clase III: anticoagulación.
Estos pacientes son tributarios de un tratamiento individualizado. Por ello se incluyen como clase IIa muchos procedimientos que deberán ser utilizados en cada caso concreto. La recomendación fundamental es intentar la corrección completa lo antes posible.
Subgrupo C2A. Corrección total
Corrección t = 0. Postoperatorio resuelto. Sin comunicación interventricular residual. Gradiente transpulmonar residual menor de 30 mmHg. Insuficiencia pulmonar leve.
Seguimiento t = 0 + n1 año + n3 años:<$>
- Clase I: eco-Doppler. ECG.
- Clase IIa: radiografía de tórax. Holter. Ergometría. Gammagrafía pulmonar.
Clase IIb: resonancia nuclear magnética.
Clase III: cateterismo cardíaco.
El Holter, la ergometría y la gammagrafía se recomienda efectuarlas una vez en las revisiones tardías.
Los resultados a largo plazo son muy satisfactorios. Entre el 85 y el 98% de los pacientes se encuentran en clase funcional I de la NYHA. Probablemente los resultados, incluso, mejorarán 27.
Subgrupo C2B. Corrección total
Corrección t = 0. Postoperatorio resuelto. Comunicación interventricular con QP/QS menor de 1,5 y/o gradiente transpulmonar menor de 30 mmHg o sin comunicación interventricular residual, pero con gradiente mayor de 30 mmHg en el tracto de salida ventricular derecho. Insuficiencia pulmonar leve.
Seguimiento t = 0 + n6 meses:
- Clase I: eco-Doppler. ECG.
-Clase IIa: cateterismo cardíaco. Angiografía. Gammagrafía pulmonar. Resonancia nuclear magnética. Ergometría. Holter.
- Clase IIb: radiografía de tórax. Angioplastia. Stent en arterias pulmonares.
- Clase III: cirugía.
Estos pacientes también deben ser tratados individualizadamente dada la diversidad de lesiones residuales que pueden presentar.
La presencia de disfunción sinusal o arritmias supraventriculares (taquicardia, flúter o fibrilación) se ha comunicado en un 30% de estos pacientes.
No se pueden protocolizar resultados adversos de la corrección completa. Se hace referencia a la comunicación interventricular con QP/QS mayor de 1,5, a la insuficiencia pulmonar de moderada a severa, a la estenosis pulmonar en el tracto de salida o en las ramas mayor de 40-50 mmHg o a trastornos del ECG significativos. Todos estos hallazgos deben ser tratados de forma individualizada 24,27.
CORRECCIÓN UNIVENTRICULAR EN CARDIOPATÍAS COMPLEJAS
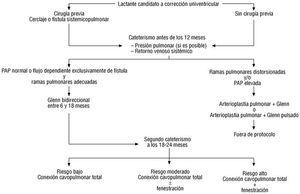
La fisiología de Fontan consiste en la separación de las circulaciones pulmonar y sistémica mediante diferentes técnicas quirúrgicas que dirigen el flujo venoso sistémico directamente a los pulmones, eliminando la hipoxemia y la sobrecarga de volumen ventricular. De este principio se benefician numerosas cardiopatías, incluidas las siguientes: atresia tricúspide, algunas formas de atresia pulmonar con septum íntegro, corazones univentriculares, hipoplasia ventricular izquierda, síndromes de heteroataxia, canal auriculoventricular disbalanceado, algunas formas de ventrículo derecho de doble salida y conexiones auriculoventriculares en cris-cross, etc. La experiencia acumulada ha suavizado los criterios originales para su realización, siendo criterios básicos el tamaño de las arterias pulmonares, las resistencias pulmonares arteriolares y el estado de las funciones diastólica y sistólica del ventrículo, determinándose los factores de riesgo preoperatorios junto con el tipo de cardiopatía 28. La mortalidad quirúrgica actual es menor del 5% en la atresia tricúspide y en el ventrículo izquierdo de doble entrada. En las formas más complejas de corazón univentricular, como las asociadas a asplenia-poliesplenia o en la atresia pulmonar, la mortalidad quirúrgica aumenta al 10% 29.
La mayoría de los grupos quirúrgicos realizan actualmente la conexión cavopulmonar total en dos tiempos 30. El primer tiempo es el Glenn bidireccional (anastomosis terminolateral entre vena cava superior y arteria pulmonar) y se realiza a partir del sexto mes de vida o antes si fuese necesario. El segundo tiempo, conexión de vena cava inferior a arteria pulmonar, se efectúa mediante un túnel intra o extracardíaco y entre el segundo y el cuarto años de vida. En función de los factores de riesgo, en el segundo tiempo se puede llevar a cabo una fenestración en el túnel, que pese a producir cierto grado de desaturación mejorará la función ventricular y disminuirá la mortalidad perioperatoria. En un tercer tiempo se intentará el cierre percutáneo de la fenestración mediante cardiología intervencionista. Este esquema terapéutico evita precozmente la sobrecarga que produce una fístula sistemicopulmonar, y presumiblemente el túnel extracardíaco disminuye la incidencia de arritmias tardías. La mayor parte de los autores están de acuerdo en que la corrección tipo Fontan en un solo tiempo debe reservarse, exclusivamente, a los pacientes con parámetros preoperatorios de bajo riesgo y con cardiopatía de base que no sea una forma compleja de corazón univentricular.
Los resultados a largo plazo demuestran una mortalidad tardía del 13% en un seguimiento a 20 años, siendo menor en los últimos años con mejor selección los de pacientes. Las causas de fallecimiento incluyen reoperación, muerte súbita, tromboembolismo y deterioro progresivo de la función ventricular. Entre un 10 y un 20% de los pacientes presentarán episodios de taquicardia auricular paroxística, flúter o fibrilación auricular que precisarán tratamiento antiarrítmico, ablación con radiofrecuencia o marcapasos 31.
El riesgo potencial de formación de trombos derechos en el Fontan es consecuencia del flujo no pulsátil y del relativo bajo gasto. Se discrepa en cuanto a la necesidad de anticoagulación o antiagregación, pero a largo plazo una cuarta parte de los pacientes reciben dicumarínicos.
La enteropatía pierdeproteínas, como consecuencia del aumento de las presiones derechas, y probablemente por la falta de flujo pulsátil constituye una complicación tardía que afecta al 14% de los pacientes a los 10 años de la cirugía. Su tratamiento se basa en medidas anticongestivas, infusión secuencial de albúmina o incluso la fenestración 32. Se considerará el trasplante cardíaco si el paciente es refractario a estas medidas.
En la tabla 1 se presenta una clasificación del riesgo preoperatorio en los candidatos a cirugía tipo Fontan, y en la figura 1 se expone un algoritmo diagnóstico-terapéutico para la corrección univentricular.
Fig. 1. Algoritmo diagnóstico terapéutico para la corrección univentricular. PAP: presión de la arteria pulmonar.
INDICACIONES DE MARCAPASOS PERMANENTES EN NIÑOS Y ADOLESCENTES33
Las bradiarritmias son raras en la edad pediátrica. La causa más frecuente de bradiarritmia sintomática son las lesiones en el sistema de conducción tras cirugía cardíaca, siendo mucho menos habitual el bloqueo auriculoventricular (AV) congénito. El tratamiento de estas lesiones, cuando son sintomáticas, es la implantación de un marcapasos. Existen lesiones, aún más raras, que también pueden ser tributarias de este tratamiento y que se especifican en los siguientes apartados.
Clase I:
1. Bloqueo AV avanzado de segundo o tercer grados asociado a bradicardia sintomática, insuficiencia car-díaca o bajo gasto.
2. Disfunción del nodo sinusal con correlación entre síntomas y bradicardia inapropiada para la edad.
3. Bloqueo AV avanzado de segundo o tercer grados postoperatorio, del que no se espera resolución o que persiste al menos 7 días.
4. Bloqueo AV congénito de tercer grado con escape de QRS ancho o disfunción ventricular.
5. Bloqueo AV congénito de tercer grado en niños con frecuencia ventricular menor de 50 a 55 lat/min o con cardiopatía congénita asociada y frecuencia menor de 70 lat/min.
6. Taquicardia ventricular sostenida pausa-dependiente con o sin QT largo en la que se documenta la eficacia del marcapasos.
Clase IIa:
1. Síndrome de taquicardia-bradicardia en el que es necesario un tratamiento antiarrítmico a largo plazo distinto de la digital.
2. Bloqueo AV congénito de tercer grado mas allá del primer año de vida, con una frecuencia media menor de 50 lat/min o pausas bruscas de dos o tres veces el ciclo básico.
3. Síndrome del QT largo con bloqueo AV 2:1 o de tercer grado.
4. Bradicardia sinusal asintomática en el niño con cardiopatía congénita compleja y frecuencia basal menor de 35 lat/min o pausas mayores de 3 s.
Clase IIb:
1. Bloqueo de tercer grado postoperatorio que revierte a ritmo sinusal con bloqueo bifascicular residual.
2. Bloqueo AV congénito de tercer grado en neonatos, niños y adolescentes asintomáticos con frecuencia aceptable, QRS estrecho y función ventricular normal.
3. Bradicardia sinusal asintomática en el adolescente con cardiopatía congénita, frecuencia basal menor de 35 lat/min o pausas mayores de 3 s.
Clase III:
1. Bloqueo AV postoperatorio transitorio con vuelta a la conducción normal en 7 días.
2. Bloqueo bifascicular postoperatorio asintomático con o sin bloqueo de primer grado.
3. Bloqueo AV de segundo grado tipo I asintomático.
4. Bradicardia sinusal asintomática en adolescente con intervalo R-R largo menor de 3 s y frecuencia cardíaca mínima mayor de 40 lat/min.
TAQUICARDIA SUPRAVENTRICULAR
Es la causa más frecuente de trastorno del ritmo en la edad pediátrica. Su mecanismo de producción se ha relacionado con la edad del paciente 34. Es mucho más habitual en los pacientes con cardiopatía congénita que en la población general, y más en los sometidos a determinadas cirugías cardíacas que requieren actuaciones intraauriculares.
Se recomienda determinar el mecanismo de la taquicardia debiéndose registrar, cuando es posible, el mecanismo de terminación y comienzo mediante ECG de 12 derivaciones o Holter.
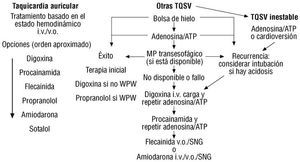
Para el tratamiento agudo de las crisis de taquicardia supraventricular deben utilizarse los fármacos con menor probabilidad de efectos secundarios 35,36.
En la figura 2 se propone un algoritmo para el tratamiento inicial de las taquicardias auriculares y supraventriculares.
Fig. 2. Algoritmo para el tratamiento inicial de las taquicardias auriculares y supraventriculares. TQSV: taquicardia supraventricular; i.v.: intravenoso; v.o.: vía oral; SNG: sonda nasogástrica; MP: marcapasos; WPW: Wolf-Parkison-White.
El tratamiento farmacológico de mantenimiento sigue siendo el primer escalón hasta que se tome la decisión de remitir al paciente a electrofisiología. La uti-lización de digital, propranolol, sotalol, quinidina, procainamida, flecainida, propafenona o amiodarona dependerá del mecanismo de la taquicardia y de la experiencia de cada grupo.
RECOMENDACIONES PARA LA ABLACIÓN CON RADIOFRECUENCIA EN LAS TAQUICARDIAS SUPRAVENTRICULARES EN NIÑOS Y ADOLESCENTES37
A. Corazón normal con taquicardia supraventricular
Clase I:
1. Atleta con taquicardia supraventricular.
2. Taquicardia supraventricular con síncope en el que la prueba de esfuerzo demuestra que la taquicardia es probablemente la causa.
3. Taquiarritmia que provoca disfunción ventricular.
4. Paciente mayor de 2 años con episodios de taquicardia supraventricular recurrentes pese a la medicación o efectos secundarios no tolerables.
Clase IIb:
1. Menores de 2 años, con raras excepciones en centros experimentados.
2. Episodio único de taquicardia supraventricular nunca tratado con antiarrítmicos.
B. Wolf-Parkinson-White asintomático
Clase I:
1. Atleta en el que el estudio electrofisiológico demuestra un período refractario efectivo anterógrado corto de la vía accesoria.
2. Paciente con síncope en el que el estudio electrofisiológico demuestra un período refractario efectivo anterógrado corto de la vía accesoria.
Clase IIb: paciente mayor de 12 años sin episodios de taquicardia supraventricular o síncope.
C. Corazón anormal con taquicardia supraventricular
Clase I:
1. Taquicardia supraventricular resistente a medicación en el postoperatorio.
2. Tratamiento antiarrítmico a largo plazo con efectos secundarios significativos.
3. Efectos secundarios de fármacos antiarrítmicos presentes o probables, incluyendo efectos sobre la función ventricular, umbrales de marcapasos (si ha sido implantado) o disfunción del nódulo sinusal.
4. Ablación preoperatoria que pueda simplificar la cirugía posterior de una cardiopatía, especialmente si el acceso tras la cirugía es complicado o si se espera compromiso hemodinámico en el postoperatorio.
TAQUICARDIA VENTRICULAR
La taquicardia ventricular es una arritmia con riesgo vital que casi siempre requiere tratamiento urgente. En la infancia la probable etiología incluye: idiopática, trastornos hidroelectrolíticos, catéteres, hipotermia, fármacos, miocarditis, miocardiopatías, tumores, displasias musculares, postoperatorios, displasia arritmogénica, síndrome de QT largo, etc.
Tratamiento agudo de la taquicardia ventricular
A. Paciente hemodinámicamente estable
1. Tratamiento de las causas desencadenantes: trastornos hidroelectrolíticos, catéteres, etc. La intoxicación digitálica es la primera causa de taquicardia ventricular secundaria a la medicación. Las torsades de pointes se asocian a la intoxicación por quinidina. y sotalol.
2. Lidocaína 1 mg/kg, i.v., tres dosis, separadas por 5 min, seguida de perfusión continua de 0,5-1,5 mg/kg/h.
3. Procainamida 10-15 mg/kg, i.v., en una hora. Contraindicada en intoxicación por fármacos IA (quinidina), amiodarona o síndrome de QT largo.
4. Atropina, 0,01 mg/kg, i.v., sólo si el ritmo sinusal es lento o normal, ya que el incremento puede suprimir la extrasistolia ventricular.
5. En las torsades de pointes:
- Implantación de un marcapasos transvenoso estimulando a frecuencias de 150 lat/min en menores de un año y 120 en mayores de un año.
- Sulfato de magnesio i.v.
B. Paciente inestable
1. Cardioversión sincronizada de 0,5-1,5 W/s/kg. Si ésta falla, corregir la hipoxia, acidosis e hipoglucemia. Repetir.
2. Sobrestimulación con marcapasos, 5 min, 30 a 50 latidos más rápida. Puede desencadenar fibrilación ventricular.
3. Propranolol, 0,025 mg/kg, i.v., repetido cada 5 min hasta cuatro dosis. Antes de su administración es necesario tener instalado un marcapasos transitorio.
4. Amiodarona, 5 mg/kg, i.v. en 30 min.
Todas estas medidas pueden ser consideradas clase I.
Tratamiento crónico de la taquicardia ventricular
El tratamiento a largo plazo de las arritmias ventriculares en niños se basa en la experiencia acumulada y en los estudios controlados en adultos. La escasa frecuencia de esta afección en la infancia hace imposible diseñar estudios controlados que aporten evidencias científicas en estos grupos de edad. Debe recordarse la necesidad de completar los estudios de imagen, incluyendo resonancia nuclear magnética y estudio electrofisiológico para descartar la existencia de un tumor.
Los fármacos IA sólo deben emplearse cuando otros han fallado, no deben emplearse en pacientes con QT largo y se han de evitar si existe disfunción ventricular. Los fármacos IB se usan frecuentemente en la taquicardia ventricular del postoperatorio de cardiopatías congénitas. Los fármacos IC, tras la evidencia demostrada en el CAST (Cardiac Arrithmyas Suppresion Trial), no deberían emplearse en pacientes con taquicardia ventricular y cardiopatía congénita 38. La propafenona ha demostrado su eficacia en adultos, pero existen pocos trabajos en la edad pediátrica. Los betabloqueadores siguen siendo fármacos muy empleados para el tratamiento a largo plazo de la taquicardia ventricular en niños con QT largo o secundarias a miocardiopatías postoperatorias y displasia arritmogénica. La amiodarona y el sotalol (clase III) han probado su utilidad en la taquicardia ventricular de niños. La amiodarona consigue una tasa de éxito cercana al 90% 39. La experiencia con sotalol es más limitada; se recomienda iniciar su administración con el niño hospitalizado dado su efecto proarrítmico.
Los pacientes pediátricos con desfibrilador implantable representan el 1% de todos los implantes. Sus indicaciones son similares a las del paciente adulto, con la salvedad de que los criterios de estratificación de riesgos para la enfermedad coronaria tienen menor valor predictivo en niños y adolescentes. Tales indicaciones serían: miocardiopatía hipertrófica, QT largo e historia de muerte súbita familiar, miocardiopatías dilatadas con arritmias ventriculares en espera de trasplante cardíaco, pacientes con taquicardia ventricular documentada y muerte súbita en quienes, a pesar de la medicación, se induce la arritmia, pacientes resucitados con corazón anormal o abandono de la medicación 40.
MIOCARDIOPATÍAS
Son enfermedades del músculo cardíaco que cursan con alteración de las funciones sistólica, diastólica o ambas. Se han descrito tres tipos: dilatada, hipertrófica y restrictiva 41.
Miocardiopatía dilatada
Es la forma más frecuente, con una incidencia anual de 2 a 8 casos por 100.000 habitantes.
Manejo inicial t = 0:
- Clase I: eco-Doppler. ECG. Radiografía de tórax. Estudio etiológico.
- Clase IIa: Holter.
- Clase IIb: Cateterismo cardíaco. Biopsia endomiocárdica. Spect cardíaco.
La etiología es muy variada, la más frecuente es la idiopática, seguida de miocarditis y otras, incluidos fármacos, tóxicos, enfermedades metabólicas, inflamatorias, familiares, etc. En lactantes debe descartarse la existencia de origen anómalo de la coronaria izquierda en el tronco pulmonar.
La biopsia endomiocárdica tiene un valor limitado y los resultados son variables. En menores de 2 años existe miocarditis en el 45%, fibrosis endomiocárdica en el 25% y no se identifica la causa en el resto 42.
Los estudios con isótopos radiactivos van a permitir de forma no invasiva cuantificar la fracción de eyección.
Seguimiento t = 0 + n3 meses + n6 meses:
- Clase I: eco-Doppler. ECG.
- Clase IIa: Holter.
- Clase IIb: estudio con isótopos radiactivos. Ergometría.
- Clase III: cateterismo cardíaco. Biopsia endomiocárdica.
Tratamiento médico de la míocardiopatía dilatada
- Clase I: diuréticos. Inhibidores de la enzima conversora de la angiotensina (IECA). Gammaglobulina hiperinmune. Dopamina. Dobutamina. Nitroprusiato. Aspirina.
- Clase IIa: digoxina. Heparina. Dicumarínicos. L-carnitina.
- Clase IIb: carvedilol. Azatriopina. Ciclosporina. Interferón alfa.
- Clase III: corticoides.
Los únicos fármacos que han demostrado inequívocamente una mejoría de los síntomas, de la supervivencia y de la clase funcional son los IECA 43. Los más utilizados son captopril y enalapril.
La inmunoterapia ha demostrado de forma variable su efectividad. Actualmente se recomienda en todo niño con miocarditis o miocardiopatía dilatada de inicio.
En los casos graves se deben emplear inotrópicos i.v. y vasodilatadores, así como ventilación mecánica para disminuir el gasto energético. El último escalón son los dispositivos de asistencia ventricular o ECMO como puente hacia el trasplante cardíaco 44,45.
La incidencia de trombos en la miocardiopatía dilatada es del 23 y del 80% en las autopsias. Todos los niños con esta enfermedad deben recibir aspirina a dosis antiagregantes. La necesidad de anticoagulación es más discutida. Algunos grupos la recomiendan cuando hay evidencia de trombos intracavitarios, fibrilación auricular o pacientes en lista de espera de trasplante cardíaco.
El déficit de L-carnitina provoca una cardiomiopatía e hipotonía progresiva a lo largo de la infancia. Dadas su fácil administración y la ausencia de efectos secundarios y de interferencias con procedimientos diagnósticos, puede administrarse de manera empírica a dosis de 100 mg/kg/día.
Los betabloqueadores de tercera generación (carvedilol) han demostrado su eficacia en adultos, pero la experiencia en niños es muy escasa 46.
Hay estudios controlados en los que la administración de prednisona, azatriopina y ciclosporina no demostró mejoría de la función ventricular y sí una mayor mortalidad 47. Un estudio multicéntrico está valorando estos resultados y la eficacia de asociación de gammaglobulina e interferón alfa 48.
Indicaciones de trasplante cardíaco en pacientes pediátricos con miocardiopatía dilatada
Clase I:
1.Miocardiopatía dilatada de más de 2 años de evolución con fracción de acortamiento menor del 15%, presiones telediastólicas del ventrículo izquierdo mayores de 25 mmHg y congestión en la radiografía de tórax pese a tratamiento óptimo con diuréticos e IECA.
2.Miocardiopatía dilatada de más de 2 años de evolución y falta de crecimiento, con clase funcional no aceptable para el desarrollo de una actividad social/escolar adecuada a la edad, pese a tratamiento máximo con IECA y diuréticos.
3.Miocardiopatía dilatada que precisa más de 2 semanas de ventilación mecánica y/o soporte inotrópico intravenoso.
4.Miocardiopatía dilatada que precisa asistencia extracorpórea (ECMO, asistencia ventricular).
Clase IIa:
1.Miocardiopatía dilatada de menos de 2 años de evolución con fracción de acortamiento menor del 15%, presiones telediastólicas mayores de 25 mmHg y congestión en la radiografía de tórax pese a máximo tratamiento con IECA y diuréticos.
2. Miocardiopatía dilatada de menos de 2 años de evolución y falta de crecimiento, con clase funcional no aceptable para el desarrollo de una actividad social/escolar adecuada a la edad, pese a máximo tratamiento con IECA y diuréticos.
Clase IIb:
1. Miocardiopatía dilatada con buena clase funcional, crecimiento aceptable, fracción de acortamiento superior al 15% y episodios de taquicardia ventricular sostenida.
Clase III:
1. Miocardiopatía dilatada con buena clase funcional, fracción de acortamiento superior al 20% y asintomática en tratamiento con IECA.
Miocardiopatía hipertrófica
Es una alteración idiopática del músculo cardíaco caracterizada por un incremento desproporcionado de la masa miocárdica en ausencia de otra enfermedad cardíaca o sistémica. Representa entre el 20 y el 30% de todas las miocardiopatías primarias en la edad pediátrica. La mayor parte de las veces afecta al ventrículo izquierdo y sólo en el 30% de los casos se afecta el derecho. La enfermedad es frecuentemente familiar, con un modelo autosómico, pero existe un 45% de casos espontáneos. Se han identificado los genes comprometidos en los cromosomas 14,1,15 y 11 que codifican las proteínas contráctiles betamiosina, T troponina y alfatropomiosina 49.
La clínica de esta entidad es variable y muchos pacientes permanecen asintomáticos, lo que dificulta el diagnóstico. Menos del 10% de los pacientes pediátricos presentan limitaciones significativas. Otros pacientes manifiestan dolor precordial, disnea o síncope. En niños y adolescentes la incidencia de muerte súbita es del 4 al 6% anual, superior a la registrada en adultos. Son factores de riesgo la edad inferior a 14 años; el síncope; la muerte súbita abortada; la historia familiar de muerte súbita, y ciertas mutaciones. El grupo de peor pronóstico, con mortalidad superior al 80%, lo constituyen los menores de un año que desarrollan insuficiencia cardíaca 50.
El método diagnóstico de elección y de seguimiento es el eco-Doppler, que determina el grado de hipertrofia y si existe obstrucción en el tracto de salida ventricular izquierdo. El ECG y el Holter deben realizarse a todos los pacientes para determinar la existencia de arritmias ventriculares, que están relacionadas con una mayor incidencia de muerte súbita.
Los pacientes con miocardiopatía hipertrófica deben evitar el ejercicio físico, ya que una gran parte de las muertes súbitas están relacionadas con su práctica. Se recomienda profilaxis de endocarditis en las formas con gradiente en el tracto de salida y anticoagulación si existe fibrilación auricular asociada o embolias previas.
El tratamiento se basa en la administración de betabloqueadores en las formas obstructivas y suele ser la primera elección en los pacientes pediátricos 51. El verapamilo se emplea en las formas no obstructivas o si predomina el dolor torácico. No está definitivamente establecido que estos fármacos protejan de la muerte súbita o retrasen la progresión de la enfermedad. Otras formas de tratamiento no médico incluyen la miectomía cuando el gradiente es superior a 50 mmHg, la implantación de marcapasos bicameral o la embolización de la primera rama septal de la descendente anterior.
Puesto que la taquicardia ventricular es el mecanismo de muerte súbita en la miocardiopatía hipertrófica, el uso de amiodarona se ha asociado con una mejor supervivencia, aunque la predicción de la eficacia de estos fármacos es difícil y controvertida. Los pacientes con miocardiopatía hipertrófica y muerte súbita abortada deben ser considerados candidatos a la implantación de un desfibrilador.
Miocardiopatía restrictiva
La miocardiopatía restrictiva es una enfermedad infrecuente en el niño y adolescente. Representa menos del 5% del total de las miocardiopatías en estas edades. La forma más frecuente es la idiopática, con antecedentes familiares en el 15% de los casos, y existen formas secundarias a sarcoidosis, amiloidosis, hemocromatosis, esclerodermia, glucogenosis, mucopolisacaridosis y en el corazón trasplantado, entre otras 52. La miocardiopatía restrictiva tiene un período silente muy prolongado, y los síntomas, disnea, edemas, ascitis y síncope aparecen cuando la afectación cardíaca es severa. El método diagnóstico fundamental es el eco-Doppler, siendo característica la dilatación auricular con ventrículos normales y función sistólica conservada. El diagnóstico diferencial debe establecerse siempre con la pericarditis constrictiva. El cateterismo cardíaco y la resonancia nuclear magnética pueden ser necesarios para diferenciar estas enfermedades. El pronóstico es muy malo, siendo la supervivencia a los 2 años del inicio de los síntomas menor del 50% 53.
El tratamiento está dirigido a aliviar los síntomas. No se ha demostrado que ninguno de ellos modifique la historia natural de la enfermedad. La base del tratamiento es el empleo de diuréticos de asa, inhibidores de la aldosterona y restricción salina. La digoxina, los IECA y los antagonistas del calcio no aportan beneficios y pueden ser contraproducentes. Se desarrollan tromboembolismos en el 20% de los casos, estando indicada la antiagregación en niños y la anticoagulación en adolescentes.
El trasplante cardíaco es la única opción aceptada en estos pacientes. En la miocardiopatía restrictiva la presión pulmonar elevada es un dato constante, y las resistencias vasculares pulmonares se elevan en los primeros 4 años del comienzo de los síntomas. Aunque muchos pacientes sobreviven entre 8 y 10 años después del diagnóstico de la enfermedad, el desarrollo de resistencias vasculares pulmonares elevadas y la irreversibilidad de la enfermedad obligan a que el trasplante se plantee de forma precoz. Se deben realizar estudios hemodinámicos cada 6-12 meses e incluir al paciente en lista de espera cuando las resistencias vasculares pulmonares 54 se sitúen entre 4 y 6 U/m 2. En los pacientes con resistencias superiores a 6 U/m 2, una opción es el trasplante heterotópico, siendo muy limitada la experiencia en pediatría, y otra alternativa es el trasplante cardiopulmonar.
Bibliografía
[1]
Bonow RO, Carabello B, De Leon AC Jr, Edmunds LH Jr, Fedderly BJ, Free MD et al..
ACC/AHA guidelines for the management of patients with valvular heart disease: executive summary. A report of the American College of Cardiology/American Heart Association Tasks Force on Practice Guidelines (Committee on management of patients with Valvular Heart Disease)..
Circulation, (1998), 981949- pp. 1984
[2]
Cathet Cardiovasc Diag 1995; 34: 23- 28.
[3]
Nugent EW, Freedom RM, Nora JJ, Ellison RC, Rowe RD, Nadas AS..
Clinical course in pulmonary stenosis..
Circulation, (1977), (SuplI) pp. 38-47
[4]
Hayes CJ, Gersony WM, Driscoll DJ, Keane JF, Kidd L, O'Fallon M et al..
Second natural history of congenital heart defects: results of treatment of patients with pulmonary valvar stenosis..
Circulation, (1993), 87(SuplI) pp. 28-37
[5]
Circulation 1994; 90: 2180-2188.
[6]
Stanger P, Cassidy SC, Girod DA, Kan JS, Lababidi Z, Shapiro SR..
Balloon pulmonary valvulopasty: results of the Valvuloplasty and Angioplasty of Congenital Anomalies Registry..
Am J Cardiol, (1990), 65 pp. 775-783
[7]
McCrindle BW..
Indepent predictors of long terme results after balloon pulmonary valvuloplasty. Valvuloplasty and Angioplasty of Congenital Anomalies (VACA) Registry Investigators..
Circulation, (1994), 89 pp. 1751-1759
[8]
Rocchini AP, Beekman RH, Ben Shachar G, Benson L, Schwartz D, Kan JS..
Balloon aortic valvuloplasty: results of the Valvuloplasty and Angioplasty of Congenital Anomalies Registry..
Am J Cardiol, (1990), 65 pp. 784-789
[9]
Wagner HR, Ellison CR, Keane JF, Humphries JO, Nadas AS..
Clinical course in aortic stenosis..
Circulation, (1977), 56(SuplI) pp. 47-54
[10]
Keane JF, Driscoll DJ, Gersony WM, Hayes CJ, Kidd L, O'Fallon WM et al..
Second natural history of congenital heart defects: results of treatment of patients with aortic valvular stenosis..
Circulation, (1993), 87(SuplI)16- pp. 27
[11]
Sudow G, Solymar L, Berggen H, Erickson B, Hocmgren D, Gilliam T..
Aortic valve replacement with a pulmonary autograft in infants with critical aortic stenosis..
J Thorac Cardiovasc Surg, (1996), 112 pp. 433-436
[12]
Rao PS, Galal O, Smith PA, Wilson AD..
Five to nine year follow-up results of balloon angioplasty of native aortic coartaction in infants and children..
J Am Coll Cardiol, (1996), 27462- pp. 470
[13]
Fletcher SE, Nihill MR, Grifka RG, O'Laughlin MP, Mullins CE..
Balloon angioplasty of native coartaction of the aorta: midterm follow-up prognostic factors..
J Am Coll Cardiol, (1995), 25 pp. 730-734
[14]
Johnson SE, Canter CE, Strauss AW, Spray TL..
Repair of coartaction of the aorta in infancy: comparison of surgical and balloon angioplasty..
Am Heart J, (1993), 125 pp. 464-468
[15]
Kappetein AP, Zwinderman AH, Bogers AJ, Rohmer J, Huysmans HA..
More than thirty-five years of coartaction repair. An unexpected relapse rate..
J Thorac Cardiovasc Surg, (1994), 107 pp. 87-95
[16]
Bulbul ZR, Bruckhimer E, Love JC, Fahey JE.T, Hellenbrand WE..
Implantation of balloon-expandable stents for coartaction of the aorta: implantation data and short-term results..
Cathet Cardiovasc Diag, (1996), 39 pp. 36-42
[17]
Ferreira SMA.G, Ho SY, Anderson RH..
Morphological study of defects of the atrial septum within the oval fossa: implications for transcatheter closure of left to right shunt..
Br Heart J, (1992), 67 pp. 316-320
[18]
Moos AJ, Siassi B..
The small atrial septal defect: operate o procrastinate?..
Am J Cardiol, (1973), 32 pp. 978-981
[19]
Patent ductus arteriosus. En: Garson A Jr, Bricker JT, Fisher DJ, Heish SR, editores. The science and practice of pediatric cardiology (2.» ed.). Baltimore: Williams & Wilkins, 1998; 1181-1199.
[20]
Defecto septal ventricular. En: Fyler DC, editor. Nadas. Cardiología Pediátrica. Madrid: Mosby España S.A., 1994: 437-460.
[21]
Frontera-Izquierdo P, Cabezuelo Huerta G..
Natural and modified history of isolated ventricular septal defect. A 17 years study..
Pediatr Cardiol, (1992), 4 pp. 193-197
[22]
Doty DB, Lamberth WC..
Repair of ventricular septal defects..
World J Surg, (1985), 9 pp. 516-541
[23]
Hanley FL, Fenton KN, Jonas RA, Mayer JE, Cook NR, Wernovsky G et al..
Surgical repair of complete atrioventricular canal defect in infancy..
J Thorac Cardiovasc Surg, (1993), 106 pp. 387-397
[24]
Tetralogy of Fallot. En: Stark J, De Leval M, editores. Surgery for congenital heart defects. Filadelfia: WB Saunders Company, 1994: 405-416.
[25]
Bertranou E, Blackstone E, Hazelring J, Turner M, Kirklin JW..
Life expectancy without surgery in tetralogy of Fallot..
Am J Cardiol, (1978), 42 pp. 458-466
[26]
Herraiz JI, Lobelo R, Bermúdez Cañete R, Acerete F, Villalba J..
Tetralogía de Fallot: Estado actual de su terapéutica..
Rev Esp Cardiol, (1996), 49 pp. 88-96
[27]
Mijboorn Z, Szatmari A, Keckers JW, Utens EMW.J, Roeland JRT.C, Boss E et al..
Cardiac status and health related quality of life in the long term after surgical repair of tetralogy of Fallot in infancy and chilhood..
J Thorac Cardiovasc Surg, (1995), 110 pp. 883-891
[28]
Mair DD, Hagler DJ, Puga FJ, Schaff HV, Danielson GK..
Fontan operation in 176 patients with tricuspid atresia: results and a proposed new index for patients selection..
Circulation, (1990), 82 pp. 164-169
[29]
Mair DD, Hagler DJ, Julsrup PR, Puga FJ, Schaff HV, Danielson GK..
Early and late results on the modified Fontan procedure for double inlet left ventricle: the Mayo Clinic experience..
J Am Coll Cardiol, (1991), 18 pp. 1727-1732
[30]
Cetta F, Feldt RH, O'Leary PW, Mair DD, Warnes CA, Driscoll DJ et al..
Improved early morbidity and mortality after Fontan operation: the Mayo Clinic experience, 1987 to 1992..
J Am Coll Cardiol, (1996), 28 pp. 480-486
[31]
Poter CJ, Garson A..
Incidence and management of dysrritmias after Fontan procedure..
Herz, (1993), 18 pp. 318-327
[32]
Mertens L, Dumouln M, Gewillig M..
Effects of percutaneous fenestration of the atrial septum on protein- loising enterophaty after the Fontan operation..
Br Heart J, (1994), 72 pp. 591-592
[33]
ACC/AHA guidelines for implantation of cardiac pacemakers and antiarrythmia devices..
A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Pacemakers Implantation)..
J Am Coll Cardiol, (1998), 31 pp. 1175-1209
[34]
Ko JK, Deal BJ, Strasburger JF, Benson DW Jr..
Supraventricular tachycardia mecanisms and their age distribution in pediatric patients..
Am J Cardiol, (1992), 691028- pp. 1032
[35]
Supraventricular tachycardia. En: Garson A Jr, Bricker JT, Fisher DJ, Neish SR, editores. The science and practique of pediatric cardiology (2.» ed.). Baltimore: Williams & Wilkins, 1998; 2059-2101.
[36]
Perry J, Fenrich A, Husle JL, Triedman JK, Friedman RA, Lamberti JJ..
Pediatric use of intravenous amioradone: efficacy and safety in critically ill patients from a multicenter protocol..
J Am Coll Cardiol, (1996), 271246- pp. 1250
[37]
Kugler JD, Danford DA, Deal J, Gillette PC, Perry JC, Silka MJ et al..
Radiofrequency catheter ablation for tachyarrhytmias in children and adolescents. The Pediatric Electrophysiology Society..
N Engl J Med, (1994), 330 pp. 1481-1487
[38]
Perry JC, Garson A Jr..
Flecainidina acetato for treatment of ta-chyarrytmias in children: review of world literature on efficacy, safety and dossing..
Am Heart J, (1992), 124 pp. 1614-1621
[39]
Guccione P, Paul T, Garson A Jr..
Long-term follow-up of amioradones therapy in the young: continued efficacy, unipaired growth, moderate side effects..
J Am Coll Cardiol, (1990), 15 pp. 1118-1124
[40]
Silka MJ, Kron J, Dunnigan A, Dick M..
Sudden death and the use of implantable cardioverter-defibrillators in pediatric patients. The Pediatric Electrophysiology Society..
Circulation, (1993), 87 pp. 800-807
[41]
Circulation 1996; 93: 841-842.
[42]
Matitiau A, Pérez-Atayde S, Sanders SP, Sluysmans T, Parness IA, Spevak PJ et al..
Infantile dilated cardiomyopathy. Relation of outcome to left ventricular mechanics, hemodynamics and histology at the time presentation..
Circulation, (1994), 90 pp. 1310-1318
[43]
Lewis AB, Chabot M..
The effect of treatment with angiotensin-converting enzyme inhibitors on survival of pediatric patients with dilated cardiomyopathy..
Pediatr Cardiol, (1993), 14 pp. 9-12
[44]
Williams MR, Quaegebeur JM, Hsu DT, Addonizio LJ, Kichuk MR, Oz MC..
Biventricular assist device as a bridge to transplantation in a pediatric patient..
Ann Thorac Surg, (1996), 62 pp. 578-580
[45]
Hosepud JD, Novick J, Breen TJ, Daily OP..
The Registry of the International Society for Heart and Lung Transplantation: eleventh official report..
J Heart Lung Transplant, (1994), 13 pp. 561-572
[46]
Robert ES..
Beta-blocker therapy in young children with congestive heart failure under consideration for heart transplantation..
Am Heart J, (1998), 136 pp. 19-21
[47]
Mason JW..
Immunopathogenesis and treatment of myocarditis: the United States Myocarditis Treatment Trial..
J Card Fail, (1996), 2(Supl4) pp. 173-177
[48]
Maisch B, Hufnagel G, Schonian U, Hengstenberg C..
The European Study of Epidemiology and Treatment of Cardiac Imfammatory Disease (ESETCID)..
Eur Heart J, (1995), 16(SuplO) pp. 173-175
[49]
Genetic factors in familial hypertrophic cardiomyopathy: does molecular cardiology offer new perspectives? Heart 1996; 76: 465-466.
[50]
Maron BJ, Tajik AJ, Ruttenberg HD, Graham TP, Atwood GP, Victorica BE et al..
Hypertrophic cardiomyopathy in infants: clinical features and natural history..
Circulation, (1982), 65 pp. 7-17
[51]
Spirito P, Seidman CE, McKena WJ, Maron BJ..
The management of hypertrophic cardiomyopathy..
N Engl J Med, (1997), 336 pp. 775-785
[52]
Huelmos A, Barba J, Martínez-Caro D..
Miocardiopatía restrictiva: concepto, clasificación y actitud clínica..
Rev Esp Cardiol, (1996), 49 pp. 523-531
[53]
Cetta F, O'Leary PW, Seward JB, Driscoll DJ..
Idiopatic restrictive cardiomyopathy in childhood: diagnostic features and clinical courses..
Mayo Clin Proc, (1995), 70 pp. 634-638