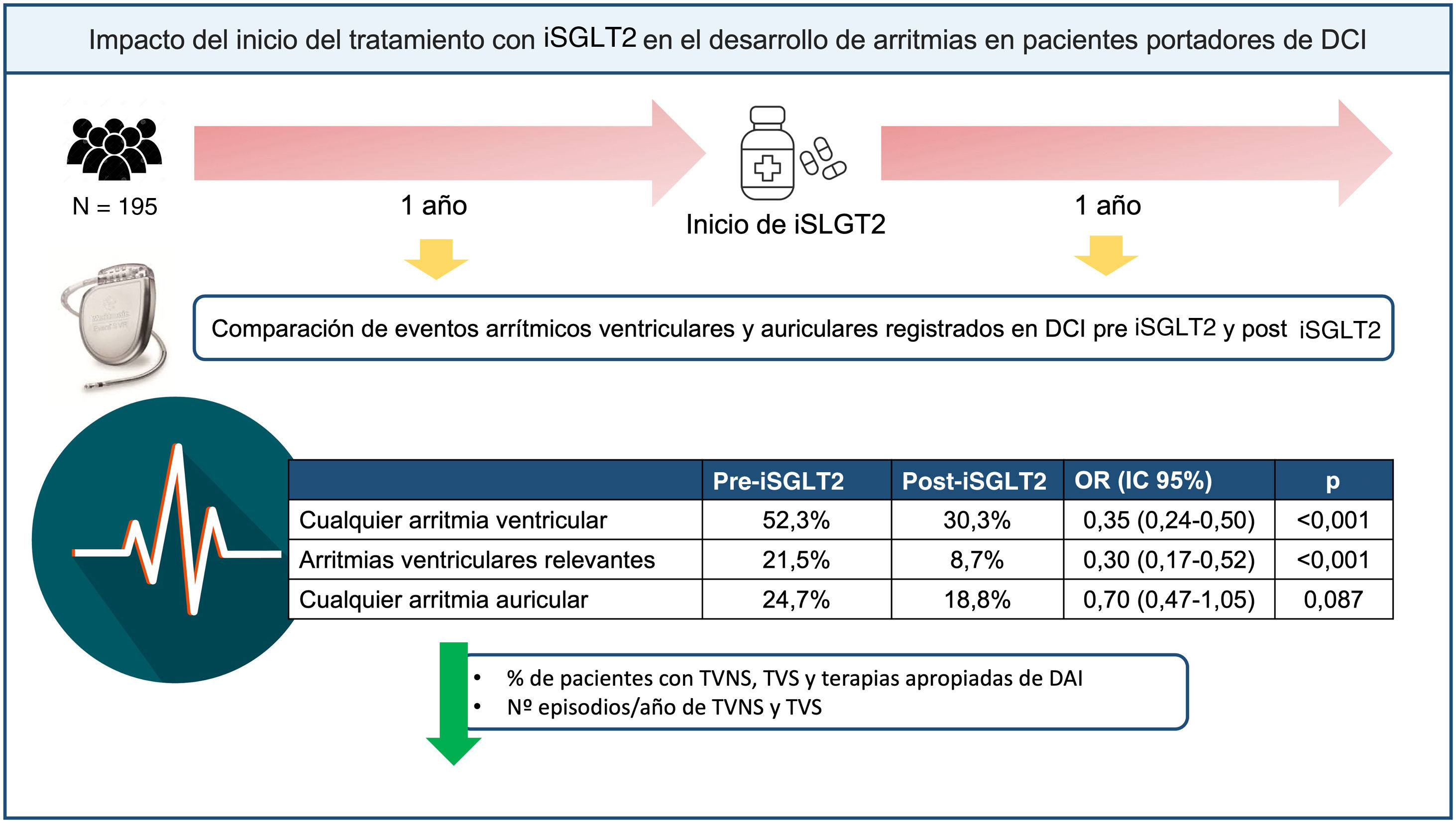
Los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) se han asociado con una mejoría pronóstica en pacientes con insuficiencia cardiaca. Sin embargo, su impacto en las arritmias auriculares (AA) y ventriculares (AV) no se conoce del todo.
MétodosEstudio retrospectivo multicéntrico que incluyó a pacientes portadores de desfibrilador automático implantable que iniciaron tratamiento con iSGLT2. Se compararon las AA y AV en 2 periodos de tiempo para cada paciente: 1 año antes y 1 año después de iniciar el iSGLT2.
ResultadosSe incluyó a 195 pacientes (media de edad, 66,8 [61,3-73,1] años; el 18,5% mujeres). Se registró una reducción en el porcentaje de pacientes con cualquier AV (antes frente a después, el 52,3 frente al 30,3%; p<0,001) y con AV clínicamente relevantes (excluida la taquicardia ventricular no sostenida) (el 21,5 frente al 8,7%; p<0,001) en el periodo post-iSGLT2. Se observó también una reducción en la incidencia del número de episodios de taquicardia ventricular no sostenida por paciente/año —antes frente a después, 2 (1-5) frente a 1 (0-2) (p<0,001)— y de taquicardia ventricular sostenida —1 (1-3) frente a 0 (0-2) (p=0,046)—. No se observaron diferencias en la prevalencia de AA (el 24,7 frente al 18,8%; p=0,117) ni en la carga de fibrilación auricular: el 0 (0-0,1) frente al 0 (0-0) (p=0,097).
ConclusionesTras el inicio del tratamiento con iSGLT2, se observó una reducción del porcentaje de pacientes con AV relevantes. Este efecto no se registró en las AA.
Palabras clave
En los últimos años, los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) han demostrado en diversos estudios una mejoría pronóstica en pacientes con insuficiencia cardiaca (IC)1–4, y son uno de los 4 pilares del tratamiento médico recomendados en la guía de práctica clínica vigente junto con los bloqueadores beta, los antagonistas de los receptores de mineralocorticoides (ARM) y los inhibidores de la neprilisina y el receptor de la angiotensina (INRA)5,6.
Diversos estudios han relacionado el uso de estos fármacos con una reducción de muertes súbitas (MS) y de las incidencias de arritmias auriculares (AA) y de fibrilación auricular (FA)7,8. Sin embargo, su impacto en los eventos arrítmicos no se conoce del todo y algunos estudios arrojan conclusiones contradictorias9,10. Esto podría deberse a que solo se reportan eventos clínicamente sintomáticos, y no los episodios arrítmicos asintomáticos pero con interés pronóstico, que únicamente podrían detectarse en los pacientes con monitorización electrocardiográfica continua. Hasta la fecha, solo un estudio observacional ha evaluado la asociación del tratamiento mediante iSGLT2 con la reducción de AA y arritmias ventriculares (AV) en pacientes portadores de dispositivos cardiacos implantables (DCI)11, y detectó una reducción de las AA, pero no de las AV. Sin embargo, los grupos no eran del todo comparables, pues los pacientes con iSGLT2 eran más jóvenes y en mayor proporción portadores de un desfibrilador automático implantable (DAI) o terapia de resincronización cardiaca (TRC). Por ello, el objetivo de este estudio es evaluar el impacto del inicio de este tratamiento en la prevalencia y la incidencia de AA y AV en una cohorte de pacientes con DAI, comparando los eventos en 2 periodos similares antes y después del inicio del fármaco.
MÉTODOSPoblaciónEstudio retrospectivo multicéntrico de 2 centros que incluyó a pacientes portadores de DAI con o sin TRC asociada y que hubieran iniciado tratamiento con iSGLT2 entre enero de 2015 y enero de 2022. Los criterios de inclusión del estudio fueron: a) indicación de tratamiento con iSGLT2 (insuficiencia cardiaca [IC] o diabetes mellitus); b) ser portador de DAI/DAI-TRC durante al menos 1 año previo a la fecha de inicio de iSGLT2, y c) seguimiento completo de al menos 1 año tras el inicio del tratamiento. Se definió la variable IC como la presencia de ingresos por IC o una clase funcional de la New York Heart Association (NYHA) >I ambulatoria en seguimiento por la unidad de IC de cada centro. Se dividió el seguimiento en 2 periodos iguales; un primer periodo de 1 año previo al inicio de iSGLT2 (pre-iSGLT2) y otro de 1 año tras el inicio (post-iSGLT2), y se compararon los eventos arrítmicos entre ambos. El estudio fue aprobado por el comité ético local de cada centro y a todos los pacientes que permanecían vivos en el momento de realizar el análisis se les entregó consentimiento informado que firmaron para dar su autorización a participar.
Recolección de eventos arrítmicosLos eventos se recogieron en consulta presencial o en un seguimiento a distancia. Analizaron todos los episodios recolectados 2 electrofisiólogos especializados en la lectura de trazados intracavitarios. Los casos en los que hubo alguna duda sobre el tipo de evento fueron analizados por los 2 electrofisiólogos para llegar a un diagnóstico final. De los pacientes con seguimiento a distancia, se recopilaron los episodios durante los 2 periodos de tiempo a través de las distintas plataformas disponibles. Del resto, se accedió a la historia clínica para recolectar los episodios. Se definió el evento taquicardia ventricular no sostenida (TVNS) como la presencia de 3 o más complejos ventriculares, y el evento taquicardia ventricular sostenida (TVS), cuando esta era >30 s o requirió una terapia del dispositivo para su finalización. Se definió el evento fibrilación ventricular (FV) como cualquier taquiarritmia ventricular a una frecuencia cardiaca >200 lpm. Si tras una terapia apropiada el episodio no finalizaba, se contaba dentro del mismo episodio. Se definió el evento terapia apropiada como la presencia de episodios de estimulación antitaquicardia (EAT) o de descarga apropiada de DAI. Se calculó la incidencia de TVNS, TVS, EAT, FV y descargas apropiada e inapropiada del DAI como el número de episodios por paciente/año. Las AV con una frecuencia cardiaca menor que la primera ventana de taquicardia programada en el dispositivo no se registraban y no se incluyeron en el análisis.
En cuanto a las AA, se recolectaron los episodios de alta frecuencia auricular y de FA de 30 s a 6 min, de 6 min a 24 h y >24 h. Se definió la variable cualquier AA como la presencia de algún episodio, independientemente de la duración. En los pacientes con dispositivo que otorgaba información sobre la carga de FA, esta se recogió. Para realizar el análisis de las AA entre los 2 periodos, se excluyó a los pacientes con FA permanente.
ObjetivosEl objetivo principal del estudio fue evaluar diferencias en el porcentaje de pacientes con AV relevantes (AVR) y con cualquier tipo de AV entre los 2 periodos. Las AVR se definieron como cualquier episodio de TVS, FV, EAT o descarga apropiada de DAI. La variable cualquier tipo de AV se definió como la presencia de AVR o TVNS. Los objetivos secundarios del estudio incluyeron las diferencias entre los porcentajes de pacientes con TVNS, TVS, FV, EAT o descarga apropiada y en las incidencias de episodios por paciente entre los 2 periodos.
En cuanto a los eventos de AA, se definió también como objetivo la diferencia en el porcentaje de pacientes con episodios de cualquier AA, así como en función de su duración. También se evaluaron diferencias en su incidencia y en la carga de FA.
Análisis estadísticoLas variables continuas se expresaron como media±desviación estándar o como mediana [intervalo intercuartílico] en función de su normalidad, que se verificó mediante la prueba de Shapiro-Wilk. Los datos categóricos se expresaron como números y porcentajes, y se compararon mediante la prueba de la χ2 o el test exacto de Fisher. Las variables continuas se compararon mediante la prueba de la t de Student o la prueba de Wilcoxon para datos apareados y las variables categóricas antes y después del inicio de iSGLT2 se compararon usando el test de McNemar. Se realizó un análisis de sensibilidad excluyendo a los pacientes con eventos en los primeros 30 días desde el inicio de iSGLT2, con el objetivo de que transcurriera cierto tiempo de inducción hasta que comenzaran a hacerse efectivos los efectos del fármaco. Para valorar la influencia del uso de iSGLT2 en la reducción de eventos arrítmicos, se realizó un modelo de regresión multivariable utilizando el método generalized estimating equations, incluyendo como variables de confusión los diferentes tratamientos concomitantes en cada periodo (inhibidores de la enzima de conversión de la angiotensina [IECA] o antagonistas del receptor de la angiotensina II [ARA-II], INRA, bloqueadores beta, ARM, amiodarona y cualquier antiarrítmico). El nivel de significación estadística se estableció con una probabilidad<0,05. Se utilizó el programa STATA vs 15.1 (STATA Corp., Estados Unidos).
RESULTADOSPoblaciónDe 442 pacientes portadores de DAI con iSGLT2, se excluyó a 247 porque no se cumplió el tiempo de seguimiento previo o posterior al tratamiento. Finalmente, se incluyó a 195 pacientes (el 18,5% mujeres; media de edad, 66,8 [61,3-73,1] años). El 43,5% de toda la cohorte tenía un diagnóstico de FA previo a la inclusión. La mayoría (89,7%) tenía diagnóstico de IC clínica, y la etiología isquémica (63%) era la más prevalente.
En cuanto al dispositivo, 132 (67,7%) pacientes eran portadores de DAI y el resto, de DAI-TRC. El 68,2% eran portadores de un dispositivo monocameral y, de los pacientes con DAI-TRC, el 74,6% tenía implantado un electrodo auricular. La indicación fue en prevención primaria en el 77,9% de los casos. El seguimiento de 157 pacientes (80,5%) se hizo con control a distancia durante los 2 periodos, mientras que el seguimiento del resto fue ambulatorio. En cuanto a la programación, el 100% de los pacientes presentaban una zona de FV (212±9,6 lpm), el 95,4% presentaba una zona de taquicardia ventricular (TV) rápida (176±7,6 lpm) y el 5,6%, una zona de TV lenta (158±30,3 lpm) (tabla 1).
Características basales de la cohorte
| Variable | Población (n=195) |
|---|---|
| Edad (años) | 66,8 [61,3-73,1] |
| Mujeres | 36 (18,5) |
| Hipertensión | 123 (63,1) |
| Dislipemia | 121 (62,1) |
| Diabetes mellitus | 54 (27,7) |
| EPOC | 14 (7,2) |
| ERC | 21 (10,8) |
| Fibrilación auricular | 85 (43,5) |
| Fibrilación auricular paroxística | 42 (21,5) |
| Fibrilación auricular persistente | 2 (1,0) |
| Fibrilación auricular permanente | 41 (21,0) |
| Insuficiencia cardiaca clínica | 175 (89,7) |
| Tipo de cardiopatía | |
| Isquémica | 109 (63,0) |
| Dilatada no isquémica | 59 (29,5) |
| Valvular | 6 (3,5) |
| Infiltrativa | 0 (0) |
| Miocardiopatía | 3 (1,7) |
| Tóxica | 3 (1,7) |
| Taquimiocardiopatía | 1 (0,6) |
| Tiempo de evolución de la IC (meses) | 53,0 [30,3-113,2] |
| FEVI (%) | 30 [25-36] |
| Tipo de FEVI | |
| FEVI >50% | 11 (5,6) |
| FEVI 40-50% | 17 (8,7) |
| FEVI<40% | 167 (85,6) |
| Tipo de dispositivo | |
| DAI | 132 (67,7) |
| DAI-TRC | 63 (32,3) |
| Tiempo desde implante de dispositivo (meses) | 19,4 [8,2-38,8] |
| Prevención primaria | 152 (77,9) |
| Prevención secundaria | 43 (22,1) |
DAI: desfibrilador automático implantable; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; TRC: terapia de resincronización cardiaca.
Los datos expresan n (%) o mediana [intervalo intercuartílico].
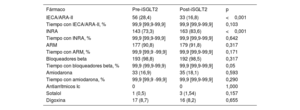
La indicación de tratamiento fue por IC en 175 (89,7%) y por diabetes mellitus en el resto; la dapaglifozina fue el iSGLT2 más usado (71,8%). Hubo un mayor porcentaje de pacientes en tratamiento con IECA/ARA-II (el 28,4 frente al 16,8%; p<0,001) y un menor porcentaje de pacientes en tratamiento con INRA (el 73,3 frente al 83,6%; p<0,001) en el primer periodo en comparación con el segundo. No hubo diferencias en el porcentaje de pacientes con tratamiento con ARM, bloqueadores beta, amiodarona, antiarrítmicos para la IC, sotalol o digoxina ni en el porcentaje de tiempo de tratamiento con cada fármaco entre ambos periodos (tabla 2).
Tratamiento médico recibido en los dos periodos
| Fármaco | Pre-iSGLT2 | Post-iSGLT2 | p |
|---|---|---|---|
| IECA/ARA-II | 56 (28,4) | 33 (16,8) | <0,001 |
| Tiempo con IECA/ARA-II, % | 99,9 [99,9-99,9] | 99,9 [99,9-99,9] | 0,103 |
| INRA | 143 (73,3) | 163 (83,6) | <0,001 |
| Tiempo con INRA, % | 99,9 [99,9-99,9] | 99,9 [99,9-99,9] | 0,642 |
| ARM | 177 (90,8) | 179 (91,8) | 0,317 |
| Tiempo con ARM, % | 99,9 [99,9 -99,9] | 99,9 [99,9-99,9] | 0,171 |
| Bloqueadores beta | 193 (98,8) | 192 (98,5) | 0,317 |
| Tiempo con bloqueadores beta, % | 99,9 (99,9-99,9) | 99,9 [99,9-99,9] | 0,05 |
| Amiodarona | 33 (16,9) | 35 (18,1) | 0,593 |
| Tiempo con amiodarona, % | 99,9 [99,9 -99,9] | 99,9 [99,9-99,9] | 0,290 |
| Antiarrítmicos Ic | 0 | 0 | 1,000 |
| Sotalol | 1 (0,5) | 3 (1,54) | 0,157 |
| Digoxina | 17 (8,7) | 16 (8,2) | 0,655 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Durante el seguimiento, a 2 pacientes (1,0%) se les realizó ablación de venas pulmonares y a 16 (8,2%), ablación de TV. Se diagnosticó FA a 12 pacientes (6,8%), 16 (8,2%) ingresaron por causa arrítmica y 24 (12,3%), por IC descompensada. Tras un periodo de seguimiento de 30,8 (26,7-37,0) meses, 8 pacientes (4,1%) murieron fuera del periodo de estudio.
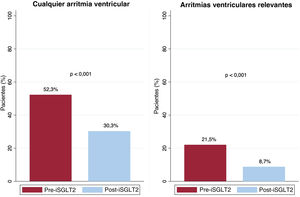
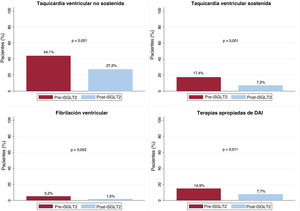
Arritmias ventricularesDel total de la cohorte, 102 pacientes (52,3%) presentaron algún tipo de AV en el periodo previo al inicio de iSGLT2 frente a 59 (30,3%) tras el inicio del fármaco (p<0,001). En cuanto al porcentaje de pacientes que sufrieron AVR, 42 (21,5%) presentaron algún episodio en el primer periodo, frente a 17 (8,7%) en el segundo (p<0,001) (figura 1). Esta reducción de las AV se debió a una reducción del porcentaje de pacientes con TVNS (el 44,1 frente al 27,2%; p<0,001), TVS (el 17,4 frente al 7,2%; p<0,001) y EAT (el 12,8 frente al 6,7%; p=0,023). Aunque se detectó una reducción en el número de pacientes con FV (el 5,2 frente al 1,5%; p=0,052) y con descarga apropiada del DAI (el 6,7 frente al 3,1%; p=0,07), esta no fue significativa. Se registró una reducción del número de pacientes con terapia apropiada del DAI en el periodo post-iSGLT2 (el 14,9 frente al 7,7%; p=0,011) (figura 2 y tabla 3). Por otra parte, en el análisis multivariado, el efecto protector de los iSGLT2 se mantuvo tanto para cualquier tipo de AV (odds ratio [OR]=0,35; intervalo de confianza del 95% [IC95%], 0,24-0,5; p<0,001) como para las AVR (OR=0,30; IC95%, 0,17-0,52; p<0,001).
Porcentajes de pacientes con taquicardia ventricular no sostenida, taquicardia ventricular sostenida, fibrilación ventricular y terapias del DAI apropiadas en los 2 periodos. DAI: desfibrilador automático implantable; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2.
Porcentajes de pacientes con eventos arrítmicos ventriculares e incidencia de estos en los 2 periodos
| Variable | Pre-iSGLT2 | Post-iSGLT2 | p |
|---|---|---|---|
| TVNS | 86 (44,1) | 53 (27,2) | <0,001 |
| Número de episodios de TVNS por paciente/año | 2 [1-5] | 1 [0-2] | <0,001 |
| TVS | 34 (17,4) | 14 (7,2) | <0,001 |
| Número de episodios de TVS por paciente/año | 1 [1-3] | 0 [0-2] | 0,046 |
| FV | 10 [5,2] | 3 [1,5] | 0,052 |
| Número de episodios de FV por paciente/año | 1 [1-1] | 0 [0-0] | 0,054 |
| EAT | 25 (12,8) | 13 (6,7) | 0,023 |
| Número de episodios de EAT por paciente/año | 1 [0-3] | 0 [0-2] | 0,045 |
| Descarga del DAI apropiada | 13 (6,7) | 6 (3,1) | 0,07 |
| Número de episodios de descarga del DAI apropiada por paciente/año | 1 [0-2] | 0 [0-1] | 0,399 |
| Terapia del DAI apropiada | 29 (14,9) | 15 (7,7) | 0,011 |
| Descarga del DAI inapropiada | 5 (2,6) | 1 (0,5) | 0,103 |
| Número de episodios de descarga del DAI inapropiada por paciente/año | 1 [0,5-1] | 0 [0-0,5] | 0,179 |
| Cualquier tipo de AV | 102 (52,3) | 59 (30,3) | <0,001 |
| AV clínicamente relevante | 42 (21,5) | 17 (8,7) | <0,001 |
AV: arritmia ventricular; DAI: desfibrilador automático implantable; EAT: estimulación antitaquicardia; FV: fibrilación ventricular; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; TVNS: taquicardia ventricular no sostenida; TVS: taquicardia ventricular sostenida.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
En el análisis de sensibilidad, excluyendo a los pacientes con eventos en los 30 días desde el inicio del fármaco, se observaron resultados similares tanto para cualquier tipo de AV (el 41,9 frente al 15,0%; p<0,001) como para las AVR (el 21,7 frente al 8,3%; p<0,001). Estos resultados se registraron tanto en los pacientes con indicación de DAI por prevención primaria (cualquier AV, el 52,0 frente al 28,9%; p<0,001; AVR, el 19,7 frente al 6,6%; p<0,001) como secundaria (cualquier AV, el 54,7 frente al 35,7%; p=0,033; AV relevantes, el 31,0 frente al 16,8%; p=0,034), así como al excluir a los pacientes sometidos a ablación de TV (AV, el 51,4 frente al 29,1%; p<0,001; AVR, el 19,0 frente al 6,2%; p<0,001). Dado el mayor número de pacientes con INRA en el periodo post-iSGLT2, se realizó un subanálisis del que se excluyó a los que iniciaron este fármaco en el segundo periodo, y se detectaron los mismos resultados (AV, el 52,6 frente al 31,4%; p<0,001; AVR, el 20,6 frente al 9,1%; p<0,001).
En cuanto a la incidencia de AV, disminuyó el número de episodios de TVNS por paciente/año en el periodo post-iSGLT2 (antes frente a después, 2 [1-5] frente a 1 [0-2]; p<0,001), así como de TVS (1 [1-3] frente a 0 [0-2]; p=0,046) y de EAT (1 [0-3] frente a 0 [0-2]; p=0,045). No hubo una reducción significativa de la incidencia de episodios de FV (1 [1-1] frente a 0 [0-0]; p=0,054) ni en el número de episodios de descargas apropiadas (1 [0-2] frente a 0 [0-1]; p=0,399) e inapropiadas (1 [0,5-1] frente a 0 [0-0,5]; p=0,179).
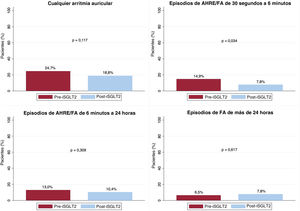
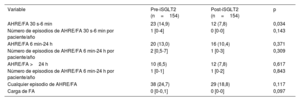
Arritmias auricularesDe los 85 pacientes (43,5%) con FA previa a la inclusión en el estudio, 42 (49,4%) tenían FA paroxística; 2 (2,4%), FA persistente y 41 (48,2%), FA permanente. Excluidos estos últimos, no se registró una disminución en el porcentaje de pacientes con AA de 6 min a 24 h (el 13,0 frente al 10,4%; p=0,371) ni de más de 24 h (el 6,5 frente al 7,9%; p=0,617). Sí se redujo el porcentaje de pacientes con episodios de 30 s a 6 min (el 14,9 frente al 7,8%; p=0,034). Entre los pacientes que presentaron algún tipo de AA, tampoco hubo diferencias en las incidencias de episodios de AA de 30 s a 6 min (p=0,143), de 6 min a 24 h (p=0,309) y de más de 24 h (p=0,843). Además, pese a observarse una reducción en el porcentaje de pacientes con AA de cualquier tipo, esta no fue estadísticamente significativa (el 24,7 frente al 18,8%; p=0,117) (figura 3). Estos resultados se mantuvieron cuando se llevó a cabo el análisis multivariado para cualquier AA, a pesar de detectarse cierto efecto protector, pero sin significación estadística (OR=0,70; IC95%, 0,47-1,05; p=0,087). Un total de 112 pacientes (57,4%) en el periodo pre-iSGLT2 y 129 (66,2%) en el periodo post-iSGLT2 tenían datos disponibles sobre la carga de FA. Cuando se analizó, no se observaron diferencias significativas entre los 2 periodos (p=0,097) (tabla 4).
Porcentajes de pacientes con eventos arrítmicos auriculares, incidencia y carga de FA excluidos los pacientes con FA permanente
| Variable | Pre-iSGLT2 (n=154) | Post-iSGLT2 (n=154) | p |
|---|---|---|---|
| AHRE/FA 30 s-6 min | 23 (14,9) | 12 (7,8) | 0,034 |
| Número de episodios de AHRE/FA 30 s-6 min por paciente/año | 1 [0-4] | 0 [0-0] | 0,143 |
| AHRE/FA 6 min-24 h | 20 (13,0) | 16 (10,4) | 0,371 |
| Número de episodios de AHRE/FA 6 min-24 h por paciente/año | 2 [0,5-7] | 1 [0-3] | 0,309 |
| AHRE/FA >24 h | 10 (6,5) | 12 (7,8) | 0,617 |
| Número de episodios de AHRE/FA 6 min-24 h por paciente/año | 1 [0-1] | 1 [0-2] | 0,843 |
| Cualquier episodio de AHRE/FA | 38 (24,7) | 29 (18,8) | 0,117 |
| Carga de FA | 0 [0-0,1] | 0 [0-0] | 0,097 |
AHRE: episodios de alta frecuencia auricular; FA: fibrilación auricular; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
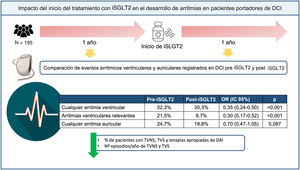
Este es el primer estudio que evalúa el impacto del inicio de tratamiento con iSGLT2 en la prevalencia y la incidencia de AA y AV en una misma cohorte de pacientes portadores de DAI a lo largo de 2 periodos de seguimiento, uno sin iSGLT2 y otro con iSGLT2. Los hallazgos principales de nuestro estudio fueron: a) tras iniciar los iSGLT2, se observó una reducción en el número de pacientes con cualquier tipo de AV y de AVR; b) esto se debió a una reducción en el número de pacientes con TVNS, TVS y terapias apropiadas del DAI, así como a una reducción en las incidencias de TVNS y TVS, y c) no hubo diferencias en el número de episodios de AA ni en la carga de FA (figura 4).
Figura central. Impacto del inicio del iSGLT2 en los eventos arrítmicos auriculares y ventriculares en pacientes portadores de DCI. DCI: dispositivo cardiaco implantable; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; OR: odds ratio; TVNS: taquicardia ventricular no sostenida; TVS: taquicardia ventricular sostenida.
Desde la irrupción de los iSGLT2, se han publicado subestudios que han asociado su uso con una reducción en la incidencia de FA y de AA12,13. En un metanálisis de 34 estudios aleatorizados que englobó a más de 60.000 pacientes diabéticos, los iSGLT2 se asociaron con una reducción del 19% en la incidencia de AA7. Otro metanálisis que incluyó a pacientes con IC encontró una reducción del 25% en el riesgo de sufrir eventos de FA, tanto en pacientes con FA como sin FA previa14. Sin embargo, otros estudios han mostrado resultados contradictorios. En un estudio sobre diabéticos de la práctica clínica, aunque el tratamiento con iSGLT2 se asoció con una reducción de arritmias de nueva aparición, esta no fue significativa cuando se evaluaron los eventos de FA y de arritmias supraventriculares por separado15. En esta misma línea, en el metanálisis más reciente de pacientes con IC, el tratamiento con iSGLT2 no se asoció con una reducción del riesgo de AA8. Sin embargo, una de las principales limitaciones de estos estudios es que solo reportan AA clínicamente relevantes, y se desconoce la carga arrítmica. En el único estudio publicado hasta la fecha que evaluó los eventos en pacientes portadores de DCI, Younis et al. valoraron en retrospectiva el efecto de los iSGLT2 en la carga de AA11. Su uso se asoció de manera independiente con un 15% de reducción en el riesgo de AA y una reducción en el número de eventos al año. Sin embargo, tal como reflejan los autores, a pesar de que estos resultados se ajustaron por edad, los pacientes en tratamiento con iSGLT2 eran más jóvenes, por lo cual se requiere que estas conclusiones se validen en estudios prospectivos. En nuestro estudio, peses a encontrarse una reducción en el número de pacientes con AA entre los 2 periodos, esta no fue estadísticamente significativa (el 24,7 frente al 18,8%; p=0,117). Por otra parte, tampoco se encontró una reducción significativa en la carga de FA ni en la incidencia de episodios de AA pese a observarse una tendencia protectora a favor de los iSGLT2 (OR=0,70; IC95%, 0,47-1,05; p=0,087). Esta ausencia de beneficio podría explicarse por el corto periodo de seguimiento en nuestra cohorte y el escaso número de pacientes con electrodo auricular implantado, lo cual podría haber limitado la monitorización de estos eventos.
En cuanto al efecto en las AV, existen estudios que han relacionado estos fármacos con una reducción de las MS7. Un estudio de más de 150.000 pacientes detectó una reducción en el riesgo de MS respecto a otros antidiabéticos, aunque no fue significativa16. Otro metanálisis de 19 estudios aleatorizados tampoco encontró una asociación con un menor riesgo de AV9. Sin embargo, en otro metanálisis de 22 estudios con más de 50.000 pacientes, sí se detectó una reducción del riesgo de TV, pero no de parada cardiaca10. Estas discrepancias podrían deberse a la heterogeneidad de los estudios incluidos, así como al bajo número de AV registradas. Por otra parte, un subanálisis del estudio DAPA-HF describió una asociación entre el tratamiento con dapaglifozina y un menor riesgo del evento combinado de AV importante, parada cardiaca y MS17. Sin embargo, este efecto no se halló en los pacientes portadores de un DCI ni al evaluar las AV por separado. En esta línea, en un metanálisis reciente, Oates et al. describieron una reducción del riesgo de MS, pero no de AV sostenidas8.
Sin embargo, al igual que al evaluar las AA, estos estudios solo reportan AV clínicamente relevantes y no las asintomáticas. En nuestro estudio, la reducción de AV se debió a la reducción del porcentaje de pacientes con TVNS y de TVS y de su incidencia. Estos eventos normalmente cursan asintomáticos, sobre todo si se tratan de modo eficaz con EAT; sin embargo, su aparición y su carga están asociadas con un peor pronóstico18. Por otra parte, y al contrario de lo observado en nuestra cohorte, en el estudio de Younis et al., pese a registrarse con este fármaco una reducción de la mortalidad y el riesgo de AA, no se detectó una reducción del riesgo de AV. Estas discrepancias podrían deberse a un mayor porcentaje de pacientes con DAI en nuestra cohorte, con mayor riesgo arrítmico, hecho que se refleja en el alto porcentaje de eventos registrados en comparación con ese estudio.
Desde el punto de vista fisiopatológico, recientemente se han descrito algunos mecanismos de los iSGLT2 que podrían conferirles propiedades antiarrítmicas. Por una parte, se ha descrito su papel como inhibidores de las corrientes de Ca2+, al reducir la actividad de la cinasa II Ca2+/dependiente de calmodulina, que disminuye la liberación de Ca2+ del retículo sarcoplásmico y reduce así la arritmogénesis por despolarizaciones tardías19. También se ha estudiado la inhibición de las corrientes de sodio tardías en modelos murinos20. Además, se han asociado con un remodelado inverso y una disminución de la fibrosis intersticial relacionada con fenómenos de microrreentrada y macrorreentrada21,22. Gracias a este efecto, así como por su efecto diurético, reducirían las presiones intracavitarias, con lo que disminuiría el estrés parietal relacionado con la génesis de eventos arrítmicos23. Por último, podrían tener un posible efecto modulador del sistema nervioso autónomo en pacientes con IC24. Estudios preclínicos en ratones han detectado un posible efecto inhibitorio del sistema nervioso simpático al observarse una reducción de las concentraciones renal de tirosina hidroxilasa y renal y cardiaca de norepinefrina25. Además, en el ensayo EMBODY, que aleatorizó a empaglifozina o placebo a 105 pacientes diabéticos tras un infarto agudo de miocardio26, hubo una mejoría de la actividad del sistema nervioso autónomo al observarse una mayor variabilidad de la FC con iSGLT2, reflejo de un mayor balance parasimpático.
A pesar de lo descrito, existen todavía muchas incógnitas sobre el efecto de estos fármacos en los eventos arrítmicos. Sin embargo, actualmente están en marcha varios estudios aleatorizados, como el ERASe (NCT04600921)27 o el DAPA-AF (NCT04792190)28, que evaluarán el impacto de la ertuglifozina y la dapaglifozina en los eventos arrítmicos en pacientes con DCI.
LimitacionesNuestro estudio presenta algunas limitaciones debidas a su diseño y a su carácter retrospectivo. Una de las principales es inherente al sesgo de selección producido al excluir a los pacientes con menos de 1 año de seguimiento, ya que se excluyó a los que fallecieron durante ese periodo. Por esta razón, las conclusiones de este estudio no se pueden generalizar a pacientes con una clase funcional más avanzada o que fallecen al poco tiempo de iniciar el tratamiento. Por otra parte, al irse aplicando las recomendaciones de la última guía de práctica clínica, en el segundo periodo se registró un aumento de la proporción de pacientes con INRA, un fármaco que se ha asociado con una reducción de eventos arrítmicos29. Sin embargo, el subanálisis que excluyó a los pacientes que cambiaron de tratamiento arrojó las mismas conclusiones, pese a que disminuyó el tamaño muestral. Por otra parte, en cuanto al tratamiento para la IC, este se definió de forma categórica y no tuvo en cuenta el ajuste de dosis, por lo que no se pudo evaluar el impacto de la dosis completa en los resultados. Además, se registró la fracción de eyección del ventrículo izquierdo en el momento de inclusión en el estudio, y no se pudo extraer conclusiones sobre los cambios dinámicos durante este periodo. Por otra parte, el 19,5% de la cohorte no tuvo un seguimiento a distancia completo y podría haber una pérdida de información de estos pacientes; sin embargo, la recogida de datos en consulta fue muy exhaustiva y solo el 9,7% no tuvo seguimiento a distancia en ninguno de los periodos. Además, no se realizó un análisis segregado por sexos debido al bajo porcentaje (18,5%) de mujeres incluidas en el estudio. Por último, el seguimiento tras el inicio del fármaco solo corresponde a 1 año, por lo que no se pueden establecer conclusiones para periodos más largos.
CONCLUSIONESEn conclusión, en nuestra cohorte, el inicio de iSGLT2 en pacientes portadores de DAI o DAI-TRC se asoció con una reducción de las AV y las AVR en comparación con igual periodo previo al tratamiento. Esta reducción se debió a una reducción del porcentaje de pacientes con TVNS, TVS y terapias del DAI apropiadas y a las incidencias de TVNS y TVS. El inicio de iSGLT2 no se acompañó de una reducción de AA en nuestro estudio. Sin embargo, es necesario llevar a cabo estudios aleatorizados prospectivos que sustenten estas conclusiones.
- -
Existen estudios observacionales que han relacionado el uso de iSGLT2 con una menor incidencia de fibrilación auricular y muerte súbita.
- -
Los iSGLT2 podrían tener cierto efecto antiarrítmico y podrían disminuir el riesgo de arritmias ventriculares relevantes en pacientes portadores de dispositivos cardiacos implantables.
Ninguna.
CONSIDERACIONES ÉTICASEl estudio fue aprobado por el comité ético local de cada centro y todos los pacientes que permanecían vivos en el momento del análisis firmaron el consentimiento informado para dar su autorización para participar.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALLos autores de este manuscrito declaran no haber utilizado ninguna herramienta de inteligencia artificial para la elaboración de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORESC. Minguito-Carazo, E. Sánchez Muñoz, M. Rodríguez Mañero, J.L. Martínez-Sande, M.L. Fidalgo Andrés, J. García Seara, J.M. González Rebollo, M. Rodríguez Santamarta, L. González Melchor, T. González Ferrero, L. Romero Roche, J.A. Fernández López y E. Tundidor Sanz contribuyeron en la recogida de datos.
C. Minguito-Carazo y E. Sánchez Muñoz contribuyeron en el análisis estadístico.
C. Minguito-Carazo y E. Sánchez Muñoz contribuyeron en la redacción del manuscrito.
C. Minguito-Carazo, E. Sánchez Muñoz, M. Rodríguez Mañero, J.L. Martínez-Sande, M.L. Fidalgo Andrés, J. García Seara, J.M. González Rebollo, M. Rodríguez Santamarta, L. González Melchor, T. González Ferrero, L. Romero Roche, J.A. Fernández López, E. Tundidor Sanz, F. Fernández Vázquez y J.R. González-Juanatey contribuyeron en la revisión del manuscrito.
CONFLICTO DE INTERESESSin conflictos de intereses.
Los autores agradecen el esfuerzo de la enfermería encargada de la recopilación de los eventos arrítmicos en consulta de dispositivos a distancia.