Palabras clave
INTRODUCCIÓN
La estenosis valvular aórtica es la lesión valvular más frecuente en Europa y el pronóstico con tratamiento médico es muy desfavorable1. La sustitución valvular aórtica quirúrgica es el tratamiento de elección en pacientes con estenosis aórtica severa. Mediante este procedimiento, en la mayoría de los pacientes se consigue el alivio de los síntomas y un aumento de la supervivencia. Sin embargo, debido a que la etiología más frecuente de la estenosis aórtica en los países occidentales es la degenerativa, la edad de los pacientes es avanzada (en adultos de 75 o más años, se halla estenosis aórtica en el 4,6% de los casos)2, por lo que con frecuencia los pacientes tienen comorbilidades que incrementan el riesgo quirúrgico y la morbilidad postoperatoria. En pacientes en alto riesgo con disfunción ventricular izquierda, enfermedad coronaria concomitante, cirugía de revascularización coronaria previa, enfermedad pulmonar obstructiva crónica y/o edad avanzada, la mortalidad de la sustitución valvular aórtica quirúrgica aumenta de forma significativa2-4. Por otra parte, según los datos de Euro Heart Survey, se rechazó para cirugía hasta un tercio de los pacientes con estenosis aórtica por presentar excesivas comorbilidades asociadas o expectativa de vida corta5. Por todo ello, se han diseñado prótesis valvulares aórticas implantables a través de catéteres que constituyen actualmente una alternativa terapéutica para los pacientes con estenosis aórtica severa rechazados para cirugía por alto riesgo quirúrgico6-12.
El objetivo de este estudio es presentar la experiencia inicial en tres centros españoles del implante percutáneo de la prótesis valvular aórtica percutánea autoexpandible CoreValve®. Analizamos los resultados hospitalarios y el seguimiento a medio plazo.
MÉTODOS
Diseño
Estudio multicéntrico prospectivo.
Población de estudio
Tras ser evaluado cada caso por un equipo multidisciplinario (cardiólogos clínicos, intervencionistas y cirujanos cardiacos), se incluyó en el estudio a un total de 108 pacientes (43 en Málaga, 34 en Córdoba y 31 en Asturias) con estenosis aórtica severa sintomática de alto riesgo quirúrgico (n = 44) o que rechazaron la intervención quirúrgica (n = 64). Para valorar la idoneidad de los pacientes, se realizaron las siguientes exploraciones antes del procedimiento: coronariografía, aortografía con inyecciones en el territorio iliofemoral, ecocardiograma transtorácico y/o transesofágico (si el estudio transtorácico no era concluyente) y en algunos casos tomografía computarizada (TC) con inyección de contraste. El riesgo quirúrgico se calculó con el EuroSCORE logístico13.
Los criterios de inclusión fueron: pacientes con estenosis aórtica severa sintomática con un área < 1 cm2; diámetro del anillo aórtico medido por ecocardiograma transtorácico y/o transesofágico ≥ 20 y ≤ 27 mm, y diámetro de la aorta ascendente a nivel de la unión sinotubular ≤ 40 (prótesis pequeña) o ≤ 43 mm (prótesis grande). Los criterios de exclusión fueron: hipersensibilidad o contraindicación a la administración de alguna de las medicaciones necesarias durante el procedimiento; infarto de miocardio en los 30 días anteriores al procedimiento; angioplastia coronaria en los 15 días anteriores al procedimiento o programada durante el mes posterior al procedimiento; presencia de trombos en cavidades izquierdas; fracción de eyección < 20%; accidente cerebrovascular reciente; sepsis o endocarditis; aneurismas de aorta; coagulopatía o diátesis hemorrágica, e insuficiencia mitral severa con inversión del flujo de las venas pulmonares.
Descripción del dispositivo
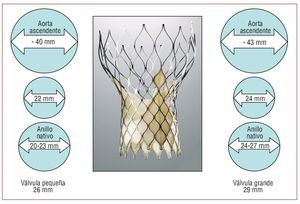
El dispositivo (CoreValve ReValving System®) consta de tres elementos: a) prótesis aórtica trivalva, de pericardio porcino, que va montada sobre un stent autoexpandible de nitinol —existen dos tamaños de válvulas (fig. 1), uno para anillos aórticos comprendidos entre 20 y 23 mm (prótesis pequeña, mide 26 mm en la porción insertada en el anillo nativo) y otra para anillos de 24-27 mm (prótesis grande, mide 29 mm en la porción insertada en el anillo nativo)—; b) catéter liberador de 18 Fr, y c) dispositivo de carga.
Fig. 1. Características de las dos válvulas CoreValve® disponibles: la válvula pequeña mide 26 mm en la porción que se inserta en el anillo del paciente, para aortas ascendentes ≤ 40 mm y anillos de 20-23 mm, y la válvula grande mide 29 mm en la porción que se inserta en el anillo del paciente, para aortas ascendentes ≤ 43 mm y anillos de 24-27 mm.
Procedimiento
Teniendo en cuenta el periodo de aprendizaje del implante de la válvula (todos los procedimientos son tutelados) y que inicialmente la disponibilidad de los profesionales que tutelaban los procedimientos era muy limitada, a 7 pacientes que se encontraban en estado crítico se les realizó valvuloplastia aórtica como puente al implante de la válvula.
El implante de las válvulas se llevó a cabo en todos los casos en el laboratorio de hemodinámica mediante anestesia general (58 pacientes) o local en combinación con sedación profunda (50 pacientes). Se realizó profilaxis antibiótica con cefalosporinas o vancomicina en caso de alergia a los betalactámicos.
El acceso vascular se realizó por vía femoral; el procedimiento se realizó de forma completamente percutánea en la gran mayoría de los casos y en una minoría por vía subclavia (4 por izquierda y 1 por derecha) mediante cirugía abierta (en casos de excesiva calcificación, tortuosidad o aterosclerosis del territorio iliofemoral o diámetro de las arterias iliacas/femorales < 6 mm).
Tras el implante de un catéter de marcapasos por vía yugular derecha, se punciona la arteria femoral a través de la cual se va a implantar la válvula y se coloca un dispositivo de cierre vascular (PROSTAR XL®). Dicha punción se realiza mediante fluoroscopia, y se inyecta contraste a través de un catéter introducido por la arteria femoral contralateral.
A continuación, en los casos en que no se ha realizado valvuloplastia aórtica en el mes anterior al procedimiento (101 pacientes), se realiza valvuloplastia aórtica con sobrestimulación simultánea a una frecuencia de 180 lat/min para evitar el desplazamiento del balón. Se utilizaron balones de 22 mm (casos de implante de válvula pequeña) o de 25 mm (casos de implante de válvula grande). A continuación se libera el dispositivo de forma retrógrada con guía por fluoroscopia y aortografías. Tras el implante se mide el gradiente entre ventrículo izquierdo y aorta y se valora la presencia de insuficiencia aórtica residual. En casos de insuficiencia aórtica de grado angiográfico > 2, se realiza posdilatación y/o tracción de la válvula. El procedimiento se finaliza mediante cierre percutáneo de ambas arterias femorales. Con el PROSTAR XL® implantado previamente, se cierra la arteria femoral a través de la cual se ha implantado el dispositivo y mediante PERCLOSE® o ANGIOSEAL® se cierra la arteria femoral contralateral. Cuando el acceso es subclavio, se realiza exposición quirúrgica de la arteria, seguida de punción según técnica de Seldinger, y se realiza el procedimiento de forma idéntica al acceso femoral. Finalmente el cierre de la arteria es quirúrgico.
Medicación antiplaquetaria y antitrombótica
De no haber contraindicación, se administró a todos los pacientes 100 mg de aspirina antes del procedimiento e indefinidamente después. Además, los pacientes recibieron 300 mg de carga de clopidogrel (administrada días antes del procedimiento) y posteriormente 75 mg durante al menos 3 meses. Durante el procedimiento se administró heparina sódica ajustada al peso (80-100 U/kg).
Cuidados tras el procedimiento
Tras el procedimiento, los pacientes permanecieron ingresados con monitorización continua en una unidad de críticos durante 48 h. A las 48 h del procedimiento se los trasladaba a la planta y se retiraba el marcapasos transitorio. Si durante ese periodo se registraba algún episodio de bloqueo auriculoventricular (BAV), se implantaba un marcapasos definitivo.
Seguimiento
Todos los pacientes fueron seguidos al cabo de 30 días y posteriormente cada 6 meses. La mediana de seguimiento fue de 7,6 meses.
Definiciones
Éxito del procedimiento: implantación correcta y normofuncionante de la prótesis (valorado por angiografía y ecocardiograma), en ausencia de mortalidad durante el procedimiento. Complicaciones vasculares: disección aórtica, fallo del dispositivo de cierre percutáneo, rotura iliaca o femoral, hemorragia que requiera cirugía y/o trasfusión de hematíes. Mortalidad al mes: muerte por cualquier causa ocurrida en el hospital o durante el mes posterior al procedimiento. Mortalidad a partir del primer mes: muerte por cualquier causa ocurrida a partir del primer mes del procedimiento. Mortalidad total: es la suma de ambas mortalidades.
Análisis estadístico
Los datos se expresan como media ± desviación estándar en el caso de variables continuas y como número (porcentaje) en caso de variables categóricas. Se realizó un análisis estadístico descriptivo básico y un estudio de supervivencia mediante un análisis de Kaplan-Meier. Los datos se analizaron con el programa estadístico SPSS versión 16 (Chicago, Illinois).
RESULTADOS
Características de la población
Entre diciembre de 2007 y julio de 2009, se incluyó en el estudio a 108 pacientes (49 varones; media de edad, 78,6 [intervalo, 50-92] años). Las características basales de la población se recogen en la tabla 1. Todos los pacientes tenían una estenosis valvular aórtica severa sintomática con gradiente transaórtico ecocardiográfico sistólico de 83,8 (34-163) mmHg y medio de 55 (20-93) mmHg. El área valvular aórtica media, calculada por ecocardiograma antes del procedimiento fue de 0,63 ± 0,2 cm2. La media del EuroSCORE logístico fue del 16% ± 13,9% (intervalo, 2,27%-86,4%). El 21,3% de los pacientes tenían un EuroSCORE logístico ≥ 20%. El 58,4% de los pacientes se encontraban en clases funcionales de la NYHA III o IV.
Datos del procedimiento
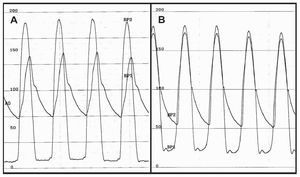
Se realizó valvuloplastia aórtica previa al procedimiento a 7 pacientes (6,5%). En el 95,4% de los casos, el acceso vascular utilizado fue la arteria femoral. En 64 casos (59,3%) se implantó una válvula pequeña. El procedimiento se finalizó con éxito en 106 casos (98,1%) (tabla 2). De los 2 casos fallidos, en uno fue necesario implantar una segunda válvula sobre la primera durante el mismo procedimiento, debido a un implante bajo de la primera que dejaba insuficiencia aórtica severa; se obtuvo un buen resultado tras el implante de la segunda válvula. En el otro caso se produjo una rotura del anillo aórtico tras la valvuloplastia. Se realizó posdilatación de la válvula en 25 casos (23,1%). Ningún paciente presentó insuficiencia aórtica angiográfica residual superior a grado 2. El gradiente hemodinámico pico-pico tras el procedimiento fue de 2,4 ± 4,2 mmHg (fig. 2). El gradiente transaórtico máximo instantáneo medido por ecocardiograma fue de 12,6 ± 6 mmHg. El cierre percutáneo del acceso vascular se realizó con éxito en 100 de los 103 casos en que se realizó abordaje femoral (97,1%).
Fig. 2. Gradientes de presión intraventricular e intraaórtica antes (A) y después (B) del implante de la prótesis aórtica. En el panel B se aprecia la existencia de un mínimo gradiente aórtico residual.
Complicaciones del procedimiento
Las complicaciones derivadas del procedimiento se muestran en la tabla 2. Las complicaciones vasculares se presentaron en 6 pacientes (5,6%), de los que 2 tenían un EuroSCORE logístico > 20%; se tuvo que intervenir de urgencia a 3 pacientes, 2 por fallo del dispositivo de cierre percutáneo y 1 por una rotura iliaca; 1 falleció en situación de shock séptico al tratarse de una paciente inmunodeficiente con una agammaglobulinemia común. Una paciente presentó un seudoaneurisma femoral que se resolvió con inyección de trombina y compresión local. En un caso se produjo una disección de aorta ascendente a nivel del seno de valsalva causada por el dilatador de una vaina larga, que se resolvió al implantar la válvula. Un paciente presentó un hematoma importante con anemización que requirió transfusión sanguínea. En cuanto a las complicaciones no vasculares, 3 pacientes presentaron taponamiento cardiaco, 1 debido a perforación de la guía rígida preformada, 1 por perforación del marcapasos transitorio implantado durante el procedimiento y 1 por rotura del anillo aórtico tras la realización de la valvuloplastia aórtica. Un paciente con cirugía de revascularización coronaria previa, con un puente permeable de arteria mamaria interna izquierda a descendente anterior, presentó un infarto de miocardio debido a disección de la arteria mamaria durante el procedimiento (realizado por vía subclavia izquierda), que se trató con éxito implantando un stent. En otro caso, al implantar la válvula aórtica, se produjo una obstrucción dinámica al flujo en el tracto de salida del ventrículo izquierdo por movimiento sistólico anterior de la válvula mitral, acompañado de insuficiencia mitral severa, que se resolvió con tratamiento con bloqueadores beta intravenosos. Debido a la presencia de BAV, fue necesario implantar un marcapasos definitivo a 38 pacientes (35,2%).
Seguimiento al mes
Durante el periodo hospitalario fallecieron 8 pacientes (7,4%) (tabla 3). El EuroSCORE logístico de estos pacientes era de 23% ± 26,6% (7%-86,4%). De los 8 pacientes fallecidos, 2 tenían un EuroSCORE logístico > 20%. Tres pacientes fallecieron por insuficiencia aórtica moderada-severa residual. En 2 de ellos se realizó conversión a cirugía cardiaca (no urgente); fallecieron ambos, uno en situación de shock cardiogénico a los 11 días del procedimiento y otro debido a una hemorragia masiva retroperitoneal a los 10 días de la cirugía. Las causas de muerte de los otros 5 pacientes que fallecieron fueron: perforación del ventrículo izquierdo por la guía rígida preformada, taponamiento pericárdico tras la valvuloplastia, shock cardiogénico en una paciente con disfunción diastólica severa y válvula normofuncionante, shock séptico en paciente inmunodeficiente e imposibilidad de extubación en paciente anciana.
Seguimiento a partir del primer mes
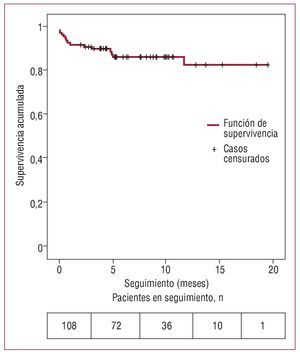
A partir del primer mes de seguimiento, fallecieron 7 pacientes (6,5%) (tabla 3), con EuroSCORE del 12,6% ± 4,9% (6,8%-18,6%). A partir del primer mes de seguimiento, 6 pacientes fallecieron por causas no cardiológicas (fallo multiorgánico tras radioterapia por carcinoma espinocelular, encefalopatía hipercápnica en paciente con enfermedad pulmonar obstructiva crónica severa, encefalopatía hipercápnica en paciente con fibrosis pulmonar, tromboembolia pulmonar, accidente cerebrovascular, pancreatitis aguda) y otro falleció a los 3 meses del procedimiento por muerte súbita. La supervivencia total estimada al año por el método de Kaplan-Meier fue del 82,3% (fig. 3). La me-diana de seguimiento es de 7,6 meses.
Fig. 3. Estimación de la supervivencia al año de la población estudiada (n = 108) mediante el análisis de supervivencia de Kaplan-Meier.
DISCUSIÓN
Los resultados de nuestro estudio confirman los datos publicados previamente, en los que se demuestra que el implante de la válvula aórtica percutánea CoreValve® en pacientes con estenosis aórtica severa es posible y con una alta tasa de éxito7. En 1 paciente fue necesario implantar una segunda válvula de forma inmediata, debido a un implante bajo con insuficiencia aórtica severa, con buen resultado final. En otro paciente se produjo una rotura del anillo aórtico tras la valvuloplastia. Esta tasa de éxito en el implante (106/108; 98,1%) es superior a la publicada por Grube et al7 (88%) y similar a la de Piazza et al14 (97%).
La mortalidad hospitalaria fue del 7,4%, inferior a la resultante de aplicar el algoritmo del EuroSCORE (media, 16%)13,15. La comparación de mortalidad con el EuroSCORE debe hacerse con cautela, ya que existen estudios que demuestran que este modelo predictivo puede sobrestimar la mortalidad de estos pacientes16-19.
A pesar de estos resultados alentadores, llama la atención la alta tasa de complicaciones agudas derivadas del procedimiento, a expensas de taponamiento cardiaco y de las complicaciones vasculares. En cuanto a la prevención del taponamiento cardiaco, consideramos un factor muy importante el correcto preformado de la guía rígida, así como la visión continua del borde distal de ésta mediante control fluoroscópico para detectar rápidamente desplazamientos, que conllevan riesgo de perforación. En este sentido también es muy importante el uso de marcapasos endocavitarios de bajo calibre (4 Fr) y su correcto y cuidadoso posicionamiento. Las complicaciones vasculares tienen una alta mortalidad, por lo que la manipulación cuidadosa del dispositivo y una correcta selección de los pacientes son extremadamente importantes para evitar roturas arteriales y sangrados. Por todo ello, creemos que son muy importantes los cuidados tras el procedimiento en una unidad de críticos para realizar una vigilancia estrecha y detectar y tratar rápidamente las posibles complicaciones.
La tasa de marcapasos implantados tras los procedimientos en nuestra serie (35,2%) concuerda con los últimos datos publicados por Grube et al20 y es alta comparada con las primeras series publicadas14. En 136 pacientes tratados con las tres generaciones de la válvula CoreValve®, se implantó un marcapasos definitivo al 33,3% de los pacientes tratados con la válvula de tercera generación20; sin embargo, en 646 pacientes con estenosis aórtica a los que se implantó la válvula CoreValve®, los marcapasos definitivos implantados fueron el 9,3%14. Ambos porcentajes son superiores a los publicados en series quirúrgicas, que rondan un 6-6,5%21-23. Las diferencias encontradas entre ambos estudios en cuanto a la tasa de implante de marcapasos se justifica por el hecho de que se siguieron distintos criterios para implantar un marcapasos definitivo. Esta alta tasa de implantes puede deberse a que muchas indicaciones sean profilácticas, ya que nos encontramos ante un nuevo tipo de paciente en el que no sabemos cómo van a evolucionar ciertos trastornos electrocardiográficos de nueva aparición como bradicardias o bloqueos de rama izquierda. En nuestra serie, un paciente que tras el implante de la válvula desarrolló un bloqueo de rama izquierda (anchura del QRS, 180 ms) falleció de forma súbita durante el seguimiento. Se necesitan estudios específicos sobre estos aspectos para establecer las indicaciones de implante de marcapasos definitivo en estos pacientes.
En cuanto a la mortalidad al mes del procedimiento (8 pacientes; 7,4%), el 60% de las muertes se produjeron entre los primeros pacientes incluidos en el estudio. Este dato demuestra nuevamente la importancia de la curva de aprendizaje del procedimiento y la concentración de la mortalidad en ese periodo, aspecto ya observado previamente por otros autores7. Webb et al9 demostraron con la válvula de Cribier-Edwards que la acumulación de experiencia aumenta la tasa de éxito del procedimiento, ya que la tasa de éxito de los primeros 25 pacientes tratados fue del 76% y aumentó hasta el 96% en los 25 siguientes pacientes. Al comparar la mortalidad a los 30 días de uno y otro grupo, también se observó una diferencia importante (el 16 frente al 8%).
Desde el punto de vista del procedimiento y al comparar con la válvula aórtica de Edwards-Sapien®, la prótesis CoreValve® presenta ciertas ventajas24. Se implanta (tanto la de 26 como la de 29 mm) a través de un introductor 18 Fr, mientras que la de Edwards-Sapien® se implanta a través de introductores de 22 Fr (la de 23 mm) y de 24 Fr (la de 26 mm). Este aspecto es importante, dado que las complicaciones vasculares representan un porcentaje muy importante de la morbimortalidad del procedimiento. Por otra parte, para el implante de la válvula de Edwards-Sapien® es necesaria la sobrestimulación con marcapasos a alta frecuencia, mientras que con la de CoreValve® no lo es.
La medición de presiones y gradientes hemodinámicos tras el procedimiento demuestra la eficacia de esta nueva técnica. Nada más implantar la válvula, los gradientes transvalvulares aórticos bajan de forma notable, habitualmente junto con insuficiencia aórtica de grado, en general, no severo. No obstante, los datos de nuestro estudio muestran que fue necesario posdilatar la válvula por la presencia de insuficiencia aórtica > 2 en el 23,1% de los casos, dato que es similar a los de las series previas7,14. Las consecuencias de esta posdilatación y su efecto en la estructura de la válvula a largo plazo serán objeto de estudio en futuros ensayos clínicos con seguimiento a largo plazo.
Limitaciones
En este estudio multicéntrico analizamos los resultados del implante de la válvula aórtica CoreValve® en un pequeño número de pacientes y con un periodo de seguimiento corto (mediana de seguimiento, 7,6 meses), todo ello sin comparar con un grupo control. La supervivencia al año demostrada en nuestro estudio debe interpretarse con cautela, ya que disponemos de un periodo de seguimiento de más de 1 año en 22 pacientes (fig. 3). Consideramos que para evaluar la eficacia del dispositivo son necesarios estudios con mayor tamaño muestral y con un seguimiento no inferior a 5 años.
CONCLUSIONES
Nuestra experiencia inicial indica que la sustitución valvular aórtica percutánea es una opción terapéutica segura y factible para los pacientes con estenosis aórtica severa de alto riesgo quirúrgico.
ABREVIATURAS
ACTP: angioplastia coronaria transluminal percutánea.
EuroSCORE: European System for Cardiac Operative Risk Evaluation.
IA: insuficiencia aórtica.
IAM: infarto agudo de miocardio.
IMC: índice de masa corporal.
NYHA: clase funcional de la New York Heart Association.
Full English text available from: www.revespcardiol.org
VÉASEEDITORIALENPÁGS. 131-3
Correspondencia: Dr. C. Morís de la Tassa.
Área del Corazón. Hospital Universitario Central de Asturias. Celestino Villamil, s/n. 33006 Oviedo. Asturias. España.
Correo electrónico: cesarmoris@gmail.com
Recibido el 25 de marzo de 2009.
Aceptado para su publicación el 7 de agosto de 2009.