La hospitalización por insuficiencia cardiaca (HoIC) es frecuente en el paciente con fibrilación auricular (FA) y asocia una mayor mortalidad. Los objetivos fueron estimar la incidencia de HoIC, identificar los predictores de su aparición y el desarrollo de una nueva escala de riesgo.
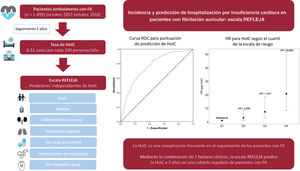
MétodosCon los datos del registro prospectivo unicéntrico REFLEJA de pacientes ambulatorios con FA (inclusión: octubre 2017-octubre 2018), se estimó la incidencia de HoIC, se calculó un modelo de regresión de Cox multivariante para la identificación de los predictores de HoIC y se elaboró un nomograma para la valoración del riesgo individual.
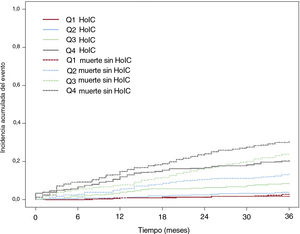
ResultadosDe los 1.499 pacientes incluidos (edad media 73,8± 11,1 años, 48,1% mujeres), tras un seguimiento a 3 años, 127 presentaron una HoIC (tasa de incidencia de 8,51 por cada 100 personas/año) y 319 fallecieron (tasa de muerte por cualquier causa de 21,1 por cada 100 personas/año). Los predictores independientes de HoIC fueron la edad, la presencia de diabetes, enfermedad renal crónica o hipertensión pulmonar, el implante previo de marcapasos, el uso basal de diuréticos y la insuficiencia aórtica moderada o grave. El estadístico C para la predicción del evento fue de 0,762 (IC95% tras remuestreo por boostrapping de 0,753-0,791). Las incidencias acumuladas del evento principal para los cuartiles de la escala de riesgo fueron 1,613 (Q1), 3,815 (Q2), 8,378 (Q3) y 20,436 (Q4) casos por cada 100 personas/año (p <0,001).
ConclusionesEn esta cohorte de FA, la HoIC fue frecuente. La combinación de algunas características clínicas puede identificar a pacientes con muy alto riesgo de HoIC.
Palabras clave
El aumento en la esperanza de vida de la población, junto con una reducción global de la mortalidad cardiovascular hacen que tanto la incidencia como la prevalencia de la fibrilación auricular (FA) y la insuficiencia cardiaca (IC) sigan creciendo a ritmo de pandemia1,2. Dada su interrelación fisiopatológica y el gran número de factores de riesgo cardiovasculares que comparten, ambas entidades coexisten con frecuencia2. La FA se asocia a un riesgo que multiplica por 3 la incidencia de IC3, y el pronóstico de ambas empeora cuando coinciden en el mismo paciente, al incrementar el riesgo de mortalidad y de hospitalización4,5.
A pesar de que se conocen algunos de los factores asociados al desarrollo de IC en los pacientes con FA, la frecuencia y la magnitud de cada uno en la génesis de la enfermedad es desconocida6. Además, no todos los pacientes con FA desarrollan IC sintomática4, por lo que la identificación mediante una escala individual de este riesgo de IC permitiría estratificar el cribado y aportar acciones preventivas o terapéuticas tempranas que retrasarían su aparición7,8. Aunque se han descrito con anterioridad escalas de riesgo para la detección de IC incidente, algunas de ellas no son contemporáneas7 y otras no son específicas de poblaciones con FA6,9 o proceden de otros países8,10. Algunos de los pacientes incluidos no procedían de registros de la vida real, ni de sistemas sanitarios no públicos, ni habían contado con la participación de especialidades diferentes a la de cardiología. De hecho, aunque en España hay disponibles datos epidemiológicos actualizados de IC11,12, se desconoce la incidencia de IC asociada específicamente a pacientes con FA en nuestro medio.
A partir de los datos procedentes de la población del estudio REFLEJA (Registro de Fibrilación de Jaén), el objetivo principal fue estimar la incidencia y los factores de riesgo predictores de una primera hospitalización por IC (HoIC) en pacientes con FA y calcular una escala de riesgo propia.
MÉTODOSPoblación incluidaSe incluyó a los pacientes procedentes del estudio REFLEJA: un registro observacional prospectivo unicéntrico de pacientes consecutivos con FA, evaluados en las consultas de cardiología (octubre 2017-octubre 2018) del Hospital Universitario de Jaén. Los detalles del diseño y las características del registro se han publicado con anterioridad13. Se incluyó a todos los pacientes mayores de 18 años que aceptaron firmar el consentimiento informado y solo se excluyó a los que presentaban aleteo auricular. El estudio fue aprobado por el Comité de Ética de la Investigación Provincial de Jaén (figura 1 del material adicional).
Características evaluadasEn la visita inicial se registraron todas las características clínicas basales, electrocardiograma basal, datos analíticos y ecocardiográficos. El tiempo medio transcurrido entre la última ecocardiografía realizada y la inclusión del paciente fue de 3,4 meses. Se definió obesidad como tener un índice de masa corporal ≥ 30kg/m2. Se consideró anemia cuando los valores de hemoglobina eran inferiores a 13g/dl en hombres y menores de 12g/dl en mujeres, y enfermedad renal crónica (ERC) cuando —según la fórmula CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration)— el filtrado glomerular era menor de 60ml/min. Se decidió categorizar estas variables como dicotómicas con fines prácticos para utilizar la escala, así como por la sencillez de su aplicación. No obstante, se realizó un análisis de sensibilidad que introdujo como continuas las variables cuantitativas obtenidas de los datos (tabla 1 del material adicional).
El ritmo cardiaco y la morfología del QRS se determinó en el electrocardiograma basal. Se definió la hipertrofia ventricular izquierda como un grosor parietal del septo interventricular o pared posterior del ventrículo izquierdo ≥ 12mm. La hipertensión pulmonar (HTP) se definió como alta probabilidad ecocardiográfica, entendiéndola como velocidad pico de la insuficiencia tricuspídea> 3,4 m/s o> 2,9 m/s con dilatación de cámaras derechas u otros signos ecocardiográficos indirectos de HTP. En ausencia de todos estos datos, se consideró que la probabilidad de HTP era baja14. La insuficiencia aórtica y mitral moderada o grave se definió por los criterios ecocardiográficos recomendados por la Sociedad Europea de Cardiología15. En la tabla 2 del material adicional se incluye un análisis de sensibilidad eliminando la variable HTP, teniendo en cuenta que la velocidad de la insuficiencia tricuspídea no estaba disponible en todos los casos.
Eventos y seguimientoLa incidencia de HoIC a 3 años se calculó hasta octubre de 2021. Los cardiólogos del centro registraron la información de los episodios de los pacientes mediante consulta presencial, llamada telefónica o registro de la historia clínica electrónica. La HoIC se definió como la necesidad de una estancia de al menos una noche en el hospital por síntomas o signos de IC secundaria a una anomalía estructural o funcional del corazón (fracción de eyección [FE] <50%, volúmenes anómalos de las cámaras, hipertrofia ventricular izquierda, etc.), además de elevación de las concentraciones de péptidos natriuréticos o evidencia de congestión pulmonar o sistémica de origen cardiaco16. Como otros objetivos secundarios, se calculó la incidencia a 3 años de mortalidad por cualquier causa y de mortalidad cardiovascular, así como la hospitalización por FA (definida como la necesidad de ingreso hospitalario para control de la FA sintomática) y la tasa de ictus/accidente isquémico transitorio.
Análisis estadísticoLas características basales se muestran estratificadas sobre la base de un primer episodio de HoIC durante el seguimiento.
La incidencia de los eventos se calculó como el número de casos por cada 100 personas/año. Para el estudio de los factores de riesgo para la primera HoIC en pacientes con FA, se calcularon modelos individuales de riesgos proporcionales de Cox para cada variable independiente. No se imputaron los datos perdidos, sino que solo se analizó a los pacientes con registros completos. El modelo multivariante se construyó mediante la selección de las variables de los modelos individuales que se consideraron más plausibles desde el punto de vista clínico, estadístico y biológico, y se utilizó el criterio de información de Akaike. En la tabla 3 del material adicional se incluye un análisis de riesgos competitivos de Fine y Gray como alternativa a la regresión de Cox.
El modelo obtenido cumplía con la hipótesis de riesgos proporcionales. Se validó internamente a través de un remuestreo usando Bootstrap (R Core Team, Austria) con 10.000 réplicas, y se obtuvo el optimismo corregido del estadístico C. Para la calibración de la escala se utilizó la prueba de Gronnesby y Borgan.
Para poder evaluar el riesgo de experimentar una HoIC, se realizó un nomograma que contenía una escala del riesgo de presentar el evento tras 12, 24 y 36 meses. Se obtuvieron los cuartiles de categorías de riesgo y se creó una calculadora de riesgo individual. Se representaron las curvas de incidencia acumulada de HoIC considerando la muerte sin HoIC un evento competitivo, para toda la muestra, estratificadas por cuartiles de la escala de riesgo y según las variables que resultaron predictoras independientes del evento.
En todos los análisis se consideró estadísticamente significativo un valor de alfa inferior a 0,05. Los análisis estadísticos se llevaron a cabo con los programas IBM SPSS versión 21 (IBM Corp., Estados Unidos) y R versión 4.2.1 (R Core Team, Austria).
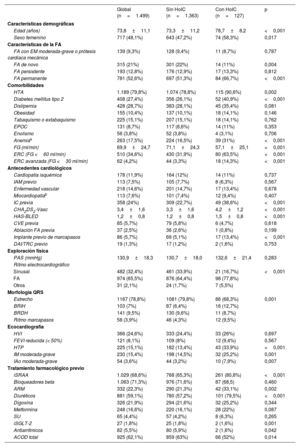
RESULTADOSDescripción de la cohorteLas características basales de la población se muestran en la tabla 1. Se incluyó a 1.499 pacientes y, de forma global, la edad media fue de 73,8±11,1 años, con un 48,1% de mujeres y un 52,6% presentaba FA permanente. Las prevalencias de hipertensión, diabetes y dislipemia fueron del 79,8, el 27,4 y el 28,7% respectivamente. Los pacientes con un evento de HoIC durante el seguimiento eran con mayor frecuencia mujeres, más ancianas y con mayor presencia de diabetes, anemia, ERC e historia previa de IC.
Características basales de la población global
| Global (n=1.499) | Sin HoIC (n=1.363) | Con HoIC (n=127) | p | |
|---|---|---|---|---|
| Características demográficas | ||||
| Edad (años) | 73,8±11,1 | 73,3±11,2 | 78,7±8,2 | <0,001 |
| Sexo femenino | 717 (48,1%) | 643 (47,2%) | 74 (58,3%) | 0,017 |
| Características de la FA | ||||
| FA con EM moderada-grave o prótesis cardiaca mecánica | 139 (9,3%) | 128 (9,4%) | 11 (8,7%) | 0,787 |
| FA de novo | 315 (21%) | 301 (22%) | 14 (11%) | 0,004 |
| FA persistente | 193 (12,8%) | 176 (12,9%) | 17 (13,3%) | 0,812 |
| FA permanente | 781 (52,6%) | 697 (51,3%) | 84 (66,7%) | <0,001 |
| Comorbilidades | ||||
| HTA | 1.189 (79,8%) | 1.074 (78,8%) | 115 (90,6%) | 0,002 |
| Diabetes mellitus tipo 2 | 408 (27,4%) | 356 (26,1%) | 52 (40,9%) | <0,001 |
| Dislipemia | 428 (28,7%) | 383 (28,1%) | 45 (35,4%) | 0,081 |
| Obesidad | 155 (10,4%) | 137 (10,1%) | 18 (14,1%) | 0,146 |
| Tabaquismo o extabaquismo | 225 (15,1%) | 207 (15,1%) | 18 (14,1%) | 0,762 |
| EPOC | 131 (8,7%) | 117 (8,6%) | 14 (11%) | 0,353 |
| Enolismo | 56 (3,8%) | 52 (3,8%) | 4 (3,1%) | 0,706 |
| Anemiaa | 263 (17,5%) | 224 (16,5%) | 39 (31%) | <0,001 |
| FG (ml/min) | 69,9±24,7 | 71,1±24,3 | 57,1±25,1 | <0,001 |
| ERC (FG <60 ml/min) | 510 (34,6%) | 430 (31,9%) | 80 (63,5%) | <0,001 |
| ERC avanzada (FG <30 ml/min) | 62 (4,2%) | 44 (3,3%) | 18 (14,3%) | <0,001 |
| Antecedentes cardiológicos | ||||
| Cardiopatía isquémica | 178 (11,9%) | 164 (12%) | 14 (11%) | 0,737 |
| IAM previo | 113 (7,5%) | 105 (7,7%) | 8 (6,3%) | 0,567 |
| Enfermedad vascular | 218 (14,6%) | 201 (14,7%) | 17 (13,4%) | 0,678 |
| Miocardiopatíab | 113 (7,6%) | 101 (7,4%) | 12 (9,4%) | 0,407 |
| IC previa | 358 (24%) | 309 (22,7%) | 49 (38,6%) | <0,001 |
| CHA2DS2-Vasc | 3,4±1,6 | 3,3±1,6 | 4,2±1,2 | <0,001 |
| HAS-BLED | 1,2±0,8 | 1,2±0,8 | 1,5±0,8 | <0,001 |
| CVE previa | 85 (5,7%) | 79 (5,8%) | 6 (4,7%) | 0,618 |
| Ablación FA previa | 37 (2,5%) | 36 (2,6%) | 1 (0,8%) | 0,199 |
| Implante previo de marcapasos | 86 (5,7%) | 69 (5,1%) | 17 (13,4%) | <0,001 |
| DAI/TRC previo | 19 (1,3%) | 17 (1,2%) | 2 (1,6%) | 0,753 |
| Exploración física | ||||
| PAS (mmHg) | 130,9±18,3 | 130,7±18,0 | 132,6±21,4 | 0,283 |
| Ritmo electrocardiográfico | ||||
| Sinusal | 482 (32,4%) | 461 (33,9%) | 21 (16,7%) | <0,001 |
| FA | 974 (65,5%) | 876 (64,4%) | 98 (77,8%) | |
| Otros | 31 (2,1%) | 24 (1,7%) | 7 (5,5%) | |
| Morfología QRS | ||||
| Estrecho | 1167 (78,8%) | 1081 (79,8%) | 86 (68,3%) | 0,001 |
| BRIH | 103 (7%) | 87 (6,4%) | 16 (12,7%) | |
| BRDH | 141 (9,5%) | 130 (9,6%) | 11 (8,7%) | |
| Ritmo marcapasos | 58 (3,9%) | 46 (4,3%) | 12 (9,5%) | |
| Ecocardiografía | ||||
| HVI | 366 (24,6%) | 333 (24,4%) | 33 (26%) | 0,697 |
| FEVI reducida (< 50%) | 121 (8,1%) | 109 (8%) | 12 (9,4%) | 0,567 |
| HTP | 225 (15,1%) | 182 (13,4%) | 43 (33,9%) | <0,001 |
| IM moderada-grave | 230 (15,4%) | 198 (14,5%) | 32 (25,2%) | 0,001 |
| IAo moderada-grave | 54 (3,6%) | 44 (3,2%) | 10 (7,9%) | 0,007 |
| Tratamiento farmacológico previo | ||||
| iSRAA | 1.029 (68,6%) | 768 (65,3%) | 261 (80,8%) | <0,001 |
| Bloqueadores beta | 1.063 (71,3%) | 976 (71,6%) | 87 (68,5) | 0,460 |
| ARM | 332 (22,3%) | 290 (21,3%) | 42 (33,1%) | 0,002 |
| Diuréticos | 881 (59,1%) | 780 (57,2%) | 101 (79,5%) | <0,001 |
| Digoxina | 326 (21,9%) | 294 (21,6%) | 32 (25,2%) | 0,344 |
| Metformina | 248 (16,6%) | 220 (16,1%) | 28 (22%) | 0,087 |
| SU | 65 (4,4%) | 57 (4,2%) | 8 (6,3%) | 0,265 |
| iSGLT-2 | 27 (1,8%) | 25 (1,8%) | 2 (1,6%) | 0,001 |
| Antiarrítmicos | 82 (5,5%) | 80 (5,9%) | 2 (1,6%) | 0,042 |
| ACOD total | 925 (62,1%) | 859 (63%) | 66 (52%) | 0,014 |
ACOD: anticoagulantes orales de acción directa; ARM: antagonistas del receptor de mineralocorticoides; BRDH: bloqueo de rama derecha del His; BRIH: bloqueo de rama izquierda del His; DAI: desfibrilador automático implantable; EM: estenosis mitral; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; FG: filtrado glomerular; HoIC: hospitalización por insuficiencia cardiaca; HTA: hipertensión arterial; HTP: hipertensión pulmonar; HVI: hipertrofia ventricular izquierda; IAM: infarto agudo de miocardio; IAo: insuficiencia aórtica; IECA: inhibidores de la enzima de conversión de la angiotensina; IM: insuficiencia mitral; iSGLT-2: inhibidores del contransportador de sodio-glucosa tipo 2; iSRAA: inhibidor del sistema renina angiotensina; SU: sulfonilureas; TRC: terapia de resincronización cardiaca.
Los datos expresan n (%) o media±desviación estándar.
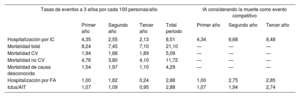
Tras un seguimiento de 3 años, con 23 pacientes perdidos (1,5%), 127 pacientes (8,5% de la población total) tuvieron una primera HoIC y 319 murieron. La tasa de incidencia del evento principal fue de 8,51 por cada 100 personas/año. La incidencia de muerte por cualquier causa y de muerte cardiovascular fue de 21,10 y 5,09 por cada 100 personas/año respectivamente (tabla 2). En la figura 1A se representa la incidencia de la HoIC en el seguimiento, considerando la muerte sin HoIC como evento competitivo. Las tasas de hospitalización por FA y de ictus/accidente isquémico transitorio a los 3 años fueron de 2,88 por cada 100 pacientes/año en ambos casos (tabla 2).
Incidencia de eventos en la población a 3 años
| Tasas de eventos a 3 años por cada 100 personas/año | IA considerando la muerte como evento competitivo | ||||||
|---|---|---|---|---|---|---|---|
| Primer año | Segundo año | Tercer año | Total periodo | Primer año | Segundo año | Tercer año | |
| Hospitalización por IC | 4,35 | 2,55 | 2,13 | 8,51 | 4,34 | 6,68 | 8,48 |
| Mortalidad total | 8,24 | 7,45 | 7,10 | 21,10 | — | — | — |
| Mortalidad CV | 1,94 | 1,68 | 1,89 | 5,09 | — | — | — |
| Mortalidad no CV | 4,76 | 3,80 | 4,10 | 11,72 | — | — | — |
| Mortalidad de causa desconocida | 1,54 | 1,97 | 1,10 | 4,29 | — | — | — |
| Hospitalización por FA | 1,00 | 1,82 | 0,24 | 2,88 | 1,00 | 2,75 | 2,85 |
| Ictus/AIT | 1,07 | 1,09 | 0,95 | 2,88 | 1,07 | 1,94 | 2,74 |
AIT: accidente isquémico transitorio; CV: cardiovascular; FA: fibrilación auricular; IA: incidencia acumulada; IC: insuficiencia cardiaca.
Curvas de incidencia de hospitalización por insuficiencia cardiaca y de incidencia de mortalidad sin hospitalización previa por insuficiencia cardiaca en el seguimiento. A: población general. B: estratificada por edad. C: por diabetes. D: por ERC. E: por implante previo de marcapasos. F: por HTP. G: por insuficiencia aórtica moderada o grave. H: por uso basal de diuréticos. ERC: enfermedad renal crónica; HoIC: hospitalización por insuficiencia cardiaca; HTP: hipertensión pulmonar; IAo: insuficiencia aórtica; MP: marcapasos.
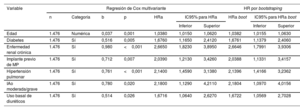
Tras el análisis multivariante final, los factores que se asociaron a una primera HoIC fueron la edad, la presencia de diabetes, ERC o HTP, el implante previo de marcapasos, el uso basal de diuréticos y la insuficiencia aórtica moderada o grave. En la figura 1 se representa la incidencia acumulada del evento principal según estos predictores. El modelo multivariante propuesto fue estadísticamente significativo (p <0,001) y presentó un estadístico C de 0,772 para la predicción a 3 años del evento de HoIC, con un valor de optimismo corregido de 0,762. El intervalo de confianza calculado tras aplicar un remuestreo por boostrapping con 10.000 muestras fue de 0,753-0,791. En la tabla 4 del material adicional se exponen los resultados de las regresiones de Cox individuales y multivariantes de las variables seleccionadas. Si se eliminaba la variable HTP del modelo, la IC previa aparecía como predictor independiente de HoIC (tabla 2 del material adicional). Igualmente, los resultados no variaron de forma significativa si se aplicaba el análisis multivariante de Fine y Gray (tabla 3 del material adicional).
Escala de riesgo de hospitalización por insuficiencia cardiacaCon los 7 factores predictores independientes del evento principal se creó un nomograma (figura 2) donde se sumaba hasta un máximo de 240 puntos en función de las hazard ratio (HR). El puntaje que se le asignó a la presencia de cada uno de los factores se indica en la tabla 5 del material adicional. De forma sencilla, se puede obtener en función de la puntuación la probabilidad de presentar el evento principal tras 12, 24 y 36 meses de seguimiento. Se observó una adecuada calibración de la escala con un valor de p=0,2616 para el test de Gronnesby y Borgan (figura 2 del material adicional).
Nomograma para el cálculo del riesgo de hospitalización por insuficiencia cardiaca tras 12, 24 y 36 meses. DM: diabetes mellitus; HoIC: hospitalización por insuficiencia cardiaca; HTP: hipertensión pulmonar; IAo: insuficiencia aórtica; IRC: insuficiencia renal crónica; MP: marcapasos.
En la figura 3 se presenta, mediante curvas de incidencia acumulada, considerando la muerte sin el evento como un riesgo competitivo y la probabilidad de HoIC según los cuartiles de riesgo de la escala calculada. La incidencia acumulada de HoIC a 3 años para los cuartiles de la escala de riesgo REFLEJA fueron 1,613 (Q1), 3,815 (Q2), 8,378 (Q3) y 20,436 (Q4) casos por cada 100 personas/año (p <0,001). Igualmente existía una mayor mortalidad por cualquier causa asociada a un mayor cuartil de riesgo (incluso sin HoIC). Los pacientes con HoIC presentaron 2,54 veces más riesgo de mortalidad por cualquier causa que los pacientes sin hospitalización (IC95%, 1,90-3,40; p <0,001). Respecto a la muerte cardiovascular, la HoIC también incrementó el riesgo (HR=8,57; IC95%, 5,41-13,58; p <0,001) (tabla 3).
Regresión de Cox multivariante para la hospitalización por insuficiencia cardiaca a los 3 años de seguimiento
| Variable | Regresión de Cox multivariante | HR por bootstraping | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | Categoría | b | p | HRa | IC95% para HRa | HRa boot | IC95% para HRa boot | |||
| Inferior | Superior | Inferior | Superior | |||||||
| Edad | 1.476 | Numérica | 0,037 | 0,001 | 1,0380 | 1,0150 | 1,0620 | 1,0382 | 1,0155 | 1,0630 |
| Diabetes | 1.476 | Sí | 0,516 | 0,005 | 1,6760 | 1,1650 | 2,4120 | 1,6761 | 1,1379 | 2,4060 |
| Enfermedad renal crónica | 1.476 | Sí | 0,980 | <0,001 | 2,6650 | 1,8230 | 3,8950 | 2,6646 | 1,7991 | 3,9306 |
| Implante previo de MP | 1.476 | Sí | 0,712 | 0,007 | 2,0390 | 1,2130 | 3,4260 | 2,0388 | 1,1331 | 3,4157 |
| Hipertensión pulmonar | 1.476 | Sí | 0,761 | <0,001 | 2,1400 | 1,4590 | 3,1380 | 2,1396 | 1,4166 | 3,2362 |
| IAo moderada/grave | 1.476 | Sí | 0,780 | 0,020 | 2,1800 | 1,1290 | 4,2110 | 2,1804 | 1,0970 | 4,0156 |
| Uso basal de diuréticos | 1.476 | Sí | 0,514 | 0,026 | 1,6716 | 1,0640 | 2,6270 | 1,6722 | 1,0569 | 2,7028 |
HRa: hazard ratio ajustada; IAo: insuficiencia aórtica; IC95%: intervalo de confianza del 95%; MP: marcapasos.
En el modelo multivariante inicial se incluyeron las variables sexo, edad, hipertensión arterial, diabetes mellitus, infarto agudo de miocardio previo, enolismo, neoplasia previa, enfermedad renal crónica, insuficiencia cardiaca previa, ritmo electrocardiográfico, tipo de fibrilación auricular (paroxística, persistente o permanente), escalas CHA2DS2-VASc y HAS-BLED, anemia, insuficiencia mitral moderada o grave, IAo moderada o grave, hipertrofia ventricular izquierda, hipertensión pulmonar, fracción de eyección del ventrículo izquierdo, morfología del QRS, implante previo de MP, implante de desfibrilador automático implantable/terapia de resincronización cardiaca previa, tratamiento con metformina, sulfonilureas, inhibidor del cotransportador de sodio-glucosa tipo 2, inhibidores del sistema renina angiotensina, bloqueadores beta, antagonistas de la aldosterona, diuréticos, digoxina, anticoagulantes directos y antiarrítmicos.
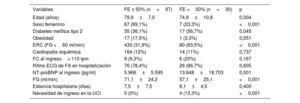
De los 127 pacientes hospitalizados por IC, el 58,3% eran mujeres, y la edad media fue de 78,7±8,3 años. El 80,3% ingresaron en ritmo de FA, la FE media fue del 56% (75,6% presentaron FE conservada), y el valor medio de NT-proBNP fue de 7.822±10.811 (mediana 5.400) pg/ml. Los pacientes con FE conservada presentaban mayor edad, mayoritariamente eran mujeres y con menor ERC (tabla 4). A los 3 años, la mortalidad de los pacientes que tuvieron una HoIC fue del 44,1%, siendo principalmente no cardiovascular (66,9%). El 25,2% presentó una muerte cardiovascular y casi un 8% de causa desconocida.
Características de los pacientes hospitalizados por insuficiencia cardiaca
| Variables | FE ≥ 50% (n=97) | FE <50% (n=30) | p |
|---|---|---|---|
| Edad (años) | 79,9±7,0 | 74,9±10,8 | 0,004 |
| Sexo femenino | 67 (69,1%) | 7 (23,3%) | <0,001 |
| Diabetes mellitus tipo 2 | 35 (36,1%) | 17 (56,7%) | 0,045 |
| Obesidad | 17 (17,5%) | 1 (3,3%) | 0,051 |
| ERC (FG <60 ml/min) | 430 (31,9%) | 80 (63,5%) | <0,001 |
| Cardiopatía isquémica | 164 (12%) | 14 (11%) | 0,737 |
| FC al ingreso> 110 lpm | 9 (9,3%) | 6 (20%) | 0,167 |
| Ritmo ECG de FA en hospitalización | 76 (78,4%) | 26 (86,7%) | 0,605 |
| NT-proBNP al ingreso (pg/ml) | 5.966±5.595 | 13.648±18.703 | 0,001 |
| FG (ml/min) | 71,1±24,3 | 57,1±25,1 | <0,001 |
| Estancia hospitalaria (días) | 7,5±7,5 | 6,1±4,5 | 0,400 |
| Necesidad de ingreso en la UCI | 0 (0%) | 4 (13,3%) | <0,001 |
ECG: electrocardiograma; ERC: enfermedad renal crónica; FA: fibrilación auricular; FC: frecuencia cardiaca; FE: fracción de eyección; FG: filtrado glomerular; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B); UCI: unidad de cuidados intensivos.
Los datos expresan n (%) o media±desviación estándar.
En este registro prospectivo de pacientes con FA, se observó que la HoIC era un evento frecuente a los 3 años de seguimiento, por encima de otros como la hospitalización por FA o ictus/accidente isquémico transitorio, y que se relacionaba con una mayor mortalidad total y cardiovascular.
La edad, la presencia de diabetes, ERC o HTP, el implante previo de marcapasos, el uso basal de diuréticos y la presencia de insuficiencia aórtica moderada o grave se asociaron a un mayor riesgo de HoIC, mientras que la presencia previa de IC no lo hacía de forma independiente (figura 4).
Respecto a otros registros de FA en los que se ha obtenido una escala predictora de IC, el registro REFLEJA es el único estudio contemporáneo que se ha desarrollado en nuestro país, incluyendo a todos los pacientes consecutivos atendidos en consultas de cardiología y sin criterios de exclusión, lo que haría de la escala una herramienta útil en esta población, en el caso de que estudios posteriores confirmen su validez externa. Su capacidad de discriminación, con un estadístico C entre 0,7 y 0,8 es buena, pero no puede considerarse un modelo completamente robusto.
Incidencia de hospitalización por insuficiencia cardiacaEn nuestra serie, la incidencia de HoIC fue alta, en torno al 4% al año, similar a la de otros estudios observacionales clásicos4,17,18, y por encima de los registros más contemporáneos, donde la incidencia anual de IC es de aproximadamente 1-2 por cada 100 personas/año8,10, lo que podría justificarse por la edad media superior de la población de nuestra serie y una mayor presencia de comorbilidad y de carga de factores de riesgo cardiovascular. En el presente estudio, la tasa de HoIC en el primer año fue del 4,35% y del 8,51% a los 3 años, lo que demuestra una mayor hospitalización en la fase temprana del diagnóstico de FA, como también ha sido descrito por Suzuki et al.19.
A los 3 años de seguimiento, la mortalidad de la cohorte alcanzó el 21,1% y la mayoría de las muertes fueron de causa no cardiovascular, probablemente influido por la edad avanzada de la cohorte y la alta comorbilidad no cardiovascular. Este aumento de la mortalidad no cardiovascular también se ha observado en los pacientes hospitalizados por IC con FE conservada, cuya edad media suele ser superior y también presentan una mayor comorbilidad20.
Predictores de hospitalización por insuficiencia cardiaca y cálculo de la escala de riesgoLa relación existente entre la edad6,7,9,10,21–23 y la diabetes6–8,10,19,22,24–26 con una mayor probabilidad de aparición de HoIC se repite de forma constante en la mayoría de los trabajos descritos anteriormente. De la misma forma, otros factores evaluados en estudios observacionales, como la ERC8,10,19,24 o la enfermedad valvular8,10,27, también son predictores de HoIC en nuestra serie. Sin embargo, en nuestro caso, tan solo la presencia de una insuficiencia valvular aórtica moderada o grave lo fue, lo que permitiría una predicción más específica.
Frecuentemente, la HTP evoluciona hacia el desarrollo de una IC derecha y un aumento del riesgo de mortalidad14. La HTP se asocia a una mayor prevalencia de FA, y su aparición supone un progreso de la enfermedad y empeoramiento clínico28. Sin embargo, hasta donde se sabe, no existe ningún trabajo en pacientes con FA que haya demostrado que la alta probabilidad de HTP se comporte como predictor independiente de HoIC. Es probable que esta condición identifique a un grupo de pacientes que, más allá de la etiología de la propia HTP, tienen un mayor riesgo de fracaso del ventrículo derecho y, por tanto, de aparición clínica de IC. Cabe destacar que, si eliminamos del modelo la HTP, aparece como nuevo predictor de HoIC la IC previa, algo plausible teniendo en cuenta que ambas variables presentaban una asociación significativa (tabla 6 del material adicional).
El uso basal de diuréticos, descrito previamente también en otros trabajos19,27, predijo la HoIC, y puede justificarse porque se tratase de un marcador indirecto de gravedad de la IC o incluso de la propia existencia de la enfermedad previa al episodio de hospitalización.
Por último, el implante previo de marcapasos predijo un grupo de pacientes con FA que también tenían mayor riesgo de HoIC. Aunque no hemos encontrado otros estudios donde relacionaran este factor con la HoIC, sí que los trastornos de la conducción intraventricular (anchura del QRS)8 se han asociado a ella. Ambos factores son un reflejo del mismo hecho, la disincronía intra e interventricular que puede conllevar frecuentemente el descenso de la fracción de eyección del ventrículo izquierdo (FEVI) y los consiguientes síntomas de IC. Este fenómeno es el más frecuente observado por la estimulación monocameral del ventrículo derecho, que además es la más frecuente entre los pacientes con FA29.
Destaca la ausencia de relación entre la FEVI reducida o el antecedente de miocardiopatía con la HoIC, aunque teniendo en cuenta que los ingresos fueron mayoritariamente por IC con FEVI conservada, podría justificar este hallazgo, típico de pacientes más ancianos y una mayor comorbilidad no cardiaca20.
Aunque existen múltiples escalas previas descritas en la literatura que se centran en la predicción de mortalidad de pacientes con diagnóstico establecido de IC como el MAGGIC Risk Score30, o el BIOSTAT-CHF31, nuestra escala aporta información sobre la capacidad predictiva de aparición de IC en pacientes con FA (con o sin IC previa). A diferencia de la nuestra, estas escalas se han aplicado a pacientes procedentes de ensayos clínicos8 o registros retrospectivos de menor tamaño22 o con un seguimiento medio inferior (2 años)8,19. Además, algunos de ellos procedían de población asiática con una edad media inferior a la del presente estudio. En el artículo recientemente publicado por Melendo-Viu et al.32, en una población más numerosa de octogenarios españoles con FA, la tasa de incidencia de IC era superior a la descrita en nuestro trabajo (incluyeron también el diagnóstico de IC ambulatoria) y coincidían como predictores de IC, la edad, la diabetes, la ERC y la presencia de una valvulopatía significativa.
Fenotipos del paciente con fibrilación auricular hospitalizado por insuficiencia cardiacaLa mayoría de los pacientes que ingresaron por IC (hasta 3 de cada 4) tenían FE conservada y, como era de esperar, en este grupo la edad era superior y había un mayor porcentaje de mujeres, como mostraron los trabajos de Pandey et al.10 y Potpara et al.26 Se desconoce el motivo por el que en la actualidad es más frecuente el fenotipo de IC con FE conservada en pacientes con FA, pero podría explicarse porque ambas entidades comparten factores comunes como la edad avanzada o la presencia de hipertensión arterial, diabetes u obesidad.
Implicaciones clínicas y limitacionesLa aparición de IC en pacientes con FA es frecuente, por lo que disponer de una herramienta que identifique a los pacientes con alto riesgo de desarrollarla permitiría aplicar ciertas estrategias para retrasar su aparición. Así, se podrían considerar algunas opciones como el seguimiento clínico más estrecho y el diagnóstico proactivo de la enfermedad, los cambios en los estilos de vida y el inicio de terapias farmacológicas con beneficio cardiovascular demostrado (como el uso de inhibidores del contransportador de sodio-glucosa tipo 2 en la diabetes; finerenona en el paciente con diabetes y ERC, o los análogos de glucagón tipo 1 en pacientes con diabetes y obesidad33,34.
Son varias las limitaciones de esta escala, aunque la principal es su carácter monocéntrico que impide una adecuada validación externa de la escala y, por tanto, limita su aplicabilidad fuera de esta población mientras dicha validación no esté disponible. Al tratarse de un estudio observacional, está sujeto a posibles sesgos y factores de confusión no identificados. No se aporta información sobre la duración de la FA para correlacionarla con la probabilidad de aparición de IC. El hecho de haber incluido en el análisis ciertas variables continuas (índice de masa corporal o presión arterial sistólica pulmonar) como dicotómicas (obesidad, hipertensión pulmonar, etc.) por no disponer de los datos, puede haber limitado la capacidad de selección de mejores puntos de corte. Tampoco se han recogido variables relacionadas con la fragilidad, la demencia, el soporte social u otras variables ecocardiográficas (como la disfunción sistólica del ventrículo derecho o el volumen de la aurícula izquierda) que podrían haber mejorado la capacidad de discriminación de la escala. Por otro lado, la amplitud de los intervalos de confianza en la predicción de riesgo de la escala obtenida ha podido limitar la estimación óptima del riesgo.
El periodo de seguimiento máximo fue de 3 años, lo que podría haber infraestimado la incidencia de IC a más largo plazo. Los eventos clínicos no fueron recogidos por un comité externo independiente y, por último, no se incluyó a los pacientes atendidos en otras especialidades, como atención primaria o medicina interna, lo que pudo sesgar los resultados.
CONCLUSIONESLa incidencia de HoIC a 3 años en esta cohorte de pacientes con FA es alta. La escala REFLEJA (con 7 variables clínicas) predice la HoIC a 3 años con una capacidad de discriminación similar a la de otras escalas descritas con anterioridad7–9,18, con la peculiaridad de que se aplica a una población exclusivamente española y atendida por cardiólogos.
FINANCIACIÓNEl proyecto ha sido financiado parcialmente por una beca no condicionada de Bayer y Daiichi-Sankyo.
CONSIDERACIONES ÉTICASEl estudio contó con la aprobación del Comité de Ética de la Investigación Provincial de Jaén y se obtuvo el consentimiento informado de los pacientes incluidos. Se han tenido en cuenta las posibles variables de sexo.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALEn la elaboración de este artículo no se ha utilizado ninguna forma de inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores del manuscrito han participado de forma equitativa en su elaboración. J. Torres-Llergo elaboró el primer borrador del manuscrito, que posteriormente fue corregido por el resto de los autores.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses en relación con este artículo.
- -
La HoIC es una complicación frecuente en los pacientes con FA y, además, la coincidencia de ambos procesos se asocia a una mayor mortalidad.
- -
Entre los pacientes con FA hay ciertas características clínicas que se asocian a un mayor riesgo de desarrollar IC.
- -
Se han descrito diferentes escalas predictivas de aparición de IC en pacientes con FA fuera de España.
- -
La incidencia de HoIC en una población contemporánea con FA es más alta que la descrita en otras series.
- -
El implante previo de marcapasos o la alta probabilidad de HTP se han identificado como 2 nuevos predictores de HoIC en pacientes con FA.
- -
Hasta donde se sabe, es la primera escala predictora de HoIC descrita en una población española con FA.
A María del Carmen Rosa Garrido, de la Unidad de Metodología y Estadística de la Fundación para la Investigación Biosanitaria de Andalucía Oriental «Alejandro Otero», por su inestimable ayuda en el asesoramiento metodológico y estadístico del artículo.