El tejido adiposo epicárdico se ha asociado con diversos índices de adiposidad y resistencia a insulina. La medición de este tejido por ecocardiografía se considera una herramienta útil y accesible para valorar factores de riesgo cardiometabólico; no obstante, aún no existen suficientes estudios en mujeres posmenopáusicas, que es una etapa en la que se presenta un incremento del riesgo cardiovascular. El objetivo del estudio es analizar la relación entre las mediciones del tejido adiposo epicárdico y tejido adiposo visceral, perímetro de cintura, índice de masa corporal y resistencia a insulina en mujeres posmenopáusicas.
MétodosEstudio transversal comparativo en 34 mujeres posmenopáusicas con y sin síndrome metabólico a las que se realizó ecocardiograma transtorácico y análisis de composición corporal.
ResultadosSe encontró asociación positiva de las medidas de grasa epicárdica con el tejido adiposo visceral, el índice de masa corporal y el perímetro de cintura; en el surco aortoventricular derecho, las correlaciones fueron r = 0,505 (p < 0,003), r = 0,545 (p < 0,001) y r = 0,515 (p < 0,003) respectivamente. También se observó que las mujeres posmenopáusicas con síndrome metabólico presentaban aumento del tejido adiposo epicárdico en comparación con las que no tienen el síndrome (544,2 ± 122,9 frente a 363,6 ± 162,3mm2; p = 0,03).
ConclusionesEl tejido adiposo epicárdico medido por ecocardiografía se asocia con el tejido adiposo abdominal y corporal en las mujeres posmenopáusicas. Las posmenopáusicas con síndrome metabólico presentan mayor cantidad de grasa epicárdica. La medición del tejido adiposo epicárdico por ecocardiografía puede ser un método de utilidad para evaluar el riesgo cardiovascular en la posmenopausia.
Palabras clave
Durante la etapa posmenopáusica, se presenta un incremento del riesgo cardiovascular y de síndrome metabólico (SM)1. Los cambios en las concentraciones de hormonas sexuales que aparecen durante esta etapa tienen efectos en la resistencia a la insulina y la distribución del tejido adiposo visceral y corporal1,2.
Durante mucho tiempo se consideró el tejido adiposo como un depósito de energía, hasta que en 1994 este concepto cambió cuando se identificó que en ese tejido se secretaba la hormona leptina; a partir de entonces, se reconoció su función como órgano endocrino, en el cual se producen hormonas o adipocinas3,4. La obesidad se caracteriza por hipertrofia e hiperplasia de los adipocitos y alteración de la secreción de adipocinas, que contribuyen al incremento de la resistencia a la insulina y la inflamación3. El tejido adiposo visceral (VAT, del inglés visceral adipose tissue) es el tejido que envuelve los órganos internos, y su aumento está relacionado con un perfil de riesgo cardiometabólico4,5.
El tejido adiposo epicárdico (EAT, del inglés epicardial adipose tissue) tiene el mismo origen embrionario que el intraabdominal6. El EAT se localiza sobre el miocardio, en los surcos auriculoventriculares e interventriculares, se extiende al ápex y rodea las arterias coronarias7. Este tejido graso es extremadamente activo y produce numerosas adipocinas, entre ellas citocinas proinflamatorias y proaterogénicas como el factor de necrosis tumoral alfa, el inhibidor del activador del plasminógeno tipo 1, interleucina 6, visfatina, leptina, omentina y angiotensina8. Se ha señalado también que la grasa epicárdica sirve como una fuente de energía para el miocardio y lo protege de la toxicidad de los ácidos grasos8,9.
La evaluación del EAT a través de la ecocardiografía se asocia directamente con la acumulación de VAT, incluso mejor que algunas variables antropométricas como el perímetro de la cintura (PC)10.
El objetivo de este trabajo es estudiar en población posmenopáusica la relación entre la EAT y otras medidas de obesidad como el VAT, el PC y el índice de masa corporal (IMC), así como con la resistencia a la insulina.
MÉTODOSSe realizó un estudio transversal y comparativo en 34 mujeres en etapa posmenopáusica de 50–65 años de edad que acudieron consecutivamente a la Unidad de Investigación Médica de Enfermedades Endocrinas del Hospital de Especialidades del Centro Médico Nacional IMSS. Se confirmó el diagnóstico de menopausia con base en concentraciones séricas de estradiol bajas e incremento de folitropina; ninguna de las participantes recibía terapia hormonal sustitutiva. Se establecieron dos grupos de estudio: pacientes con diagnóstico de SM y mujeres sin SM. Este diagnóstico se estableció según las definiciones para la práctica clínica de la Federación Internacional de Diabetes11,12. Estos criterios son obesidad central (definida por PC ≥ 80 cm) además de dos de los siguientes componentes: triglicéridos ≥ 150 mg/dl, disminución del colesterol unido a lipoproteínas de alta densidad < 50 mg/dl, presión arterial sistólica ≥ 130 o presión arterial diastólica ≥ 85mmHg y/o glucosa en ayunas ≥ 100mg/dl.
Se excluyó del estudio a las mujeres con diagnóstico establecido de diabetes mellitus, insuficiencia renal y hepática, infecciones crónicas, endocrinopatías, enfermedades hemáticas, antecedentes de enfermedad cardiovascular y trombosis. También se excluyó a las participantes que se encontraban en tratamiento con anticoagulantes. Este protocolo de estudio fue aprobado por el Comité de Ética del Instituto Mexicano del Seguro Social. Se informó a los voluntarios y estos firmaron la correspondiente carta de consentimiento.
Evaluación clínicaSe realizó a todas las pacientes historia clínica completa y se tomaron las medidas antropométricas. Se las pesó y midió sin zapatos y con ropa ligera en una báscula y estadímetro marca Bame. Se determinaron las presiones arteriales sistólica y diastólica con baumanómetro aneroide. Se midió la circunferencia de cadera y el PC. El IMC se calculó como el peso en kilogramos dividido por el cuadrado de la talla en metros.
Análisis corporalSe realizó el análisis corporal mediante un analizador de composición corporal 353ioi JAWON. El análisis de impedancia bioeléctrica se llevó a cabo por la mañana tras ayuno de 12 h e hidratación adecuada. La impedancia bioeléctrica se midió con ropa ligera, de pie y sin calzado. El analizador midió el peso con una precisión de 0,1kg, así como de la impedancia corporal (en ohmios). Se obtuvo el valor de la VAT y el porcentaje de grasa corporal total.
Análisis bioquímicoSe obtuvieron muestras de sangre venosa antecubital entre las 8.00 y las 9.00, después de un ayuno ≥ 12 h. Se colectaron en tubos sin anticoagulante. Las muestras se centrifugaron a 3.500rpm durante 20min para separar el suero y preparar alícuotas de 500 μl, que se mantuvieron en congelación a –70°C hasta la realización de los ensayos. La glucosa, el colesterol unido a lipoproteínas de alta densidad y los triglicéridos se determinaron en suero mediante el analizador químico semiautomatizado Ekem Control Lab. La insulina se midió por radioinmunoanálisis en fase sólida (Millipore, Billerica; Mississippi, Estados Unidos); la sensibilidad de este ensayo fue de 2 μU/ml y el coeficiente de variación intraanalítica e interanalítica fue del 4,0 y 8,6% respectivamente. La resistencia a insulina se evaluó mediante HOMA (homeostasis model assessment) según el método de Matthews et al13:
HOMA-IR = insulina (μU/ml) × glucosa en ayunas (mmol/l) / 22,5.
Evaluación ecocardiográfica del tejido adiposo epicárdicoPara la valoración cardiológica estructural, se realizó a todas las participantes un ecocardiograma transtorácico en modo M, bidimensional y Doppler (ecocardiógrafo Phillips IE33, versión 5.2.0.289). Se utilizó la metodología estándar para obtener las imágenes colocando a la paciente en decúbito lateral izquierdo con la sincronización del electrocardiograma registrado en pantalla del ecocardiógrafo14. Se tomaron imágenes en eje largo longitudinal y apical de cuatro cámaras. La grasa epicárdica se identificó como un tejido hipoecoico que rodea el corazón inmediatamente sobre el miocardio y por debajo de la hoja visceral del pericardio15. Este tejido presenta compresión en diástole y aumento del grosor en sístole15,16.
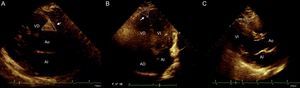
Se seleccionaron cuatro sitios de depósito de la grasa epicárdica, utilizando la profundidad de campo para mejorar la visualización bidimensional. Dos de estos en la vista de eje largo longitudinal, el surco entre la raíz de la aorta y el ventrículo derecho que forma un triángulo con la base externa y la cúspide justo en la unión de la aorta con el ventrículo derecho y el sitio entre este ventrículo y la porción apical (surco ventrículo derecho-porción apical). En la vista de cuatro cámaras, se midió el surco inferior, que se encuentra entre la aurícula y el ventrículo izquierdo (surco auriculoventricular inferior). En esta misma vista se midió la grasa epicárdica a nivel apical, que se observa igualmente con morfología de triángulo invertido con la base superior y la punta inferior, en el sitio de la unión de las regiones apicales de ambos ventrículos. Se utilizó la medida lineal tomando dos ejes principales, vertical y horizontal, y considerando como principio que los surcos llenos de tejido graso muestran una forma triangular, por lo que con base en estas dos mediciones se obtuvo el área de estos «triángulos grasos» (figura 1). Además, se midió el tejido adiposo sobre la pared libre del ventrículo derecho utilizando la vista en el eje paraesternal largo y paraesternal corto, como se ha descrito previamente17,18. El mismo cardiólogo ecocardiografista realizó todas las mediciones.
Evaluación ecocardiográfica de la grasa epicárdica. A: grasa epicárdica en el surco aortoventricular derecho, entre la raíz de la aorta y el ventrículo derecho. B: grasa epicárdica en el surco apical localizado entre los ápices de ambos ventrículos. C: grasa epicárdica en el surco ventrículo derecho-porción apical. En todos los casos se tomaron las medidas base y altura y se trazó con planimetría para señalar el sitio de interés. AD: aurícula derecha; AI: aurícula izquierda; Ao: aorta; VD: ventrículo derecho; VI: ventrículo izquierdo.
Por el tipo de distribución de las variables, se utilizaron pruebas no paramétricas. Para identificar la correlación entre las variables se utilizó la prueba de Spearman y para identificar las diferencias entre los grupos, la prueba de la U de Mann-Whitney. Todo el análisis se efectuó en el programa de cómputo estadístico SPSS v.14.
El cálculo para obtener un poder estadístico del 90% y una correlación de al menos 0,5019, con un valor de p < 0,05, señaló la necesidad de una muestra de 31 participantes.
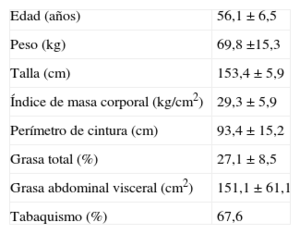
RESULTADOSSe evaluó a 34 mujeres con una media de edad de 56,1 ± 6,5 años e IMC en un amplio rango de 22–40 (tabla 1). La grasa corporal promedio de las participantes se encontró dentro del límite normal superior (27,1% ± 8,5%); sin embargo, la grasa abdominal presentaba incremento (media, 151,1 ± 61,1 [intervalo, 32-194] cm2).
Características generales de las participantes
| Edad (años) | 56,1 ± 6,5 |
| Peso (kg) | 69,8 ±15,3 |
| Talla (cm) | 153,4 ± 5,9 |
| Índice de masa corporal (kg/cm2) | 29,3 ± 5,9 |
| Perímetro de cintura (cm) | 93,4 ± 15,2 |
| Grasa total (%) | 27,1 ± 8,5 |
| Grasa abdominal visceral (cm2) | 151,1 ± 61,1 |
| Tabaquismo (%) | 67,6 |
Salvo otra indicación, los valores expresan media ± desviación estándar.
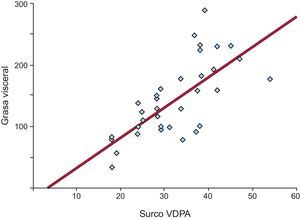
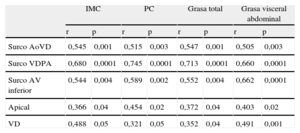
Todas las mediciones lineales de grasa epicárdica mostraron una correlación significativa y positiva con los distintos índices de obesidad (tabla 2). El espesor del tejido adiposo sobre el ventrículo derecho se correlacionó con el IMC (r = 0,488; p = 0,05), la cintura (r = 0,321; p = 0,05), la grasa total (r = 0,352; p = 0,04) y la VAT (r = 0,491; p = 0,001). La más alta correlación entre VAT y EAT se presentó con la medición del área grasa del surco ventrículo derecho-porción apical (r = 0,680; p < 0,0001) (figura 2).
Asociación entre los índices de obesidad y las medidas de grasa epicárdica
| IMC | PC | Grasa total | Grasa visceral abdominal | |||||
| r | p | r | p | r | p | r | p | |
| Surco AoVD | 0,545 | 0,001 | 0,515 | 0,003 | 0,547 | 0,001 | 0,505 | 0,003 |
| Surco VDPA | 0,680 | 0,0001 | 0,745 | 0,0001 | 0,713 | 0,0001 | 0,660 | 0,0001 |
| Surco AV inferior | 0,544 | 0,004 | 0,589 | 0,002 | 0,552 | 0,004 | 0,662 | 0,0001 |
| Apical | 0,366 | 0,04 | 0,454 | 0,02 | 0,372 | 0,04 | 0,403 | 0,02 |
| VD | 0,488 | 0,05 | 0,321 | 0,05 | 0,352 | 0,04 | 0,491 | 0,001 |
AoVD: aortoventricular derecho; AV inferior: auriculoventricular izquierdo; IMC: índice de masa corporal; PC: perímetro de cintura; VD: espesor en la pared libre del ventrículo derecho; VDPA: ventrículo derecho-porción apical.
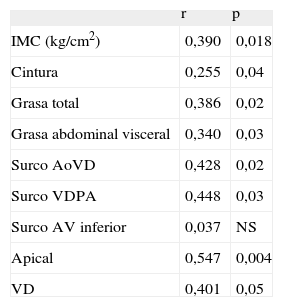
De la misma forma, la resistencia a la insulina se correlacionó significativamente con los índices de adiposidad y con todas las mediciones de grasa epicárdica, con excepción del surco auriculoventricular inferior (tabla 3). Esta asociación de la resistencia a la insulina con el surco aorta-ventrículo derecho fue r = 0,428 (p = 0,02) y con el espesor del ventrículo derecho, r = 0,401 (p < 0,05).
Correlaciones de la resistencia a la insulina (evaluada por homeostasis model assessment) con la grasa epicárdica e índices de obesidad
| r | p | |
| IMC (kg/cm2) | 0,390 | 0,018 |
| Cintura | 0,255 | 0,04 |
| Grasa total | 0,386 | 0,02 |
| Grasa abdominal visceral | 0,340 | 0,03 |
| Surco AoVD | 0,428 | 0,02 |
| Surco VDPA | 0,448 | 0,03 |
| Surco AV inferior | 0,037 | NS |
| Apical | 0,547 | 0,004 |
| VD | 0,401 | 0,05 |
AoVD: aortoventricular derecho; AV inferior: auriculoventricular izquierdo; IMC: índice de masa corporal; VD: espesor en la pared libre del ventrículo derecho; VDPA: ventrículo derecho-porción apical.
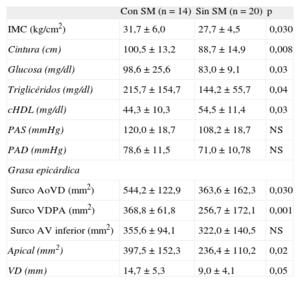
De las participantes del estudio, el 41% presentaba SM y consecuentemente mayores IMC y concentraciones de glucosa y triglicéridos y menor concentración de colesterol unido a lipoproteínas de alta densidad que las mujeres sin SM (tabla 4). Además, se demostró que las mujeres con SM tenían mayor cantidad de tejido adiposo epicárdico; esta diferencia entre mujeres con y sin SM fue en el surco aorta-ventrículo derecho de 544,2 ± 122,9 frente a 363,6 ± 162,3mm2 (p = 0,03) y en el grosor del ventrículo derecho de 14,7 ± 5,3 frente a 9,0 ± 4,1mm (p < 0,05) respectivamente.
Grasa epicárdica entre participantes con y sin síndrome metabólico
| Con SM (n = 14) | Sin SM (n = 20) | p | |
| IMC (kg/cm2) | 31,7 ± 6,0 | 27,7 ± 4,5 | 0,030 |
| Cintura (cm) | 100,5 ± 13,2 | 88,7 ± 14,9 | 0,008 |
| Glucosa (mg/dl) | 98,6 ± 25,6 | 83,0 ± 9,1 | 0,03 |
| Triglicéridos (mg/dl) | 215,7 ± 154,7 | 144,2 ± 55,7 | 0,04 |
| cHDL (mg/dl) | 44,3 ± 10,3 | 54,5 ± 11,4 | 0,03 |
| PAS (mmHg) | 120,0 ± 18,7 | 108,2 ± 18,7 | NS |
| PAD (mmHg) | 78,6 ± 11,5 | 71,0 ± 10,78 | NS |
| Grasa epicárdica | |||
| Surco AoVD (mm2) | 544,2 ± 122,9 | 363,6 ± 162,3 | 0,030 |
| Surco VDPA (mm2) | 368,8 ± 61,8 | 256,7 ± 172,1 | 0,001 |
| Surco AV inferior (mm2) | 355,6 ± 94,1 | 322,0 ± 140,5 | NS |
| Apical (mm2) | 397,5 ± 152,3 | 236,4 ± 110,2 | 0,02 |
| VD (mm) | 14,7 ± 5,3 | 9,0 ± 4,1 | 0,05 |
AoVD: aortoventricular derecho; AV inferior: auriculoventricular izquierdo; cHDL: colesterol unido a lipoproteínas de alta densidad; IMC: índice de masa corporal; NS: no significativo; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SM: síndrome metabólico; VD: espesor en la pared libre del ventrículo derecho; VDPA: ventrículo derecho-porción apical.
En el presente estudio se ha demostrado asociación entre la cantidad de tejido graso epicárdico evaluada por ecocardiografía y el tejido adiposo abdominal, el IMC, el PC y la cantidad de grasa corporal. El EAT tiene la capacidad de modular localmente la fisiología cardiaca y puede desempeñar un papel causal en la aterosclerosis y los eventos cardiovasculares7,20,21. La grasa epicárdica es metabólicamente activa y contigua al miocardio, de tal forma que en condiciones patológicas esta grasa puede afectar directamente a las arterias coronarias y el corazón a través de la secreción de sustancias proinflamatorias20,22. En diversos estudios se ha señalado que el EAT puede participar en el desarrollo de la enfermedad coronaria, pero se desconocen aún los mecanismos exactos23.
La grasa epicárdica tiene mayor relación con la grasa visceral abdominal que con la grasa corporal total y se considera que el engrosamiento de la grasa epicárdica puede reflejar la cantidad de grasa visceral10. En este trabajo se encontró una asociación elevada entre estos dos tipos de tejido adiposo; aunque el PC es un marcador de la grasa visceral cuya medición es muy accesible, su especificidad no es elevada para medir adiposidad visceral. Se ha señalado por ello que la medición ecocardiográfica de la grasa epicárdica puede proporcionar una medida más específica de la grasa visceral intraabdominal con lo que se evita la posible confusión por el incremento del tejido adiposo subcutáneo a nivel abdominal7,17.
Otro hallazgo interesante en este trabajo es la alta asociación entre grasa epicárdica y resistencia a la insulina. Los datos de este estudio son similares a dos trabajos previamente publicados, en los que se encontró también una asociación directa entre la resistencia a la insulina y el grosor del EAT en población adulta de ambos sexos17–24. En el presente trabajo, esta relación directa entre la resistencia a la insulina y el tejido graso epicárdico se observó en mujeres en etapa posmenopáusica. De la misma forma, se ha demostrado en diferentes estudios clínicos la asociación entre el incremento del EAT y los factores de riesgo cardiovascular. En dos estudios de población abierta y sujetos de ambos sexos, se ha identificado que el EAT está más engrosado en sujetos con SM25,26. Resultados similares a los del presente estudio, en el que se demostró que las posmenopáusicas con SM también tienen mayor cantidad de grasa epicárdica que las mujeres sin factores cardiometabólicos. En contraste con otros estudios que han incluido a participantes de ambos sexos, el interés de este estudio es la mujer, no solo porque existen diferencias relevantes de la distribución de los factores de riesgo entre los sexos, sino porque también se presentan algunas diferencias en la grasa epicárdica27. Se ha observado en la grasa epicárdica de las mujeres mayor cantidad de adiponectina y leptina que en los varones, y se ha propuesto que estas diferencias podrían deberse al efecto de las hormonas sexuales28.
A pesar de la importancia potencial de la medición del EAT, no hay consenso sobre su medición; algunos grupos, como el de Iacobellis et al18, han propuesto que la ecocardiografía es un método sencillo y presenta una correlación muy elevada con la medición por resonancia magnética (r = 0,901), con la ventaja de su bajo coste, su reproducibilidad y que no es invasiva, lo que permite considerar el método por ecocardiografía como una herramienta fácil para la valoración de los factores de riesgo cardiometabólico y de SM18.
En este trabajo se midieron las grasas visceral y corporal por la técnica de impedancia bioeléctrica, lo cual se podría considerar una limitación, ya que se considera más precisa la evaluación por tomografía computarizada. Sin embargo, la impedancia bioléctrica es una técnica económica, fácil de realizar y más segura, que evita la exposición a la radiación29. Se ha demostrado que la técnica de impedancia tiene una correlación elevada (r = 0,905) con la tomografía computarizada en la evaluación de la grasa visceral29. Por otra parte, aunque el tamaño muestral de este estudio es de 34 participantes, el análisis estadístico confirmó que con este número se alcanzaba una potencia estadística elevada y suficiente para detectar la asociación entre el EAT y los otros índices de adiposidad.
La principal fortaleza de este trabajo es que se haya realizado en población posmenopáusica; hasta donde conocemos, este es el primer estudio de medición ecocardiográfica de la grasa epicárdica centrado en esta etapa de la vida de la mujer. El estudio de la mujer posmenopáusica es importante porque durante esta etapa aumentan algunos factores de riesgo, como la resistencia a la insulina y la grasa abdominal, que, junto con otras alteraciones como en el perfil de lípidos, conduce a un incremento del riesgo cardiovascular30.
Los sitios de medición de la grasa epicárdica mostraron indistintamente correlación con la grasa abdominal y con la corporal, pero el surco auriculoventricular inferior presentó menor asociación con la resistencia a la insulina y el SM. La medición en el surco aorta-ventrículo derecho representa probablemente el sitio más accesible y reproducible, ya que los bordes en este surco se observan bien delimitados. Por el contrario, a nivel de los surcos ventrículo derecho-porción apical, la medición puede estar influida por la ventana ecocardiográfica; por ello es recomendable siempre la estandarización de la técnica. Además de las mediciones lineales del EAT, en este estudio se exploró un método sencillo para evaluar el área de la grasa en los surcos, que son los sitios del corazón en que se distribuye principalmente el tejido adiposo4,6. Con la medición del área de los surcos se observó una mayor asociación con el IMC, la grasa corporal total, la grasa visceral y la resistencia insulínica.
CONCLUSIONESEn este trabajo se demostró una asociación elevada del EAT medido por ecocardiografía con la grasa abdominal y otros índices de adiposidad en mujeres posmenopáusicas. También se observó que la cantidad de grasa epicárdica se relaciona con el grado de resistencia insulínica y la presencia de SM. Por lo anterior, medir el EAT por ecocardiografía puede ser de gran utilidad para identificar a mujeres con alto riesgo cardiovascular durante la menopausia.
CONFLICTO DE INTERESESNinguno.
Los autores Lourdes Basurto Acevedo y Arturo Zárate Treviño agradecen la beca de investigación que reciben del Sistema Nacional de Investigadores-CONACyT.