La investigación sobre la aterosclerosis coronaria humana está limitada por la incapacidad de realizar experimentos totalmente controlados y por la lentitud en la progresión de las lesiones. Afortunadamente, los modelos animales de daño arterial pueden aportar resultados comparables a los de ensayos en humanos y añaden información relevante sobre la respuesta vascular a distintas noxas. Estos modelos se han convertido en armas indispensables para conocer la interacción de la arteria coronaria con los dispositivos médicos y, en especial, la génesis de la neoíntima. Constituyen el primer paso en el análisis de la seguridad y la eficacia de los nuevos dispositivos. Las ventajas de estos modelos son la capacidad de simulación fisiopatológica de la enfermedad, el control estricto de las variables de confusión y la posibilidad de obtener datos cuantificables en breve tiempo. Para el estudio de la reestenosis, se han usado distintos modelos animales. Esta variedad refleja la ausencia del modelo animal ideal. Cada modelo tiene sus propias ventajas y desventajas. Este artículo revisa los principales modelos animales empleados en el estudio de la reestenosis, sus características, sus ventajas y desventajas en comparación con los humanos y las consideraciones necesarias para alcanzar el modelo animal ideal y el diseño del estudio perfecto.
Palabras clave
Los modelos más empleados en los estudios de reestenosis son los de roedores (ratas, ratones, conejos), cerdos, perros y primates. Los métodos para causar daño vascular más empleados en estos modelos son:
- •
Daño mecánico: sobredistensión de la arteria con balones de angioplastia no distensibles inflados a altas presiones1, balones muy distensibles inflados a bajas presiones para denudación endotelial2, inducción de daño con lazos formados con guías de angioplastia3,4 o mediante aterectomía direccional.
- •
Daños vasculares inducidos por agentes químicos (dieta), daños eléctricos5, por calor6, desecación endoluminal por aire7,8 o irradiación9.
- •
Inducción de inflamación grave implantando stents de cobre, que inducen reacción a cuerpo extraño10,11.
Para aumentar el grado de la lesión producida o reproducir las condiciones clínicas de los humanos que necesitan tratamiento con angioplastia (como la presencia de placas ateroscleróticas), distintos autores han empleado métodos complementarios de daño vascular antes o después del método principal12,13. Se puede someter a los animales a dietas con alto contenido en colesterol y grasas (daño químico) o a distintos medios de daño vascular, aisladamente o en combinación con la dieta hiperlipemiante. Esto genera modelos de doble o triple daño vascular. Sin embargo, no está totalmente demostrada la influencia que estos modelos de daño vascular múltiple tienen en los resultados finales14,15.
Modelos Experimentales en RoedoresModelo de arteria carótida de rataEl modelo de arteria carótida de rata se ha utilizado ampliamente para comprobar el daño vascular años antes de que la técnica de angioplastia se desarrollase. Estos estudios se basaban en el daño por denudación endotelial, identificando la capa intimal como la localización clave en la respuesta proliferativa. En este modelo, se suele emplear ambas arterias carótidas en cada animal. Estas se lesionan por desecación con aire8 o denudación endotelial con balón muy distensible a baja presión16,17. En este modelo se introduce un balón de trombectomía Fogarty de 2 Fr a través de una incisión en la arteria carótida externa hasta llegar a la arteria carótida común. Entonces se hincha el balón, que se retira a través de la arteria (aún hinchado) tres o más veces. Luego se deshincha el balón y se liga la arteria carótida externa.
Modelo de conejo hipercolesterolémico, arteria iliacaEl modelo de arteria iliaca en conejo aterosclerótico es un buen ejemplo del modelo de doble daño vascular. Aunque las lesiones observadas en este modelo difieren de las de la enfermedad humana, el modelo aporta información fundamental sobre los mecanismos de reparación después del daño vascular en una arteria enferma, así como para el análisis de tratamientos antirreestenóticos18–25. Otros modelos de conejo han empleado métodos de daño vascular simples, dobles o incluso triples, incluyendo daño de características bioquímicas mediante dietas proaterogénicas, seguido habitualmente de daño mecánico en ambas arterias iliacas mediante balones de angioplastia26–28 o desecación por aire. A las 4–6 semanas tras la inducción del daño vascular, es frecuente encontrar lesiones ateroscleróticas incipientes a las que aplicar un nuevo método de provocación de daño vascular o el tratamiento intervencionista que se pretende analizar.
Modelos Experimentales en Perros: Mínima Respuesta al Daño VascularVarios autores han explorado el modelo canino para el estudio de la reestenosis, principalmente por su reducido tamaño, su bajo coste y su amplia disponibilidad. Sin embargo, los perros tienen una elevada actividad fibrinolítica29 y un sistema de coagulación marcadamente distinto del humano30. Además, los vasos caninos sufren solo una mínima reacción neointimal tras el daño vascular en comparación con otros modelos animales31. Por ello, el modelo canino no es el más adecuado para el estudio de la reestenosis.
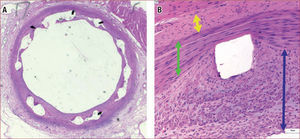
Modelo Porcino de Arterias CoronariasEl corazón porcino (fig. 1) es muy similar en tamaño y estructura anatómica al de los humanos32–34. El acceso endovascular al corazón porcino emplea catéteres y materiales habitualmente empleados en la angioplastia coronaria humana tanto para la arteria coronaria izquierda como para la derecha, lo que es una gran ventaja de este modelo. El abordaje arterial se realiza comúnmente a través de las arterias carótidas, aunque también es simple realizarlo a través de las arterias femorales. El daño mecánico mediante sobredistensión de la arteria y la denudación endotelial se han demostrado como noxas eficaces, aunque la primera induce más proliferación de células musculares lisas que la simple denudación endotelial. La sobredistensión de la arteria coronaria se puede conseguir con un balón de angioplastia sobredimensionado1,35 o implantando un stent sobredimensionado36. Este modelo permite reproducir una respuesta neointimal prácticamente idéntica a la humana en cuanto a tamaño celular, densidad celular y apariencia histopatológica1,10,37. Los especímenes patológicos obtenidos tras el daño exclusivamente con balón muestran laceración de la capa media simple; las muestras tras el implante de stents sobredimensionados muestran múltiples lesiones en la vecindad de los struts de los stents, muy similares a las observadas tras el empleo clínico en humanos38.
Tinción de hematoxilina-eosina de una arteria coronaria porcina, 1 mes tras el daño mecánico (stent sobredimensionado). A: daño mecánico tras el implante de un stent. B: respuesta neointimal (flecha azul) en relación con la capa media (flecha verde) y la adventicia (flecha amarilla).
Los modelos preclínicos basados en primates no humanos comparten una total similitud filogenética con los humanos, lo que constituye una ventaja singular. Sin embargo, la secuencia temporal de la respuesta proliferativa y la actividad trombótica en las arterias coronarias no tiene tan buena relación con los fenómenos presentes en la reestenosis humana u otros modelos animales. Su limitada disponibilidad, las restricciones legales, las dudas éticas y su elevado coste hacen poco práctico este modelo animal. Pocos estudios han empleado arterias en primates para analizar la respuesta al daño vascular con balón39–41.
Distintas Especies: ¿Respuesta Arterial Específica al Daño?Cada especie animal tiene mecanismos de reparación molecular y celular distintos; por ello, las lesiones vasculares tras el daño inducido pueden ser totalmente distintas de una especie a otra. Los modelos de daño vascular en carótidas de rata, ratón o porcinas casi nunca provocan estenosis arteriales hemodinámicamente significativas. En los modelos de conejos hipercolesterolémicos y en las arterias coronarias porcinas, se puede observar estenosis hemodinámica y macroscópicamente significativas, pero no ocurre de forma sistemática.
La respuesta arterial al daño inducido se desarrolla típicamente en seis fases:
- 1.
Daño arterial: denudación endotelial, fractura de la lámina elástica interna, daño de la capa media y la adventicia.
- 2.
Agregación plaquetaria y formación de trombo.
- 3.
Retroceso elástico.
- 4.
Inflamación.
- 5.
Migración de células musculares lisas, proliferación y producción de matriz extracelular42, componentes fundamentales del engrosamiento neointimal43–45.
- 6.
Remodelado arterial.
Cada uno de estos factores individuales contribuye a la reestenosis tras la angioplastia46,47. Tras el implante de stent, los factores esenciales en la inducción de reestenosis son el daño endotelial, la trombosis, la inflamación y la hiperplasia intimal48,49. Parece que ningún modelo preclínico por sí solo reproduce totalmente todos los componentes como sucede en la clínica humana. En el diseño de los estudios y la interpretación de los resultados, se debe tener en cuenta especialmente las diferencias entre especies en la reparación vascular. Si no, los resultados obtenidos pueden causar confusión o malentendidos. El propósito de la siguiente sección es resaltar las diferencias fisiopatológicas existentes entre las distintas especies.
Grado de daño arterial: injury scoreTodos los métodos de daño vascular comienzan con la denudación endotelial, y luego se progresa en profundidad. El grado y la susceptibilidad a daños más profundos varían entre especies. En el modelo de carótida de rata, es frecuente observar la denudación endotelial mientras permanecen intactas otras estructuras arteriales como las láminas elásticas y la capa media50. Este grado ligero del daño contrasta con el daño en profundidad que habitualmente se observa en los modelos de iliaca de conejo y de coronarias porcinas, en los que el daño en la lámina elástica interna y las disecciones de la media son similares a lo observado tras la angioplastia coronaria en humanos.
El tipo de noxa empleado en la inducción de daño vascular es otro factor esencial en el grado de la lesión obtenida, incluso dentro del mismo modelo. Por ejemplo, el daño arterial observado en ratas tras emplear lazos con guía (denudación endotelial) es mucho menor que el obtenido mediante daño eléctrico, en el que se observan zonas necróticas que abarcan desde la íntima hasta la adventicia. El distinto grado de daño inducido podría estimular distintas fases de reparación vascular en el mismo modelo animal.
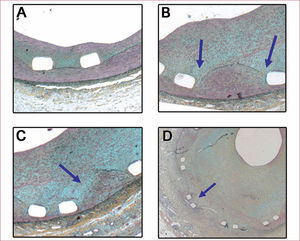
El grado de daño mecánico inducido en estos modelos experimentales puede condicionar la variabilidad observada en la producción de hiperplasia neointimal38. Por ello es importante contar con un sistema de gradación del daño vascular: en el modelo porcino de arterias coronarias (fig. 2), se ha descrito la escala de injury score, basada en la integridad de los componentes de la pared vascular. El grado más leve de daño vascular (injury score=0) representa un daño superficial de la íntima, en respuesta al cual se desarrolla una capa muy fina de neoíntima, como ocurre en el implante de stents de tamaño apropiado. Se puede observar grados de estenosis mayores a medida que la estructura metálica del stent fractura la lámina elástica interna (injury score=1), lacera la capa media (injury score=2) o la lámina elástica externa (injury score=3). Se desconoce aún si la integridad de las membranas elásticas tiene alguna influencia en los aspectos biomoleculares de la formación neointimal o si solo se trata de un marcador de la gravedad del daño vascular inducido. Hay evidencias de que la lámina elástica interna puede funcionar como barrera a la difusión de macromoléculas desde la luz vascular y como base para el anclaje de células endoteliales51.
Gradación del daño arterial (injury score) en el modelo de coronarias porcinas. A: injury score 0, daño vascular superficial con lámina elástica interna intacta. B: injury score 1, fractura de la lámina elástica interna por la estructura metálica del stent (flechas) con capa media intacta. C: injury score 2, laceración de la media (flecha) sin rotura completa de esta. D: injury score 3, fractura de la capa media con laceración de la lámina elástica externa.
La injury score se puede emplear para comparar distintos estudios entre sí y valorar la respuesta a distintas terapias37,52,53. Este sistema de cuantificación del daño vascular se ha demostrado útil también en el análisis de las arterias periféricas54–56.
Formación del trombo: la importancia de la respuesta trombótica y fibrinolíticaTras la inducción de daño vascular los sistemas de coagulación y de fibrinolisis se activan. Esta respuesta es totalmente diferente entre especies29,30,57, y se aprecian cantidades muy distintas de trombo mural en función del modelo animal empleado. En los modelos de carótida de rata y caninos, raramente se aprecia gran cantidad de trombo. Sin embargo, en el modelo de iliaca de conejo y de coronaria porcina, la presencia de trombos macroscópicos es frecuente. Los primates tienen sistemas hemostáticos y fibrinolíticos similares a los humanos, y se ha descrito una elevada propensión a la trombosis aguda del stent en los primeros 3 días tras el implante. Este fenómeno es distinto del observado en modelos porcinos, en el que hay riesgo de trombosis del stent solo en las primeras 6h29,31.
El trombo mural constituye un importante sustrato para la colonización por células musculares lisas provenientes de la capa media. Siguiendo este concepto, la cantidad de trombo mural podría condicionar la cantidad total de neoíntima desarrollada. Así, esta teoría explicaría, entre otros factores, por qué el modelo de carótida de rata y los modelos caninos no consiguen generar suficiente respuesta neointimal (y estenosis macroscópica) en comparación con la observable en modelos porcinos y de conejo. Sin embargo, son muchos los estudios que han fracasado en el intento de disminuir la reestenosis inhibiendo la formación del trombo con agentes anticoagulantes orales o intravenosos. Tampoco hay evidencia de ensayos clínicos de que los regímenes de tratamiento empleados eliminen la formación de trombo local.
Se debe tener en cuenta las diferencias en la formación de trombo mural tras la angioplastia en el diseño y la interpretación de los resultados de ensayos con agentes antitrombóticos en distintos modelos. Los modelos animales con más tendencia a la formación del trombo (como los cerdos) pueden ser más sensibles a los agentes antitrombóticos que los humanos. Esto explicaría que los agentes antitrombóticos sean efectivos en el modelo porcino pero no en la clínica humana. La literatura refleja varios ejemplos de este fenómeno con prostaciclina58, ácido acetilsalicílico (AAS)59, hirudina60–62 o heparinas de bajo peso molecular61. Estos estudios se realizaron en cerdos, y demostraron distintos grados de eficacia de estas intervenciones hemostáticas en la reducción de la reestenosis; sin embargo, su traslación a la clínica humana no mostró el beneficio esperado63–65. No solo se debe buscar la explicación de este hallazgo en la tendencia natural a la formación del trombo de los modelos porcinos, sino que también hay que analizar los objetivos de los estudios y su comparabilidad entre animales y humanos.
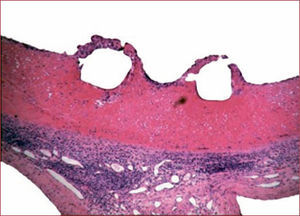
InflamaciónAunque el papel de la inflamación en la reestenosis es clave, pocos estudios analizan en profundidad su contribución. Lo que es más importante, la resolución de la inflamación es muy importante a largo plazo, puesto que puede producir una cicatriz fibrosa, con el consecuente remodelado vascular negativo. En el modelo de carótida de rata, se aprecia muy escasa respuesta inflamatoria al daño vascular. Sin embargo, los modelos de conejos hipercolesterolémicos y de coronarias porcinas muestran reacciones inflamatorias muy importantes (fig. 3), con infiltrado mononuclear precoz desde la superficie luminal y afectando a todo el trombo57,66.
En el modelo porcino la inflamación tiene relación directa con el engrosamiento neointimal obtenido67–69. El estudio histopatológico de las arterias humanas tratadas con stent también muestra un fenómeno precoz de inflamación aguda, especialmente intenso cuando la estructura metálica produce daño de la capa media o penetración en el núcleo lipídico70–72. Se ha correlacionado la infiltración de macrófagos en tejidos obtenidos de aterectomía y la activación del sistema monocitario sanguíneo con un aumento en la tasa de reestenosis73,74.
Migración y proliferación de células musculares lisasFueron los modelos de rata y ratón los que inicialmente demostraron el concepto de proliferación, aunque la migración y la proliferación de células musculares lisas de la media a la íntima se considera un hallazgo prominente en todos los modelos animales. Es indiscutible que el crecimiento neointimal formado por células musculares lisas causa la reestenosis del stent; no obstante, el papel de la proliferación celular dentro de la neoíntima es controvertido. La migración y la proliferación celular muestran diferencias entre especies. En ratas, ratones y cerdos, comienza precozmente tras la denudación endotelial (1–2 días) y persiste durante las 2–4 semanas siguientes, alcanzando el pico de actividad a las 2–3 semanas44,75. El modelo de arterias iliacas de conejo muestra la proliferación celular durante el mismo periodo, pero con pico de actividad a los 8 días76. En los primates, la proliferación es máxima entre los 4 y los 7 días, y después desciende a valores basales39. Todos estos modelos animales demuestran una respuesta hiperplásica al daño vascular, mientras que en la especie humana la cinética de proliferación celular no está tan bien definida. Las lesiones humanas muestran una respuesta hiperplásica con mucho menor contenido celular y matriz mucho más abundante que las observadas en modelos animales.
Retroceso elástico y remodelado vascularEl retroceso elástico agudo tras el deshinchado del balón y la constricción vascular tardía (remodelado vascular)77–80 es uno de los mecanismos más importantes en la producción de reestenosis en la época previa al stent. Los stents coronarios, que actúan como soporte mecánico dentro del vaso, eliminan el retroceso vascular y la pérdida general de calibre del vaso81,82. Los modelos de conejo hipercolesterolémico83,84, de arterias coronarias porcinas85 y de primates no humanos19 demuestran un comportamiento de remodelado muy similar al observado en humanos80. Las arterias de ratón tienden a dilatarse tras la angioplastia y son particularmente susceptibles al remodelado positivo5,86.
Aunque el papel del retroceso vascular y el remodelado ha perdido importancia en la época del stent, aún se debe tener en cuenta los modelos animales propensos a remodelado positivo o negativo, puesto que se ha detectado remodelado vascular positivo tras el implante de stents metálicos82, después del tratamiento con braquiterapia tras el implante de stent convencional81 y tras el implante de stents farmacoactivos87,88.
Preguntas Vigentes en Modelos PreclínicosLa relevancia de la variabilidad de distintos factores biológicos entre especies en la aparición de reestenosis y en los valores predictivos positivos o negativos aún no está totalmente aclarada. La validez de los resultados de los modelos animales con aterosclerosis es un buen ejemplo de este interrogante. La inducción de reestenosis se puede estudiar en arterias normales o previamente dañadas. Hasta ahora, la técnica empleada más frecuentemente era el daño vascular sobre una arteria normal. La arteria normal de un animal joven, sea rata, conejo o cerdo, difiere significativamente de la arteria aterosclerótica de un paciente anciano. Las arterias de estos animales, incluso tras emplear dietas hiperlipémicas (que generan lesiones en solo unas pocas semanas, en lugar de las décadas que tardan en humanos), no son capaces de mostrar las placas característicamente humanas con fibrosis densa, contenido habitualmente acelular y con aspectos de complejidad como ulceración, calcificación, trombosis o hemorragias. El impacto de esta complejidad de las placas ateroscleróticas humanas en la reestenosis y las potenciales ventajas que modelos animales de aterosclerosis distinta de la humana podrían presentar sobre modelos de arterias sanas son aún objeto de debate.
Otro ejemplo de líneas de investigación sin resultados definitivos es la influencia de moléculas protectoras contra la aterosclerosis (p. ej., la proteína colesteril-ester-transferasa [CETP]) en la generación de reestenosis en modelos preclínicos. Esta enzima está presente en humanos, cerdos y conejos, mientras que es deficiente en perros y roedores. Este hecho explica en parte la dificultad para producir lesiones ateromatosas en los últimos modelos89,90.
Conclusiones: El Modelo IdealSon muchos los artículos «catastrofistas» que hacen hincapié en el fracaso de los modelos animales para predecir los resultados en la clínica humana. Estos han generado un ambiente de desconfianza en los modelos preclínicos actualmente disponibles. Sin embargo, son estos modelos lo que ha permitido avanzar en el conocimiento del mecanismo de la reestenosis y sus potenciales dianas terapéuticas. El fracaso de los estudios animales en la predicción de la eficacia en la prevención de la reestenosis se puede atribuir a dos factores generales. Las diferencias entre especies son evidentes, si bien este factor no es fácilmente modificable excepto en los animales transgénicos. Además, hay varios factores modificables que muchas veces no se tiene en cuenta y se debe analizar y corregir para obtener el modelo animal ideal.
Actualmente no existe el modelo único ideal, aunque cada vez hay más investigación en ese campo. En la selección del modelo animal hay distintas variables que se debe tener en cuenta, basadas en las limitaciones y ventajas de cada modelo en función del propósito específico del estudio (p. ej., trombosis frente a migración celular). Teniendo en cuenta todos los datos analizados en este artículo, más que un «modelo ideal», debemos considerar en cada situación individual el «estudio ideal». Para conseguir un estudio ideal se debe tener en cuenta distintos factores:
- 1.
Estudios de patogenia, respuesta arterial al daño vascular: son válidos distintos modelos animales. Puesto que este modelo sirve para generar hipótesis y analizar posteriormente estrategias terapéuticas, es suficiente con detectar mínimos cambios arteriales. La confirmación de las hipótesis debe realizarse en modelos animales que demuestren buenos valores predictivos, como el modelo de coronarias porcinas.
- 2.
Estudios de seguridad: de nuevo, se debe considerar las diferencias fisiopatológicas entre especies antes de analizar qué tipo de arteria, dispositivo, dosis y fármaco, etc., se quiere emplear. En este caso es fundamental emplear modelos lo más semejantes al empleo clínico, el implante de stent coronario. Por ello, no todos los modelos animales serán válidos en este caso.
- 3.
Estudios de eficacia: el parámetro fundamental en estos estudios, además de la seguridad, es la cantidad de hiperplasia neointimal inducida. Los modelos que desarrollan más hiperplasia neointimal son los mejores en este caso. Es esencial analizar la respuesta histológica en distintos momentos, como en los humanos.
Hasta la fecha, considerando todas las variables descritas, el modelo de arterias coronarias porcinas sometidas a sobredistensión parece el más semejante al escenario clínico humano debido a las similitudes en anatomía, fisiología y fisiopatología coronarias. Además, permite emplear los mismos dispositivos que en humanos, y se obtiene la neoíntima más proliferativa en respuesta al daño vascular de todos los modelos animales.
Los modelos animales continuarán aportando información sobre reestenosis y ayudando en la selección de las mejores terapias para tratarla. Sin embargo, debemos mejorar la elaboración de modelos animales para proporcionar información adicional sobre los mecanismos y los potenciales tratamientos efectivos que después se pueda aplicar en la clínica humana.
Conflicto de InteresesNinguno.