Varón de 49 años, ex fumador y con historia familiar de cardiopatía isquémica prematura, acudió a urgencias por clínica de 1 mes de evolución de angina progresiva hasta mínimos esfuerzos. En 2001 había sufrido un infarto agudo de miocardio no Q tratado mediante un stent metálico convencional (SM) en la descendente anterior media. En la coronariografía realizada en 2007 por angina de esfuerzo, no presentaba reestenosis en el stent. Tras ajustar el tratamiento, se mantuvo asintomático y con ergometrías negativas hasta este ingreso de 2012.
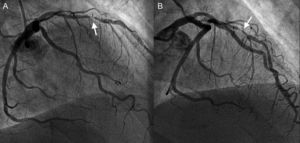
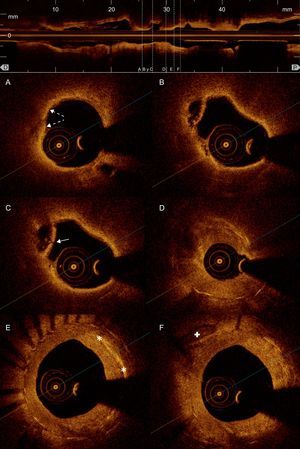
Ante la clínica de angina inestable, se solicitó una nueva coronariografía, que mostraba una reestenosis intra-stent focal y grave (fig. 1). Se avanzó sin complicaciones una guía de angioplastia a través de la estenosis y se decidió evaluarla con tomografía de coherencia óptica. Así se demostró la correcta expansión del stent, la ausencia de struts descubiertos y la presencia de neoaterosclerosis intra-stent (fig. 2), con una neoíntima de aspecto lipídico, una cavidad resultante de la rotura de la cápsula fibrosa de un fibroateroma de cápsula fina y una porción proximal de aspecto más fibroso con imágenes compatibles con depósitos de cristales de colesterol. Se predilató con balón la reestenosis intra-stent y se implantó otro stent farmacoactivo.
Tomografía de coherencia óptica: reestenosis intra-stent. A: neoíntima de aspecto lipídico (tejido de baja intensidad, bordes mal definidos y alta atenuación, que origina una sombra que limita la visualización de los struts del stent); presenta áreas hiperintensas puntiformes superficiales, compatibles con infiltración por macrófagos (flechas discontinuas). B: cavidad originada por la rotura de una placa neointimal con el remanente de su cápsula fibrosa. C: rotura puntual de la cápsula fibrosa de la misma placa (flecha). D: proliferación neointimal heterogénea que origina una importante estenosis de la luz arterial. E: áreas lineales muy hiperintensas compatibles con depósitos de colesterol (asteriscos) en la neoíntima. F: proliferación neointimal difusa y más homogénea que indica mayor contenido fibroso, con una placa de calcio (cruz) por fuera del stent.
Se ha considerado tradicionalmente que la reestenosis en los SM es una afección estable y benigna, que presentaría un crecimiento neointimal en los primeros 6-12 meses seguido de un estado quiescente posterior. Sin embargo, la evolución angiográfica de nuestro paciente y las imágenes de tomografía de coherencia óptica obtenidas apoyan la reciente teoría de la neoaterosclerosis como mecanismo activo causal de buena parte de las reestenosis y trombosis tardías de los stents1. Además, la clínica de angina progresiva y el hallazgo de una placa rota intra-stent confirman que su presentación tampoco se produce de manera constante como isquemia silente o angina estable, y se ha estimado que hasta un 9,5% de las reestenosis de SM se podrían manifestar como síndromes coronarios agudos2.
Estudios histológicos han mostrado que, si bien la neoaterosclerosis es un proceso común a los SM y los stents farmacoactivos, no se produce ni homogénea ni simultáneamente3. Su incidencia es superior y se manifiesta más precozmente en los stents farmacoactivos, mientras que resulta excepcional en los SM antes de los 2 años3,4. Pese a ello, la detección de lesiones de riesgo (fibroateromas de cápsula fina y placas rotas) es más frecuente en las reestenosis en SM, aunque —como se observa en nuestro caso (figs. 2A-C)— aparecen en la gran mayoría de los pacientes a partir de los 5 años del implante3–5.
Son muy escasos los datos disponibles respecto a la valoración por tomografía de coherencia óptica de las reestenosis tardías en SM. Takano et al4 valoraron el comportamiento inicial (<6meses) y evolutivo (>5años) de segmentos coronarios revascularizados con SM, y encontraron que en la primera fase había un recubrimiento neointimal homogéneo en todos los casos, mientras que sólo en la segunda se demostraba la presencia de depósitos de calcio, núcleos lipídicos o cristales de colesterol que se acompañaban de una reducción significativa de las áreas luminales. Habara et al5 compararon los hallazgos de reestenosis precoces (<1año) y tardías (>5 años) de SM y describieron diferencias significativas en la estructura de la neoíntima, estas con aspecto más heterogéneo y muy similar al de las placas aterosclóticas típicas. Por último, Yonetsu et al6 también han comunicado mayor atenuación y contenido lipídico en las neoíntimas de las reestenosis tardías de SM (>48 meses) respecto a las precoces.
Dada la conocida morbimortalidad asociada a las reestenosis y las trombosis de los stents, resulta fundamental profundizar en el estudio de sus mecanismos fisiopatológicos; la rotura y la exposición a la circulación sanguínea del material lipídico protrombótico contenido en la neoíntima pueden ser causa de buena parte de las segundas. Nuestro caso ilustra la capacidad que puede tener la tomografía de coherencia óptica para contribuir a la comprensión de dichos mecanismos.
FINANCIACIÓNEl Dr. Juan Ruiz-García agradece la ayuda económica recibida de la Sociedad Española de Cardiología a través de la Beca de la Sección de Hemodinámica y Cardiología Intervencionista para la Formación en Investigación Post Residencia del año 2011.