Se revisan los avances más relevantes relacionados con el tratamiento antiagregante y anticoagulante en el campo del síndrome coronario agudo y el intervencionismo coronario percutáneo. En primer lugar, se revisan los últimos estudios sobre la seguridad y la efectividad de la bivalirudina en el intervencionismo coronario. Se describen también los nuevos datos del abciximab en pacientes con síndrome coronario agudo sometidos a intervencionismo coronario. Además, se realiza una actualización sobre los antiplaquetarios de tercera generación, en concreto la nueva tienopiridina prasugrel. En cuanto a los fármacos anti-factor X, se comentan los resultados de los ensayos clínicos más recientes en cardiología intervencionista y síndrome coronario agudo. Por último, se revisan los avances en la utilización de heparinas de bajo peso molecular, sobre todo en el intervencionismo coronario.
Palabras clave:
adenosindifosfato.
glucoproteína.
heparina de bajo peso molecular.
heparina no fraccionada.
intervencionismo coronario percutáneo.
síndrome coronario agudo.
La bivalirudina es un inhibidor directo, reversible y específico de la trombina que, a diferencia de la heparina, puede actuar en la trombina unida al trombo, no precisa cofactor, no se inactiva por inhibidores circulantes, no se une a proteínas plasmáticas y, además, inhibe la activación plaquetaria mediada por la trombina1. Aunque existen otros inhibidores directos de la trombina, como la hirudina, la lepirudina o el argatrobán, estudios comparativos con la heparina no fraccionada (HNF) han demostrado que la bivalirudina tiene mejor perfil en la reducción de eventos isquémicos sin aumentar las tasas de sangrado2. Así, la bivalirudina está indicada en pacientes con un síndrome coronario agudo (SCA) que se someten a intervencionismo coronario percutáneo (ICP).
En el estudio REPLACE II (Randomized Evaluation in PCI Linking Angiomax to Reduced Clinical Events), se comparó en 6.010 pacientes a los que se realizó ICP la administración de bivalirudina, a veces asociada a un inhibidor de la glucoproteína IIb/IIIa (anti-GPIIb/IIIa) sólo en caso de necesidad por complicaciones en el procedimiento, con HNF más un anti-GPIIb/IIIa3. Los resultados mostraron la no inferioridad de la bivalirudina asociada a un anti-GPIIb/IIIa en situación de rescate (7,2%), con respecto al tratamiento con HNF más un anti-GPIIb/IIIa, con disminución del riesgo de hemorragia. No obstante, la población estudiada tenía un perfil de riesgo bajo y no incluía a pacientes con SCA, por lo que los resultados deben interpretarse con mucha cautela.
El estudio ACUITY (Acute Catheterization and Urgent Intervention Triage strategY) aleatorizó a 13.819 pacientes con SCA sin elevación del segmento ST (SCASEST) de moderado-alto riesgo, seleccionados para estrategia invasiva, a un tratamiento con heparina más un anti-GPIIb/IIIa, a bivalirudina más un anti-GPIIb/IIIa o a bivalirudina sola4. La bivalirudina tanto sola como combinada con un anti-GPIIb/IIIa no fue inferior al tratamiento estándar de heparina más un anti-GPIIb/ IIIa (el 7,8 frente al 7,3%; p = 0,32 para el tratamiento combinado; el 7,7 frente al 7,3%; p = 0,39 para la bivalirudina sola). La tasa de hemorragias mayores fue significativamente menor en el grupo de bivalirudina sola que en el de tratamiento estándar (el 3 frente al 5,7%; p < 0,001), resultados que se mantenían al año de seguimiento5. Como dato importante, casi la mitad de los pacientes incluidos en el estudio no presentaron elevación de troponinas, por lo que quizá el riesgo de hemorragias en el grupo de heparina pudo haber aumentado sin que se produjera beneficio con la adición de anti-GPIIb/IIIa. El único subgrupo donde la bivalirudina no mostró similar eficacia fue en el de pacientes pretratados con carga de clopidogrel, lo que resalta la importancia que tiene un correcto e intenso tratamiento antiplaquetario previo al ICP4. Por lo tanto, se puede considerar la bivalirudina como tratamiento anticoagulante de primera opción en pacientes con SCASEST que se someten a ICP, de la misma manera que la HNF y un anti-GPIIb/IIIa, como queda reflejado en las actuales guías de práctica clínica6,7.
El papel de la bivalirudina en pacientes con SCA con elevación del segmento ST (SCACEST) ha sido evaluado recientemente en el estudio HORIZONS-AMI (Harmonizing Outcomes with Revascularization and Stents in Acute Myocardial Infarction)8. En él se aleatorizó a 3.602 pacientes con SCACEST referidos a ICP primario a un tratamiento con bivalirudina o con heparina más un anti-GPIIb/IIIa. El uso de bivalirudina en monoterapia disminuyó la incidencia del evento combinado de sangrado mayor y eventos cardiovasculares mayores (muerte, reinfarto, nueva revascularización e ictus a los 30 días) respecto al tratamiento convencional (el 9,2 frente al 12,1%; p = 0,005). Esta reducción se produjo a expensas de un 40% en las tasas de sangrado (el 4,9 frente al 8,3%; p < 0,001). Al igual que en los pacientes con SCASEST, estos resultados se mantenían al año de seguimiento9. Hay que destacar que el grupo tratado con bivalirudina presentó una mayor incidencia de trombosis del stent en las primeras 24 h, sin diferencias a los 30 días, lo cual se atribuyó a un efecto antiplaquetario insuficiente durante las primeras 24 h a pesar de la carga de 600 mg de clopidogrel. De hecho, hasta el 66% de los pacientes del estudio recibieron HNF antes de la aleatorización y sólo un 60%, carga de 600 mg de clopidogrel, por lo que no es de extrañar que la administración de bivalirudina sola o una dosis de carga menor de clopidogrel se hayan postulado como factores independientes para que se produzca trombosis del stent10. En resumen, la utilización de bivalirudina, independientemente de la administración previa de heparina, en pacientes con SCACEST referidos a ICP primario es una opción válida, como queda reflejado en la última actualización de las guías de práctica clínica11.
Por último, se ha estudiado el papel de la bivalirudina en pacientes con angina estable o inestable referidos a ICP. Así, el estudio ISAR-REACT 3 (Intracoronary Stenting and Antithrombotic Regimen: Rapid Early Action for Coronary Treatment) aleatorizó a 4.570 pacientes con angina estable o inestable y pretratados con 600 mg de clopidogrel a bivalirudina o HNF12. El tratamiento con bivalirudina no resultó en una disminución de eventos adversos (combinado de sangrado mayor y eventos cardiovasculares) respecto a la HNF, aunque sí se asoció a una menor tasa de sangrados, tanto a 30 días como al año de seguimiento13.
NUEVOS DATOS DE ABCIXIMAB EN EL INTERVENCIONISMO CORONARIO DEL SÍNDROME CORONARIO AGUDOEl abciximab es el fragmento Fab del anticuerpo monoclonal 7E3 dirigido contra el receptor GPIIb/ IIIa localizado en la superficie plaquetaria14. A pesar de su corta semivida plasmática, su efecto antiagregante dura aproximadamente 48 h tras su administración15. El abciximab fue el primer anti-GPIIb/IIIa estudiado en el ICP, y se demostró reducción en la tasa de eventos cardiovasculares16,17. No obstante, esos estudios se realizaron en escenarios donde el tratamiento antiagregante dista mucho del actualmente recomendado, fundamentalmente en lo que concierne a la administración de clopidogrel. Los estudios ISAR-REACT 1 y 2 evaluaron la adición de abciximab en comparación con placebo en pacientes pretratados con 600 mg de clopidogrel sometidos a ICP18,19. En el estudio ISARREACT 1 se incluyó a 2.159 pacientes en riesgo bajo-moderado referidos a ICP, y no se objetivaron diferencias significativas en la tasa de eventos adversos entre el grupo de abciximab y el de placebo18. Sin embargo, en el estudio ISAR-REACT 2, que evaluó a 2.022 pacientes con SCA de alto riesgo sometidos a ICP, sí se redujo el porcentaje de eventos adversos en la rama de abciximab19. Lo que parece seguro, a raíz de los resultados del estudio GUSTO IV-ACS (Global utilization of streptoquinase and t-PA for occluded coronary arteries trial IV in Acute Coronary Syndromes), es que la administración de abciximab en pacientes con SCASEST no referidos a ICP no aporta ningún beneficio a la reducción de la mortalidad20. Además, parece que el uso intracoronario de esta molécula puede reducir la obstrucción microvascular y el tamaño del infarto, aunque esta última afirmación precisa de grandes estudios aleatorizados que lo confirmen21.
El uso de abciximab en pacientes con SCACEST remitidos a ICP primario se evaluó en el estudio CADILLAC (Controlled Abciximab and Device Investigation to Lower Late Angioplasty Complications)22. En él, se aleatorizó a 2.082 pacientes con SCACEST remitidos a ICP mediante un diseño factorial a angioplastia con balón o con stent y a abciximab o placebo. La incidencia a 6 meses de eventos adversos (definidos como muerte, reinfarto, ictus o nueva revascularización) fue menor en los pacientes a quienes se trató con stent en vez de balón, independientemente de si se los trató con abciximab o no. Para comprobar el efecto del abciximab en el ICP primario en comparación con placebo, se realizó un metaanálisis con más de 1.100 pacientes, y se objetivó una disminución significativa del riesgo de muerte o reinfarto en el grupo de abciximab, a expensas de un aumento en la tasa de sangrado23. Sin embargo, este efecto del abciximab no es diferente del logrado con otros anti-GPIIb/IIIa, como tirofibán o eptifibatida24. Por último, la estrategia de utilizar de forma «facilitada» abciximab antes del ICP primario, ya sea solo o combinado con dosis reducidas de reteplasa, no fue más eficaz que la utilización de abciximab en el momento del ICP, por lo que se recomienda el uso de abciximab como terapia coadyuvante en el momento del ICP25.
Por lo tanto, en pacientes con un SCASEST sometidos a ICP, el beneficio de la administración de abciximab es más marcado en aquellos pacientes con criterios de alto riesgo6,7. En cuanto a los pacientes con SCACEST, es razonable comenzar con la administración de abciximab en el momento del ICP primario y siempre en pacientes seleccionados (p. ej., con mucha carga trombótica)11,26.
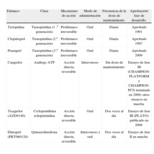
ANTIPLAQUETARIOS DE TERCERA GENERACIÓN: PRASUGRELEl tratamiento antiagregante es una terapia fundamental para los pacientes con SCA. Desde que se conoce que el adenosindifosfato (ADP) es uno de los mediadores más importantes en el fenómeno de aterotrombosis, la inhibición del receptor plaquetario de ADP, en particular el subtipo P2Y12, tiene un papel fundamental en la prevención de eventos cardiovasculares en pacientes en alto riesgo, como son aquellos con SCA o los que se someten a ICP27. Aunque existen numerosos estudios que demuestran la eficacia del inhibidor del receptor de ADP P2Y12 clopidogrel en este contexto, la experiencia clínica y los hallazgos de laboratorio han mostrado que hay una amplia variabilidad en su respuesta inhibitoria plaquetaria, en la que se implican factores clínicos, genéticos y celulares28. Pero lo más importante es que estos efectos farmacodinámicos van asociados a una mayor frecuencia de eventos adversos, lo cual subraya la necesidad de mejores estrategias de tratamiento antiagregante29. Dado que los efectos alcanzados con el bloqueo del receptor ADP P2Y12 son indiscutibles, diferentes moléculas se encuentran en fase de investigación con el objetivo de lograr una inhibición más rápida, potente y eficaz que con clopidogrel (tabla 1)30. De todas estas, prasugrel es la primera en ser aprobada por las autoridades reguladoras.
Propiedades de los actuales y los futuros antagonistas del receptor de ADP P2Y12
| Fármaco | Clase | Mecanismo de acción | Modo de administración | Frecuencia de la dosis de mantenimiento | Aprobación/ fase de desarrollo |
| Ticlopidina | Tienopiridina (1 .a generación) | Profármaco irreversible | Oral | Diaria | Aprobado 1991 |
| Clopidogrel | Tienopiridina (2.a generación) | Profármaco irreversible | Oral | Diaria | Aprobado 1997 |
| Prasugrel | Tienopiridina (3.a generación) | Profármaco irreversible | Oral | Diaria | Aprobado 2009 |
| Cangrelor | Análogo ATP | Acción directa, reversible | Intravenoso | Sin dosis de mantenimiento | Ensayo de fase III (CHAMPION-PLATFORM y CHAMPION-PCI) terminado en 2009; otros ensayos en marcha |
| Ticagrelor (AZD6140) | Ciclopentiltrina zolopirimidina | Acción directa, reversible | Oral | Dos veces al día | Ensayo de fase III (PLATO) publicado en 2009 |
| Elinogrel (PRT060128) | Quinazolinediona | Acción directa, reversible | Intravenoso y oral | Dos veces al día | Ensayo de fase II en marcha |
Adaptada de Vivas et al30.
La tienopiridina de tercera generación prasugrel es un profármaco que se administra por vía oral y, al igual que el clopidogrel, debe sufrir una biotransformación hepática para convertirse en su metabolito activo antes de ejercer su efecto, el bloqueo irreversible del receptor P2Y1231. No obstante, prasugrel presenta un inicio de acción más rápido y una menor variabilidad interindividual que clopidogrel, con lo que se obtiene una mayor inhibición plaquetaria32.
La evidencia científica del prasugrel tiene su base en el ensayo TRITON (Trial to assess Improvement in Therapeutic Outcomes by optimizing platelet inhibition with prasugrel)-TIMI 38, que evaluó la eficacia clínica y la seguridad de prasugrel (dosis de carga de 60 mg seguida de una dosis de mantenimiento de 10 mg), en comparación con clopidogrel (dosis de carga de 300 mg seguida de una dosis de mantenimiento de 75 mg) en 13.608 pacientes con SCA de moderado-alto riesgo tratados con ICP33. En ese estudio de fase III, aleatorizado, a doble ciego y de grupos paralelos, prasugrel obtuvo una significativa reducción relativa del 19% (el 9,9% con prasugrel frente al 12,1% con clopidogrel; hazard ratio [HR] = 0,81; p < 0,001) en las tasas de la variable de valoración principal (combinación de muerte cardiovascular, infarto de miocardio e ictus no fatal), además de una disminución significativa de la tasa de trombosis del stent (el 9,7 frente al 11,9%; HR = 0,81; p = 0,0001) durante un periodo de seguimiento de 15 meses34. Estos beneficios se produjeron a costa de un aumento del riesgo de hemorragias mayores según los criterios del grupo TIMI, no relacionadas con bypass coronario (el 2,4 frente al 1,8%; p = 0,03), observadas sobre todo en la fase de mantenimiento con prasugrel33. Debido a este hecho, es importante analizar si la disminución de eventos cardiovasculares supera el riesgo de hemorragias en pacientes en tratamiento con prasugrel. Así, el beneficio clínico neto de prasugrel fue superior al de clopidogrel, a pesar del mayor número de sangrados (el 12,2 frente al 13,9%; HR = 0,87; p = 0,004). Este efecto beneficioso se debió en gran parte a una notable disminución de los infartos de miocardio no fatales, sin observarse diferencias en la mortalidad o en el porcentaje de ictus, y se comprobó desde el tercer día y se mantuvo durante todo el periodo de seguimiento35. Es importante destacar que existen determinados subgrupos de pacientes que parecen obtener un mayor beneficio con prasugrel, como fue el caso de los pacientes con diabetes mellitus y los pacientes con SCACEST, en los que no se observó aumento alguno del riesgo hemorrágico36,37. Por el contrario, el análisis neto mencionado anteriormente no objetivó beneficio en los pacientes de edad avanzada (> 75 años), en pacientes con un peso < 60 kg ni en los que tenían antecedentes de ictus o accidente isquémico cerebral transitorio33.
El uso clínico de prasugrel ha sido aprobado recientemente, pero sólo en pacientes con SCA tratados mediante ICP. La eficacia clínica de prasugrel en pacientes con angina inestable/SCASEST que reciben tratamiento médico se está evaluando actualmente en el ensayo TRILOGY-SCA (Targeted Platelet Inhibition to Clarify the Optimal Strategy to Medically Manage Acute Coronary Syndromes, NCT00699998). Prasugrel también se está evaluando en pacientes sometidos a ICP electivo en un estudio de función plaquetaria llamado TRIGGER-PCI (Testing Platelet Reactivity in Patients Undergoing Elective Stent Placement on Clopidogrel to Guide Alternative Therapy With Prasugrel, NCT00910299).
FÁRMACOS ANTI-FACTOR Xa. RESULTADOS DE LOS ENSAYOS CLÍNICOS MÁS RECIENTES EN CARDIOLOGÍA INTERVENCIONISTA Y SÍNDROME CORONARIO AGUDODe los fármacos anti-factor Xa, el fondaparinux es del que hay más evidencias científicas en la actualidad. Al igual que las heparinas de bajo peso molecular, el fondaparinux tiene disponibilidad subcutánea y una larga semivida, que permite su administración una vez al día para todas sus indicaciones38. La eficacia y la seguridad de una única dosis subcutánea diaria de fondaparinux (2,5 mg) se compararon con el tratamiento subcutáneo con enoxaparina 1 mg/kg en el ensayo clínico OASIS-5 (Organization to Assess Strategies in Acute Ischemic Syndromes Investigators)39. En ese estudio se aleatorizó a 20.078 pacientes con SCASEST a estos dos tratamientos; el objetivo primario fue la no inferioridad del fondaparinux con respecto a la enoxaparina. Se objetivó una proporción de eventos cardiovasculares similar en ambos grupos; sin embargo, la tasa de sangrados en los tratados con fondaparinux resultó ser inferior respecto al grupo de enoxaparina (el 2,2 frente al 4,1%; p < 0,001). Es interesante que la mortalidad a los 6 meses fuera menor en el grupo de fondaparinux (el 5,8 frente al 6,5%; p = 0,05), disminución relacionada con el porcentaje de sangrados. Otro hallazgo importante de este estudio fue la mayor tasa de trombosis del catéter durante el ICP con fondaparinux (el 0,9 frente al 0,4%; p < 0,001).
El fondaparinux también se ha evaluado en el contexto de pacientes con SCACEST. En el estudio OASIS-6 se aleatorizó a 12.092 pacientes a 2,5 mg diarios de fondaparinux subcutáneo durante 8 días o hasta el alta hospitalaria y a HNF o ningún tratamiento anticoagulante40. Los pacientes se dividieron en dos estratos en función de que estuviese indicado o no el uso de HNF a juicio del investigador: estrato 1 (sin indicación de HNF) y estrato 2 (con indicación de HNF). Se observó un beneficio estadísticamente significativo en el grupo de fondaparinux en el evento combinado de muerte o reinfarto a los 9 días, 30 días y al final del estudio (6 meses). Esta reducción sólo se observó en el estrato 1 (el 14 frente al 11,2%; p < 0,001), pero no en el estrato 2, en el que la mayoría de los pacientes recibieron ICP. Los pacientes tratados con fondaparinux presentaron, además, un mayor número de trombosis relacionadas con el catéter y una menor tasa de sangrados. Por lo tanto, a la luz de los datos del estudio OASIS-6, se puede concluir que en los pacientes con SCACEST sin indicación de tratamiento con HNF el fondaparinux es más efectivo y seguro que ninguna terapia anticoagulante, independientemente de que se use o no estreptocinasa como agente fibrinolítico. Si el tratamiento incluye un agente trombolítico específico de la fibrina con indicación de HNF, el fondaparinux es tan eficaz y seguro como la HNF. Por último, en los pacientes manejados con ICP primario, el fondaparinux se asocia a un mayor número de complicaciones que la HNF, sobre todo en relación con el procedimiento.
El hecho de que en esos estudios se observara un mayor número de complicaciones relacionadas con el procedimiento en el grupo de fondaparinux llevó a analizar retrospectivamente los datos, sobre todo del estudio OASIS-5. En este, los investigadores encontraron que el aumento del riesgo de trombosis relacionada con el catéter se podía evitar usando HNF durante el procedimiento sin perder las ventajas del fondaparinux en cuanto a una menor tasa de sangrados. No obstante, la respuesta a esta hipótesis se analiza actualmente en el estudio FUTURA (FondaparinUx Trial with UFH during Revascularization in patients with ACS)-OASIS 8.
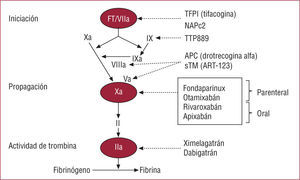
Actualmente se encuentra en fase de investigación una serie de agentes orales e intravenosos que inhiben el factor Xa (fig. 1)41. El otamixabán es un agente intravenoso que inhibe directamente el factor Xa. Sus propiedades farmacocinéticas, con una semivida de 30 min, una dosificación ajustada al peso, sin necesidad de monitorizar las concentraciones y su poca eliminación por vía renal, hacen de esta molécula un tratamiento anticoagulante prometedor en los pacientes que van a someterse a un ICP. Los estudios de fase II SEPIA (Study Program to Evaluate the Prevention of Ischemia with direct Anti-Xa inhibition)-PCI y SEPIA-ACS1 TIMI 42 compararon cinco infusiones crecientes de otamixabán con HNF o HNF más eptifibatida, respectivamente42,43. En ambos estudios de búsqueda de dosis se observó que infusiones de 0,100-0,140 mg/kg/h disminuían la tasa de eventos isquémicos y presentaban un perfil de seguridad similar al de HNF o HNF más eptifibatida.
Mecanismo de acción de los nuevos anticoagulantes (adaptado de Weitz et al41).
Acrónimos y nombres de los diferentes estudios citados en el texto
| Acrónimo | Nombre |
| ACUITY | Acute Catheterization and Urgent Intervention Triage strategY |
| APPRAISE | Apixaban for Prevention of Acute Ischemic and Safety Events |
| ATLAS | Anti-Xa Therapy to Lower Cardiovascular Events in Addition to Aspirin With or Without Thienopyridine Therapy in Subjects With Acute Coronary Syndrome |
| CADILLAC | Controlled Abciximab and Device Investigation to Lower Late Angioplasty Complications |
| EXTRACT | Enoxaparin and Thrombolysis Reperfusion for Acute Myocardial Infarction |
| FUTURA | FondaparinUx Trial with UFH during Revascularization in patients with ACS |
| GUSTO IV-ACS | Global utilization of streptoquinase and t-PA for occluded coronary arteries trial IV in Acute Coronary Syndromes |
| HORIZONS-AMI | Harmonizing Outcomes with Revascularization and Stents in Acute Myocardial Infarction |
| ISAR-REACT | Intracoronary Stenting and Antithrombotic Regimen: Rapid Early Action for Coronary Treatment |
| OASIS | Organization to Assess Strategies in Acute Ischemic Syndromes Investigators |
| REPLACE | Randomized Evaluation in PCI Linking Angiomax to Reduced Clinical Events |
| SEPIA | Study Program to Evaluate the Prevention of Ischemia with direct Anti-Xa inhibition |
| STEEPLE | Safety and Efficacy of Enoxaparin in PCI Patients, an International Randomized Evaluation |
| SYNERGY | Superior Yield of the New Strategy of Enoxaparin, Revascularization and Glycoprotein IIb/IIIa inhibitors |
| TRIGGER-PCI | Testing Platelet Reactivity in Patients Undergoing Elective Stent Placement on Clopidogrel to Guide Alternative Therapy With Prasugrel |
| TRILOGY-ACS | Targeted Platelet Inhibition to Clarify the Optimal Strategy to Medically Manage Acute Coronary Syndromes |
| TRITON | Trial to assess Improvement in Therapeutic Outcomes by optimizing platelet inhibition with prasugrel |
Entre los agentes inhibidores del factor Xa orales, el rivaroxabán y el apixabán se encuentran en evaluación en ensayos fase III. El estudio fase II APPRAISE (Apixaban for Prevention of Acute Ischemic and Safety Events) evaluó la adición de diferentes dosis de apixabán al tratamiento antiagregante convencional durante 6 meses en 1.715 pacientes con SCA44. Tanto la dosis de 2,5 mg dos veces al día como la de 10 mg/día se asociaron a una tasa mayor de sangrados, fundamentalmente en los pacientes doblemente antiagregados, con tendencia a menor incidencia de eventos isquémicos. El estudio de fase III APPRAISE-2 intentará aclarar cuál es el perfil riesgo/beneficio de este fármaco. En cuanto al rivaroxabán, el estudio de fase II ATLAS ACS (Anti-Xa Therapy to Lower Cardiovascular Events in Addition to Aspirin With or Without Thienopyridine Therapy in Subjects With Acute Coronary Syndrome)-TIMI 46, publicado recientemente, investigó qué dosis de rivaroxabán puede ser segura y efectiva para combinarla con ácido acetilsalicílico y clopidogrel en pacientes con SCA45. Así, se aleatorizó a 3.491 pacientes a diferentes dosis de rivaroxabán o placebo durante 6 meses. A pesar de no estar diseñado para demostrar una mayor eficacia, se objetivó una reducción en la tasa de eventos cardiovasculares (muerte, infarto de miocardio o ictus) a favor del tratamiento con rivaroxabán, beneficio mayor en el grupo tratado sólo con ácido acetilsalicílico.
Sin embargo, el tratamiento con rivaroxabán se asoció a una mayor incidencia de sangrado dependiente de la dosis. El estudio de fase III ATLAS-2 TIMI 52 se encargará de evaluar en más de 15.000 pacientes con SCA si la adición de rivaroxabán al tratamiento antiagregante se traduce en una menor incidencia de eventos adversos sin aumentar la tasa de sangrado.
HEPARINAS DE BAJO PESO MOLECULAR. UTILIDAD EN INTERVENCIONISMO CORONARIOEn comparación con la HNF, las heparinas de bajo peso molecular (HBPM) presentan una serie de ventajas: no requieren monitorizar ni ajustar la dosis y muestran un mejor perfil de seguridad con una menor tasa de sangrados46. Por ello no es de extrañar que las HBPM hayan ido sustituyendo a la HNF en el manejo de los pacientes con SCA. Así, la enoxaparina es la única HBPM de la que se ha demostrado una clara superioridad evitando la recurrencia de eventos isquémicos frente a la HNF en el manejo de pacientes con SCASEST, mientras que otras HBPM (dalteparina y nadroparina) sólo se han demostrado de eficacia similar a la de la HNF en estos pacientes47.
El uso de las HBPM también se ha evaluado en pacientes con SCACEST. Así, el estudio EXTRACT (Enoxaparin and Thrombolysis Reperfusion for Acute Myocardial Infarction)-TIMI 2548 aleatorizó a un total de 20.506 pacientes con SCACEST tratados con agentes fibrinolíticos a recibir enoxaparina durante toda la hospitalización o HNF utilizada durante al menos las primeras 48 h de tratamiento. En ese estudio, la enoxaparina disminuyó de forma significativa la incidencia de muerte o recurrencia de infarto de miocardio no mortal los primeros 30 días en un 17% (el 9,9% en los pacientes tratados con enoxaparina frente al 12% en los tratados con HNF).
Las HBPM se han usado en el contexto del ICP, pero la mayoría de los datos se han obtenido con enoxaparina. Hasta hace poco tiempo y debido a la ausencia de estudios clínicos, se recomendaba añadir HNF a los pacientes tratados con enoxaparina que iban a ser sometidos a ICP. En el estudio SYNERGY (Superior Yield of the New Strategy of Enoxaparin, Revascularization and Glycoprotein IIb/IIIa inhibitors) se comparó la administración de enoxaparina (1 mg/kg dos veces al día) con la de HNF como agente antitrombótico en el contexto del ICP en 4.587 pacientes con SCASEST49. No hubo diferencias en el objetivo primario del estudio (muerte o infarto en los 30 días posteriores a la aleatorización) ni en la incidencia de eventos isquémicos durante el ICP entre los dos grupos. No obstante, se produjo una marcada tendencia hacia mayor frecuencia de hemorragias con la enoxaparina cuando se la comparó con la HNF, posiblemente aumentadas por las reacciones cruzadas del tratamiento antitrombótico después de la aleatorización49.
El estudio STEEPLE (Safety and Efficacy of Enoxaparin in PCI Patients, an International Randomized Evaluation), que incluyó a 3.528 pacientes sometidos a ICP electivo, demostró la seguridad y la eficacia del tratamiento con enoxaparina, con menores tasas de hemorragia que el tratamiento con HNF50. Por lo tanto, de la evidencia científica se puede extraer que lo más importante para evitar un mayor número de eventos adversos es mantener el mismo tratamiento anticoagulante que se aplicaba antes de llegar al laboratorio de hemodinámica, ya sea HNF o HBPM. Respecto a esta, las actuales guías de práctica clínica recomiendan el uso de enoxaparina a dosis subcutánea de 1 mg/kg, y no es necesario administrar dosis adicionales si la última dosis se aplicó en las 6–8 h previas al ICP, mientras que si han pasado más de 6–8 h se deberá administrar una dosis intravenosa de enoxaparina de 0,3 mg/kg antes del ICP6,11.
CONCLUSIONESEl tratamiento antiagregante y anticoagulante es un componente fundamental en el manejo de los pacientes con SCA e ICP. En los últimos años se ha producido un avance considerable en el desarrollo de estos fármacos, y ha disminuido la incidencia de eventos cardiovasculares, aunque se ha producido en algunos casos un aumento de la tasa de hemorragias. De un adecuado equilibrio entre su eficacia y su seguridad dependerá el uso adecuado de estos fármacos. No obstante, los estudios actualmente en desarrollo ayudarán a identificar para cada escenario clínico el agente antitrombótico con mejor perfil riesgo/beneficio.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.