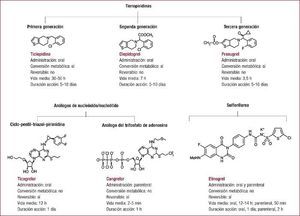
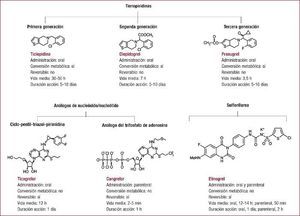
La antiagregación en el infarto agudo de miocardio con elevación del segmento ST es uno de los aspectos que más ha cambiado en los últimos años. Después de más de una década en que la pauta era ácido acetilsalicílico y clopidogrel tanto en la angioplastia primaria como en la fibrinolisis, estamos en una nueva era en que la presencia de nuevos fármacos como el prasugrel y el ticagrelor aporta nuevas opciones para mejorar el pronóstico de nuestros pacientes. Este artículo revisa la evidencia existente sobre los diferentes antiagregantes en el contexto del infarto agudo de miocardio con elevación del segmento ST y dedica gran parte a los nuevos antiagregantes en el campo de la angioplastia primaria. Se abordan otros aspectos como la antiagregación durante la fibrinolisis, el papel actual de los inhibidores de la glucoproteína IIb/IIIa o la duración del tratamiento.
Palabras clave
La antiagregación en el infarto agudo de miocardio con elevación del segmento ST (IAMCEST) es uno de los aspectos que más ha cambiado en los últimos años.
Después de más de una década en la que la doble antiagregación que acompañaba al tratamiento del infarto (angioplastia primaria o fibrinolisis) era ácido acetilsalicílico (AAS) más clopidogrel, estamos en una nueva era en que la presencia de otros antiagregantes, prasugrel y ticagrelor, aporta nuevas opciones para mejorar el pronóstico de nuestros pacientes.
En este artículo se revisa la evidencia existente con los diferentes antiagregantes en el contexto del IAMCEST. Se dedica gran parte de la revisión a la antiagregación en la angioplastia primaria (intervención coronaria percutánea primaria [ICPp]) con una descripción detallada de los nuevos antiagregantes (NAG) en este contexto. A continuación se revisa la doble antiagregación durante la fibrinolisis, el papel actual de los inhibidores de la glucoproteína IIb/IIIa (GPIIb/IIIa), la duración del mantenimiento de la antiagregación y el análisis de un subgrupo importante y nada despreciable, como el de los pacientes anticoagulados que padecen un infarto.
Aunque algunos de los conceptos farmacológicos y estudios clínicos se comentan en otros artículos de esta monografía, consideramos que es necesario revisarlos en relación con el IAMCEST para dar coherencia a este trabajo.
Tipo de estrategia de reperfusiónLa reperfusión mediante ICPp es la estrategia de reperfusión recomendada y potenciada para el tratamiento del IAMCEST, siempre que se pueda realizar en unos tiempos adecuados desde el primer contacto médico y por equipos experimentados. Los diferentes programas que se han ido generando y extendiendo en los últimos años han llevado a un crecimiento, si no exponencial, sí muy importante de la ICPp, hasta el punto de que en España se ha pasado de realizar poco más de 5.000 ICPp en 2005 a cerca de 14.000 en 20121. Seguro que este aumento seguirá produciéndose en los próximos años, pero no debemos olvidar que a muchos de los pacientes con IAMCEST no se los trata con ICPp. Según datos comunicados en el registro DIOCLES2, se revascularizó con ICPp a un 53% de los pacientes con IAMCEST incluidos en el registro, pero seguía habiendo un 26% que se trataba con fibrinolisis y, lo más importante, no se reperfundía al 21%. Con los años se ha visto que los programas de ICPp determinan un aumento obvio de la penetración de la revascularización mecánica, pero se debe destacar sobre todo la reducción de los pacientes no reperfundidos.
Al hablar de antiagregación en el IAMCEST debemos comentar al mismo tiempo las estrategias de reperfusión, pues serán lo que determine qué tipo de antiagregantes podemos usar, cuándo iniciar la antiagregación y con qué dosis.
Antiagregación en la angioplastia primariaÁcido acetilsalicílicoEl primer estudio que mostró el beneficio clínico del AAS en el infarto fue el ISIS-2, un ensayo clínico multicéntrico que incluyó a 17.187 pacientes, en el que se demostró que el AAS reduce el 23% la mortalidad vascular frente a placebo, sin incremento de la hemorragia cerebral o el sangrado que requiere transfusión3. En un metanálisis4 de más de 200.000 pacientes incluidos en estudios aleatorizados, se encontró que el tratamiento antiplaquetario, incluido el AAS, reduce el riesgo de padecer un evento vascular en un 25%.
El AAS debe administrarse preferiblemente por vía oral (es recomendable una dosis de 150–300 mg), pero también puede administrarse por vía intravenosa a pacientes que no sean capaces de deglutir. Hay muy pocos datos clínicos sobre la dosis intravenosa óptima, aunque los datos farmacológicos apuntan a que se considera adecuada una dosis de AAS de 80–150 mg en bolo intravenoso5.
ClopidogrelLa eficacia del clopidogrel en pacientes con síndrome coronario agudo se ha demostrado en ensayos clínicos; durante más de una década ha constituido la piedra angular indiscutible del tratamiento antiagregante en la cardiopatía isquémica aguda. Tras ensayos que estudiaron el clopidogrel en poblaciones de pacientes con síndrome coronario agudo sin elevación del segmento ST, en 2005 se publicaron los estudios COMMIT6 y CLARITY7, que estudiaron a pacientes con IAMCEST. El estudio COMMIT evaluó el efecto del clopidogrel comparado con placebo en adición al AAS en pacientes con IAMCEST no tratados mediante intervencionismo coronario percutáneo, y mostró una reducción significativa de un 9% del objetivo combinado de muerte, infarto o accidente cerebrovascular en los pacientes tratados con clopidogrel. El estudio CLARITY también evidenció un beneficio del tratamiento concomitante con clopidogrel en pacientes con IAMCEST tratados con fibrinolisis, y mostró una reducción del objetivo combinado de muerte, infarto o accidente cerebrovascular. El estudio PCI-CLARITY8 analizó a los pacientes sometidos a intervencionismo coronario (entre 2 y 8 días después de la fibrinolisis) y obtuvo datos concordantes con los generales del estudio, con una reducción significativa del objetivo primario (el 7,5 frente al 12%; p = 0,008).
Estos estudios han contribuido a establecer la indicación del clopidogrel en la cardiopatía isquémica aguda y concretamente en el IAMCEST, si bien muchas veces de forma indirecta y, en el campo concreto de la ICPp, como recomendación de clase I y nivel de evidencia C (consenso de opinión de expertos y/o estudios a pequeña escala, estudios retrospectivos, registros)5, pues ningún ensayo clínico de gran tamaño ha estudiado el beneficio del clopidogrel en este subgrupo y la información procede, como hemos mostrado, de estudios de pacientes con IAMCEST y fibrinolisis, subestudios de pacientes que acabaron en angioplastia o estudios que analizaron diferentes cargas. Se recomienda una dosis de carga alta y administrada lo más precozmente posible (600 mg) para que ejerza su acción en el contexto de urgencia de la angioplastia primaria, a pesar de que no exista ningún ensayo clínico de gran tamaño que lo haya evaluado frente a placebo en dicha situación5.
Pese a ser uno de los antiagregantes más utilizado y mejor estudiado en el síndrome coronario agudo, los grandes problemas del fármaco —la variabilidad de su respuesta, un inicio de acción lento a pesar de dosis altas de carga y una absorción impredecible— han desembocado en la necesidad de encontrar inhibidores de P2Y12 mejores, como el prasugrel y el ticagrelor.
PrasugrelEl prasugrel se ha evaluado en comparación con el clopidogrel en pacientes con síndrome coronario agudo con manejo invasivo en el ensayo clínico TRITON-TIMI 38, publicado en 20079. Se realizó un subanálisis del grupo de pacientes con IAMCEST formado por 2.438 pacientes sometidos a angioplastia primaria (primeras 12 h desde el inicio de los síntomas) y 1.094 en los que la angioplastia fue realmente diferida, denominada «secundaria», practicada entre las primeras 12 h y los primeros 14 días tras el síndrome coronario. En este segundo grupo se incluyó a pacientes con y sin isquemia recurrente pero sometidos a tratamiento invasivo electivo10. Se excluyó a los pacientes tratados con tienopiridinas los 5 días previos a la aleatorización y los pacientes con necesidad de tratamiento con anticoagulantes orales, en shock cardiogénico o que hubieran recibido tratamiento fibrinolítico recientemente. El objetivo primario de eficacia se vio reducido significativamente en el grupo tratado con prasugrel a los 30 días y a los 15 meses. Al analizar por separado las subpoblaciones, se objetivó que dicha reducción solo alcanzaba la significación estadística en el grupo de pacientes sometidos a la denominada angioplastia secundaria. Analizados los eventos por separado, el prasugrel redujo significativamente la tasa de infarto de miocardio, sin que realmente existieran diferencias significativas con el clopidogrel en las tasas de muerte cardiovascular, mortalidad por cualquier causa, ictus o revascularización urgente del vaso diana. La trombosis del stent se vio reducida de forma muy importante en el grupo de pacientes tratados con prasugrel (Tabla 1).
Tabla 1. Eficacia y seguridad del prasugrel frente al clopidogrel en pacientes con IAMCEST sometidos a ICP a los 15 meses. Análisis de subgrupo del ensayo TRITON TIMI-38
| Prasugrel (n = 1.769) | Clopidogrel (n = 1.765) | HR (IC95%) | p | |
| Eficacia | ||||
| Objetivo primario (infarto de miocardio no mortal, ictus no mortal y muerte cardiovascular) | 174 (10,0) | 216 (12,4) | 0,79 (0,65–0,97) | 0,0221 |
| Muerte cardiovascular o infarto de miocardio | 153 (8,8) | 201 (11,5) | 0,75 (0,61–0,93) | 0,0071 |
| Muerte por cualquier causa | 58 (3,3) | 76 (4,3) | 0,76 (0,54–1,07) | 0,1127 |
| Muerte cardiovascular | 43 (2,4) | 58 (3,4) | 0,74 (0,50–1,09) | 0,1290 |
| Infarto de miocardio | 119 (6,8) | 157 (9,0) | 0,75 (0,59–0,95) | 0,0163 |
| Trombosis del stent | 26 (1,6) | 45 (2,8) | 0,58 (0,36–0,93) | 0,0232 |
| ACV | 26 (1,6) | 25 (1,5) | 1,03 (0,60–1,79) | 0,9110 |
| Seguridad | ||||
| Sangrados mayores no relacionados con CABG (definición TIMI) | 38 (2,4) | 34 (2,1) | 1,11 (0,70–1,77) | 0,6451 |
| Sangrados mayores después de CABG (definición TIMI) | 12/64 (18,8) | 2/73 (2,7) | 8,19 (1,76–38,18) | 0,0033 |
| Sangrado mortal no relacionado con CABG (definición TIMI) | 7 (0,45) | 2 (0,13) | 3,48 (0,72–16,75) | 0,0973 |
ACV: accidente cerebrovascular; CABG: cirugía de revascularización coronaria; HR: hazard ratio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IC95%: intervalo de confianza del 95%; ICP: intervencionismo coronario percutáneo.
Salvo otra indicación, los datos expresan n (%).
El objetivo combinado secundario de eficacia (muerte cardiovascular, infarto no mortal y revascularización urgente no mortal del vaso diana) también se vio reducido significativamente en los pacientes tratados con prasugrel a expensas del grupo de angioplastia secundaria, tanto al mes como a los 15 meses. En cuanto al objetivo de seguridad, el prasugrel no mostró diferencias respecto al clopidogrel en sangrados no relacionados con cirugía a los 30 días (p = 0,33) ni a los 15 meses (p = 0,64).
Otro dato de interés al hablar de angioplastia en el infarto es que, en el subgrupo de pacientes que utilizaron inhibidores de la glucoproteína IIb/IIIa, se dio una reducción significativa del objetivo primario en los pacientes tratados con prasugrel respecto al grupo de clopidogrel (el 10,4 y el 13,5%; p = 0,02). No hubo interacción entre los efectos favorables del prasugrel en la reducción del objetivo primario y el uso de inhibidores de la glucoproteína IIb/IIIa10.
Es importante destacar que el ensayo clínico TRITON-TIMI 38 evaluó el prasugrel frente a la que se consideraba entonces dosis óptima de carga de clopidogrel (300 mg), cuando actualmente la dosis de clopidogrel utilizada mayoritariamente en la angioplastia primaria es de 600 mg.
La evidencia disponible demuestra que el prasugrel presenta un perfil de eficacia superior al del clopidogrel en el tratamiento del IAMCEST, y así lo recogen las guías de práctica clínica del manejo de estos síndromes, que relegan a un segundo puesto al clopidogrel5. El pretratamiento con prasugrel se acepta para pacientes con IAMCEST y los dirigidos a estrategias de ICPp (dosis de carga de 60 mg para posteriormente continuar con 10 mg diarios). En caso de que los pacientes hayan recibido pretratamiento con clopidogrel, los datos recientes del estudio TRIPLET nos muestran que la administración de dosis de carga de 60 mg de prasugrel antes de 24 h tras 600 mg de clopidogrel determina una inhibición plaquetaria similar a prasugrel 60 mg11. Los autores describen además pocos eventos hemorrágicos, si bien el estudio no tenía potencia para detectar diferencias clínicas de eficacia y seguridad.
TicagrelorLas evidencias actualmente disponibles sobre el ticagrelor se fundamentan en el estudio PLATO12, en el que se evaluó el ticagrelor comparado con el clopidogrel en 18.624 pacientes con síndrome coronario agudo. Uno de sus subestudios analizó la población de pacientes con IAMCEST (n = 7.544; el 40,5% del estudio PLATO) que iban a ser sometidos a ICPp13. Se incluyó como IAMCEST a los pacientes con un cuadro típico y electrocardiograma diagnóstico, así como a los que presentaban un bloqueo completo de rama izquierda de nueva o presumiblemente nueva aparición. Además, para evaluar la concordancia de los resultados con diferentes definiciones de la población con IAMCEST, y debido a la existencia de posibles discrepancias entre el diagnóstico al ingreso y al alta del paciente, se realizó un análisis adicional en el que se incluyó además a los pacientes con diagnóstico de IAMCEST solo al alta (n = 886). En el subgrupo de pacientes con IAMCEST en la aleatorización (n = 7.544), los beneficios encontrados fueron coherentes con los del análisis general, y se registró una tasa de aparición del objetivo primario del 9,4% de los pacientes tratados con ticagrelor frente al 10,8% del grupo de clopidogrel, lo que roza la significación estadística (hazard ratio [HR] = 0,87; intervalo de confianza del 95% [IC95%], 0,75–1,01; p = 0,07)13. Esta reducción nominal del 13% del riesgo relativo con ticagrelor fue similar para los pacientes que se presentaron con elevación del segmento ST de entrada y los que presentaron bloqueo completo de rama izquierda o tuvieron un diagnóstico final de IAMCEST al alta. Usando cualquiera de estos tres criterios para la definición de la población con IAMCEST (n = 8.430), el ticagrelor reduce el objetivo primario en un 15% respecto al clopidogrel, lo cual alcanza la significación estadística (el 9,3 y el 11,0%; HR = 0,85; IC95%, 0,74–0,97; p = 0,02). Además, en el subgrupo de pacientes con IAMCEST, el ticagrelor también mostró notables reducciones en la incidencia de varios objetivos secundarios: infarto de miocardio, trombosis del stent, muerte cardiovascular o mortalidad por cualquier causa (Tabla 2). Se registró una baja tasa de ictus, que fue superior con ticagrelor (el 1,7 y el 1,0%; p = 0,02). Esta diferencia fue concordante, aunque no estadísticamente significativa, cuando se realizó el análisis incluyendo a los pacientes con IAMCEST como diagnóstico al alta (el 1,6 y el 1,0%; p = 0,07).
Tabla 2. Eficacia y seguridad del ticagrelor frente al clopidogrel en pacientes con SCACEST derivados a reperfusión con angioplastia primaria. Análisis de subgrupo del ensayo PLATO
| Ticagrelor (n = 4.201) | Clopidogrel (n = 4.229) | HR (IC95%) | p | |
| Coronariografía realizada | 3.496 (93,2) | 3.554 (93,7) | 0,35 | |
| ICPp (< 12 h tras aleatorización) | 2.706 (72,1) | 2.733 (72,1) | 0,98 | |
| Angioplastia durante el ingreso índice | 3.061 (81,6) | 3.097 (81,7) | 0,93 | |
| Anti-GPIIb/IIIa en el evento índice | 1.343 (35,8) | 1.407 (37,2) | 0,22 | |
| (n = 3.752) | (n = 3.792) | |||
| Eficacia | ||||
| Objetivo primario (infarto de miocardio, ictus o muerte cardiovascular) | 331 (9,4) | 384 (10,8) | 0,87 (075–1,01) | 0,07 |
| Muerte cardiovascular o infarto de miocardio | 294 (8,4) | 360 (10,2) | 0,82 (0,71–0,96) | 0,01 |
| Muerte por cualquier causa | 175 (5,0) | 216 (6,1) | 0,82 (0,67–1,00) | 0,05 |
| Muerte cardiovascular | 159 (4,5) | 195 (5,5) | 0,83 (0,67–1,02) | 0,07 |
| Infarto de miocardio | 159 (4,7) | 201 (5,8) | 0,80 (0,65–0,98) | 0,03 |
| ACV | 56 (1,7) | 35 (1,0) | 1,63 (1,07–2,48) | 0,02 |
| Trombosis del stent | 45 (1,6) | 70 (2,4) | 0,66 (0,45–0,95) | 0,03 |
| Seguridad | ||||
| Sangrados mayores no relacionados con CABG (definición PLATO) | 137 (4,1) | 130 (3,7) | 1,06 (0,84–1,35) | 0,61 |
| Sangrados mayores no relacionados con CABG (definición TIMI) | 84 (2,5) | 78 (2,2) | 1,09 (0,80–1,48) | 0,60 |
| Sangrados mayores después de CABG (definición PLATO) | 170 (5,1) | 191 (5,8) | 0,90 (0,73–1,10) | 0,30 |
| Sangrado mortal | 7 (0,2) | 5 (0,1) | NS | |
| Disnea que requirió interrupción del tratamiento | 17 (0,5) | 2 (0,1) | 0,0004 | |
ACV: accidente cerebrovascular; CABG: cirugía de revascularización coronaria; GPIIb/IIIa: glucoproteína IIb/IIIa; HR: hazard ratio; IC95%: intervalo de confianza del 95%; ICPp: intervencionismo coronario percutáneo primario; SCACEST: síndrome coronario agudo con elevación del segmento ST.
Salvo otra indicación, los datos expresan n (%).
En el subgrupo de IAMCEST no hubo diferencias en las tasas de sangrados mayores por cualquiera de las definiciones. En los pacientes con IAMCEST13 se registró un moderado incremento de «cualquier disnea», pero la frecuencia de disnea que precisó retirada del tratamiento, aunque mayor con ticagrelor, fue muy baja en ambos grupos (el 0,5 y el 0,1%; p = 0,0003). No se registró un incremento de la frecuencia de bradicardia con ticagrelor en el grupo con IAMCEST.
Existen limitaciones en este análisis de subgrupos, ya que, como se ha explicado, los resultados de ticagrelor en la población de pacientes con IAMCEST no alcanzaron la significación estadística en algunos de los objetivos y en ocasiones variaban según las definiciones empleadas. Sin embargo, los resultados sí concuerdan con los del análisis general para los objetivos principales de eficacia y seguridad, independientemente de la definición de IAMCEST empleada, las características de los pacientes o la dosis de clopidogrel administrada antes de la aleatorización (el 44% de los pacientes aleatorizados a ticagrelor recibieron alguna dosis de clopidogrel previa a la carga de ticagrelor, y de estos, el 35% recibió al menos 600 mg de clopidogrel sin que afectara a los resultados de eficacia o seguridad). Además, en el seguimiento se pudo observar que la reducción de la aparición de eventos de eficacia con ticagrelor parecía incrementarse con el tiempo, lo que indica que el mayor beneficio clínico se obtiene con el tratamiento a largo plazo.
El tratamiento con ticagrelor se debe iniciar con una dosis de carga de 180 mg y continúa con 90 mg/12 h. La doble antiagregación plaquetaria con AAS y ticagrelor debe prolongarse hasta 12 meses después del IAMCEST (I C)5. En caso de olvido de una dosis, se recomienda continuar con la siguiente sin ningún otro cambio.
Cuándo iniciar la doble antiagregaciónSi bien la guía europea5 recomienda administrar la doble antiagregación antes del cateterismo y lo más precozmente posible para alcanzar su eficacia más rápidamente, esta recomendación no se basa en información procedente de evidencia sólida. Ningún ensayo clínico hasta el momento ha evaluado en el IAMCEST la superioridad de aportar un antagonista del receptor del ADP en el primer contacto médico o durante la angiografía coronaria. Datos muy interesantes de Ferreiro et al14 revelan que pretratar a pacientes con IAMCEST con dosis de carga de clopidogrel (600 mg) en el primer contacto médico en emergencias no genera apenas efecto antiagregante medido por diferentes métodos a la llegada de estos pacientes a la sala de hemodinámica para la ICPp. Cerca del 90% de estos pacientes presentan una pobre respuesta al clopidogrel en el inicio de la ICPp. Esta es una de las limitaciones importantes del clopidogrel frente a los NAG, su lentitud de acción en un contexto en que precisamente urge la rápida antiagregación. Esta práctica de la administración precoz del segundo antiagregante es simplemente una recomendación de expertos, basada en lo que es práctica habitual en gran parte de los hospitales europeos y en información farmacocinética. Lo cierto es que esta práctica cada vez genera más controversia, con grupos partidarios de la administración precoz y otros que prefieren la administración precoz en exclusiva del AAS, con la decisión de usar el segundo antiagregante en la sala de hemodinámica. Esta segunda corriente también tiene argumentos a favor, como son la ausencia de datos clínicos que indiquen el uso precoz, el porcentaje no despreciable de falsos positivos en el diagnóstico de IAMCEST al expandirse los programas de ICPp (entre el 10 y el 20%) e incluso la posibilidad de realizar una anamnesis más exhaustiva con valoración del riesgo hemorrágico y otras variables que puedan ayudar a decidir cuál es el mejor antiagregante para el paciente, lo cual no siempre es posible en el primer contacto médico.
El estudio ATLANTIC15, recientemente publicado, es un ensayo clínico a doble ciego que estudia la eficacia y la seguridad de la administración prehospitalaria de dosis de carga de ticagrelor junto con AAS comparada con la administración hospitalaria. No se alcanzó el objetivo de eficacia (mejoría de la elevación del segmento ST o restauración del flujo coronario). La estrategia del pretratamiento fue segura con un índice de sangrados bajo e idéntico al del grupo de pacientes tratados con ticagrelor en el hospital. Debe destacarse la reducción significativa de la trombosis definitiva del stent, uno de los objetivos secundarios preespecificados, a favor de la estrategia del pretratamiento. Este dato, junto con el beneficio del pretratamiento en el subgrupo de pacientes que no recibieron morfina y la pequeña diferencia de tiempo en la toma de ticagrelor entre las dos estrategias, hace que esta polémica posiblemente no haya quedado zanjada.
Parecería prudente consensuar mediante protocolos locales o regionales el momento de iniciar la doble antiagregación, y quizá evitando el uso precoz en cuadros clínicos o ECG dudosos, o en pacientes con alta comorbilidad o riesgo de sangrado, para los cuales, a lo mejor, la administración precoz pueda y deba esperar.
Antiagregación en la fibrinolisisLa antiagregación recomendada en pacientes sometidos a fibrinolisis es AAS y clopidogrel. El beneficio del AAS en esta población se conoce desde hace 25 años, cuando se demostró un efecto positivo y aditivo a la fibrinolisis con estreptoquinasa en pacientes con IAMCEST3. La dosis de AAS debe ser de 150–300 mg y vía oral si es posible. En caso de no ser posible, se recomienda la administración intravenosa de 250 mg. La dosis de mantenimiento es la estándar, con dosis de 75–100 mg/día vía oral.
Debe complementarse con clopidogrel, único inhibidor del ADP estudiado y con demostrado beneficio añadido al AAS, con reducción de eventos cardiovasculares7 e incluso de la mortalidad en un gran estudio con casi 46.000 pacientes6. La dosis de carga recomendada, a diferencia de en la ICPp, es de solo 300 mg para pacientes de edad ≤ 75 años y 75 mg para los mayores de 75. La dosis de mantenimiento es idéntica que en las demás poblaciones, con 75 mg/día vía oral.
Los NAG no se han estudiado en esta población. Se excluyó a los pacientes con IAMCEST dirigidos a fibrinolisis tanto del estudio TRITON9 como del PLATO12, por lo que no disponemos de información alguna, y su uso a día de hoy no está indicado como terapia adyuvante a la fibrinolisis.
Angioplastia de rescate y angioplastia tardía posterior a la fibrinolisisEn los casos en que la fibrinolisis sea fallida o si hay datos de posible reoclusión o reinfarto en las horas posteriores, se debe derivar a los pacientes a angiografía urgente y angioplastia de rescate. No tenemos evidencia alguna con los NAG en este subgrupo de pacientes pues, como se ha comentado, se los excluyó de los estudios TRITON9 y PLATO12. Además, la angioplastia de rescate no parece el contexto más adecuado, por tratarse de pacientes en los que se ha empleado fibrinolíticos, AAS, clopidogrel y heparinas en las horas previas. Por lo tanto, se debe contraindicar los NAG en este contexto.
Otro subgrupo que hay que tener en cuenta es el de los pacientes sometidos a fibrinolisis con éxito. La realización de angiografía con posibilidad de revascularización está indicada en las horas siguientes a la fibrinolisis (estrategia famacoinvasiva) con una ventana que las guías recomiendan entre las 3 y las 24 h. Lo cierto es que, en estos pacientes que responden correctamente a la reperfusión farmacológica, la angiografía suele programarse de manera no urgente al día siguiente del infarto (< 24 h), por lo que acuden al cateterismo en situación clínica mucho más estable y cuando el efecto del fibrinolítico prácticamente ha desaparecido. En el caso de realizar la angioplastia, las guías no resuelven ni aclaran qué antiagregación es la óptima en esta población. La guía europea5 menciona de manera vaga que «la angioplastia debe estar asistida por un tratamiento de doble antiagregación plaquetaria en dosis similares a las usadas para angioplastia primaria». Las guías estadounidenses16 tampoco aclaran mucho qué medicación usar en estos pacientes y solo recomiendan el prasugrel como indicación IIa para pacientes a los que se realiza angioplastia al menos 24 h después de la fibrinolisis y si no se ha usado como terapia adyuvante una dosis de carga de clopidogrel, situación harto infrecuente.
A la hora de posicionar los NAG para pacientes sometidos a fibrinolisis, y pendientes de información que nos aporte cierta evidencia al menos en lo que a seguridad se refiere, parece razonable distinguir claramente entre pacientes sometidos a angioplastia de rescate, para quienes debemos contraindicar el uso de NAG, y pacientes con fibrinolisis con éxito, en los que la angioplastia se realiza al día siguiente en una situación clínica estable y ya sin efecto del fibrinolítico. En este escenario, el uso de los NAG puede dejarse a elección del equipo médico, con indicación de prasugrel y ticagrelor para pacientes con un perfil adecuado y sin contraindicaciones a estos fármacos y seguir usando el clopidogrel cuando los NAG estén contraindicados o exista un riesgo hemorrágico más alto.
Papel actual de los inhibidores de la glucoproteína IIb/IIIa en el tratamiento del infartoCon la llegada de los NAG, no está claro qué lugar deben ocupar los anti-GPIIb/IIIa, fármacos estudiados en la época del clopidogrel y que demostraron un valor añadido en el infarto. La actual guía de práctica clínica europea los recomienda como tratamiento de rescate, en caso de evidencia angiográfica de trombo y ausencia de reflujo o flujo lento (indicación IIa C)5, si bien estas recomendaciones no se han probado en ensayos clínicos. La vía de administración estándar debe ser la intravenosa. En el estudio GRACIA-3 tampoco se observó beneficio del uso de tirofibán en términos de mejora de la perfusión epicárdica o miocárdica en la angioplastia postrombolítica precoz17.
Duración de la doble antiagregaciónDado que el AAS tiene beneficios bien establecidos en prevención secundaria, su uso por tiempo indefinido está recomendado para todos los pacientes con IAMCEST. Si los pacientes tienen riesgo de hemorragia, se debe considerar el uso de protectores gástricos, preferiblemente inhibidores de la bomba de protones. Los pacientes con historia de hipersensibilidad al AAS pueden someterse a una desensibilización y continuar el tratamiento indefinidamente. Los pacientes que son verdaderamente intolerantes al AAS, pueden tomar clopidogrel (75 mg/día) en su lugar como prevención secundaria a largo plazo.
Tras un IAMCEST, se recomienda mantener el tratamiento de doble antiagregación plaquetaria, que combina AAS y un inhibidor del receptor de ADP (clopidogrel, prasugrel o ticagrelor) durante un periodo largo de 12 meses, independientemente del tipo de revascularización aplicada o el stent utilizado. No hay estudios clínicos en el IAMCEST que apoyen esta recomendación, pero es el consenso que recogen las guías y la práctica más común. En pacientes con hemorragias secundarias a la doble antiagregación, cirugías no demorables o incluso riesgo hemorrágico muy alto, la duración de la doble antiagregación podría recortarse a un mínimo estricto de 1 mes para pacientes con stents convencionales y 3–6 meses para pacientes tratados con stents farmacoactivos de segunda generación, de los que ya se ha demostrado su seguridad en estas situaciones5.
Antiagregación en el paciente anticoagulado que padece un infartoLos pacientes con anticoagulación oral (ACO) que sufren un IAMCEST son un grupo nada despreciable que puede suponer un 5–8% de los IAMCEST. La estrategia de reperfusión ideal para estos pacientes debe ser la ICPp, ya que la ACO es una contraindicación relativa para la fibrinolisis. Aunque no hay estudios aleatorizados, diferentes estudios observacionales concuerdan en demostrar el beneficio del tratamiento anticoagulante para estos pacientes, incluso con una reducción de la mortalidad18. Si bien la triple terapia con doble antiagregación más ACO se asocia a un incremento del riesgo hemorrágico, se han publicado dos documentos de consenso que recomiendan acortar en lo posible la triple terapia reduciendo el tiempo con doble antiagregación19,20. La guía europea recomienda también esta actitud de triple terapia lo más corta posible5. Una estrategia atractiva como la planteada en el estudio WOEST, que aleatorizó a pacientes con ACO revascularizados con stent a triple terapia o ACO+clopidogrel, no aporta información alguna en este contexto, ya que excluyó a los pacientes con IAMCEST21; por lo tanto, no debe aplicarse salvo contraindicación o alto riesgo hemorrágico.
Estos pacientes deben recibir tratamiento antiagregante con AAS y clopidogrel; los NAG están contraindicados por el aumento de eventos hemorrágicos. Se excluyó a los pacientes con ACO de los estudios TRITON y PLATO. Sí disponemos de información puntual sobre el uso de triple terapia con ACO, AAS y prasugrel. Un estudio retrospectivo ha analizado el efecto de incluir en la triple terapia, además de ACO y AAS, prasugrel en vez de clopidogrel. Los autores describen una incidencia de hemorragias significativamente mayor en el grupo del prasugrel, sin reducción en los eventos isquémicos. Por lo tanto, esta estrategia está contraindicada22.
Como hemos comentado, es fundamental reducir la duración del tratamiento antiagregante en esta población. A este respecto, un reciente artículo23 revisa las mejores opciones terapéuticas y recomendaciones para este tipo de pacientes (Figura 1). Para poder acortar lo máximo la doble antiagregación, se debe considerar el uso de stents convencionales que permitan reducir el uso de la triple terapia a solo 1 mes; después se podría continuar con ACO y un antiagregante. En caso de usar stents farmacoactivos, se deberá valorar el riesgo hemorrágico para mantener la triple terapia entre 3 y 6 meses y continuar después con ACO y un antiagregante. Es importante saber que, para los pacientes con alto riesgo de sangrado y riesgo trombótico asumible y una vez pasados los primeros 6–12 meses, una opción es mantener la ACO con antagonistas de la vitamina K en monoterapia con el fin de reducir los eventos hemorrágicos.
Figura 1. Recomendaciones sobre el uso de fármacos antitrombóticos para pacientes con fibrilación auricular sometidos a intervencionismo coronario. Reproducido con permiso de Ruiz-Nodar et al 23 . ACO: anticoagulante oral; FA: fibrilación auricular; RT: riesgo de trombosis; SLF: stent liberador de fármaco; SMSR: stent metálico sin recubrimiento; TT: triple terapia (anticoagulación oral + ácido acetilsalicílico [100 mg/día] + clopidogrel [75 mg/día]).
ConclusionesAl decidir el tratamiento antiagregante para pacientes con IAMCEST, se debe pensar primero en la estrategia de reperfusión empleada. En los pacientes derivados a ICPp, el prasugrel y el ticagrelor son superiores al clopidogrel y, salvo contraindicación, se debería indicarlos. Los NAG generan una inhibición plaquetaria más rápida y profunda, acompañada de menos variabilidad, lo que determina una reducción significativa de las complicaciones isquémicas (especialmente reducción de infarto agudo de miocardio con prasugrel y de infarto y muerte con ticagrelor). Así lo refleja la guía europea de IAMCEST5, que posiciona al prasugrel (si no hay antecedente de accidente cerebrovascular y la edad es ≤ 75 años) con indicación IB y el ticagrelor sin restricciones también con indicación IB, por encima de clopidogrel (IC), que queda relegado a cuando los NAG no estén disponibles o estén contraindicados (Figura 2).
Figura 2. Algoritmo de manejo del IAMCEST y terapia antiagregante indicada. Se muestran los antiagregantes recomendados con su nivel de evidencia; no se incluye el ácido acetilsalicílico, que debe acompañar todas las estrategias de reperfusión del IAMCEST. IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervencionismo coronario percutáneo.aPrasugrel condicionado a «si no hay historia previa de accidente cerebrovascular y la edad es ≤ 75 años».bProbablemente esperar para usar los nuevos antiagregantes a las 24 h de la fibrinolisis.
A la hora de buscar alguna superioridad del prasugrel sobre el ticagrelor, o viceversa, en el IAMCEST, no se dispone de información para decidir por uno u otro. No se han comparado de manera directa y los subestudios que han demostrado la superioridad del prasugrel y el ticagrelor sobre el clopidogrel se realizaron en poblaciones con diferencias claras y con uso concomitante de medicación también distinta, lo que no permite siquiera especular sobre las ventajas o desventajas de cada uno de los fármacos sobre el otro.
El clopidogrel no queda eliminado del tratamiento del IAMCEST, ni mucho menos. Es el fármaco indicado, además del AAS, para los pacientes tratados con fibrinolisis o sometidos a angioplastia de rescate (Figura 2). Además, un porcentaje no despreciable de pacientes remitidos a ICPp deberán recibir tratamiento con clopidogrel, ya que tiene mejor perfil de seguridad (pacientes con antecedentes de hemorragia intracraneal, necesidad de anticoagulación crónica o contraindicaciones al uso de NAG).
Nos encontramos en una nueva etapa del tratamiento del infarto con nuevos antiagregantes, prasugrel y ticagrelor, que aportan mejores resultados a una gran mayoría de nuestros pacientes; el conocimiento de los fármacos y una selección adecuada permitirán, además, minimizar los riesgos intrínsecos de usar fármacos antiagregantes más potentes, una etapa en que la decisión clínica del cardiólogo al seleccionar el mejor antiagregante alcanza un nuevo protagonismo y será esencial para conseguir la mejora del pronóstico de nuestros pacientes con IAMCEST.
Conflicto de interesesNinguno.
Autor para correspondencia: Unidad de Hemodinámica, Hospital General, Universitario de Alicante, Maestro Alonso s/n, 2.a planta, 03010 Alicante, España. ruiz_jmi@gva.es